文章信息
- 邱瑶, 夏冰, 江洪, 孟文, 冯兴, 王利民, 陶志刚, 杜权, 陈雪琴, 马胜林
- Qiu Yao, Xia Bing, Jiang Hong, Meng Wen, Feng Xing, Wang Limin, Tao Zhigang, Du Quan, Chen Xueqin, Ma Shenglin
- EGFR突变阳性肺腺癌患者多学科诊疗一例
- Diagnosis and management of EGFR-mutant lung adenocarcinoma by a multidisciplinary team: A case report
- 实用肿瘤杂志, 2021, 36(5): 387-392
- Journal of Practical Oncology, 2021, 36(5): 387-392
基金项目
- 杭州市科技发展计划重大项目(20180417A01)
-
通信作者
- 陈雪琴,E-mail:chenlucy1437@aliyun.com
-
文章历史
- 收稿日期:2021-09-18
2. 浙江大学医学院附属杭州市肿瘤医院肺癌 MDT 团队,浙江 杭州 310002
2. Lung Cancer Multidisciplinary Team, Affiliated Hangzhou Cancer Hospital, Zhejiang University School of Medicine, Hangzhou 310002, China
患者,女性,55岁,因体检发现右中肺结节于2017年2月20日收治于南京医科大学附属杭州医院。当时有干咳,不剧烈,无痰,无胸闷、胸痛或气急等明显不适。无吸烟史,否认家族性肿瘤史。入院体检:体温36.9℃,血压126/70 mmHg(1 mmHg=0.133 kPa),美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状况(performance score,PS)评分0分,意识清,精神好,颈部及锁骨上淋巴结未触及肿大,双肺呼吸音清,未闻及啰音。心率74次/min,律齐,未闻及病理性杂音。腹软,无压痛反跳痛。四肢活动自如。
实验室检查:血常规、肝肾功能、凝血功能和肿瘤标志物均无明显异常(癌胚抗原5.04 μg/L,正常范围0~5 μg/L);气管镜和骨扫描检查未见明显异常。胸部CT检查提示右中肺类结节影,范围约1.6 cm×1.2 cm,边缘不规则可见毛刺样改变,纵隔内未见明显肿大淋巴结影(图 1)。头颅MRI检查示,多发腔隙性脑梗死,左侧枕叶软化灶。上腹部超声和双侧肾上腺超声未见明显占位。
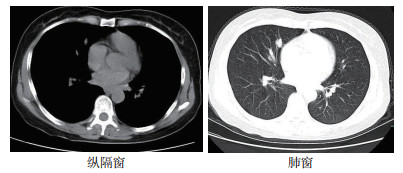
|
| 图 1 肺癌患者初诊时胸部CT检查结果 Fig.1 Results of chest CT in the lung cancer patient at the initial diagnosis |
陶志刚副主任医师(放射科):患者胸部CT检查提示右肺中叶类结节影,大小约为1.6 cm×1.2 cm,边缘不规则可见毛刺样改变。肺结节一般指直径 < 3 cm的占位性病灶,小而实的结节多数为良性,实性结节中若边缘有细毛刺、分叶、胸膜凹陷和空腔等则恶性可能大。该患者肺结节密度均匀,有部分强化,且边缘不规则、有毛刺,考虑恶性肿瘤。
江洪主任医师(胸外科):根据病史及影像表现,患者右肺占位首先考虑恶性肿瘤,早期原发性肺癌可能性大。Ⅰ期肺癌患者在身体条件允许的情况下,外科医师常规建议手术切除。早期肺癌的手术方式包括全肺切除、肺叶切除、肺段切除以及亚肺叶切除等,相较于传统的肺叶切除术,肺段切除能较好保留患者肺功能并减少围术期并发症。胸部立体定向放疗(stereotactic body radiotherapy,SBRT)为不能耐受手术的高危人群提供替代方案。美国一项研究显示,369 931例Ⅰ期非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者中仅有6.6%的患者接受SBRT,而选择肺叶和亚肺叶切除的患者占比分别为49.5%和17.4%,可见有更多的胸外科医师和患者选择手术治疗[1]。根据胸部CT检查结果,该患者考虑早期肺癌,且一般情况可,可耐受手术,故建议给予肺癌根治及淋巴结清扫术。
夏冰主任医师(肿瘤放疗科):SBRT的特点是分割次数少和单次剂量高。SBRT无创且具有较高的局部控制率,已成为无法手术切除的早期NSCLC患者的标准治疗方案。对于可以手术的早期NSCLC,一项汇总分析比较可手术Ⅰ期NSCLC患者接受SBRT治疗(n=31)和肺叶切除手术治疗(n=27)的预后,两组无复发生存率比较,差异无统计学意义(86.0% vs 80.0%,P=0.54),但接受SBRT患者的3年总生存率更高(95.0% vs 79.0%,P=0.037)[2]。此外,4~5级毒性及死亡事件均发生在手术组,SBRT组则仅有10.0%的患者发生3级毒性。该研究提示,SBRT无论是总生存率或不良反应均不劣于手术,但该研究由于样本量小和随访时间短等局限性,仍需大样本随机对照研究来比较两种治疗方案的差异。因此,手术仍是早期NSCLC的首选治疗方案。另外,该患者肺结节的位置紧邻心脏,如果选择SBRT治疗,也要考虑到单次大剂量照射所带来的心脏损伤风险。
马胜林教授(肿瘤综合治疗科)总结:结合各位专家意见,患者右肺中叶结节首先考虑恶性。尽管有小样本随机研究表明SBRT有不亚于手术治疗的优点[2],但该患者为中年女性,无心肺疾病和糖尿病等并发症,可耐受手术,属于可切除Ⅰ期NSCLC,根据美国国立癌症综合网络(National Comprehensive Cancer Network,NCCN)指南(version 4. 2017)推荐[3]并结合患者意愿,建议手术治疗。
2.1.2 治疗情况患者于2017年2月27日行全麻胸腔镜下右中肺癌根治术联合淋巴结清扫术,术后恢复可。术后病理检查结果:右肺中叶浸润性腺癌,腺泡型(40%)和微乳头型(30%)为主,伴有实性(15%)和微乳头状(15%),见图 2;肿瘤大小1.5 cm×0.9 cm×0.7 cm,累及一侧肺膜,支气管切缘未累及,周围淋巴结未见癌转移。免疫组织化学(immunohistochemistry,IHC)检查结果:甲状腺转录因子-1(thyroid transcription factor-1,TTF1)+,NapsinA +,细胞角蛋白7(cytokeratin,CK7)+,CK20灶性+,Ki-67约10%+,间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)-。基因检测提示:EGFR外显子19缺失阳性,ALK基因和ROS1基因融合阴性。术后诊断:右中肺腺癌(T2N0M0,ⅠB期)。
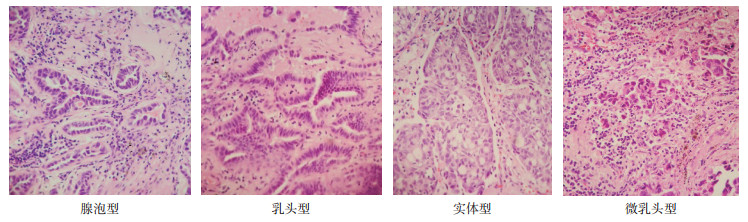
|
| 图 2 肺癌患者术后病理检查结果(HE×100) Fig.2 Postoperative pathological examination results of the lung cancer patient (HE×100) |
江洪主任医师(胸外科):通过手术切除,Ⅰ期NSCLC患者的5年生存率可达75.0%[4]。然而组织学类型不同,生物学行为及预后也不尽相同。日本的一项研究分析490例肺腺癌患者预后与病理分型的相关性,其中腺泡型、乳头型、实体型和微乳头(micropapillary,MIP)型的5年无瘤生存(disease-free survival,DFS)率分别为69.7%、66.7%、43.3%和0%,而腺泡型、乳头型和实体型肺腺癌患者5年总生存(overall survival,OS)率分别为81.2%、74.7%和39.1%,微乳头状型肺腺癌患者3年OS率为42.2%[5]。该患者病理含有MIP成分,复发风险相对较高,应考虑术后辅助治疗减少复发风险。
陈雪琴主任医师(肿瘤内科):ⅠB期NSCLC患者是否行辅助治疗一直存在争议,但有研究显示,铂类双药化疗仍是术后Ⅱ期、ⅢA期和高风险ⅠB期NSCLC患者的标准辅助治疗[6]。NCCN指南(version 4. 2017)指出,复发高风险因素包括低分化(包括神经内分泌肿瘤)、脉管侵犯、楔形切除、肿瘤 > 4 cm、累及脏层胸膜、不完全性淋巴结活检以及淋巴结分期未知等[3]。该患者有累及脏层胸膜,且病理类型中含有MIP成分。既往研究提示,MIP型患者预后不佳[5]。结合上述病史特点,患者属于高风险Ⅰ期NSCLC人群,建议行含铂双药化疗减少术后复发。此外,辅助治疗手段还包括靶向治疗,但目前尚无可靠数据支持靶向治疗用于辅助R0切除的ⅠB期NSCLC患者。
马胜林教授(肿瘤综合治疗科)总结:化疗是治疗肺癌的基石,该患者虽然为肺癌早期,但存在不良预后的病理分型,且有累及脏层胸膜等高风险因素,综合指南推荐及各位专家意见,建议行含铂双药辅助化疗。对于完全切除的N0~N1的早期NSCLC患者,NCCN指南(version 4. 2017)不推荐行术后辅助放疗[3]。EGFR-TKI用于早期尤其是Ⅰ期NSCLC患者的辅助治疗的研究数据仍不足,需更多临床研究支持。
2.2.2 治疗情况2017年3月31日起给予4个周期的培美曲塞+顺铂方案化疗(培美曲塞500 mg/m2 d1+顺铂35mg/m2 d1-d2;每3周重复),定期复查胸部CT,评估病情稳定。2018年3月14日颅脑MRI平扫+增强提示:左侧额叶囊性灶,结合病史考虑囊性转移灶(图 3)。初步考虑疾病进展,临床诊断:右肺癌术后脑转移(rT0N0M1a,ⅣA期),DFS为12.5个月。
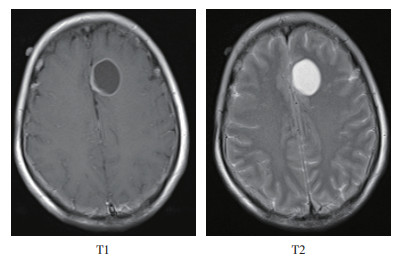
|
| 图 3 肺癌患者术后脑转移MRI检查结果 Fig.3 MRI results of postoperative brain metastases in the lung cancer patient |
杜权主任医师(神经外科):既往对Ⅳ期NSCLC患者原发灶或转移灶手术切除被认为是姑息治疗。但对于原发性肿瘤或转移灶数目较少的患者,手术切除能显著延长生存期。此外,手术切除脑转移瘤可以迅速缓解病症且快速获取准确的病理结果,但仍然需要根据转移灶的位置、数目及大小等谨慎选择。该患者年轻,体力状态良好,病灶单发,肿瘤位置较好,易切除,建议行脑部肿瘤切除术。
夏冰主任医师(肿瘤放疗科):无论用于姑息或术后辅助,SBRT均可为独立脑转移NSCLC患者带来获益,转移灶数目局限的NSCLC脑转移治疗可选择单独的SBRT,对于有症状或有病理诊断需求的患者则可选择手术联合SBRT或全脑放疗(whole brain radiation therapy,WBRT)[3, 7]。该患者无脑转移相关症状,可考虑行放疗,但该病灶为囊性转移灶,且为寡转移,结合患者基础条件等特点,同意神经外科意见,建议手术联合辅助放疗。至于术后辅助放疗的方式选择,考虑到WBRT可能对认知功能造成影响,建议该患者脑转移灶术后行SBRT治疗。
陈雪琴主任医师(肿瘤内科):脑转移是晚期肺腺癌患者的独立预后因素[8],患者发生脑转移后不经治疗的OS仅为1~2个月,颅脑转移灶手术、SBRT和WBRT等综合应用延长Ⅳ期NSCLC患者的生存,尤其是EGFR-TKI和ALK-TKI等靶向药物的研发更为驱动基因阳性晚期NSCLC患者带来福音,基于多个随机对照研究,TKI单药治疗已成为EGFR基因突变阳性患者一线首选。《中国肺癌脑转移诊治专家共识(2017年版)》推荐:肺癌脑转移患者的治疗应以全身治疗为基础,有驱动基因阳性则选TKI治疗,最终目的是治疗转移病灶、改善患者症状和提高生活质量,最大程度地延长患者生存时间[9]。脑转移患者的预后分级指数包括递归分割分析分级、预后评估分级系统和肺癌脑转移预后模型,评估项目包括年龄、PS评分、有无颅外转移、脑转移个数以及基因状态等[10]。研究显示,肺癌脑转移5年OS率约15.0%,受同时或异时脑转移的影响不大,且该研究数据显示,年轻、女性、T分期低和PS评分高的患者预后相对较好,对于PS评分良好的孤立病灶建议手术治疗或SBRT[11]。2017年的一项多中心回顾性分析显示,接受先SBRT、先WBRT和先EGFR-TKI治疗的患者中位OS分别为46、30和25个月,2年OS率分别为78.0%、62.0%和51.0%,该结果同样支持对EGFR突变NSCLC脑转移患者先进行SBRT[12]。故建议先行术后SBRT辅助治疗,序贯TKI靶向治疗。
马胜林教授(肿瘤综合治疗科)分析及总结:一项荟萃分析显示,757例寡转移NSCLC患者83.9%的原发灶和62.3%的转移灶选择手术,整体的中位OS为26个月,中位PFS为11个月,5年OS率为29.4%,其中与预后有关的因素包括是否同时出现多个病灶转移、有无淋巴结转移和是否为腺癌[13]。该患者右肺腺癌术后脑转移诊断明确,影像学综合评估为寡转移,无淋巴结转移,且患者为年轻女性,一般情况良好,建议手术切除脑转移灶,术后辅助放疗序贯TKI全身治疗,或将为患者带来长期生存。
2.3.2 治疗情况2018年3月20日在全麻下行左侧额叶肿瘤切除术,术后病理检查提示转移性腺癌,免疫组织化学检查示:CK+,CK7+,CK20-,TTF1+,NapsinA局灶+(图 4)。脑转移瘤组织EGFR基因检测示:EGFR基因外显子19缺失。患者术后转至浙江大学医学院附属杭州市肿瘤医院,行脑转移灶瘤床放疗(30 Gy/5 F),并序贯吉非替尼0.25 g每天1次口服靶向治疗。随访至2021年7月患者病情稳定,未见肿瘤复发。
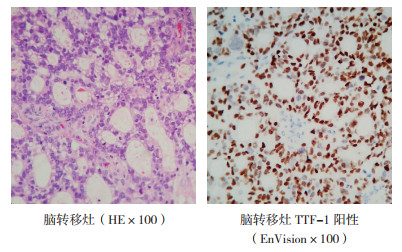
|
| 图 4 肺癌患者脑转移灶术后病理检查和免疫组织化学检查结果 Fig.4 Pathological and immunohistochemistry examination results of brain metastatic lesion in the lung cancer patient |
MDT模式是指通过多个学科集中讨论和分析指导患者的诊疗方案,这一模式贯穿于整个病程管理中,大大缩减了肺癌患者的治疗等待时间,同时也改善了患者预后以及长期生活质量。MDT模式已成为临床诊疗的趋势,且被许多欧美国家广泛接受,但在国内,由于缺乏严谨的组织架构及工作流程以及评估反馈方法,MDT尚不能普遍高效应用。2020年的《肺癌多学科团队诊疗中国专家共识》有望促进国内MDT的规范化实施,为肺癌患者带来更大获益[14]。肺癌是异质性大、病理类型复杂和容易转移的瘤种,其诊治过程需要影像科、胸外科、肿瘤放化疗科、呼吸科、病理科和分子基因诊断实验室等多学科协作,MDT是实现诊疗最优化的最佳途径。
该患者因右肺结节首诊,经MDT讨论后行手术治疗,因病理检查提示累及脏层胸膜,且有 > 5% MIP成分,因此与患者及家属沟通后采用了含铂两药方案辅助化疗。近期日本的一项回顾性研究也证实,尽管实现了R0切除,MIP成分仍是Ⅰ期NSCLC患者术后复发的高危因素[15],也有研究支持辅助化疗可使有MIP成分的ⅠB期肺腺癌患者生存获益[16]。
TKI作为辅助治疗在2017年仍处于探索阶段,前期研究因纳入人群未限定EGFR敏感突变人群,最终提前结束或获得阴性结果,随后SELECT研究提示,EGFR基因突变ⅠA~ⅢA期NSCLC患者术后辅助2年EGFR-TKI治疗可以较化疗显著延长DFS并降低疾病复发风险,但该研究仅为Ⅱ期单臂研究,且为亚组分析结果,所以并未确立术后辅助靶向治疗的地位[17]。近年来,CTONG 1104研究、EVAN研究和ADAURA研究相继证实一代或三代EGFR-TKI靶向治疗能延长EGFR敏感突变早期NSCLC患者DFS,其中EVAN研究还观察到5年OS率获益[18-21]。因此,NCCN指南(version 5.2021)推荐EGFR-TKI用于ⅠB~ⅢB期NSCLC完全切除的术后辅助治疗[22]。患者尽管接受了术后辅助化疗,12.5个月后仍出现脑转移,这提示MIP与预后不佳有关,经MDT会诊后行脑转移灶切除术,术后病理为转移性腺癌,原发灶和转移灶基因检测提示EGFR基因敏感突变,给予脑转移灶瘤床辅助放疗序贯EGFR-TKI靶向治疗。经长期随访,患者获得了高质量的长期生存。
此病例诊疗过程提示,MDT诊疗模式在肺癌初诊、手术以及术后复发转移等全程管理中均显得愈发重要,尤其是在精准靶向及免疫治疗的时代,MDT将引领精准个体化的规范治疗,为患者带来长期生存获益。
| [1] |
Mcmurry TL, Shah PM, Samson P, et al. Treatment of stage Ⅰ non-small cell lung cancer: What's trending?[J]. J Thorac Cardiovasc Surg, 2017, 154(3): 1080-1087. DOI:10.1016/j.jtcvs.2017.03.122 |
| [2] |
Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage Ⅰ nonsmall-cell lung cancer: A pooled analysis of two randomised trials[J]. Lancet Oncol, 2015, 16(6): 630-637. DOI:10.1016/S1470-2045(15)70168-3 |
| [3] |
NCCN. NCCN Clinical Practice Guidelines in Oncology: Non-small cell lung cancer (Version 4.2017)[OL]. (2017-01-18)[2021-09-23]. https://www.nccn.org/
|
| [4] |
Lang-Lazdunski L. Surgery for nonsmall cell lung cancer[J]. Eur Respir Rev, 2013, 22(129): 382-404. DOI:10.1183/09059180.00003913 |
| [5] |
Yoshizawa A, Sumiyoshi S, Sonobe M, et al. Validation of the IASLC/ATS/ERS lung adenocarcinoma classification for prognosis and association with EGFR and KRAS gene mutations: analysis of 440 Japanese patients[J]. J Thorac Oncol, 2013, 8(1): 949-959. |
| [6] |
Pakkala S, Ramalingam SS. Adjuvant therapy for nonsmall cell lung cancer: Recent advances and future perspectives[J]. Curr Opin Oncol, 2016, 28(2): 150-158. DOI:10.1097/CCO.0000000000000269 |
| [7] |
Salama JK, Chmura SJ, Mehta N, et al. An initial report of a radiation dose-escalation trial in patients with one to five sites of metastatic disease[J]. Clin Cancer Res, 2008, 14(16): 5255-5259. DOI:10.1158/1078-0432.CCR-08-0358 |
| [8] |
高楚伊, 聂俊, 朱颖, 等. EGFR突变对云南省晚期肺腺癌疗效及预后影响的真实世界研究[J]. 实用肿瘤杂志, 2021, 36(1): 37-42. |
| [9] |
石远凯, 孙燕, 于金明, 等. 中国肺癌脑转移诊治专家共识(2017年版)[J]. 中国肺癌杂志, 2017, 20(1): 1-13. |
| [10] |
Paul S, Yang TJ, Kathryn B, et al. Estimating survival in patients with lung cancer and brain metastases: An update of the graded prognostic assessment for lung cancer using molecular markers (Lung-molGPA)[J]. JAMA Oncol, 2017, 3(6): 827-831. DOI:10.1001/jamaoncol.2016.3834 |
| [11] |
Iyengar P, Lau S, Donington JS, et al. Local therapy for limited metastatic non-small cell lung cancer: What are the options and is there a benefit?[J]. Am Soc Clin Oncol Educ Book, 2016, 35: e460-467. |
| [12] |
Magnuson WJ, Lester-Coll NH, Wu AJ, et al. Management of brain metastases in tyrosine kinase inhibitor-naive epidermal growth factor receptor-mutant non-small-cell lung cancer: A retrospective multi-institutional analysis[J]. J Clin Oncol, 2017, 35(10): 1070-1077. DOI:10.1200/JCO.2016.69.7144 |
| [13] |
Ashworth AB, Senan S, Palma DA, et al. An individual patient data metaanalysis of outcomes and prognostic factors after treatment of oligometastatic non-small-cell lung cancer[J]. Clin Lung Cancer, 2014, 15(5): 346-355. DOI:10.1016/j.cllc.2014.04.003 |
| [14] |
钟文昭, 中国胸部肿瘤研究协作组, 中国抗癌协会肺癌专业委员会, 等. 肺癌多学科团队诊疗中国专家共识[J]. 中华肿瘤杂志, 2020, 42(10): 817-828. DOI:10.3760/cma.j.cn112152-20200812-00731 |
| [15] |
Watanabe K, Sakamaki K, Ito H, et al. Impact of the micropapillary component on the timing of recurrence in patients with resected lung adenocarcinoma[J]. Eur J Cardiothorac Surg, 2020, 58(5): 1010-1018. DOI:10.1093/ejcts/ezaa138 |
| [16] |
Qian FF, Yang WJ, Wang R, et al. Prognostic significance and adjuvant chemotherapy survival benefits of a solid or micropapillary pattern in patients with resected stage ⅠB lung adenocarcinoma[J]. J Thorac Cardiovasc Surg, 2018, 155(3): 1227-1235. DOI:10.1016/j.jtcvs.2017.09.143 |
| [17] |
Pennell NA, Neal JW, Chaft JE, et al. SELECT: A phase Ⅱ trial of adjuvant erlotinib in patients with resected epidermal growth factor receptor-mutant non-small-cell lung cancer[J]. J Clin Oncol, 2019, 37(2): 97-104. DOI:10.1200/JCO.18.00131 |
| [18] |
Zhong WZ, Wang Q, Mao WM, et al. Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage Ⅱ-ⅢA (N1-N2) EGFR-mutant NSCLC (ADJUVANT/CTONG1104): A randomised, open-label, phase 3 study[J]. Lancet Oncol, 2018, 19(1): 139-148. DOI:10.1016/S1470-2045(17)30729-5 |
| [19] |
Yue DS, Xu SD, Wang Q, et al. Erlotinib versus vinorelbine plus cisplatin as adjuvant therapy in Chinese patients with stage ⅢA EGFR mutation-positive non-small-cell lung cancer (EVAN): a randomised, open-label, phase 2 trial[J]. Lancet Respir Med, 2018, 6(11): 863-873. DOI:10.1016/S2213-2600(18)30277-7 |
| [20] |
Wu YL, Tsuboi M, He J, et al. Osimertinib in resected EGFR-mutated non-small-cell lung cancer[J]. N Engl J Med, 2020, 383(18): 1711-1723. DOI:10.1056/NEJMoa2027071 |
| [21] |
Yue DS, Xu SD, Wang Q, et al. Updated overall survival (OS) and exploratory analysis from the randomized, phase Ⅱ EVAN study of erlotinib (E) versus vinorelbine plus cisplatin (NP) as adjuvant therapy in Chinese patients with stage ⅢA EGFR+ NSCLC[J]. J Clin Oncol, 2021, 39(Suppl 15): 8520. |
| [22] |
NCCN. NCCN Clinical Practice Guidelines in Oncology: non-small cell lung cancer (Version 5.2021)[OL]. (2021- 6-15)[2021-09-23]. https://www.nccn.org/
|
 2021, Vol. 36
2021, Vol. 36


