文章信息
- 龚耀, 鞠立荣, 张铁成
- Gong Yao, Ju Lirong, Zhang Tiecheng
- 安罗替尼联合EP方案一线治疗广泛期小细胞肺癌的回顾性研究
- Anlotinib combined with EP regimen as first-line treatment for extensive-stage small cell lung cancer: A retrospective study
- 实用肿瘤杂志, 2022, 37(6): 555-560
- Journal of Practical Oncology, 2022, 37(6): 555-560
-
通信作者
- 龚耀,E-mail:hawk_boy120@163.com
-
文章历史
- 收稿日期:2022-06-04
2. 南京医科大学附属淮安第一医院肿瘤内科, 江苏 淮安 223300
2. Department of Medical Oncology, Affiliated First Hospital of Huai'an, Nanjing Medical University, Huai'an 223300, China
肺癌是全球发病率及死亡率均居首位的恶性肿瘤,其中小细胞肺癌(small cell lung cancer,SCLC)约占肺癌发病总数的15%~20%[1]。临床上很少采用手术治疗。广泛期患者占SCLC的70%左右[2],在我国一线化疗采用铂类/依托泊苷联合治疗。SCLC对化疗初期响应良好,但极易产生耐药和复发。在过去的30年中,治疗SCLC的方法鲜有突破[3]。
安罗替尼是小分子新型多靶点的受体酪氨酸激酶抑制剂,通过抗血管生成作用抑制肿瘤的生长及转移,可在一定程度上缓解患者的病情,改善患者的生活质量[4]。目前,安罗替尼一线治疗广泛期SCLC的临床研究数据较少。本研究将新疆生产建设兵团第七师医院及南京医科大学附属淮安第一医院收治的56例广泛期SCLC患者作为研究对象,观察安罗替尼联合EP方案(依托泊苷+顺铂)临床应用的疗效及安全性。
1 资料与方法 1.1 纳入和排除标准纳入标准:(1)年龄18~75岁;(2)经病理组织学和(或)细胞学(纤维支气管镜、胸腔镜和肺穿刺等)确诊为广泛期SCLC;(3)体能状况(performance state,PS)评分≤2分;(4)未使用免疫治疗药物[程序性死亡受体-1(programmed death-1,PD-1)/程序性死亡受体配体-1(programmed death ligand-1,PD-L1)免疫治疗药物等]治疗;(5)为首次治疗。排除标准:(1)脑转移患者;(2)2个月内有活动性出血及有出血倾向的患者;(3)有严重的心血管疾病患者;(4)有两药联合无法控制的高血压;(5)伴意识异常者;(6)有其他严重伴随疾病者。
1.2 一般资料从2018年9月至2020年3月新疆生产建设兵团第七师医院(37例)及南京医科大学附属淮安第一医院(19例)收治的肺癌住院患者中筛选出符合纳入和排除标准的广泛期SCLC患者56例。按照患者自愿原则,采用安罗替尼联合EP方案化疗的患者26例(治疗组),采用EP方案化疗的患者30例(对照组)。治疗组年龄43~75岁,中位年龄63岁;对照组年龄44~75岁,中位年龄64岁。治疗组和对照组患者性别、年龄、吸烟情况、饮酒情况、转移部位和入院PS评分方面比较,差异均无统计学意义(均P>0.05,表 1)。本研究已通过新疆生产建设兵团第七师医院伦理审查委员会审批。
| 临床特征 | 治疗组(n=26) | 对照组(n=30) | χ2值 | P值 |
| 性别 | 0.000 | 0.983 | ||
| 男性 | 19(73.1) | 22(73.3) | ||
| 女性 | 7(26.9) | 8(26.7) | ||
| 年龄 | 0.026 | 0.999 | ||
| 40~49岁 | 1(3.8) | 1(3.3) | ||
| 50~59岁 | 7(26.9) | 8(26.7) | ||
| 60~69岁 | 14(53.8) | 16(53.3) | ||
| 70~79岁 | 4(15.4) | 5(16.7) | ||
| 吸烟 | 0.004 | 0.950 | ||
| 是 | 18(69.2) | 21(70.0) | ||
| 否 | 8(30.8) | 9(30.0) | ||
| 饮酒 | 0.062 | 0.803 | ||
| 是 | 13(50.0) | 16(53.3) | ||
| 否 | 13(50.0) | 14(46.7) | ||
| 脏器转移 | 0.110 | 0.991 | ||
| 肺内 | 9(34.6) | 10(33.3) | ||
| 肝脏 | 7(26.9) | 8(26.7) | ||
| 骨 | 5(19.2) | 7(23.3) | ||
| 腹部 | 7(26.9) | 8(26.7) | ||
| PS评分 | 0.005 | 0.942 | ||
| 0~1分 | 21(80.8) | 24(80.0) | ||
| 2分 | 5(19.2) | 6(20.0) |
对照组采用EP方案化疗(依托泊苷100 mg/m2,d1~3;顺铂25 mg/m2,d1~3;21 d为1个周期),共治疗4~6个周期。治疗组在上述EP方案基础上给予口服安罗替尼12 mg每天1次,从化疗第1天开始同步进行,清晨口服,连服14 d,停7 d,21 d为1个周期,直至出现疾病进展(progression disease,PD)或不良反应无法耐受。
1.4 观察指标依据实体瘤疗效反应的评价标准(Response Evaluation Criteria In Solid Tumors,RECIST)1.1版进行疗效评价[5],评价结果为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和PD,每2个周期进行肿瘤病灶测量,达到CR或PR的患者4周后复查以确认疗效。计算客观有效率(objective response rate,ORR)和疾病控制率(disease control rate,DCR)。ORR=(CR+PR)/总例数×100%。DCR=(CR+PR+SD)/总例数×100%。
不良反应评价:服药后不良反应根据美国国立癌症研究所推荐的不良事件标准(National Cancer Institute-Common Terminology Criteria Adverse Events,NCI-CTCAE)4.0版进行评估[5]。根据不良反应严重程度分为5级。1级:轻度;无症状或轻微;仅为临床或诊断所见;无需治疗。2级:中度;需要较小、局部或非侵入性治疗;与年龄相当的劳动性日常生活活动受限。3级:严重或医学上有重要意义但不立即危及生命;导致住院或延长住院时间;致残;个人日常生活活动受限。4级:危及生命;需要紧急治疗。5级:与不良事件相关的死亡。
比较两组患者总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)。OS指患者从接受治疗到死亡的时间。PFS指患者从接受治疗到观察到PD或者发生因为任何原因的死亡之间的这段时间。分析治疗组年龄、性别、吸烟情况、饮酒情况、转移情况和PS评分等因素对PFS的影响。
1.5 随访随访截至2022年3月31日。随访方法包括电话、微信及面访。随访内容包括生存情况、血压、身体一般状况、药物不良反应、定期的实验室检查及影像学检查。治疗组1例失访,对照组2例失访。
1.6 统计学分析应用SPSS 25.0软件进行统计学分析。计数资料采用频数(百分比)表示,组间比较采用χ2检验。采用Kaplan-Meier法进行生存分析。采用方差分析方法对治疗组PFS相关临床因素进行单因素分析。以P<0.05为差异具有统计学意义。
2 结果 2.1 近期疗效56例患者均完成>2个周期的化疗,可评价疗效。治疗组CR 2例,PR 13例,SD 8例,PD 3例,ORR为57.7%,DCR为88.5%。对照组CR 2例,PR 15例,SD 8例,PD 5例,ORR为56.7%,DCR为83.3%。两组ORR和DCR比较差异均无统计学意义(均P>0.05)。
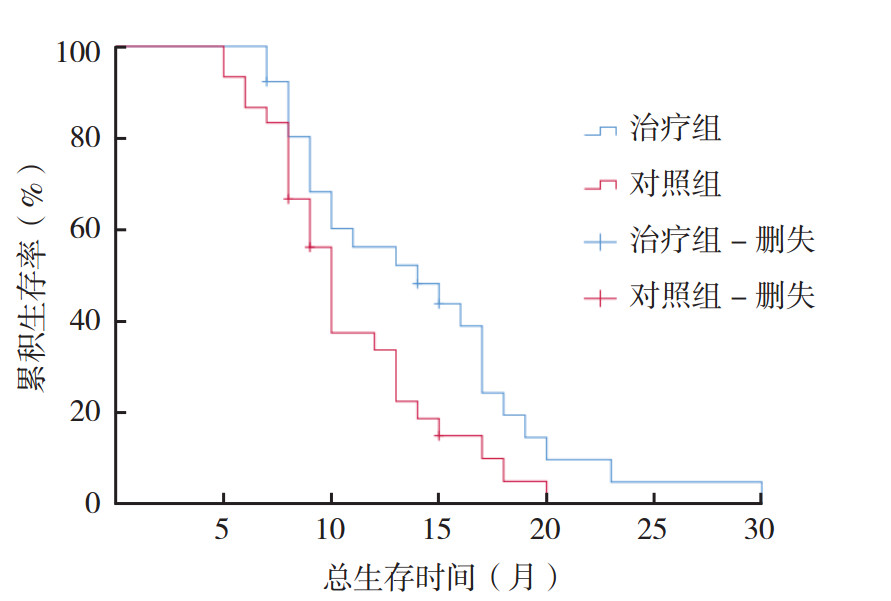
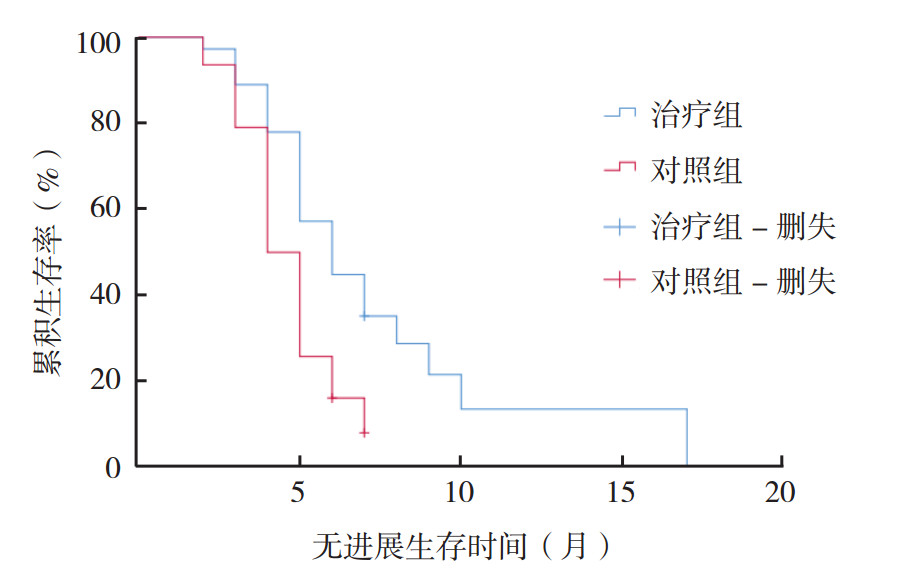
2.2 OS和PFS治疗组和对照组中位OS分别为14.2个月(95%CI:11.8~16.6个月)和10.9个月(95%CI:9.3~12.4个月),差异具有统计学意义(P=0.030,图 1)。治疗组和对照组中位PFS分别为6.0个月(95%CI:5.3~6.7个月)和4.0个月(95%CI:3.7~4.3个月),差异具有统计学意义(P<0.01,图 2)。
|
| 图 1 治疗组与对照组患者OS曲线比较 Fig.1 Comparison of OS curves of patients in the treatment and control groups |
|
| 图 2 治疗组与对照组患者PFS曲线比较 Fig.2 Comparison of PFS curves of patients in the treatment and control groups |
影响治疗组患者PFS的单因素分析显示,无肝转移的患者PFS好于有肝转移的患者(P=0.007,表 2)。PS评分0~1分的患者PFS有好于PS评分2分患者的趋势,但是差异无统计学意义(P=0.079)。患者PFS在性别、年龄、吸烟、饮酒、肺内转移、骨转移和腹部转移等方面比较,差异均无统计学意义(均P>0.05)。
| 影响因素 | 例数 | 平均PFS(月) | P值 |
| 性别 | 0.329 | ||
| 男性 | 19 | 5.2 | |
| 女性 | 7 | 6.6 | |
| 年龄 | 0.875 | ||
| 40~49岁 | 1 | 5.0 | |
| 50~59岁 | 7 | 5.1 | |
| 60~69岁 | 14 | 5.5 | |
| 70~79岁 | 4 | 6.8 | |
| 吸烟 | 0.157 | ||
| 是 | 18 | 5.0 | |
| 否 | 8 | 6.8 | |
| 饮酒 | 0.578 | ||
| 是 | 13 | 5.2 | |
| 否 | 13 | 5.9 | |
| 肺内转移 | 0.347 | ||
| 是 | 9 | 4.8 | |
| 否 | 17 | 6.0 | |
| 肝脏转移 | 0.007 | ||
| 是 | 7 | 3.0 | |
| 否 | 19 | 6.5 | |
| 骨转移 | 0.768 | ||
| 是 | 5 | 5.2 | |
| 否 | 21 | 5.7 | |
| 腹部转移 | 0.398 | ||
| 是 | 7 | 4.7 | |
| 否 | 19 | 5.9 | |
| PS评分 | 0.079 | ||
| 0~1分 | 21 | 6.1 | |
| 2分 | 5 | 3.4 | |
| 注 PFS:无进展生存期(progression-free survival) | |||
治疗组26例3例周围型SCLC的PFS均>6个月,最长的达到17个月。
2.4 不良反应治疗组与对照组在血液学毒性方面相当。非血液学毒性方面,治疗组在高血压、手足综合征、口腔黏膜炎和甲状腺功能减退方面不良反应发生率高于对照组(均P<0.05,表 3)。治疗组3~4级不良反应有高血压、手足综合征、口腔黏膜炎、咯血、甲状腺功能减退和血液学毒性。两组均未出现药物相关的死亡。
| 不良反应 | 治疗组 | 对照组 | 所有分级 | 3~4级 | |||||||
| 所有分级 | 3~4级 | 所有分级 | 3~4级 | χ2值 | P值 | χ2值 | P值 | ||||
| 血液学毒性 | |||||||||||
| 白细胞减少 | 25(96.1) | 6(23.1) | 28(93.3) | 7(23.3) | 0.219 | 0.640 | 0.001 | 0.982 | |||
| 血小板减少 | 16(61.5) | 2(7.7) | 17(56.7) | 1(3.3) | 0.137 | 0.712 | 0.522 | 0.470 | |||
| 血红蛋白减少 | 15(57.7) | 2(7.7) | 16(53.3) | 2(6.7) | 0.107 | 0.743 | 0.022 | 0.882 | |||
| 非血液学毒性 | |||||||||||
| 高血压 | 20(76.9) | 4(15.4) | 12(40.0) | 2(6.7) | 7.754 | 0.005 | 1.107 | 0.293 | |||
| 畏食/乏力 | 9(34.6) | 0(0.0) | 7(23.3) | 0(0.0) | 0.869 | 0.351 | - | - | |||
| 手足综合征 | 11(42.3) | 1(3.8) | 2(6.7) | 0(0.0) | 9.926 | 0.002 | 1.175 | 0.278 | |||
| 蛋白尿 | 3(11.5) | 0(0.0) | 2(6.7) | 0(0.0) | 0.407 | 0.524 | - | - | |||
| ALT/AST升高 | 4(15.4) | 0(0.0) | 3(10.0) | 0(0.0) | 0.369 | 0.543 | - | - | |||
| 口腔黏膜炎 | 8(30.8) | 1(3.8) | 1(3.3) | 0(0.0) | 7.773 | 0.005 | 1.175 | 0.278 | |||
| 腹泻 | 8(30.8) | 0(0.0) | 7(23.3) | 0(0.0) | 0.393 | 0.531 | - | - | |||
| 咯血 | 5(19.2) | 1(3.8) | 1(3.3) | 0(0.0) | 3.680 | 0.055 | 1.175 | 0.278 | |||
| 甲状腺功能减退 | 8(30.8) | 1(3.8) | 1(3.3) | 0(0.0) | 7.773 | 0.005 | 1.175 | 0.278 | |||
| 高脂血症 | 8(30.8) | 0(0.0) | 3(10.0) | 0(0.0) | 3.806 | 0.051 | - | - | |||
| 注 ALT:丙氨酸转氨酶(alanine aminotransferase);AST:天冬氨酸转氨酶(aspartate aminotransferase) | |||||||||||
治疗组20例发生高血压,13例使用降压药,其中包括血管紧张素转换酶抑制药(angiotensin converting enzyme inhibitor,ACEI)、血管紧张素受体拮抗剂(angiotonin receptor blocker,ARB)、利尿剂和钙离子拮抗剂,8例血压可控制在140/90 mmHg(1 mmHg=0.133kPa)以下,4例血压在140~159/90~99 mmHg。未出现高血压危象或高血压急症。未出现因高血压导致安罗替尼减量或停药。1例出现3级手足综合征,安罗替尼减至10 mg每天1次,手足综合征减轻至1级。8例出现口腔黏膜炎,建议患者保持口腔卫生,使用漱口水,避免进食辛辣等刺激性食物。7例对症处理后均控制在1级;1例为3级,安罗替尼减至10 mg每天1次后,口腔黏膜炎减轻至1级。5例出现咯血,2例为1级,对症止咳祛痰口服云南白药后缓解;2例为2级,使用氨基己酸注射液后缓解;1例为3级,静脉注射尖吻蝮蛇血凝血酶,暂停安罗替尼,咯血缓解。8例出现甲状腺功能减退,其中7例为1级,未予特殊处理;1例为3级,使用左旋甲状腺素替代治疗后缓解至1级。无因甲状腺功能减退导致药物减量或停药。出现血液学毒性的患者接受升白细胞、升血小板及纠正贫血等对症治疗后均控制良好。
3 讨论目前国内对于广泛期SCLC的一线治疗为4~6个周期的依托泊苷和顺铂/卡铂方案化疗,然后定期复查直至疾病出现进展后行二线治疗。一线化疗结果一直不尽人意。近几年来许多研究机构都在探索如何增加一线治疗的疗效。
一项关于广泛期SCLC的临床研究的治疗组为贝伐珠单抗联合依托泊苷+顺铂/卡铂方案作为一线及维持治疗药物,对照组为安慰剂联合相同化疗方案[6]。研究显示,治疗组与对照组的中位PFS为5.5个月和4.4个月,中位OS为9.4个月和10.9个月,治疗组无优势。Impower 133研究证实,阿替利珠单抗联合一线标准化疗使广泛期SCLC患者的OS延长2个月,死亡风险降低近30%,这也是近几十年来在广泛期SCLC一线系统治疗领域首个获得OS延长的临床试验[7]。阿替利珠单抗联合卡铂/依托泊苷也获得美国食品药物监督管理局(Food and Drug Administration,FDA)批准,成为广泛期SCLC一线治疗的新标准。CASPIAN研究结果显示,度伐利尤单抗联合化疗组(D+EP)中位OS优于单纯化疗组(12.9个月 vs 10.5个月),提示D+EP治疗能够为广泛期SCLC患者带来持续的OS获益[8]。KEYNOTE 604研究比较帕博利珠单抗联合标准化疗(卡铂或顺铂/依托泊苷)与安慰剂联合化疗一线治疗广泛期SCLC的疗效和安全性,帕博利珠单抗联合EP组中位OS为10.8个月,稍高于安慰剂联合EP组9.7个月,但差异无统计学意义(HR=0.80,95%CI:0.64~0.98,P=0.016 4;预先设定的OS检验界限为单侧P=0.012 8)[9]。ALTER0302[10]及ALTER0303[11]研究证实,既往接受过≥2种系统性化疗后进展或无法耐受的晚期非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者,安罗替尼能够延长其PFS和OS。ALTER1202研究证实,在SCLC患者三线及以上治疗中安罗替尼能延长PFS 3.4个月,安罗替尼组与安慰剂组患者的PFS分别为4.1个月和0.7个月[12]。安罗替尼为三线及以上SCLC患者提供一种治疗新选择。安罗替尼不仅在肺癌上取得良好疗效,在软组织肉瘤[13]、甲状腺髓样癌[14]、肾癌[15]和结直肠癌[16]等中也显现出良好的抗癌活性。安罗替尼治疗食管癌、乳腺癌和鼻咽癌等晚期肿瘤大型随机对照临床实验目前正在进行。
本研究回顾性分析安罗替尼联合化疗一线治疗广泛期SCLC的OS和PFS显示,治疗组中位OS和中位PFS较对照组均有所提高(14.2个月 vs 10.9个月,6.0个月 vs 4.0个月;均P<0.05)。其PFS及OS略高于免疫治疗联合化疗一线治疗广泛期SCLC。安罗替尼联合化疗有望成为国内一线治疗新标准。这需要大型的前瞻性研究加以证实。
在不良反应方面,安罗替尼联合化疗和单纯化疗比较血液学毒性相当,非血液学毒性上,安罗替尼联合化疗治疗的患者高血压、手足综合征、口腔黏膜炎和甲状腺功能减退发生率较高。安罗替尼联合化疗的患者3~4级不良反应有高血压、手足综合征、口腔黏膜炎、咯血、甲状腺功能减退和血液学毒性,未出现药物相关的死亡。
对治疗组患者PFS的单因素分析显示,无肝转移的患者PFS优于有肝转移患者(P=0.007)。PS评分0~1分的患者PFS有好于PS评分2分的患者的趋势,但是差异无统计学意义(P=0.079),可能是由于本研究病例数较少。
本研究通过回顾性分析安罗替尼联合化疗一线治疗广泛期SCLC获得良好效应,但在使用安罗替尼时要密切关注相关不良反应,对其进行全程管理。总之安罗替尼联合化疗一线治疗广泛期SCLC疗效显著,不良反应可控,期待大型前瞻性研究进一步证实。
| [1] |
刘通, 徐健, 许凝. CIK细胞免疫治疗联合化疗治疗广泛期小细胞肺癌一例[J]. 实用肿瘤杂志, 2021, 36(3): 218-221. |
| [2] |
Noone AM, Cronin KA, Altekruse SF, et al. Cancer incidence and survival trends by subtype using data from the surveillance epidemiology and end results program, 1992-2013[J]. Cancer Epidemiol Biomarkers Prev, 2017, 26(4): 632-641. DOI:10.1158/1055-9965.EPI-16-0520 |
| [3] |
Koinis F, Kotsakis A, Georgoulias V. Small cell lung cancer (SCLC): no treatment advances in recent years[J]. Transl Lung Cancer Res, 2016, 5(1): 39-50. |
| [4] |
Lin BY, Song XM, Yang DW, et al. Anlotinib inhibits angiogenesis via suppressing the activation of VEGFR2, PDGFRβ and FGFR1[J]. Gene, 2018, 654: 77-86. DOI:10.1016/j.gene.2018.02.026 |
| [5] |
黎超. SOX方案一线化疗后替吉奥维持治疗晚期胃癌的临床观察[J]. 实用肿瘤杂志, 2017, 32(6): 520-524. |
| [6] |
Spigel DR, Townley PM, Waterhouse DM, et al. Randomized phase Ⅱ study of bevacizumab in combination with chemotherapy in previously untreated extensive-stage small-cell lung cancer: results from the SALUTE trial[J]. J Clin Oncol, 2011, 29(16): 2215-2222. DOI:10.1200/JCO.2010.29.3423 |
| [7] |
Horn L, Mansfield AS, Szczęsna A, et al. First-line atezolizumab plus chemotherapy in extensive-stage smallcell lung cancer[J]. N Engl J Med, 2018, 379(23): 2220-2229. DOI:10.1056/NEJMoa1809064 |
| [8] |
Goldman JW, Dvorkin M, Chen YB, et al. Durvalumab, with or without tremelimumab, plus platinum-etoposide versus platinum-etoposide alone in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): updated results from a randomised, controlled, open-label, phase 3 trial[J]. Lancet Oncol, 2021, 22(1): 51-65. DOI:10.1016/S1470-2045(20)30539-8 |
| [9] |
Leal T, Wang YT, Dowlati A, et al. Randomized phase Ⅱ clinical trial of cisplatin/carboplatin and etoposide (CE) alone or in combination with nivolumab as frontline therapy for extensive-stage small cell lung cancer (ES-SCLC): ECOG-ACRIN EA5161[J]. J Clin Oncol, 2020, 38(15_suppl): 9000. DOI:10.1200/JCO.2020.38.15_suppl.9000 |
| [10] |
Han BH, Li K, Zhao YZ, et al. Anlotinib as a third-line therapy in patients with refractory advanced non-smallcell lung cancer: a multicentre, randomised phase Ⅱ trial (ALTER0302)[J]. Br J Cancer, 2018, 118(5): 654-661. DOI:10.1038/bjc.2017.478 |
| [11] |
Han BH, Li K, Wang QM, et al. Effect of anlotinib as a third-line or further treatment on overall survival of patients with advanced non-small cell lung cancer: the ALTER 0303 phase 3 randomized clinical trial[J]. JAMA Oncol, 2018, 4(11): 1569-1575. DOI:10.1001/jamaoncol.2018.3039 |
| [12] |
Cheng Y, Wang Q, Li K, et al. OA13.03 anlotinib as third-line or further-line treatment in relapsed SCLC: a multicentre, randomized, double-blind phase 2 trial[J]. J Thorac Oncol, 2018, 13(10): S351-S352. |
| [13] |
Ren BY, Wang W, Tan J, et al. Efficacy of anlotinib for the treatment of angiosarcoma of the face and neck: a case report[J]. Front Oncol, 2021, 11: 596732. DOI:10.3389/fonc.2021.596732 |
| [14] |
Ruan XH, Shi XL, Dong QM, et al. Antitumor effects of anlotinib in thyroid cancer[J]. Endocr Relat Cancer, 2019, 26(1): 153-164. |
| [15] |
宋岩, 依荷芭丽·迟, 杨林, 等. 安罗替尼治疗晚期肾细胞癌的疗效和安全性[J]. 中华肿瘤杂志, 2020, 42(9): 765-770. |
| [16] |
皇甫超男, 徐沭芬, 丁洁, 等. 安罗替尼联合5-氟尿嘧啶对结直肠癌细胞增殖和凋亡的影响[J]. 实用肿瘤杂志, 2021, 36(6): 507-513. |
 2022, Vol. 37
2022, Vol. 37


