文章信息
- 张喆琳, 廖予妹
- Zhang Zhelin, Liao Yumei
- 子宫内膜癌中MMR、p53、ER和PR表达与病理特征的关系及预后分析
- Relationship between expressions of MMR, p53, ER and PR and pathological features of endometrial carcinoma and prognostic analysis
- 实用肿瘤杂志, 2023, 38(6): 543-549
- Journal of Practical Oncology, 2023, 38(6): 543-549
基金项目
- 河南省科技攻关计划项目(182102310131)
-
通信作者
- 廖予妹, E-mail: liaoyumei99@163.com
-
文章历史
- 收稿日期:2022-06-30
子宫内膜癌是发达国家最常见的妇科恶性肿瘤,在我国居女性生殖系统恶性肿瘤第2位[1],发病率呈逐年升高趋势,且随着生活方式改变,发病人群不断呈现年轻化。目前关于子宫内膜癌的病因及发病机制尚不完全清楚。1983年,Bokhman[2]根据雌激素依赖与否将子宫内膜癌分为Ⅰ型和Ⅱ型。Ⅰ型和Ⅱ型内膜癌病理特征相互重叠,且仅使用形态学来识别这些肿瘤具有很大局限性,相同分型间内膜癌预后有时差别显著。2013年癌症基因图谱(The Cancer Genome Atlas,TCGA)对373例子宫内膜癌进行基因组学分析将子宫内膜癌分为4种亚型,分别为polymerase epsilon(POLE)突变型、微卫星不稳定型(microsatellite instability,MSI)、高拷贝型及低拷贝型;其中,高拷贝型预后最差,POLE突变型预后最好,对患者是否给予辅助治疗及判断预后提供指导价值[3]。但由于受测序技术及经济成本限制,这种分型在一些发展中国家或经济落后地区临床难以广泛开展。
近年来,有学者提出Proactive Molecular Risk Classifier for Endometrial Cancer(ProMisE)分型,通过对TCGA分类方法进行改良,即通过对DNA错配修复(mismatch repair, MMR)蛋白和p53蛋白的免疫组织化学(immunohistochemistry, IHC)检测及POLE突变分析,将子宫内膜癌分为POLE突变型、错配修复蛋白缺失(deficient mismatch repair,dMMR)型、p53突变型和p53野生型等[4]。这种分子分类方法经过证实与临床结局相关,由于进行ProMisE分型仍需进行POLE基因检测,国内关于分子分型的检测和临床应用还处于起步阶段,检测方法有待规范。目前临床上IHC测定MMR蛋白、p53蛋白、雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)技术较为成熟普及,且费用相对低廉。本研究通过对本院收治的178例子宫内膜癌组织进行IHC检测,将其分为dMMR组、p53突变组、ER和PR阳性组以及ER或PR阴性组,探讨子宫内膜癌MMR、p53、ER和PR蛋白表达与临床病理特征及预后的关系,旨在为子宫内膜癌诊治及目前临床检测现状下观察患者复发提供方向。
1 资料与方法 1.1 临床资料收集2017年1月至2020年12月就诊于郑州大学第二附属医院初次行手术治疗且临床病理资料完整的178例子宫内膜癌患者的临床信息。纳入标准:(1)临床资料完整且签署知情同意书;(2)经本院病理确诊为子宫内膜癌。排除标准:(1)病例信息不完整;(2)术前有过放化疗史。收集患者一般资料,包括年龄、绝经状态、孕产史、是否合并高血压、是否合并糖尿病、是否合并子宫肌瘤、是否合并腺肌病、病理类型、肿瘤直径、组织学分化程度、肌层浸润深度、脉管癌栓、盆腹腔淋巴结转移情况、腹腔冲洗液、国际妇产科联合会(Federation International of Gynecology and Obstetrics,FIGO)分期、MMR[包括mutL同源蛋白1(mutL homolog 1,MLH1)、mutS同源蛋白2(mutS homolog 2,MSH2)、MSH6和减数分裂后分离蛋白2(postmeiotic segregation increased 2,PMS2)]表达、p53表达、ER表达及PR表达等。本研究已经通过郑州大学第二附属医院伦理学委员会审查(伦理批件号为2022096)。
1.2 IHC染色MLH1(鼠单抗)、MSH2(兔单抗)、MSH6(兔单抗)、PMS2(兔单抗)、p53(鼠单抗)、ER(兔单抗)和PR(兔单抗)抗体试剂均购自北京中杉金桥生物技术有限公司。IHC采用链霉菌抗生物素蛋白-过氧化物酶连结法(streptavidin-perosidase,SP):石蜡切片3 μm,二甲苯脱蜡;高压修复,修复液选择乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)溶液;自来水冲洗抗原修复后的切片,用油笔圈固定玻片上待测组织区域,清洗液冲洗,在油笔圈定区域内加100 μL内源性过氧化酶封闭剂,室温下孵育5 min,清洗液冲洗;除去清洗液,加入100 μL目的抗体,室温孵育60 min,清洗液冲洗;除去清洗液,加入100 μL辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠/兔聚合物,室温孵育30 min,清洗液冲洗;除去清洗液,加入100 μL新鲜配制的二氨基联苯胺(diaminobenzidene,DAB)显色液(DAB底物和DAB缓冲液按1∶20比例配制所得),室温孵育5 min;自来水冲洗,加100 μL苏木精孵育3 min,自来水冲洗返蓝3 min;依次浸泡于70%乙醇、85%乙醇和无水乙醇脱水吹干后,二甲苯透明,中性树胶和盖玻片封片。最后置于光学显微镜下行IHC结果判读。
1.3 结果判定标准IHC染色结果由本院2位经验丰富的病理科医师独立阅片判读。MMR蛋白MLH1、MSH2、MSH6和PMS2:染色均定位于细胞核,观察到肿瘤细胞核明显着色(核着色数目≥10%)为阳性,肿瘤细胞核未着色时(核着色数目 < 10%)为阴性(图 1)。p53蛋白:在 > 80%的肿瘤细胞核出现弥漫强阳性表达或所有的肿瘤细胞核完全阴性表达时,为p53突变型(图 2);肿瘤细胞呈现细胞核散在阳性表达或强弱不等阳性表达时,为p53野生型。ER和PR表达:评估整张切片中阳性染色的肿瘤细胞数占所有肿瘤细胞的比例,当 > 10%的肿瘤细胞核呈现不同程度的着色时,判读为阳性,否则为阴性。
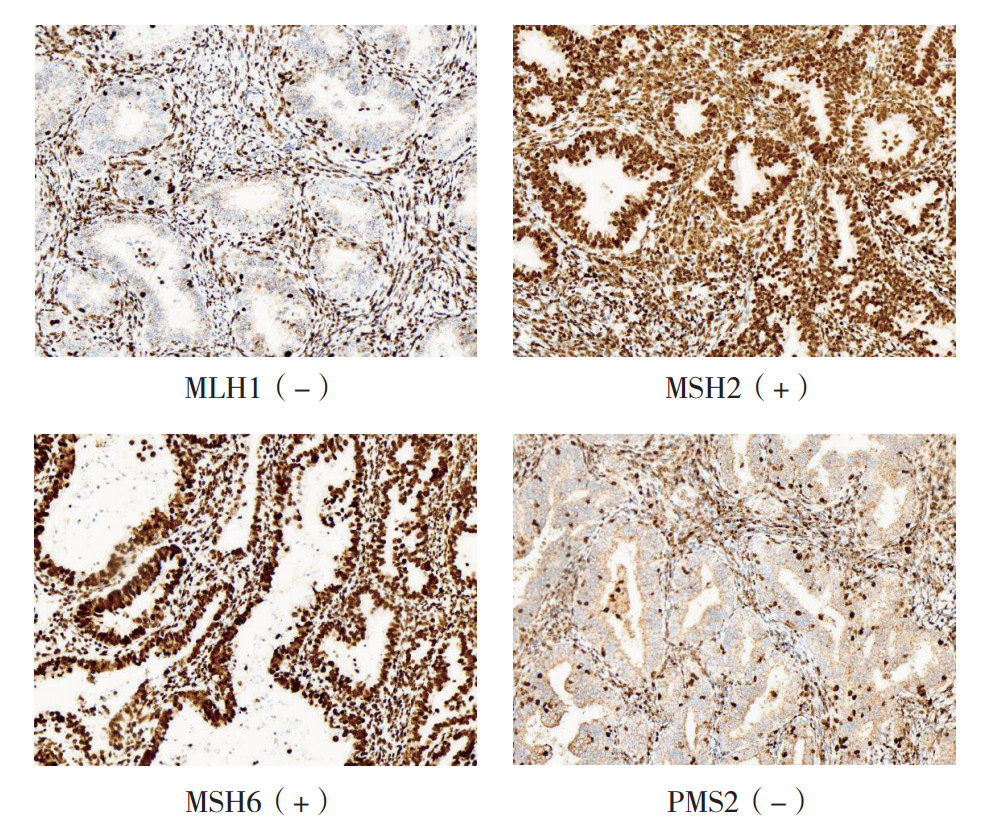
|
| 注 MLH1:mutL同源蛋白1(mutL homolog 1);MSH2:mutS同源蛋白2(mutS homolog 2);PMS2:减数分裂后分离蛋白2(postmeiotic segregation increased 2) 图 1 子宫内膜组织MMR蛋白免疫组织化学染色结果(SP×200) Fig.1 Immunohistochemical staining for MMR proteins in endometrial tissues (SP×200) |
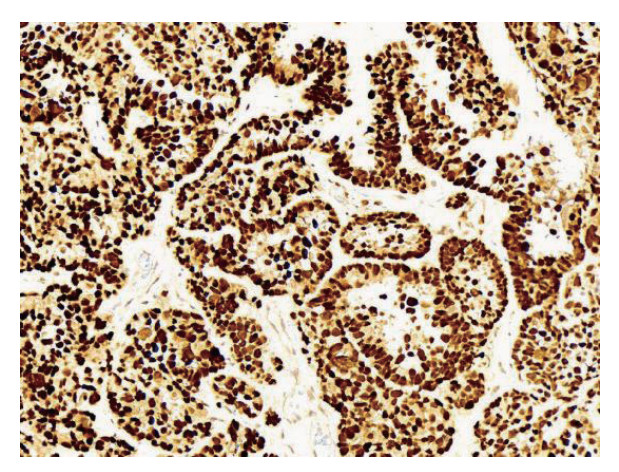
|
| 图 2 子宫内膜组织突变型p53蛋白免疫组织化学染色结果(SP×200) Fig.2 Immunohistochemical staining for mutant p53 protein in endometrial tissues (SP×200) |
子宫内膜癌分子检测中国专家共识(2021年版)提出,在分子分型的判读顺序中先根据MMR状态进行判断,若MMR蛋白表达有缺失,为dMMR;当MMR蛋白表达无缺失(proficient mismatch repair,pMMR)时,则进一步依据p53状态进行判断[5]。ER和PR表达缺失是肿瘤恶性程度较高的标志,一些肿瘤中ER和PR表达相关,PR往往作为ER功能的分子标志,PR功能依赖于ER的正常结构与功能,PR表达缺失可能是正常ER通路功能丧失的标志[6-7]。基于此,按以下顺序对子宫内膜癌患者进行分组:(1)MLH1、MSH2、MSH6和PMS2任意一项蛋白缺失者为dMMR组;(2)4个MMR蛋白均阳性表达即为pMMR时,根据p53表达情况进行分组,肿瘤细胞核弥漫强阳性表达或完全阴性表达者为p53突变组;(3)若p53呈野生型表达,根据ER和PR阳性与否,分为ER和PR阳性组(ER和PR同时为阳性者)以及ER或PR阴性组(ER或PR其中一种为阴性或同时阴性者)。
1.5 随访截止随访日期为2022年5月31日,随访时间5~64个月。随访方式为门诊复诊或者电话随访。随访内容包括有无自觉症状(腹痛、阴道出血、阴道排液和腹部肿块等)、血清肿瘤标志物情况[糖类抗原125(carbohydrate antigen 125,CA125)和人附睾蛋白4(human epididymis protein 4,HE4)等]、盆腔和腹膜后彩色多普勒超声以及盆腹腔CT和MRI检查等。随访开始时间为术后第1天,终点事件为子宫内膜癌复发,确定复发与否需有临床检验或病理学证据进行确诊。本研究定义无瘤生存期(disease-free survival,DFS)为患者自初次手术后1 d开始,到疾病出现进展或复发或因任何原因死亡的时间间隔。
1.6 统计学分析采用SPSS 26.0软件进行数据分析。符合正态分布的计量资料采用均数±标准差(x±s)表示,组间比较采用t检验;不符合正态分布的计量资料采用中位数(四分位间距)[M(Q1, Q3)]表示,采用非参数检验。计数资料比较采用χ2检验或Fisher精确检验。Kaplan-Meier生存曲线分析子宫内膜癌患者复发情况。单因素分析采用log-rank法。多因素分析采用Cox比例风险模型。以P < 0.05为差异具有统计学意义。
2 结果 2.1 一般资料178例子宫内膜癌患者发病年龄39~83岁,中位年龄56岁。其中,dMMR组39例,p53突变组65例,ER和PR阳性组51例,ER或PR阴性组23例;四组发病年龄M(Q1, Q3)分别为56(53,60)岁、58(54,63)岁、54(50,59)岁和55(53,62)岁,差异具有统计学意义(P=0.026)。
2.2 子宫内膜癌病理特征dMMR组、p53突变组、ER和PR阳性组以及ER或PR阴性组在绝经状态、是否合并子宫肌瘤或腺肌症、病理类型、肿瘤直径、盆腹腔淋巴结转移情况、腹腔冲洗液、组织学分化程度及FIGO分期方面比较,差异均具有统计学意义(均P < 0.05,表 1),在有无孕产史、是否合并高血压或糖尿病、肌层浸润深度和脉管癌栓方面比较,差异均无统计学意义(均P > 0.05)。
| 临床病理特征 | dMMR组(n=39) | p53突变组(n=65) | ER和PR阳性组(n=51) | ER或PR阴性组(n=23) | χ2值 | P值 |
| 年龄 | 3.468 | 0.326 | ||||
| <50岁 | 7(17.9) | 8(12.3) | 13(25.5) | 5(21.7) | ||
| ≥50岁 | 32(82.1) | 57(87.7) | 38(74.5) | 18(78.3) | ||
| 绝经状态 | 14.084 | 0.003 | ||||
| 未绝经 | 10(25.6) | 8(12.3) | 21(41.2) | 9(39.1) | ||
| 已绝经 | 29(74.4) | 57(87.7) | 30(58.8) | 14(60.9) | ||
| 孕产史 | 0.578 | 1.000 | ||||
| 无 | 1(2.6) | 3(4.6) | 2(3.9) | 1(4.3) | ||
| 有 | 38(97.4) | 62(95.4) | 49(96.1) | 22(95.7) | ||
| 高血压 | 4.223 | 0.238 | ||||
| 无 | 22(56.4) | 36(55.4) | 37(72.5) | 15(65.2) | ||
| 有 | 17(43.6) | 29(44.6) | 14(27.5) | 8(34.8) | ||
| 糖尿病 | 1.694 | 0.638 | ||||
| 无 | 31(79.5) | 52(80.0) | 45(88.2) | 19(82.6) | ||
| 有 | 8(20.5) | 13(20.0) | 6(11.8) | 4(17.4) | ||
| 子宫肌瘤或腺肌症 | 8.906 | 0.030 | ||||
| 无 | 19(48.7) | 41(63.1) | 18(35.3) | 12(52.2) | ||
| 有 | 20(51.3) | 24(36.9) | 33(64.7) | 11(47.8) | ||
| 病理类型 | 14.611 | 0.002 | ||||
| 子宫内膜样腺癌 | 34(87.2) | 49(75.4) | 51(100.0) | 19(82.6) | ||
| 非子宫内膜样腺癌 | 5(12.8) | 16(24.6) | 0(0.0) | 4(17.4) | ||
| 肿瘤直径 | 9.828 | 0.020 | ||||
| <2 cm | 13(33.3) | 14(21.5) | 25(49.0) | 7(30.4) | ||
| ≥2 cm | 26(66.7) | 51(78.5) | 26(51.0) | 16(69.6) | ||
| 肌层浸润深度 | 5.507 | 0.140 | ||||
| <1/2肌层 | 27(69.2) | 43(66.2) | 43(84.3) | 18(78.3) | ||
| ≥1/2肌层 | 12(30.8) | 22(33.8) | 8(15.7) | 5(21.7) | ||
| 脉管癌栓 | 3.401 | 0.334 | ||||
| 阴性 | 27(69.2) | 49(75.4) | 43(84.3) | 19(82.6) | ||
| 阳性 | 12(30.8) | 16(24.6) | 8(15.7) | 4(17.4) | ||
| 盆腹腔淋巴结 | 8.346 | 0.029 | ||||
| 阴性 | 33(84.6) | 57(87.7) | 50(98.0) | 23(100.0) | ||
| 阳性 | 6(15.4) | 8(12.3) | 1(2.0) | 0(0.0) | ||
| 腹腔冲洗液 | 7.942 | 0.033 | ||||
| 阴性 | 36(92.3) | 54(83.1) | 50(98.0) | 22(95.7) | ||
| 阳性 | 3(7.7) | 11(16.9) | 1(2.0) | 1(4.3) | ||
| 组织学分化程度 | 26.147 | <0.01 | ||||
| 高分化 | 19(48.7) | 21(32.3) | 36(70.6) | 12(52.2) | ||
| 中分化 | 12(30.8) | 24(36.9) | 15(29.4) | 4(17.4) | ||
| 低分化 | 8(20.5) | 20(30.8) | 0(0.0) | 7(30.4) | ||
| FIGO分期 | 18.182 | 0.011 | ||||
| Ⅰ期 | 28(71.8) | 43(66.2) | 47(92.2) | 21(91.3) | ||
| Ⅱ期 | 2(5.1) | 8(12.3) | 3(5.9) | 1(4.3) | ||
| Ⅲ期 | 8(20.5) | 13(20.0) | 1(2.0) | 1(4.3) | ||
| Ⅳ期 | 1(2.6) | 1(1.5) | 0(0.0) | 0(0.0) | ||
| 注 dMMR: 错配修复蛋白缺失(deficient mismatch repair);ER:雌激素受体(estrogen receptor);PR:孕激素受体(progesterone receptor);FIGO:国际妇产科联合会(Federation International of Gynecology and Obstetrics) | ||||||
178例患者中,失访8例。随访的170例患者中,23例复发,复发率为13.5%。其中dMMR组复发2例(1.2%),p53突变组复发16例(9.4%),ER和PR阳性组复发2例(1.2%),ER或PR阴性组复发3例(1.8%)。四组复发率比较,差异具有统计学意义(P=0.002)。dMMR组、p53突变组、ER和PR阳性组和ER或PR阴性组5年DFS率分别为94.1%、56.1%、92.6%和78.3%。四组DFS比较,差异具有统计学意义(P < 0.05,图 3)。
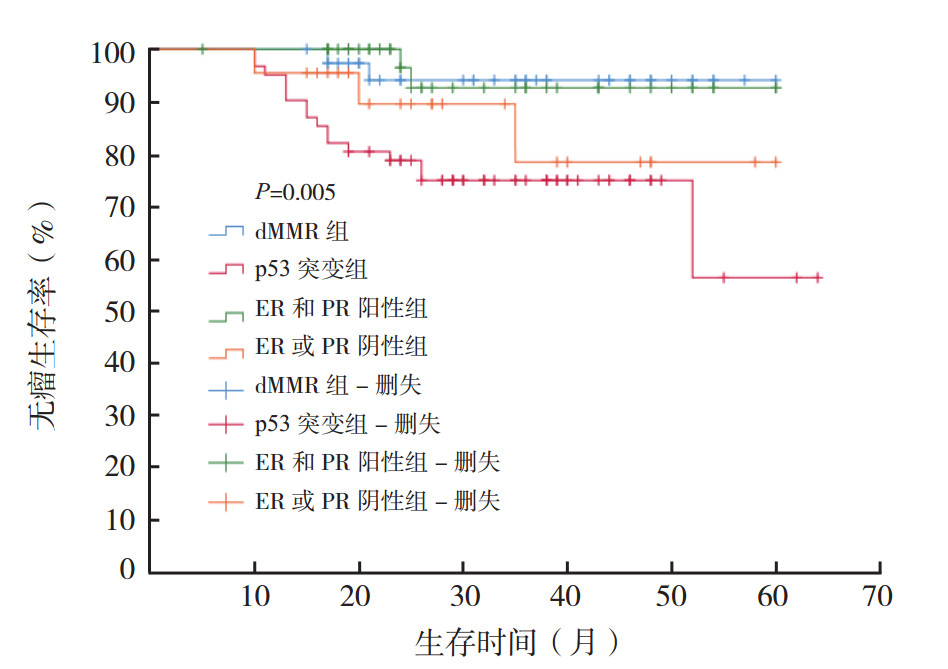
|
| 注 dMMR:错配修复蛋白缺失(deficient mismatch repair);ER:雌激素受体(estrogen receptor);PR:孕激素受体(progesterone receptor) 图 3 dMMR组、p53突变组、ER和PR阳性组以及ER或PR阴性组子宫内膜癌患者无瘤生存曲线比较 Fig.3 Disease-free survival curves of endometrial carcinoma patients in the dMMR, p53 mutation, ER and PR positive, and ER or PR negative groups |
单因素分析显示,子宫内膜癌患者DFS在病理类型、肌层浸润深度、脉管癌栓、盆腹腔淋巴结转移、组织学分化程度和FIGO分期方面比较,差异均具有统计学意义(均P < 0.05,表 2)。纳入这些相关因素,构建多因素Cox比例风险模型发现,组织学分化程度及FIGO分期均是子宫内膜癌患者DFS的独立危险因素(均P < 0.05,表 3)。
| 临床病理特征 | χ2值 | P值 | HR | 95% CI |
| 年龄 | 1.409 | 0.235 | 2.347 | 0.550~10.017 |
| 绝经状态 | 3.782 | 0.052 | 3.812 | 0.893~16.272 |
| 孕产史 | 0.145 | 0.704 | 0.679 | 0.091~5.064 |
| 合并高血压 | 2.884 | 0.089 | 2.014 | 0.883~4.595 |
| 合并糖尿病 | 0.054 | 0.816 | 0.880 | 0.299~2.588 |
| 合并子宫肌瘤或腺肌症 | 0.245 | 0.621 | 0.812 | 0.356~1.853 |
| 病理类型 | 11.447 | 0.001 | 4.008 | 1.679~9.567 |
| 肿瘤直径 | 1.244 | 0.265 | 1.745 | 0.648~4.704 |
| 肌层浸润深度 | 4.591 | 0.032 | 2.416 | 1.051~5.557 |
| 脉管癌栓 | 13.767 | <0.01 | 4.167 | 1.837~9.454 |
| 盆腹腔淋巴结转移 | 21.288 | <0.01 | 6.275 | 2.569~15.33 |
| 腹腔冲洗液 | 2.537 | 0.111 | 2.343 | 0.796~6.897 |
| 组织学分化程度 | 12.310 | 0.002 | 6.629 | 2.033~21.614 |
| FIGO分期 | 41.55 | <0.01 | 9.341 | 3.672~23.759 |
| 注 FIGO:国际妇产科联合会(Federation International of Gynecology and Obstetrics) | ||||
| 临床病理特征 | B | SE | Wald | P值 | HR | 95% CI |
| 病理类型 | 0.555 | 0.611 | 0.825 | 0.364 | 1.742 | 0.526~5.771 |
| 肌层浸润深度 | -0.578 | 0.523 | 1.222 | 0.269 | 0.561 | 0.202~1.563 |
| 脉管癌栓 | 0.412 | 0.528 | 0.607 | 0.436 | 1.510 | 0.536~4.253 |
| 盆腹腔淋巴结转移 | 0.661 | 0.663 | 0.995 | 0.319 | 1.937 | 0.528~7.097 |
| 组织学分化程度 | 1.497 | 0.752 | 3.966 | 0.046 | 4.467 | 1.024~19.485 |
| FIGO分期 | 1.843 | 0.691 | 7.111 | 0.008 | 6.316 | 1.630~24.475 |
| 注 FIGO:国际妇产科联合会(Federation International of Gynecology and Obstetrics) | ||||||
约25%~30%的子宫内膜癌为dMMR型[8],约75%的dMMR型子宫内膜癌为散发性。散发性子宫内膜癌多由MMR双等位基因体细胞突变(2个致病性变异或1个致病性变异和杂合性缺失)或MLH1基因启动子高甲基化引起[9]。10%的dMMR型子宫内膜癌与林奇综合征(Lynch syndrome,LS)有关[10]。LS是一种常染色体显性遗传的癌症综合征,发生基于4个关键MMR基因中的1个常染色体显性杂合种系突变引起,导致编码蛋白的功能丧失,相关肿瘤包括结直肠癌和子宫内膜癌等;其中子宫内膜癌中位发病年龄约48岁,较散发性子宫内膜癌早10~20岁,常作为“前哨肿瘤”发生,为检测家族中的LS提供宝贵机会。研究表明,年轻子宫内膜癌患者(年龄 < 50岁)中,每10例中有1例为LS[11]。因此,对于dMMR型子宫内膜癌需结合患者家族史及病理特征行进一步基因检测,以排除LS,从而达到早期干预。
MMR蛋白IHC测定是子宫内膜癌中MSI分子检测的高度精确替代方法[12]。有研究发现,仅检测PMS2和MSH6蛋白即可用于筛查dMMR;其准确度相当于检测所有4种蛋白[13],可以降低IHC检测的成本。原因可能是由于MMR蛋白以异源二聚体形式出现,MLH1的缺失始终导致PMS2的伴随缺失,而MSH2的缺失始终导致MSH6的伴随缺失,另一方面,PMS2或MSH6的缺失并不意味着MLH1或MSH2的伴随缺失。因此,MSH6和PMS2的IHC检测可作为更为经济的简化方法,以鉴定子宫内膜癌的MSI亚型。
有研究证实,p53蛋白IHC检测和TP53基因突变一致性可达92.1%[14]。所以p53蛋白的IHC检测可作为TP53测序的高度精确替代。如p53突变与POLE突变或dMMR同时存在,应以POLE突变或dMMR的预后因素为主[5]。本研究也显示,同时具有dMMR及p53突变的患者16例,自观察以来,无1例复发,预后较好。有研究提出一种简化的ProMisE分型:对子宫内膜癌患者首先行MMR IHC检测,pMMR者再行p53 IHC检测后,将患者分为dMMR型、p53突变型和p53野生型;研究证实,这种简化的ProMisE分型对子宫内膜癌预后有一定指导作用[15]。在子宫内膜癌中,ER和PR的表达与手术病理分期及组织分级均呈负相关;即病理分期或组织分级越高,其在EC组织中的阳性表达率越低,早期或较低级别子宫内膜癌通常保留ER和PR表达,而晚期低分化肿瘤通常缺乏这些受体之一或两者均缺乏[16]。本研究对简化ProMisE分型中的p53野生型进一步分类为ER和PR阳性组以及ER或PR阴性组;对患者复发情况进行随访发现,p53突变组DFS最差,ER或PR阴性组其次,进一步提示p53突变以及ER和PR阴性的子宫内膜癌患者预后不良。
子宫内膜癌5年总生存率 > 95%,如有局部扩散或远处转移,则5年总生存率分别降至68%或17%[17]。本研究中23例复发患者中,6例发生盆腹腔淋巴结转移,10例脉管癌栓阳性,5年DFS率为86.5%,与既往研究相符合[17]。进行分组后,p53突变组DFS最差,5年DFS率降至56.1%。p53作为一种抑癌蛋白,发生突变时,会失去功能[18]。p53突变型子宫内膜癌病理特征常表现为非子宫内膜样癌、低分化以及淋巴脉管间隙浸润等,恶性程度高。近年来有研究发现,p53突变体聚集与肿瘤生长之间有较强的相关性,小的应激分子可能具有调节p53突变体聚集的潜力[19]。未来可以考虑在隐性药物载体中配制对肿瘤微环境具有靶标特异性的应激分子,以实现对p53突变体的精准靶向治疗,提高生存率。
MSI和雌激素之间可能存在诸多联系。雌激素可能具有保护作用,在MMR系统发生一定程度的调节(突变)后,这种保护作用可能丧失。另一方面,雌激素可以通过其致癌作用直接(通过突变)或间接(通过甲基化)使MMR途径失活,从而导致MSI。MSI随后可导致辅因子或ER信号发生突变,从而调节ER调控转录,因此MMR系统是雌激素的直接或间接靶点。孕激素通过与PR结合,激活靶细胞内相应的调控途径抑制肿瘤的发展。临床上常使用孕激素治疗早期或有生育要求的子宫内膜癌患者,同时孕激素也可以对ER产生降调节作用,通过受体水平以及细胞内酶系统等拮抗雌激素的作用[20]。雌孕激素通过与雌孕激素受体结合调节一系列生物学效应,未来关于MSI型子宫内膜癌与雌孕激素、ER和PR之间的相互关系,需要进一步实验性研究进行解释。本研究将同时具有ER或PR阴性者和dMMR者,均归为dMMR组,相对于ER或PR阴性组有更好的预后,可以为后续研究提供一定的参考意义。
综上所述,子宫内膜癌各亚组间具有异质性,不同的分型之间IHC及病理特征有明显重合。本研究结合子宫内膜癌MMR、p53、ER及PR蛋白IHC结果,将子宫内膜癌分为四组,经过分析发现四组间DFS差异具有统计学意义(P < 0.05)。这提示这些蛋白的IHC检测可以用于评估患者复发情况,且临床操作经济简便,实用性强,也可通过术前诊刮检测其表达,对观察子宫内膜癌病理特征及了解其预后提供一定的指导意义。
| [1] |
McAlpine J, Leon-Castillo A, Bosse T. The rise of a novel classification system for endometrial carcinoma; integration of molecular subclasses[J]. J Pathol, 2018, 244(5): 538-549. DOI:10.1002/path.5034 |
| [2] |
Bokhman JV. Two pathogenetic types of endometrial carcinoma[J]. Gynecol Oncol, 1983, 15(1): 10-17. DOI:10.1016/0090-8258(83)90111-7 |
| [3] |
Cancer Genome Atlas Research Network, Kandoth C, Schultz N, et al. Integrated genomic characterization of endometrial carcinoma[J]. Nature, 2013, 497(7447): 67-73. DOI:10.1038/nature12113 |
| [4] |
Talhouk A, McConechy MK, Leung S, et al. A clinically applicable molecular-based classification for endometrial cancers[J]. Br J Cancer, 2015, 113(2): 299-310. DOI:10.1038/bjc.2015.190 |
| [5] |
Yan HL, Wu WG, Ge HY, et al. Up-regulation of miR- 204 enhances anoikis sensitivity in epithelial ovarian cancer cell line via brain-derived neurotrophic factor pathway in vitro[J]. Int J Gynecol Cancer, 2015, 25(6): 944-952. DOI:10.1097/IGC.0000000000000456 |
| [6] |
Köbel M, Atenafu EG, Rambau PF, et al. Progesterone receptor expression is associated with longer overall survival within high-grade histotypes of endometrial carcinoma: a Canadian high risk endometrial cancer consortium (CHREC) study[J]. Gynecol Oncol, 2016, 141(3): 559-563. DOI:10.1016/j.ygyno.2016.04.008 |
| [7] |
Hou XX, Zhao M, Wang T, et al. Upregulation of estrogen receptor mediates migration, invasion and proliferation of endometrial carcinoma cells by regulating the PI3K/AKT/ mTOR pathway[J]. Oncol Rep, 2014, 31(3): 1175-1182. DOI:10.3892/or.2013.2944 |
| [8] |
Raffone A, Travaglino A, Cerbone M, et al. Diagnostic accuracy of immunohistochemistry for mismatch repair proteins as surrogate of microsatellite instability molecular testing in endometrial cancer[J]. Pathol Oncol Res, 2020, 26(3): 1417-1427. DOI:10.1007/s12253-020-00811-5 |
| [9] |
Casey L, Singh N. POLE, MMR, and MSI testing in endometrial cancer: proceedings of the ISGyP companion society session at the USCAP 2020 annual meeting[J]. Int J Gynecol Pathol, 2021, 40(1): 5-16. DOI:10.1097/PGP.0000000000000710 |
| [10] |
张晔, 胡元晶. Lynch综合征相关子宫内膜癌诊断的思考和化学治疗的进展[J]. 现代妇产科进展, 2019, 28(1): 58-61. DOI:10.13283/j.cnki.xdfckjz.2019.01.014 |
| [11] |
Lu KH, Schorge JO, Rodabaugh KJ, et al. Prospective determination of prevalence of lynch syndrome in young women with endometrial cancer[J]. J Clin Oncol, 2007, 25(33): 5158-5164. DOI:10.1200/JCO.2007.10.8597 |
| [12] |
彭巧华, 吕卫国. 2022年第1版《NCCN子宫颈癌临床实践指南》解读[J]. 实用肿瘤杂志, 2022, 37(3): 205-214. DOI:10.13267/j.cnki.syzlzz.2022.034 |
| [13] |
Niu BT, Hammond RFL, Leen SLS, et al. Two versus four immunostains for Lynch syndrome screening in endometrial carcinoma[J]. Histopathology, 2019, 75(3): 442-445. DOI:10.1111/his.13898 |
| [14] |
Singh N, Piskorz AM, Bosse T, et al. p53 immunohistochemistry is an accurate surrogate for TP53 mutational analysis in endometrial carcinoma biopsies[J]. J Pathol, 2020, 250(3): 336-345. DOI:10.1002/path.5375 |
| [15] |
张柳萍. MMR和p53检测在子宫内膜癌中临床应用及差异基因表达研究[D]. 汕头: 汕头大学, 2021.
|
| [16] |
曹萌青. 子宫内膜癌ER、PR、p53、Ki-67的表达及血清CA125水平的临床分析[D]. 延安: 延安大学, 2017.
|
| [17] |
Colombo N, Creutzberg C, Amant F, et al. ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer: diagnosis, treatment and follow-up[J]. Ann Oncol, 2016, 27(1): 16-41. DOI:10.1093/annonc/mdv484 |
| [18] |
李珍, 董杏, 宿晓晓, 等. ING4、p53和p21在子宫内膜样癌中的表达及意义[J]. 实用肿瘤杂志, 2021, 36(3): 252-258. DOI:10.13267/j.cnki.syzlzz.2021.052 |
| [19] |
Kanapathipillai M. Treating p53 mutant aggregation-associated cancer[J]. Cancers, 2018, 10(6): 154. DOI:10.3390/cancers10060154 |
| [20] |
Markowska A, Chudecka-Głaz A, Pityński K, et al. Endometrial cancer management in young women[J]. Cancers, 2022, 14(8): 1922. DOI:10.3390/cancers14081922 |
 2023, Vol. 38
2023, Vol. 38


