文章信息
- 杨晓峰, 王倩倩
- Yang Xiaofeng, Wang Qianqian
- lncRNA BLACAT1在膀胱癌中的表达及意义
- Expression of lncRNA BLACAT1 in bladder cancer and its significance
- 实用肿瘤杂志, 2022, 37(6): 501-507
- Journal of Practical Oncology, 2022, 37(6): 501-507
基金项目
- 山东省医药卫生科技发展计划(202004050302);济宁医学院教师科研扶持基金(JYFC2019FKJ143)
-
通信作者
- 杨晓峰,E-mail:young-2001@163.com
-
文章历史
- 收稿日期:2021-04-08
2. 济宁医学院附属枣庄市立医院肾内科, 山东 枣庄 277100
2. Department of Nephrology, Zaozhuang Municipal Hospital Affiliated to Jining Medical University, Zaozhuang 277100, China
膀胱癌因其高发病率和高死亡率被列为十大最常见的致命癌症之一[1]。同时,早期缺乏生物标志物导致膀胱癌的诊断较差。因此,深入研究膀胱癌中潜在的分子机制具有重要意义。目前普遍认为,长链非编码RNA(long non-coding RNA,lncRNA)通常长度 > 200 nt,是没有蛋白质编码能力的转录物[2]。在过去的几年里,大量lncRNA被发现,是参与各种癌症细胞过程的重要调节因素[3]。lncRNA RHPN1-AS1被认为可以加速乳腺癌的发展[4],lncRNA-UCA1通过miR-495靶向肝再生磷酸酶-3(phosphatase of regenerating liver-3,PRL-3)参与胃癌细胞增殖[5]。lncRNA被发现是胃癌的潜在生物标志物[6]。研究显示,lncRNA bladder cancer-associated transcript 1(BLACAT1)表达和膀胱癌淋巴发生转移情况相关,监测其表达水平可作为膀胱癌手术清扫淋巴范围的参考[7]。然而,BLACAT1与患者预后的研究尚未报道,如何将实验室结论与临床应用有效转化仍没有报道。本文通过功能分析评估BLACAT1在膀胱癌中的具体作用,通过实验验证BLACAT1在膀胱癌中的功能,同时结合临床资料和病理数据进一步阐明其在预后评判中的指导作用。
1 材料与方法 1.1 数据库分析2019年12月1日从GEPIA数据库(http://gepia.cancer-pku.cn/)获取正常组织和肿瘤组织基因差异的数据。在Expression DIY的“Box Plot”模块中设置筛选条件:(1)Gene:BLACAT1;(2)Datasets Selection(Cancer name):BLCA(Bladder Urothelial Carcinoma);(3)Log Scale:yes;(4)Jitter Size:0.4;(5)Matched Normal data:Match TCGA normal and GTEx data。从GEPIA数据库中提取数据生成方框图,分析BLACAT1的表达水平,数据库中与膀胱肿瘤相关的肿瘤病例404例,非肿瘤28例。
1.2 细胞株来源及培养人正常膀胱上皮细胞(SV-HUC-1)和4种人膀胱癌细胞株[UM-UC-3、HTB1(J82)、HTB4(T24)和HTB-9(5637)]均来自美国模式培养物保藏所(American Type Culture Collection,ATCC)。将所有细胞置于含10% FBS的DMEM培养液中,在37℃ 5% CO2环境中培养。
1.3 临床资料选取2018年1月至2020年6月本院确诊并行膀胱癌手术治疗的患者98例为研究对象,其中,男性48例,女性50例;年龄44~72岁,(54.75±8.04)岁;临床分期(T分期):≤T2a期48例,T2b期27例,≥T2c期23例。
纳入标准:(1)经病理组织确诊为膀胱尿路上皮癌患者;(2)患者临床资料完整;(3)患者均行手术治疗;(4)患者及家属知情并签署知情同意书。排除标准:(1)非首发膀胱癌患者;(2)合并糖尿病、高血压和冠心病等疾病的患者;(3)其他恶性肿瘤患者。本研究经济宁医学院附属枣庄市立医院伦理委员会批准通过。
1.4 质粒的构建和转染设计的针对BLACAT1的shRNA以及相应的对照shRNA质粒均由上海Genechem公司合成。将pcDNA3.1载体(Invitrogen,美国)用BLACAT1亚克隆过表达,空pcDNA3.1载体作为阴性对照。所有细胞转染均使用阳离子脂质体(Lipofectamine 3000,Lipo 3000;Invitrogen,美国)。实验选取人膀胱癌UM-UC-3和HTB1(J82)细胞株进行BLACAT1基因敲除,设置对照组(sh-NC组)和两组平行实验组(sh-BLACAT1#1组和sh-BLACAT1#2组)。细胞转染后24~48 h进行后续各项研究。
1.5 总RNA提取及实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)选取患者术后膀胱癌组织50 mg加入1 mL Trizol液(Invitrogen,美国)研磨后分离核蛋白复合物,离心后去除细胞碎片。膀胱癌细胞株[UM-UC-3、HTB1(J82)、HTB4(T24)和HTB-9(5637)]经过离心分离细胞后加入Trizol液。使用Trizol液分离总RNA,使用反转录试剂盒PrimeScript RT master mix(Takara,日本)合成cDNA。为评价BLACAT1表达情况,应用SYBR Green PCR试剂盒(Takara,日本)进行qPCR。将组织研磨后进行RNA提取和反转录,所得cDNA用于qRT-PCR实验。94℃7 min;94℃50 s、65℃30 s、72℃20 s,20个循环。每个样本设置2次重复,采用2-△△Ct法计算lncRNA BLACAT1相对表达水平。lncRNA BLACAT1以GAPDH为内参。lncRNA BLACAT1上游引物序列为5'-CGCTCTGCTCCAGTTATGTA-3',下游引物序列为5'-GGACATTGATAGCCTGTGGAC-3'。GAPDH上游引物序列为5'-TGCACCAACTGCTTAGC-3',下游引物序列为5'-GGCATGGACTGTGGTCATGAG-3'。
1.6 集落形成实验细胞以每孔500个细胞的密度接种于6孔板中孵育2周。4%多聚甲醛溶液(paraformaldehyde,PFA)固定30 min后,用0.5%结晶紫溶液染色5 min,手工记录可见集落。
1.7 5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine,EdU)增殖检测实验使用BeyoClick EdU-594细胞增殖检测试剂盒(碧云天生物,上海),进行EdU增殖测定。将转染的细胞以1×104/孔在96孔板中培养,使用EdU和DAPI溶液进行双重染色后,在激光共聚焦显微镜(Olympus,日本)下观察细胞。
1.8 TUNEL实验检测将转染的UM-UC-3和HTB1(J82)细胞用4%的PFA处理,然后加入TUNEL试剂(Merck KGaA,德国)。DAPI染料染色后,使用光学显微镜(Olympus,日本)对标记的样品进行分析。
1.9 Transwell法检测取2×104细胞加入transwell板的上腔室。在底腔中加入含20%胎牛血清(fetal bovine serum,FBS)的完全培养液。将基质凝胶(BD Biosciences,美国)加入细胞进行入侵实验,不加入基质进行迁移实验。24 h后,细胞经结晶紫染色计数。
1.10 动物实验BALB/c裸鼠(6周龄)取自上海实验动物研究中心。在体内肿瘤形成实验中,将sh-NC和sh-BLACAT1#1转染的HTB1(J82)细胞悬浮在PBS中,皮下注射(0.01 mL/g)至裸鼠体内, 根据注射试剂不同,分为2组,每组5只,每5天测量肿瘤体积,1个月后,对裸鼠实施安乐死,裸鼠肿瘤被切除并称重。此外,将转染sh-NC和sh-BLACAT1#1的HTB1(J82)细胞的悬浮液按照0.01 mL/g注射到裸鼠尾静脉进行肿瘤转移实验,根据注射试剂不同,分为2组,每组5只。50 d后对裸鼠实施安乐死,取肺后用4%多聚甲醛溶液固定,进行HE染色,在光学显微镜(Olympus,日本)下观察肺转移灶。所有动物实验均经济宁医学院附属枣庄市立医院伦理委员会批准。
1.11 统计学分析采用GraphPad Prism 7软件进行数据分析。计量资料采用均数±标准差(x±s)表示,采用t检验或单因素方差分析组间差异。实验进行≥3次。以P < 0.05为差异具有统计学意义。
2 结果 2.1 BLACAT1在膀胱癌中的表达情况GEPIA数据显示,BLACAT1在膀胱癌组织和正常膀胱组织中的表达比较,差异具有统计学意义(P < 0.05,图 1A)。RT-qPCR检测显示,与人正常膀胱上皮细胞SV-HUC-1比较,4种膀胱癌细胞株[UM-UC-3、HTB1(J82)、HTB4(T24)和HTB-9(5637)]中BLACAT1表达均上调(均P < 0.05,图 1B)。

|
| 注 A:GEPIA数据库中膀胱癌组织和正常膀胱组织中BLACAT1的表达水平;B:RT-qPCR法检测BLACAT1在膀胱癌细胞株和正常膀胱上皮细胞株中的表达情况;*与正常膀胱上皮细胞株SV-HUC-1比较,P < 0.01 图 1 BLACAT1在膀胱癌组织和细胞中的表达情况 Fig.1 Expression of BLACAT1 in bladder cancer tissues and cells |
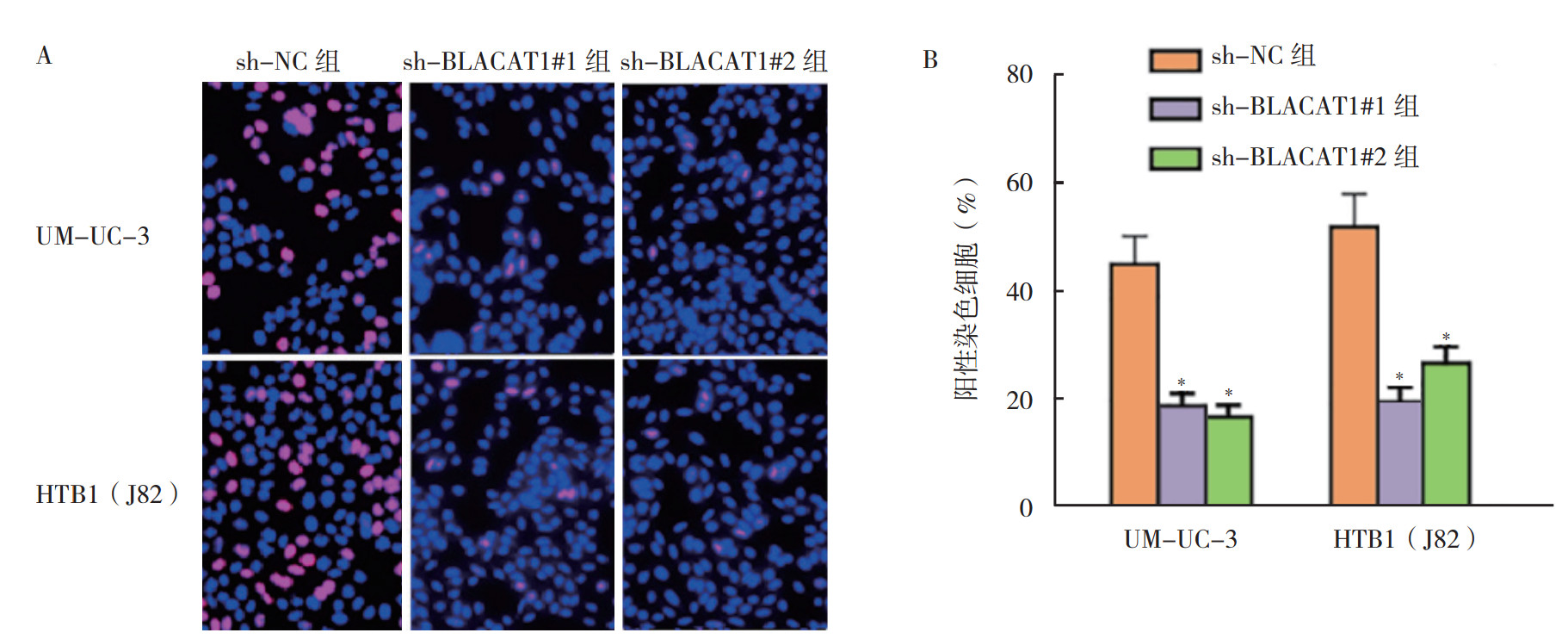
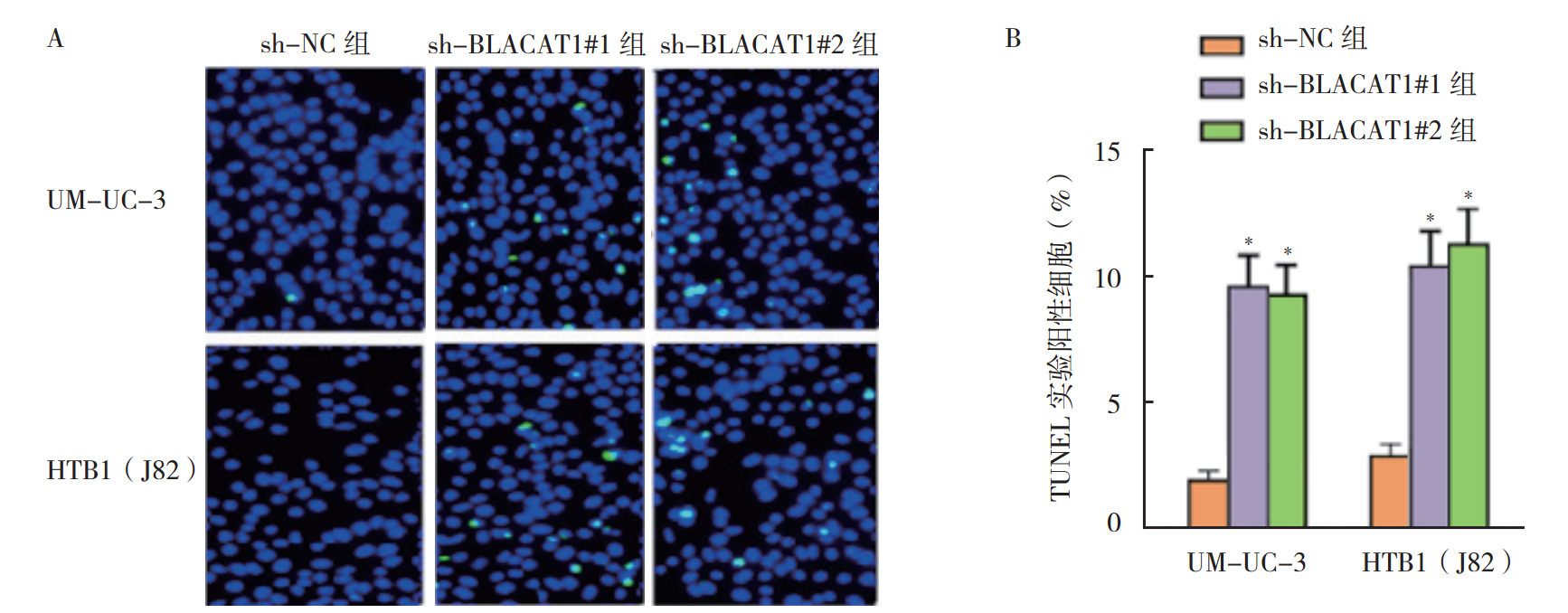
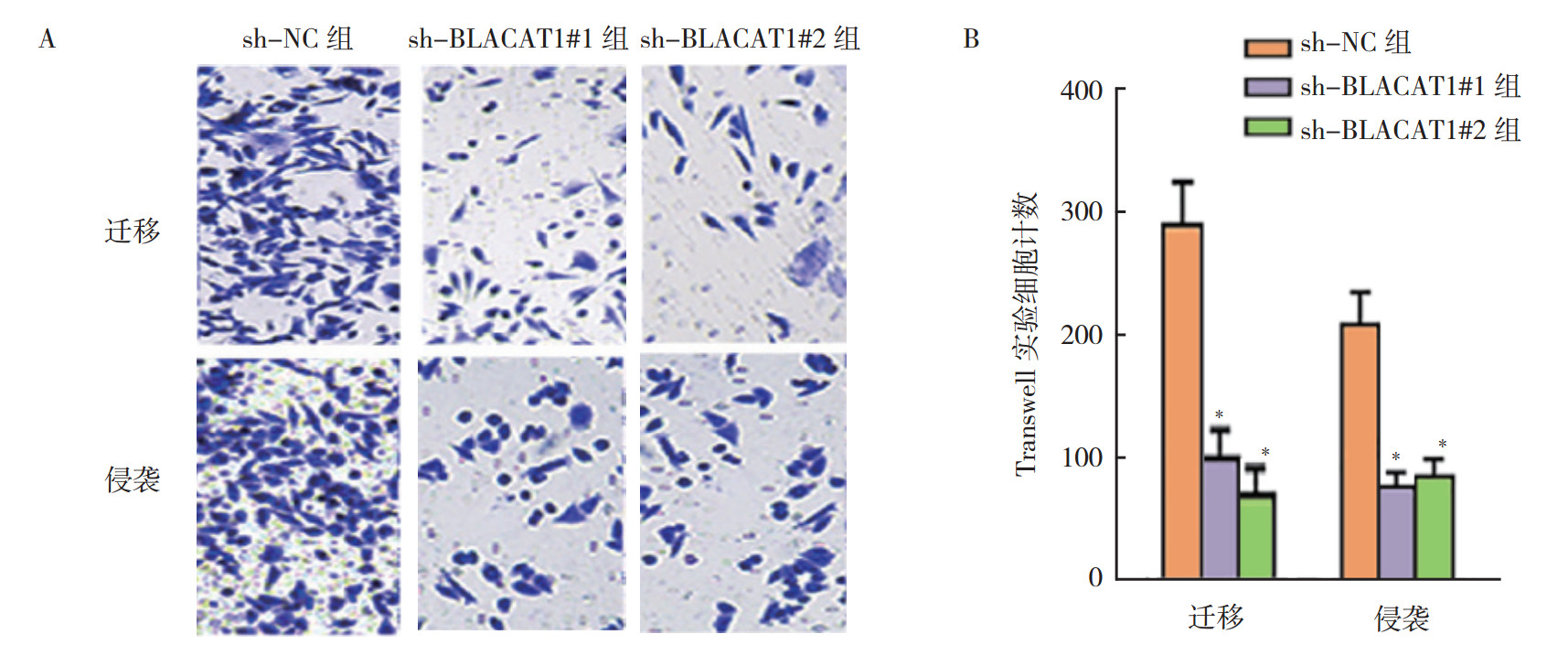
为更好理解BLACAT1在膀胱癌中的作用,通过质粒的构建和转染,设计针对BLACAT1的shRNA#1、#2以及相应的对照sh-NC质粒, 通过检测证实膀胱癌细胞中的BLACAT1被有效敲除。shBLACAT1#1和#2组相对表达较对照组降低(均P < 0.05,图 2)。敲除BLACAT1基因后,进行细胞培养增殖,发现细胞集落计数下降(图 3)。通过EdU分析(图 4A),观察到阳性染色细胞下降,BLACAT1敲除后细胞增殖下降(图 4B)。进行TUNEL分析检测细胞凋亡的改变(图 5A),BLACAT1的下调促进UM-UC-3和HTB1(J82)细胞凋亡(图 5B)。Transwell实验并染色分析(图 6A)结果显示,BLACAT1缺陷后UM-UC-3细胞的迁移和侵袭能力降低(图 6B)。

|
| 注 *与sh-NC组比较,P < 0.01 图 2 膀胱癌UM-UC-3和HTB1(J82)细胞sh-NC组、sh-BLACAT1#1组和sh-BLACAT1#2组中BLACAT1相对表达量 Fig.2 Relative expression of BLACAT1 in the sh-NC、sh-BLACAT1#1 and sh-BLACAT1#2 groups of bladder cancer UM-UC-3 and HTB1(J82) cells |

|
| 注 A:集落形成实验结果;B:细胞增殖培养集落计数统计图;*与sh-NC组比较,P < 0.01 图 3 膀胱癌UM-UC-3和HTB1(J82)细胞sh-NC组、sh-BLACAT1#1组和sh-BLACAT1#2组细胞增殖培养集落情况 Fig.3 Cell culture and colony count in the sh-NC、sh-BLACAT1#1 and sh-BLACAT1#2 groups of bladder cancer UM-UC-3 and HTB1(J82) cells |
|
| 注 A:EdU实验结果;B:EdU实验结果统计图;*与sh-NC组比较,P < 0.01 图 4 膀胱癌UM-UC-3和HTB1(J82)细胞sh-NC组、sh-BLACAT1#1组和sh-BLACAT1#2组EdU实验分析评价增殖情况 Fig.4 Cell proliferation detection of bladder cancer UM-UC-3 and HTB1(J82) cells in the sh-NC、sh-BLACAT1#1 and sh-BLACAT1#2 groups using EdU |
|
| 注 A:TUNEL实验结果;B:TUNEL实验结果统计图;*与sh-NC组比较,P < 0.01 图 5 膀胱癌UM-UC-3和HTB1(J82)细胞sh-NC组、sh-BLACAT1#1组和sh-BLACAT1#2组TUNEL实验检测细胞凋亡情况 Fig.5 Cell apoptosis analysis of bladder cancer UM-UC-3 and HTB1(J82) cells in the sh-NC、sh-BLACAT1#1 and sh-BLACAT1#2 groups using TUNEL |
|
| 注 A:Transwell实验结果;B:Transwell实验统计图;*与sh-NC组比较,P < 0.01 图 6 膀胱癌UM-UC-3细胞sh-NC组、sh-BLACAT1#1组和sh-BLACAT1#2组transwell实验分析细胞迁移和侵袭能力 Fig.6 Cell migration and invasion of bladder cancer UM-UC-3 cells in the sh-NC、sh-BLACAT1#1 and sh-BLACAT1#2 groups analyzed by transwell assay |
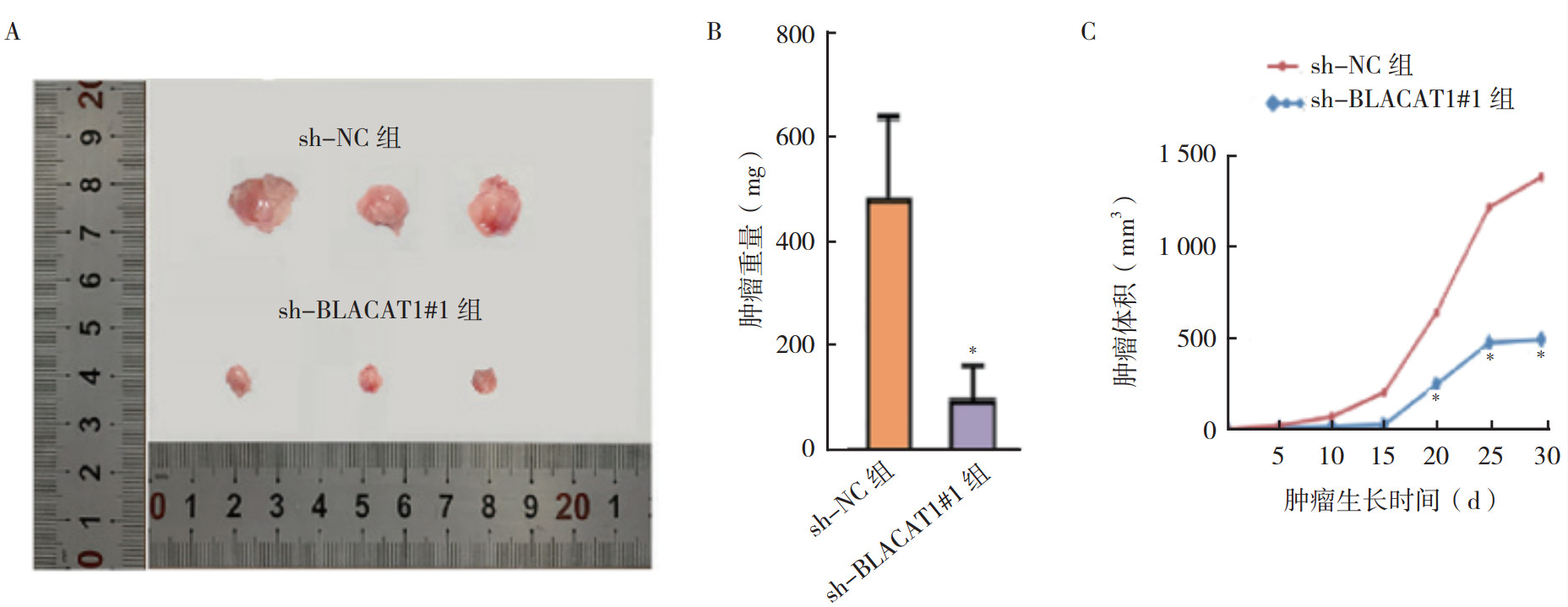
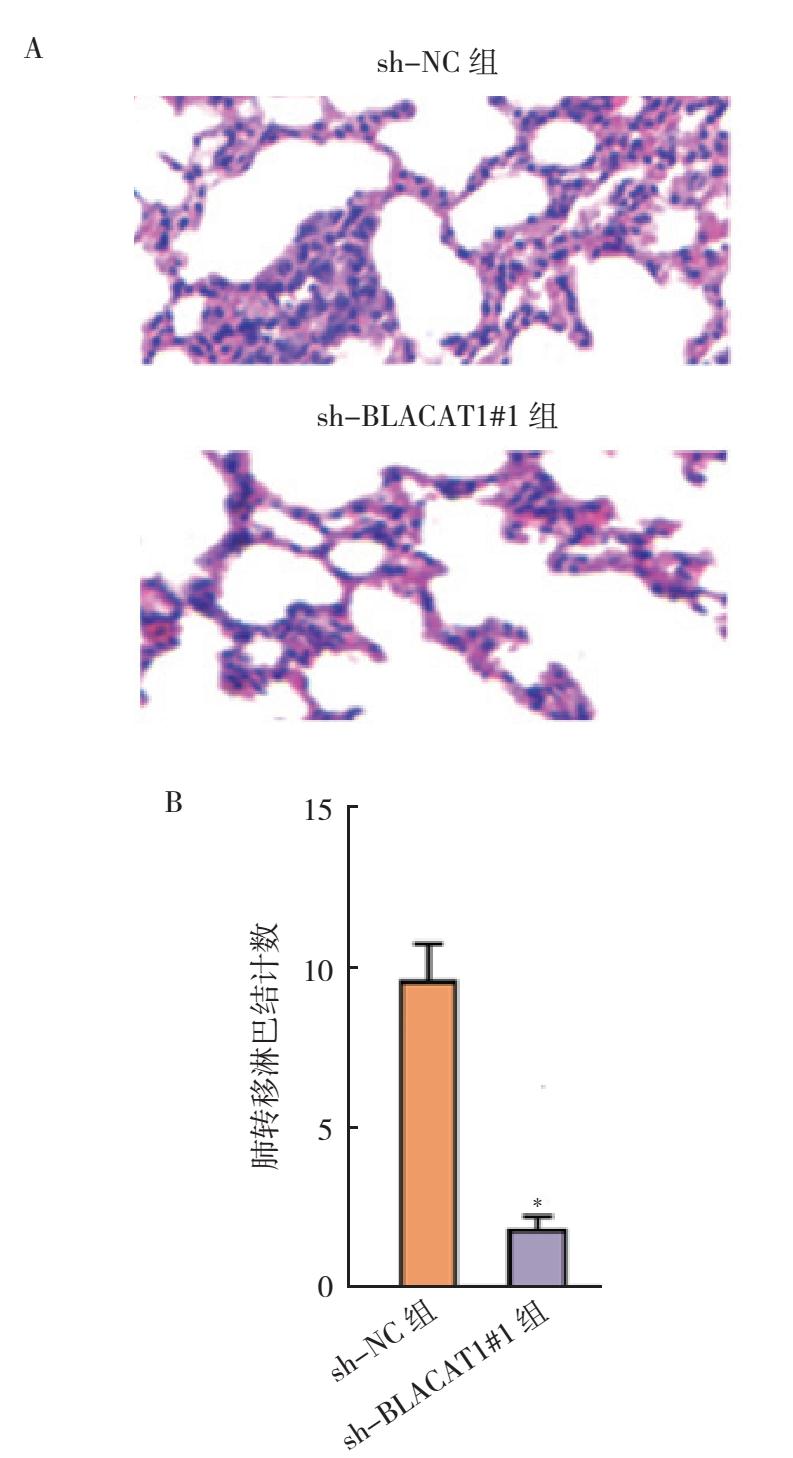
将转染sh-NC和sh-BLACAT1#1的HTB1(J82)细胞注入6周龄裸鼠体内。sh-BLACAT1#1组在20 d、25 d和30 d时肿瘤体积测量值与sh-NC组比较,差异均具有统计学意义(均P < 0.01,图 7C)。1个月时取出肿瘤,sh-BLACAT1#1组肿瘤重量低于sh-NC组(P < 0.01,图 7B)。将转染sh-NC和sh-BLACAT1#1的HTB1(J82)细胞的悬浮液注射到裸鼠尾静脉进行肿瘤转移实验,建立裸鼠肺转移模型。sh-BLACAT1#1组转移结节数量较sh-NC组减少(P < 0.01,图 8)。
|
| 注 A:sh-NC组和sh-BLACAT1#1组皮下注射1个月后肿瘤代表性图片;B:sh-NC组和sh-BLACAT1#1组皮下注射1个月后取出肿瘤重量测量数据;C:sh-NC组和sh-BLACAT1#1组皮下注射后肿瘤生长曲线比较;*与sh-NC组比较,P < 0.01 图 7 转染sh-NC和sh-BLACAT1#1的HTB1(J82)细胞皮下注射后裸鼠体内肿瘤发生情况 Fig.7 Tumorigenesis in nude mice after subcutaneous injection of HTB1(J82) cells transfected with sh-NC or sh-BLACAT1#1 |
|
| 注 A:sh-NC组和sh-BLACAT1#1组裸鼠肺组织转移瘤病灶切片染色后病理检查图片(HE×200);B:定量分析sh-NC组和sh-BLACAT1#1组50 d时肺转移结节;*与sh-NC组比较,P < 0.01 图 8 敲除BLACAT1基因对裸鼠体内肿瘤转移的影响 Fig.8 Effects of BLACAT1 gene knockout on tumor metastasis of nude mice |
98例膀胱癌组织中BLACAT1相对表达水平为(1.18±0.15),以中位数1.0为界,≥1.0为BLACAT1高表达,< 1.0为BLACAT1低表达,分析膀胱癌患者临床特征与BLACAT1表达的关系(表 1)。BLACAT1表达水平在膀胱癌患者年龄和肿瘤大小方面比较,差异均无统计学意义(均P > 0.05),在病理级别(WHO2004)[8]和淋巴结转移方面比较,差异均具有统计学意义(均P < 0.01)。
| 临床特征 | 总例数 | 高表达(n=47) | 低表达(n=51) | χ2值 | P值 |
| 年龄 | 0.038 | 0.846 | |||
| ≥55岁 | 48 | 23(47.9) | 25(52.1) | ||
| <55岁 | 50 | 24(48.0) | 26(52.0) | ||
| 肿瘤大小 | 0.000 | 0.990 | |||
| ≥2 cm | 47 | 22(46.8) | 25(53.2) | ||
| <2 cm | 51 | 25(49.0) | 26(51.0) | ||
| 病理分级 | 17.010 | <0.01 | |||
| 高级别 | 55 | 37(67.3) | 18(32.7) | ||
| 低级别+PUNLMP | 43 | 10(23.3) | 33(76.7) | ||
| 淋巴结 | 20.440 | <0.01 | |||
| 阳性 | 35 | 28(46.8) | 7(46.8) | ||
| 阴性 | 63 | 19(46.8) | 44(46.8) | ||
| 注 PUNLMP:低度恶性倾向尿路上皮乳头状瘤(papillary urothelial neoplasms of low malignant potential) | |||||
lncRNA的异常表达会影响癌症的发展[9-10]。lncRNA PCGEM1通过海绵吸附miR-433-3p靶向成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)信号通路导致肾癌细胞的恶性表型[11]。lncRNA PVT1通过隔离miR-526b在非小细胞肺癌中作为肿瘤启动子发挥作用[12]。lncRNA被证明通过作为miR-34a-5p的内源竞争RNA(competing endogenous RNA,ceRNA)来增强DAAM1,从而促进前列腺癌的发展[13]。lncRNA参与基因组印记、染色质修饰、转录干扰及转录激活等多种重要的调控过程。lncRNA与膀胱癌的发病机制、复发转移、诊断治疗及预后都有一定的相关性。
本研究结果显示,BLACAT1在膀胱癌组织中高表达,且表达水平在年龄和肿瘤大小方面比较,差异均无统计学意义(均P > 0.05),在病理分级和淋巴结转移方面比较,差异均具有统计学意义(均P < 0.05)。有研究发现,膀胱癌患者linc-UBC1(BLACAT1)检测高表达,其无复发生存期降低,linc-UBC1可以作为膀胱癌诊断和预后标志物[14]。结合本研究结果显示,这种高表达与预后因素密切相关,可能存在表达越高,患者预后情况越差。其可以作为预后评判的潜在基因靶点。需进一步探索BLACAT1参与调控膀胱癌细胞的侵袭和转移等生物学功能的途径。
本研究通过细胞基础研究表明,与人正常膀胱上皮细胞SV-HUC-1比较,BLACAT1在4种膀胱癌细胞株中均表达上调,这与朱晨曦等[15]研究一致。当沉默BLACAT1基因后,膀胱癌细胞的生物学特征受到抑制,主要是细胞增殖和侵袭能力降低,细胞凋亡增加。而在其他相关胃肠道癌的研究中,也证实癌组织中相关RNA呈现高表达,下调基因后,癌细胞侵袭、增殖和转移均下调。
因此,综合既往研究及本研究结果,BLACAT1在膀胱癌细胞中下调表达,可能减少膀胱癌的恶性程度、降低复发及转移,提示BLACAT1有致癌作用,这为膀胱癌的早期诊断、治疗及预后评估提供理论依据。
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
张本佳, 詹晓曼, 袁胜涛, 等. LncRNA-UCA1在肿瘤转移中的研究进展[J]. 中国实验诊断学, 2020, 24(5): 865-869. |
| [3] |
白茹梦, 卓帅帅, 孙苗苗, 等. 长链非编码RNA在肿瘤细胞自噬中的调控作用[J]. 中国肿瘤, 2020, 29(5): 373-378. |
| [4] |
王劲松, 李春晓, 王婷, 等. 基于长链非编码RNA的表达谱特征构建乳腺癌患者预后的风险模型[J]. 中国综合临床, 2020, 36(3): 217-222. |
| [5] |
Cao Y, Xiong JB, Zhang GY, et al. Long noncoding RNA UCA1 regulates PRL-3 expression by sponging microRNA-495 to promote the progression of gastric cancer[J]. Mol Ther Nucleic Acids, 2020, 19: 853-864. DOI:10.1016/j.omtn.2019.10.020 |
| [6] |
季凯月, 张天祺, 张梦圆, 等. 与胃癌侵袭和转移相关的lncRNA研究[J]. 胃肠病学和肝病学杂志, 2021, 30(6): 601-605. |
| [7] |
王小飞, 汪磊, 李宁忱. 长链非编码RNA在膀胱癌发生发展中的作用及其机制[J]. 中国肿瘤生物治疗杂志, 2018, 25(10): 1072-1076. |
| [8] |
Eble JN, Sauter G, Epstein JI, et al. World Health Organization classification of tumours. Pathology and genetics of tumours of the urinary system and male genital organs[M]. Lyon: IARC Press, 2004: 93-120.
|
| [9] |
宋文渊, 武金才, 吴雷, 等. 血清lncRNA-PVT1在肝细胞癌诊断及预后中的意义[J]. 实用肿瘤杂志, 2020, 35(4): 317-321. |
| [10] |
耿亚飞, 李玲, 夏春燕. 骨肉瘤RNA生物标志物的研究进展[J]. 实用肿瘤杂志, 2021, 36(4): 375-378. |
| [11] |
Duan HX, Li XJ, Chen YY, et al. LncRNA RHPN1-AS1 promoted cell proliferation, invasion and migration in cervical cancer via the modulation of miR-299-3p/FGF2 axis[J]. Life Sci, 2019, 239: 116856. |
| [12] |
Qiu C, Li S, Sun DT, et al. lncRNA PVT1 accelerates progression of non-small cell lung cancer via targeting miRNA-526b/EZH2 regulatory loop[J]. Oncol Lett, 2020, 19(2): 1267-1272. |
| [13] |
Ma EH, Wang QQ, Li JH, et al. LINC01006 facilitates cell proliferation, migration and invasion in prostate cancer through targeting miR-34a-5p to up-regulate DAAM1[J]. Cancer Cell Int, 2020, 20: 515. |
| [14] |
Zhang S, Du L, Wang L, et al. Evaluation of serum exosomal LncRNA-based biomarker panel for diagnosis and recurrence prediction of bladder cancer[J]. J Cell Mol Med, 2019, 23(2): 1396-1405. |
| [15] |
朱晨曦, 李文洲, 郭永连, 等. 长链非编码RNA-UBC1对膀胱癌细胞生物学功能的影响[J]. 重庆医学, 2017, 46(2): 169-171, 174. |
 2022, Vol. 37
2022, Vol. 37


