文章信息
- 宋文渊, 武金才, 吴雷, 赵红岩
- Song Wenyuan, Wu Jincai, Wu Lei, Zhao Hongyan
- 血清lncRNA-PVT1在肝细胞癌诊断及预后中的意义
- Signifi cance of serum lncRNA-PVT1 expression in diagnosis and prognosis of hepatocellular carcinoma
- 实用肿瘤杂志, 2020, 35(4): 317-321
- Journal of Practical Oncology, 2020, 35(4): 317-321
基金项目
- 国家自然科学基金项目(81660489)
-
作者简介
- 宋文渊(1972-), 男, 河南邺县人, 主任医师, 硕士, 从事肝胆胰肿瘤临床研究.
-
通信作者
- 宋文渊, E-mail:song_wen_yuan@sina.com
-
文章历史
- 收稿日期:2018-09-19
2. 海南省人民医院肝胆外科, 海南 海口 570311
2. Hepatobiliary Surgery, Hainan People's Hospital, Haikou 570311, China
原发性肝细胞癌(hepatocellular carcinoma,HCC)是常见的致死性恶性肿瘤之一。我国肝癌发病率位居全球第1位,病死率位居第3位[1]。我国肝癌多由肝炎和肝硬化发展而来,且肝癌的早期症状较隐匿,多数患者诊断时已属中晚期,若能在肝癌早期诊断并进行有效的治疗,肝癌患者的5年生存率可显著升高[2]。因此,寻找新的诊断及预后的标志物是改善肝癌患者预后的关键。
血清甲胎蛋白(alpha-fetoprotein,AFP)水平是诊断肝癌的重要指标,而在许多早期肝癌患者中血清AFP水平较低,且部分为AFP阴性患者,无法有效预测肝癌的发生及预后,寻找敏感度及特异度更高的生物标志物对肝癌的早期诊断及预后的预测极其重要[3]。
长链非编码RNA(long non-coding RNA,lncRNA)是一种长度 > 200个核苷酸、缺少或无开放阅读编码框和数量远低于编码RNA的非编码RNA,有更高的组织特异性,参与转录、转录后和翻译后等基因表达水平过程,在多种疾病中通过复杂的调控机制起关键作用[4]。lncRNA在多种肿瘤组织和体液(如血液、唾液和尿液等)中存在异常表达,且已应用于部分肿瘤的早期诊断[5],可较早地预测疾病的复发和转移,在疾病的诊治中至关重要。浆细胞瘤多样异位基因1(plasmacytoma-variant translocation 1,PVT1)属于lncRNA家族成员,是由人类PVT1基因编码的,位于染色体8q24.2l上[6]。至今为止,肝癌中lncRNA-PVT1的表达情况以及其在肝癌中发挥的作用尚未有报道。对这方面的研究将为寻找有效的肝癌生物诊断和治疗标志物提供一定的理论基础。
1 资料与方法 1.1 临床样本收集2014年3月至2016年12月在海南医学院第二附属医院未接受治疗的患有乙肝肝硬化的94例原发性HCC患者的血清标本(HCC组),其中男性63例,女性31例; 年龄32~75岁,中位年龄61岁,> 60岁51例,≤60岁43例。收集同期在海南医学院第二附属医院诊断的乙肝肝硬化患者52例的血液标本(肝硬化组),其中男性31例,女性21例; 年龄41~74岁,中位62岁,> 60岁28例,≤60岁24例。
HCC组纳入标准:(1)明确为肝细胞癌(有病理学组织切片诊断支持); (2)明确有乙肝肝硬化; (3)未接受放疗、化疗、免疫治疗和靶向治疗的初治患者; (4)无严重的心、肺、肾等重要脏器疾病; (5)有完整的临床病理学资料; (6)未同时患其他恶性肿瘤。肝硬化组纳入标准:(1)病理诊断为肝硬化; (2)有门静脉高压症的临床证据(脾大、腹腔积液、食管下端胃底静脉曲张); (3)排除静脉海绵样变、门静脉栓塞和肝癌等疾病; (4)排除合并丙肝等其他肝病的患者。
本研究符合医学伦理学标准,已经过海南医学院第二附属医院医学伦理委员会批准,所有治疗均取得患者或其家属的知情同意。
1.2 主要方法 1.2.1 血液样本采集与AFP检测采集所有研究对象外周静脉血约5 mL,均在清晨空腹进行,采集后在室温下以3 000 r/min速度离心10 min,取上层血清置于-80℃冰箱保存。血清甲胎蛋白(alpha-fetoprotein,AFP)含量的测定采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA),试剂盒购自美国R & D公司,所有样本检测均使用同一批次试剂。
1.2.2 RNA提取及qRT-PCR检测lncRNA-PVT1用RNA分离试剂盒(Axygen Science Inc., 美国)从血清样品中提取总RNA。对每个样本的每个基因进行3次重复试验。以1 μg总RNA为模板,用逆转录试剂盒(Genecopoeia,广州)合成单链cDNA。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3 phosphate dehydrogenase,GAPDH)作为内源性参照,采用20 μL的qRT-PCR反应体系(Genecopoeia,广州),按照以下程序进行40个循环的扩增:95℃1 min,60℃1 min,72℃1 min,以内源对照分析结果,用2-ΔΔCt法测定lncRNA-PVT1的相对表达量。PVT1上游引物序列为5’-TGGTACCGAGCTCGGATCCTCAAGATGGCTGTGCC-3’,下游引物序列为5’-CCGCCACTGTGCTGGATGATAGAAAAAGAATTTAATAG-3’。GAPDH上游引物序列为5’-ATTCCACCCATGGCAAATTC-3’,下游引物序列为5’-TGGGATTTCCATTGATGATAA-3’。
1.3 随访通过电话、门诊和住院等方式收集HCC患者的生存情况并进行lncRNA-PVT1的表达在肝癌患者预后关系的评估。随访自术后1年开始进行,随访时间截止至2019年6月,平均随访时间为28.0个月。随访开始至结束时间期间,患者如因肝癌致死,定义为事件发生,如非因肝癌致死,或仍存活,定义为事件未发生。
1.4 统计学分析采用SPSS 20.0统计软件进行数据分析。采用χ2检验和Student's t检验进行组间比较。用受试者工作特征曲线(receiver operating characteristic curve, ROC)分析标志物敏感度及特异度。采用Kaplan-Meier法分析患者生存率,Log-rank检验比较组间生存率。Cox比例风险模型作患者预后多因素分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 血清lncRNA-PVT1表达水平比较qRT-PCR法检测显示,HCC组患者血清lncRNA-PVT1水平高于肝硬化组[(4.34±0.25) vs (3.06 ± 0.23),t=3.37,P=0.001]。
2.2 血清lncRNA-PVT1表达水平与肝癌患者临床病理特征的关系HCC组患者根据lncRNA-PVT1的中位表达水平(4.56)分为高lncRNA-PVT1组和低lncRNA-PVT1组。高lncRNA-PVT1组TNM分期(P=0.013)及BCLC分期(P=0.009)晚于低lncRNA-PVT1组,而血管浸润在高lncRNA-PVT1组中多于低lncRNA-PVT1组(P=0.018)。lncRNA-PVT1表达水平在患者年龄、性别、AFP水平、肿瘤大小以及有无肿瘤包膜方面比较,差异均无统计学意义(均P > 0.05,表 1)。
| 临床特征 | 例数 | IncRNA-PVT1表达(例,%) | χ2值 | P值 | |
| 低表达 | 高表达 | ||||
| 年龄 | 1.326 | 0.401 | |||
| ≤60岁 | 43 | 21(48.8) | 22(51.2) | ||
| > 60岁 | 51 | 26(51.0) | 25(49.0) | ||
| 性别 | 1.858 | 0.445 | |||
| 男性 | 63 | 30(47.6) | 33(52.4) | ||
| 女性 | 31 | 17(54.8) | 14(45.2) | ||
| AFP | 2.042 | 0.173 | |||
| > 20 ng/mL | 72 | 37(51.4) | 35(48.6) | ||
| ≤20 ng/mL | 22 | 10(45.5) | 12(54.5) | ||
| 肿瘤大小 | 1.638 | 0.227 | |||
| ≤5 cm | 49 | 28(57.1) | 21(42.9) | ||
| > 5 cm | 45 | 19(42.2) | 26(57.8) | ||
| TNM分期 | 2.755 | 0.013 | |||
| Ⅰ~Ⅱ | 34 | 18(52.9) | 16(47.1) | ||
| Ⅲ~Ⅳ | 60 | 29(48.3) | 31(51.7) | ||
| BCLC分期 | 2.836 | 0.009 | |||
| A+B | 31 | 21(67.7) | 10(32.3) | ||
| C+D | 63 | 26(41.3) | 37(58.7) | ||
| 肿瘤包膜 | 1.463 | 0.227 | |||
| 有 | 49 | 29(59.2) | 20(40.8) | ||
| 无 | 45 | 18(40.0) | 27(60.0) | ||
| 血管浸润 | 2.442 | 0.018 | |||
| 有 | 40 | 23(57.5) | 17(42.5) | ||
| 无 | 54 | 24 (44.4) | 30(55.6) | ||
Cox模型单因素及多因素分析结果显示,TNM分期、血管浸润及lncRNA-PVT1是影响肝癌患者预后的独立因素(均P < 0.05, 表 2)。
| 临床因素 | 单因素分析 | 多因素分析 | |||
| HR(95% CI) | P值 | HR(95% CI) | P值 | ||
| 年龄 | 1.003(0.916~1.432) | 0.433 | 0.974(0.881~1.201) | 0.675 | |
| 性别 | 1.001(0.906~1.252) | 0.514 | 0.846(0.715~1.042) | 0.752 | |
| 血清AFP | 1.627(1.463~1.916) | 0.024 | 1.259(0.974~1.465) | 0.163 | |
| 肿瘤大小 | 0.895(0.67~1.196) | 0.652 | 1.118(0.820~1.524) | 0.480 | |
| 肿瘤包膜 | 1.094(0.795~1.446) | 0.242 | 0.871(0.643~1.230) | 0.685 | |
| BCLC分期 | 1.595(1.366~1.823) | 0.065 | 1.304(1.163~1.735) | 0.056 | |
| TNM分期 | 1.987(1.091~2.023) | 0.012 | 1.972(0.975~2.103) | 0.008 | |
| 血管浸润 | 1.844(1.043~2.65) | 0.007 | 2.001(1.367~2.845) | 0.004 | |
| lncRNA-PVT1 | 2.241(1.532~3.084) | < 0.01 | 2.363(1.742~3.141) | < 0.01 | |
lncRNA-PVT1表达水平比较,TNM Ⅲ~Ⅳ期患者高于Ⅰ~Ⅱ期患者[(4.37±0.30) vs (1.66±0.24),t=6.21,P < 0.05],BCLC C~D期患者高于A~B期患者[(3.55±0.25) vs (1.66±0.20),t=4.85,P < 0.05]。
血清AFP水平方面,HCC组高于肝硬化组[(564.68±74.11) vs (19.56±8.32),t=5.17,P < 0.05]。HCC组TNM Ⅲ~Ⅳ期与Ⅰ~Ⅱ期患者以及BCLC C~D期和A~B期患者AFP水平比较,差异均无统计学意义[(698.11±77.02) vs (303.66 ±59.93),(628.45±93.37) vs (466.66±94.51),均P > 0.05]。
用ROC曲线评估lncRNA-PVT1、AFP以及lncRNA-PVT1联合AFP在HCC患者早期诊断中的价值,lncRNA-PVT1的ROC曲线下面积(area under curve,AUC)为0.916(95%CI:0.868~0.922),AFP的AUC为0.824(95%CI: 0.802~0.844),lncRNA-PVT1联合AFP的AUC为0.940(95%CI: 0.913~0.965),见图 1。
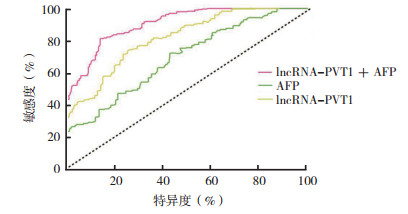
|
| 图 1 lncRNA-PVT1和AFP在HCC诊断中的ROC曲线比较 Fig.1 Comparison of ROC curves of lncRNA-PVT1 and AFP in the diagnosis of HCC |
高lncRNA-PVT1组HCC患者中位无进展生存时间(progression-free survival, PFS)短于低lncRNA-PVT1组(19.0个月vs 40.0个月,P < 0.05;图 2),术后中位总生存时间(overall survival, OS)短于低lncRNA-PVT1组(28.0个月vs 50.0个月,P < 0.05;图 3)。
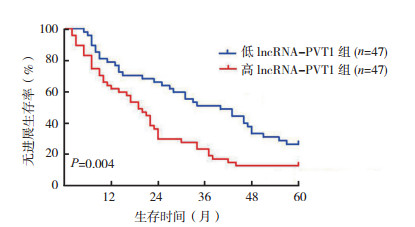
|
| 图 2 高lncRNA-PVT1组与低lncRNA-PVT1组HCC患者的无进展生存曲线比较 Fig.2 Comparison of progression-free survival curves of HCC patients with different lncRNA-PVT1 expression levels |
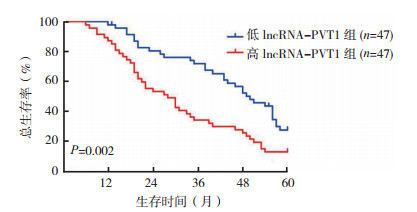
|
| 图 3 高lncRNA-PVT1组与低lncRNA-PVT1组HCC患者总生存曲线比较 Fig.3 Comparison of overall survival curves of HCC patients with different lncRNA-PVT1 expression levels |
肝癌是我国常见的恶性肿瘤之一。尽管近年来肝癌相关的大量研究取得一定进展,但目前肝癌的早期诊断率低,患者的预后仍然很差。早期发现的肝癌患者有机会获得有效的治疗,有效地延长生存时间。目前AFP指标被广泛应用于HCC的检测,但敏感度和特异度并不是最佳的,且许多早期HCC患者的AFP水平并不升高,存在一定的假阳性率[7]。因此,寻找新的分子生物标志物对诊断和监测肝癌的复发和疗效是极为迫切的,尤其是在早期筛查和诊断肝癌方面。
人类基因组中只有少数进行基因转录及编码蛋白质,同时存在许多转录的基因组是不编码蛋白质的,lncRNA是一种非编码RNA分子,其调控的异常可改变表观遗传信息,并促进细胞生长和发展[8]。因此,肿瘤相关lncRNA的鉴定及其临床意义的研究对指导肝癌的诊治具有重要的意义。血清lncRNA在多种恶性肿瘤中存在表达异常,并已被证实可作为肿瘤的早期标志物。lncRNA-PVT1在胃癌、乳腺癌和前列腺癌等多种恶性肿瘤中被报道表达异常升高[9]。lncRNA-PVT1可通过激活c-myc基因、“海绵吸附作用”与microRNA结合调节信号通路效应分子等方式促进肿瘤的进展[10-12]。然而,lncRNA-PVT1在肝癌的诊断和预后的价值尚未有报道。本研究对94例HCC患者和52例乙肝肝硬化患者进行lncRNA-PVT1的定量分析,结果显示HCC患者血清lncRNA-PVT1水平高于乙肝肝硬化患者,提示其可用于由乙肝肝硬化发展至HCC患者的早期诊断。
除了在肿瘤组织中异常表达外,lncRNA-PVT1对肿瘤的进展及患者的预后有着重要的作用。Gao等[13]发现lncRNA-PVT1与胃癌患者的总生存时间密切相关,是预测胃癌患者预后的强有力指标; 而Chen等[14]通过统计共85个队列研究中lncRNA-PVT1的表达与恶性肿瘤患者预后的关系发现,PVT1的表达越高,TNM分期越晚,患者的总生存时间越短,且PVT1的表达水平还与淋巴结转移、浸润深度、远处转移以及分化程度密切相关,可作为肿瘤预后监测的独立指标。本研究发现,血清lncRNA-PVT1水平与HCC患者TNM分期、BCLC分期及血管浸润相关,可作为HCC早期诊断的指标及HCC患者独立预后因素,其表达水平越高,肝癌的分期越晚,患者的OS及PFS更短。
综上所述,本研究结果证实lncRNA-PVT1在肝癌患者的血清中高表达,可作为HCC早期诊断指标及独立预后危险因素。提示lncRNA-PVT1有望成为肝癌在临床中应用于早期诊断及预后监测的有效指标,而其作用机制仍需要进一步的实验进行验证。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
苏泳诗, 于新发. 小肝癌临床治疗研究进展[J]. 实用肿瘤杂志, 2019, 34(2): 175-179. |
| [3] |
Bibani N, Trad D, Sabbah M, et al. Prognostic factors of survival during hepatocellular carcinoma[J]. Tunis Med, 2018, 96(6): 379-384. |
| [4] |
Lin YH, Wu MH, Yeh CT, et al. Long non-coding RNAs as mediators of tumor microenvironment and liver cancer cell communication[J]. Int J Mol Sci, 2018, 19(12): 3. |
| [5] |
Lao Y, Li Q, Li N, et al. Long noncoding RNA ENST00000455974 plays an oncogenic role through up-regulating JAG2 in human DNA mismatch repair-proficient colon cancer[J]. Biochem Biophys Res Commun, 2019, 508(2): 339-347. |
| [6] |
Xiao M, Feng Y, Liu C, et al. Prognostic values of long noncoding RNA PVT1 in various carcinomas:An updated systematic review and meta-analysis[J]. Cell Proliferation, 2018, 51(6): e12519. |
| [7] |
Mehinovic L, Islamagic E, Husic-Selimovic A, et al. Evaluation of diagnostic efficiency of alpha-fetoprotein in patients with liver cirrhosis and hepatocellular carcinoma:single-center experience[J]. Open Access Maced J Med Sci, 2018, 6(9): 1668-1673. |
| [8] |
赵一鉴, 刘敏, 荆冠军. Lnc-MALAT1在肝癌组织中的表达及对化疗敏感性的影响[J]. 实用肿瘤杂志, 2020, 35(1): 53-58. |
| [9] |
Zhan YP, Zhang Y, Zhang YL, et al. The regulation of LncRNA MEG3 in epithelial ovarian cancer autophagy[J]. J Trop Med, 2018, 18(8): 1056-1059. |
| [10] |
宋魏, 张建波, 孙淼淼, 等. 结肠癌中LINC00161的表达水平及其与临床病理参数和预后的关系[J]. 热带医学杂志, 2018, 18(10): 1308-1312. |
| [11] |
Song W, Zhang JB, Sun MM, et al. Expression level of LINC00161 in colon cancer and its relationship with the clinicopathological parameters and prognosis[J]. J Trop Med, 2018, 18(10): 1308-1312. |
| [12] |
Zou MF, Ling J, Wu QY, et al. Long non-coding RNA PVT1 functions as an oncogene in ovarian cancer via upregulating SOX2[J]. Eur Rev Med Pharmacol Sci, 2018, 22(21): 7183-7188. |
| [13] |
Gao S, Zhao ZY, Wu R, et al. Prognostic value of long noncoding RNAs in gastric cancer:a meta-analysis[J]. Onco Targets Ther, 2018, 14(11): 4877-4891. |
| [14] |
Chen X, Yang Y, Cao Y, et al. lncRNA PVT1 identified as an independent biomarker for prognosis surveillance of solid tumors based on transcriptome data and meta-analysis[J]. Cancer Manag Res, 2018, 16(10): 2711-2727. |
 2020, Vol. 35
2020, Vol. 35


