文章信息
- 彭巧华, 吕卫国
- Peng Qiaohua, Lv Weiguo
- 2022年第1版《NCCN子宫颈癌临床实践指南》解读
- Interpretation of NCCN guidelines for cervical cancer, version 1. 2022
- 实用肿瘤杂志, 2022, 37(3): 205-214
- Journal of Practical Oncology, 2022, 37(3): 205-214
-
通信作者
- 吕卫国,E-mail:lbwg@zju.edu.cn
-
文章历史
- 收稿日期:2022-05-08
根据全球癌症统计数据显示,子宫颈癌的发病率在所有癌症中居第14位,是全球女性第四大常见癌症[1]。而在发展中国家,子宫颈癌发病率居女性肿瘤第2位。在中国,子宫颈癌的发病率和死亡率居女性肿瘤的第6位和第7位,严重威胁女性健康[2]。2021年10月美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)公布了2022年第1版《NCCN子宫颈癌临床实践指南》[3],为协助临床医师更好理解和应用该指南,同时提高国内子宫颈癌诊治水平,本文通过深入剖析新版指南,同时结合相关专家指南解读及意见[4-7],为我国子宫颈癌的临床诊疗方案提供指导。
1 子宫颈癌手术分期2022年NCCN指南中子宫颈癌手术分期和2021年指南保持一致[3-4],仍然采用2018年国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)手术分期。可利用影像学及病理学资料,结合临床来补充评估子宫颈癌肿瘤大小及扩散程度,形成最终分期,但病理分期较临床及影像学分期更优选;淋巴脉管间质浸润不影响最终分期,间质浸润宽度不再纳入分期;孤立的肿瘤细胞不改变分期,但是应记录其存在;影像学及手术病理评估均纳入分期(对于ⅢC期子宫颈癌,若影像学发现盆腔淋巴结转移,分期应标记为ⅢC1r;若经病理证实盆腔淋巴结转移,分期应标记为ⅢC1p)。子宫颈癌具体分期见表 1[8]。
| 分期 | 描述 |
| Ⅰ期 | 子宫颈癌局限在子宫颈(扩展至宫体将被忽略) |
| ⅠA期 | 镜下浸润癌,浸润深度≤5 mm |
| ⅠA1期 | 间质浸润深度≤3 mm |
| ⅠA2期 | 间质浸润深度 > 3 mm且≤5 mm |
| ⅠB期 | 肿瘤局限于子宫颈,镜下最大浸润深度 > 5 mm |
| ⅠB1期 | 浸润深度 > 5 mm,肿瘤最大径线≤2 cm |
| ⅠB2期 | 肿瘤最大径线 > 2 cm且≤4 cm |
| ⅠB3期 | 肿瘤最大径线 > 4 cm |
| Ⅱ期 | 肿瘤超越子宫,但未达阴道下1/3或未达骨盆壁 |
| ⅡA期 | 侵犯上2/3阴道,无宫旁浸润 |
| ⅡA1期 | 癌灶最大径线≤4 cm |
| ⅡA2期 | 癌灶最大径线 > 4 cm |
| ⅡB期 | 有宫旁浸润,未达骨盆壁 |
| Ⅲ期 | 肿瘤累及阴道下1/3和(或)扩展到骨盆壁和(或)引起肾盂积水或肾无功能和(或)累及盆腔和(或)主动脉旁淋巴结 |
| ⅢA期 | 肿瘤累及阴道下1/3,没有扩展到骨盆壁 |
| ⅢB期 | 肿瘤扩展到骨盆壁和(或)引起肾盂积水或肾无功能 |
| ⅢC期 | 不论肿瘤大小和扩散程度,累及盆腔和(或)主动脉旁淋巴结[注明r(影像学)或p(病理)证据] |
| ⅢC1期 | 仅累及盆腔淋巴结 |
| ⅢC2期 | 主动脉旁淋巴结转移 |
| Ⅳ期 | 肿瘤侵犯膀胱黏膜或直肠黏膜(活检证实)和(或)超出真骨盆(泡状水肿不分为Ⅳ期) |
| ⅣA期 | 侵犯盆腔邻近器官 |
| ⅣB期 | 远处转移 |
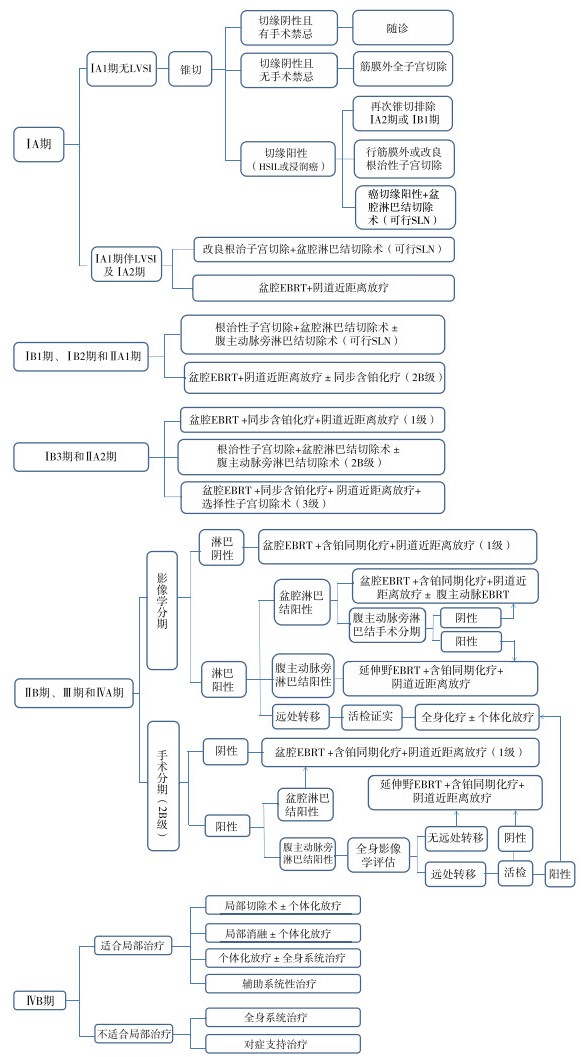
初始子宫颈癌手术指征推荐限于ⅡA2期及以下的患者,ⅡB期及以上的患者通常不推荐手术治疗,部分ⅡB期患者可首选根治性子宫切除或新辅助化疗后进行子宫切除术(图 1)[3]。对于不保留生育功能的患者,子宫颈癌治疗根据临床分期进行分级手术及处理。
可先行锥切,锥切首选子宫颈冷刀锥形切除术,若环形电切术(loop electrosurgical excision procedure,LEEP)能够完整切除并达到足够的切缘,也可考虑行LEEP术。根据锥切病理结果,有如下选择:(1)若手术切缘阴性,但不宜手术者,可考虑随访;(2)若手术切缘阴性,适合手术者,可选择筋膜外全子宫切除术;(3)若手术切缘阳性(高级别鳞状上皮内病变或浸润癌),可选择再次锥切排除ⅠA2期或ⅠB1期,或直接行筋膜外全子宫切除或改良根治性子宫切除术,对于癌切缘阳性者建议加盆腔淋巴结切除术(2B级证据)或行前哨淋巴结(sentinel lymph node,SLN)切除术。
2.2 ⅠA1期伴LVSI及ⅠA2期建议行改良根治性子宫切除+盆腔淋巴结切除术(可行SLN)或行盆腔外照射放疗(external beam radiotherapy,EBRT)+阴道近距离放疗。
2.3 ⅠB1期、ⅠB2期和ⅡA1期首选根治性子宫切除+盆腔淋巴结切除术±腹主动脉旁淋巴结切除术(可行SLN;1级证据),或行盆腔EBRT+阴道近距离放疗±含铂同步化疗(2B级证据)。
2.4 ⅠB3期和ⅡA2期首选盆腔EBRT+阴道近距离放疗+含铂同步化疗(1级证据),或行根治性子宫切除术+盆腔淋巴结清扫术±腹主动脉旁淋巴结清扫术(2B级证据),或盆腔EBRT+阴道近距离放疗+含铂同步化疗+选择性子宫切除术(3级证据)。
2.5 ⅡB期、Ⅲ期及ⅣA期推荐行手术分期(即腹主动脉旁淋巴结±盆腔淋巴结切除术),根据淋巴结活检结果指导临床治疗:(1)盆腔淋巴结和腹主动脉旁淋巴结均阴性,可选择性盆腔EBRT+阴道近距离放疗+含铂同步化疗(1级证据);(2)盆腔淋巴结阳性+腹主动脉旁淋巴结阴性,建议行盆腔EBRT+阴道近距离放疗+含铂同步化疗(1级证据);(3)腹主动脉旁淋巴结阳性,应先行颈部/胸部/腹部/骨盆/腹股沟PET-CT或胸部/腹部/骨盆CT或PET-MRI检查评估全身及远处转移情况(如果没有远处转移,可选择延伸野外照射+阴道近距离放疗+含铂同步化疗。如果有远处转移,应先行淋巴结活组织检查,若活检阴性,则行延伸野外照射+阴道近距离放疗+含铂同步化疗;若活检阳性,则建议直接行全身化疗±个体化放疗。)
或行影像学评估(即颈部/胸部/腹部/骨盆/腹股沟PET-CT或胸部/腹部/骨盆CT或PET-MRI检查评估全身及远处转移情况),若影像学评估淋巴结均阴性,建议行盆腔EBRT+阴道近距离放疗+含铂同步化疗(1级证据);若淋巴结阳性,根据不同的阳性结果有如下选择:(1)盆腔淋巴结阳性+腹主动脉旁淋巴结阴性,可选择盆腔EBRT+阴道近距离放疗+含铂同步化疗±腹主动脉旁淋巴结外照射,或行腹主动脉旁淋巴结手术分期,如果淋巴结阴性则处理同上,如果腹主动脉旁淋巴结阳性可选择延伸野外照射+阴道近距离放疗+含铂同步化疗;(2)盆腔淋巴结及腹主动脉旁淋巴结均阳性,可选择延伸野外照射+阴道近距离放疗+含铂同步化疗;(3)若发现远处转移,经活检证实,行全身化疗±个体化放疗。
2.6 ⅣB期若为局部病灶宜局部治疗的患者,后续治疗方案可选择:(1)局部切除术±个体化放疗;(2)局灶消融±个体化放疗;(3)个体化放疗±全身系统治疗;(4)辅助系统性治疗。若为多灶不宜局部治疗者,可行全身系统性治疗或对症支持治疗。
既往研究表明,腹腔镜下子宫颈癌根治术和开腹子宫颈癌根治术比较,其总生存(overall survival,OS)率及无瘤生存(disease-free survival,DFS)率均偏低[9],目前国内也正在开展相关临床研究。研究发现,子宫颈癌早期患者转移至卵巢概率低,因此对于 < 45岁的患者可考虑保留卵巢[10]。临床研究数据表明,对于腹主动脉旁淋巴结阳性者,其影像学分期预后比手术分期预后差[11-12],因此建议对于≥ⅠB1期的患者进行腹主动脉旁淋巴结切除术。SLN可用于病灶直径达4 cm的患者,但其在肿瘤直径 < 2 cm的患者中检出率和准确性最高。可以将显影剂直接注射于子宫颈3点和9点处进行显影,利用荧光摄像头显影注射吲哚菁绿(indocyanine green,ICG)者,利用γ探测器探测识别注射99Tc(technetium-99)者,也可利用肉眼直接观察注射美兰等染料,从而可以在术中识别SLN。Ⅲ期临床试验表明,采用ICG能识别出比蓝色染料更多的SLN[13]。
3 术后辅助治疗术中发现及术后病理分期是决定术后辅助治疗的主要因素。
3.1 高危因素子宫颈癌高危因素有包括淋巴阳性、切缘阳性和宫旁浸润。只要满足以上任何一项高危因素,则推荐行影像学检查了解全身其他部位的转移情况,然后行盆腔EBRT+含铂同步化疗±阴道近距离放疗。
3.2 中危因素2015年NCCN新增Sedlis标准(1级证据),若满足Sedlis标准,建议术后进一步行盆腔EBRT±含铂同步化疗(化疗为2B级证据),但中危因素并不限于Sedlis标准(表 2)[14]。
最近研究表明,子宫颈鳞癌淋巴结转移的预测因素和腺癌并不相同[15]。接受手术和放疗的患者,腺癌预后比鳞癌和腺鳞癌更差,提示腺癌是预后不良的独立危险因素。而和原发肿瘤大小比较,子宫颈间质浸润模式及脉管是否阳性更能准确预测淋巴结转移的风险[16-17]。研究表明,与鳞癌比较,子宫颈腺癌接受放疗后获益更加显著,因此建议腺癌可采用四因素模型:腺癌、淋巴脉管阳性、肿瘤 > 3 cm和深间质浸润,满足这4个因素中的任何2个,追加放疗均可获益[18-19]。
4 子宫颈癌全身治疗原则 4.1 一线联合化疗顺铂被认为是对于转移性子宫颈癌最有效的药物,对于持续性或复发转移性子宫颈癌患者,如果程序性死亡受体配体-1(programmed death ligand-1,PD-L1)阳性[肿瘤细胞阳性比例分数(tumor proportion score,TPS)≥1%,阳性联合分数(combined positive score,CPS)≥1],首先推荐帕博丽珠单抗+顺铂(或卡铂)+紫杉醇±贝伐珠单抗(1级证据)。JCOG0505的Ⅲ期临床试验表明[20],在转移性或复发性的子宫颈癌患者中,卡铂联合紫杉醇使用并不次于顺铂联合紫杉醇,因为卡铂易于管理及耐受性好,而且可以减少患者的住院时间,且卡铂联合紫杉醇(TC)方案中位OS为18.3个月(95%CI:16.1个月~22.9个月),而顺铂联合紫杉醇(TP)中位OS为17.5个月(95%CI:14.2个月~20.3个月),两者相当;但是,在既往未接受顺铂治疗的患者中,TP方案的OS长于TC方案(23.2个月 vs 13.0个月)。因此推荐子宫颈癌全身治疗的铂类药物首选顺铂,而卡铂可以作为既往接受过顺铂治疗的首选。对于紫杉醇类药物不耐受的患者,顺铂+拓扑替康仍然是一种合理的替代方案,而顺铂+吉西他滨已经在子宫颈癌的一线化疗方案中剔除。对于铂不耐受的患者才考虑选择非铂方案化疗,且还处在研究中。
4.2 单药化疗对于无法接受手术或放疗的患者,顺铂、卡铂或紫杉醇都是合理的一线单药方案,其中顺铂是复发或转移性子宫颈癌最有效的化疗单药。同样对于子宫颈癌同期放化疗的患者,通常也首选顺铂单药,顺铂不耐受者再考虑用卡铂。
4.3 二线治疗药物目前指南对于子宫颈癌的二线治疗药物主要包括白蛋白紫杉醇、帕姆单抗、多西他赛、贝伐珠单抗、吉西他滨、拓扑替康、长春瑞滨、异环磷酰胺、5-FU、伊立替康、丝裂霉素及培美曲塞,新版指南新添加药物tisotumab vedotin-tftv。对于PD-L1阳性或高度微卫星不稳定/错配修复缺陷(microsatellite instability-high/deficient mismatch repair,MSI-H/dMMR)表达的肿瘤患者,推荐使用帕博丽珠单抗。同时对于PD-L1阳性患者,新版指南新增推荐使用纳武单抗。而多数生物制剂和靶向治疗药物只在一些特定病例中有一定作用,因此全面推广使用还需要更多的临床研究证据支持。
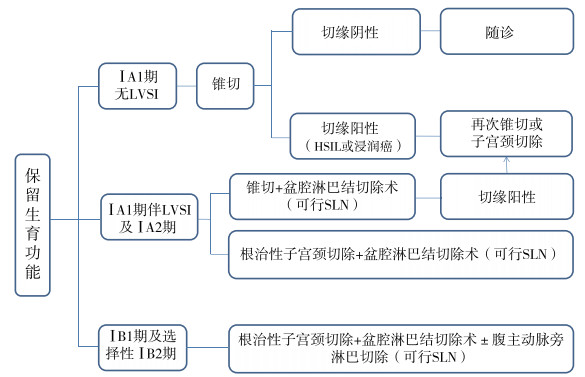
5 子宫颈癌保留生育功能子宫颈癌保留生育功能原则上适用于肿块≤2 cm的患者,对于鳞癌和腺癌同样适用,但不建议胃型腺癌及小细胞神经内分泌肿瘤等特殊病理类型患者保留生育功能,另外对于有高危因素和中危因素的患者也不建议保留生育功能。对于完成生育后是否需要行子宫切除术,需要结合患者自身情况,由医师和患者共同商议后决定。指南强调若子宫颈癌保留生育功能术后持续性子宫颈刮片异常或持续人乳头瘤病毒(human papilloma virus,HPV)感染,建议完成生育后尽快切除子宫,以降低复发转移风险。指南建议首选盆腔增强MRI评估局部病灶情况及肿瘤距离子宫颈内口的距离,对于ⅠB1~ⅠB3期保留生育功能患者,首选颈部/胸部/腹部/盆腔/腹股沟PET-CT或胸部/腹部/骨盆CT检查评估全身情况。针对不同分期子宫颈癌,选择不同保留生育功能的手术方式(图 2)[3]。
先行锥切,如切缘阴性(需至少保证距切缘3 mm内无癌及高级别上皮内病变),可随访;若切缘阳性,建议再次锥切或行子宫颈切除。锥切首选冷刀锥切,建议切除深度≥10 mm,对于已生育过的患者,锥切深度可适当增加至18~20 mm, 如果能够保证足够完整的切缘,也可选择行LEEP,LEEP术尽量整块切除以保证标本的完整性。对于子宫颈管内原位腺癌及可疑浸润癌,为避免子宫颈管病变遗漏风险,推荐锥切深度应到子宫颈内口水平,同时应在锥顶上方搔刮取样,以排除残留病灶。
5.2 ⅠA1期伴LVSI及ⅠA2期可行根治性子宫颈切除+盆腔淋巴结切除术(可行SLN),或选择锥切+盆腔淋巴结切除术(可行SLN),切缘阳性者可行子宫颈切除术或再次锥切。
5.3 ⅠB1期及选择性ⅠB2期可行根治性子宫颈切除术+盆腔淋巴结切除术±腹主动脉旁淋巴结切除术(可行SLN)。
指南原则上推荐病灶≤2 cm者保留生育功能,对于根治性子宫颈切除术可考虑经腹部或经阴道进行操作,但是对于病灶直径2~4 cm者,经腹根治性子宫颈切除可作为首选。另外对于部分病灶 > 2 cm的年轻有强烈保留生育功能女性,可予新辅助化疗后行锥切或子宫颈切除,目前国内也在开展相关的临床研究。
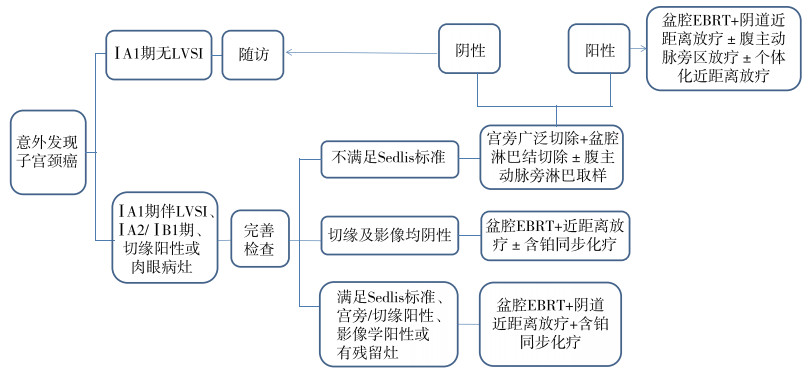
6 意外发现的子宫颈癌、子宫颈小细胞神经内分泌癌和复发性子宫颈癌的治疗 6.1 意外发现的子宫颈癌的治疗指筋膜外全子宫切除术后病理意外发现的浸润性子宫颈癌,新版NCCN指南更新推荐影像学检查,包括颈部/胸部/腹部/骨盆/腹股沟PET-CT或胸部/腹部/骨盆CT检查评估全身转移性情况和盆腔增强MRI评估盆腔局部病灶残留情况。根据病理检查结果,其可选择的治疗方案如下。
6.1.1 经病理复核确诊ⅠA1期无LVSI可选择随访。 6.1.2 ⅠA1期伴LVSI、ⅠA2/ⅠB1期、切缘阳性或有肉眼残留病灶先完善胸部CT、PET-CT或MRI等影像学检查、体格检查及实验室检查等。(1)如果手术切缘和影像学检查均提示阴性,建议行盆腔EBRT)+阴道近距离放疗±含铂同步化疗。(2)如果病理不符合Sedlis标准者,建议行宫旁广泛切除加阴道上段切除+盆腔淋巴结切除±腹主动脉旁淋巴结取样,若术后无病灶残留且淋巴结阴性的患者可选择随访;若术后切缘、宫旁和淋巴结其中任何一项阳性建议补充盆腔EBRT+含铂同步化疗±个体化近距离放疗(阴道切缘阳性者),若腹主动脉旁淋巴结阳性,可追加腹主动脉旁区放疗。(3)对于满足Sedlis标准、宫旁阳性、切缘阳性、病灶残留及影像学阳性者,只要满足以上任何一项,则不考虑手术治疗,可建议直接行盆腔EBRT+阴道近距离放疗+含铂同步化疗(图 3)[3]。
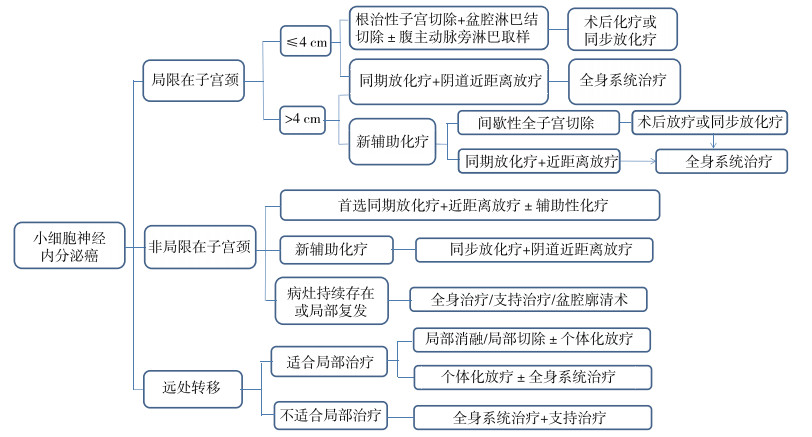
新版指南指出小细胞神经内分泌癌治疗前首选颈部/胸部/腹部/骨盆/腹股沟PET-CT+脑MRI等影像学检查进行评估,其组织形态学上和肺神经内分泌癌相似,免疫组织化学通常表现为染色粒素、CD56和突触素呈阳性。化疗首选依托泊苷+顺铂,若对顺铂不耐受,可选用卡铂。
6.2.1 肿瘤局限在子宫颈且肿块大小≤4 cm其后续治疗方式可选择:(1)无明显手术禁忌者,首先选择根治性子宫切除+盆腔淋巴结切除±腹主动脉旁淋巴结取样,术后可选择辅助化疗,化疗方案可选择依托泊苷+顺铂或依托泊苷+卡铂;或术后同步放化疗(盆腔EBRT同步顺铂/卡铂+依托泊苷化疗);(2)不适合手术者,建议行同步放化疗+阴道近距离放疗,最后进行全身系统治疗。
6.2.2 肿瘤局限于子宫颈且肿块大小 > 4 cm治疗方式可选择:(1)同期放化疗+阴道近距离放疗+其他全身治疗;(2)新辅助化疗(依托泊苷+顺铂/卡铂)+间歇性全子宫切除+术后辅助放疗或同步放化疗+全身系统治疗;(3)新辅助化疗后同期放化疗+阴道近距离放疗+其他全身治疗。
6.2.3 肿瘤非局限于子宫颈治疗方式可选择:(1)首选同期放化疗+阴道近距离放疗±辅助性化疗(依托泊苷+顺铂/卡铂);(2)新辅助化疗后同期放化疗+近距离放疗;(3)病灶持续存在或局部复发,行全身治疗/姑息支持治疗/盆腔廓清术。
6.2.4 远处转移对于适合局部治疗的患者,建议行局部切除或消融术±个体化放疗,或进行个体化放疗±全身系统治疗;对于不适合局部治疗者,建议行全身系统治疗+支持治疗(图 4)[3]。
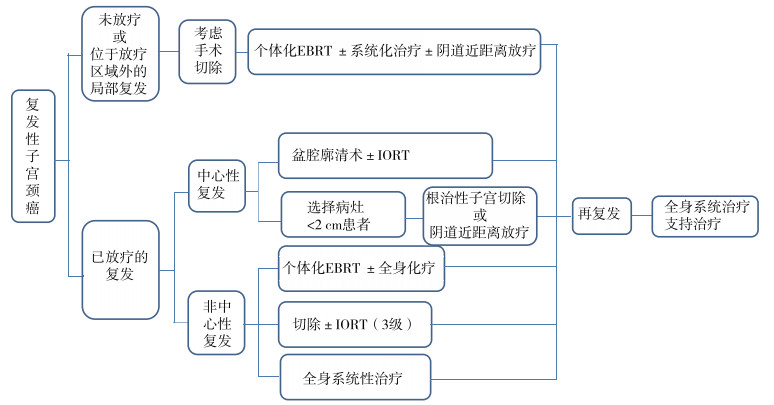
复发性子宫颈癌的治疗方法包括手术、放疗和化疗,根据复发前是否接受过放疗,其治疗方法各不相同。术中放疗(introoperative radiotherapy,IORT)是指在开放手术过程中,对孤立的不可切除的残留病灶提供单一的高度聚焦剂量的辐射。其优势在于能够精准定位,通过人为干预将正常组织离开危险区域,有效限制辐射暴露的面积和深度,避免对周边正常组织的破坏。对于复发治疗后再次复发患者选择全身系统治疗或支持治疗(图 5)[3]。
新版NCCN指南对于复发性子宫颈癌的更新在于其一线联合治疗的更新,推荐对于PD-L1阳性的患者首选紫杉醇+顺铂(或卡铂)+帕博利珠单抗±贝伐珠单抗方案(1类证据);指南新增纳武单抗用于PD-L1阳性的二线治疗(2A类推荐);对于持续性或复发转移性子宫颈癌检测方法建议对可疑部位进行或活组织检查或影像学检查。新版指南建议利用经美国食品药品管理局(Food and Drug Administration,FDA)批准的全基因组测序(comprehensive genomic profiling,CGP)对可疑部位组织进行分析,若组织活检获取困难可选择血浆循环肿瘤细胞DNA(circulating tumor DNA,ctDNA)检测进行CGP分析。
7 2022年第1版NCCN指南主要更新与讨论影像学检查原则更新较为明显:重视增强MRI评估局部病灶及PET-CT或PET-MRI评估全身情况。Ⅰ期:对于不保留生育功能的患者,考虑盆腔增强MRI评估局部病灶情况,特别是ⅠB1~ⅠB3期首先选择盆腔增强MRI评估局部病灶情况,首选颈部/胸部/腹部/骨盆/腹股沟PET-CT或胸部/腹部/骨盆CT或PET/MRI检查进行全身转移情况的评估;对于保留生育功能患者同样首先选择盆腔增强MRI评估局部病灶和肿瘤靠近子宫颈内口的距离,对于不宜行MRI检测的孕妇,也可考虑行经阴道超声检查评估局部病灶情况。Ⅱ~ⅣA期:之前指南为考虑盆腔增强MRI进行局部病灶评估更新为首选盆腔增强MRI进行评估。对于意外发现的子宫颈癌患者,建议选择颈部/胸部/腹部/骨盆/腹股沟PET-CT或胸部/腹部/骨盆CT检查评估全身转移性病灶情况,建议行盆腔增强MRI评估局部病灶残留情况。
小细胞神经内分泌癌更新:治疗前首选颈部/胸部/腹部/骨盆/腹股沟PET-CT+脑MRI等影像学检查进行评估,其组织形态学上和肺神经内分泌癌相似,免疫组织化学通常表现为染色粒素、CD56和突触素呈阳性。
复发转移性子宫颈癌治疗更新:对于持续性或复发转移性子宫颈癌的可疑部位进行影像学检测,在开始治疗前应行组织学活检证实,指南新增建议采用经FDA批准的CGP对可疑部位组织进行分析,若组织活检获取困难可选择血浆ctDNA检测进行CGP分析。推荐对于PD-L1阳性的患者一线治疗首选帕博利珠单抗+顺铂(或卡铂)+紫杉醇±贝伐珠单抗方案(1级推荐);指南新增纳武单抗用于PD-L1阳性的二线治疗(2A类推荐),其他药物新增tisotumab vedotin-tftv(抗体药物偶联物;2A级推荐)。最近随着临床研究的深入进展,子宫颈癌的诊治决策也逐渐步入精准的时代,新版指南主要更新集中体现在免疫治疗的应用上,使得免疫治疗进入复发转移性子宫颈癌的一线治疗行列,特别是对于PD-L1阳性患者,为这部分患者带来了转机和希望,KEYNOTE-158研究证实[21],帕博丽珠单抗在复发晚期子宫颈癌二线治疗中的疗效和安全性,而KEYNOTE-826研究也为免疫治疗联合化疗用于晚期、复发或转移性子宫颈癌的一线治疗提供了进一步支持[22],虽然研究结果显示免疫治疗联合化疗一线治疗可延长无进展生存期(progression-free survival, PFS)和OS,但仅延长2个月左右的PFS,即使加上程序性死亡受体-1(programmed death-1,PD-1)抗体,复发转移子宫颈癌的OS也仅延长8个月左右,因此对于子宫颈癌特别是晚期、复发转移患者的治疗仍需要更进一步探索。
8 小结与展望《NCCN子宫颈癌临床实践指南》是美国妇科肿瘤临床决策的标准,是以证据为依据的指南,被全球妇科肿瘤专家认同并成为世界范围内应用最广泛的指南,亦可作为我国子宫颈癌患者临床诊疗的重要指导。但是我国幅员辽阔,不同地区存在环境、经济、学科发展及种族等差异,标准化的手术及规范化的治疗理念还有待进一步推广。且NCCN指南很多的证据支持也存在一定局限性,并非完全适用于我国国情及中国患者。指南并不能解决所有子宫颈癌诊治相关问题,也存在很多争议:(1)手术分型演进和个体化手术治疗选择,具体手术方式需综合考虑患者具体情况和诊治医疗团队技术等作出个体化选择;(2)新辅助化疗广泛应用与患者生存获益性,虽然目前并没有证据支持新辅助化疗的获益性,且指南并不推荐新辅助化疗,但是临床实践发现其至少为大病灶子宫颈癌要求保留生育功能的年轻女性和局部晚期或巨块型子宫颈癌的手术治疗创造一定机会;(3)Sedlis标准的广泛应用与局限性,子宫颈鳞癌术后具有中危险因素的患者术后辅助治疗主要参照Sedlis标准,但是子宫颈腺癌淋巴结转移的预测因素可能与鳞癌不同,其并不适用于该标准,且对于未达Sedlis标准但存在危险因素的患者是否需要进行辅助治疗以提高预后仍没有明确的说法;(4)对于微创手术和开腹手术的优劣性,虽然国外多数指南均支持微创手术比开腹手术具有更差的肿瘤学预后,甚至将开腹手术作为子宫颈癌手术的金标准术式,但是国内学者也在不断探索微创手术的改进办法,比如废除举宫器、闭合式切阴道和加强无瘤观念,同时开展相关临床研究,为微创手术继续开展提供证据支持等。
综上所述,临床医师可以根据国外指南来指导临床诊疗决策,规范诊疗行为,从而提高诊疗结局和质量,但是不能完全依赖国外指南,因为我国医疗实际情况、疾病的地域差异和患者的体质等均和西方国家存在一定差异,因此需要我国临床医师能灵活应用指南,以临床实际作为出发点,与具体医疗实践相结合,结合每例子宫颈癌患者的具体情况,做出精准的个体化的临床决策;同时应针对国内子宫颈癌人群开展高质量的多中心、大样本的临床研究并制订符合我国实际情况的诊疗指南,在推动我国子宫颈癌治疗发展的同时,也为世界子宫颈癌诊治提供更多来自中国的证据支持。
| [1] |
Fowler JR, Maani EV, Jack BW. Cervical cancer[EB/OL]. (2021-07-07)[2022-05-01]. http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=28613745&query_hl=1
|
| [2] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [3] |
Abu-Rustum NR, Yashar CM, Bean S, et al. NCCN guidelines insights: Cervical cancer, version 1.2022[EB/OL]. (2021-10-26)[2022-05-01]. https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1426.
|
| [4] |
周晖, 刘昀昀, 罗铭, 等. 《2021 NCCN子宫颈癌临床实践指南(第1版)》解读[J]. 中国实用妇科与产科杂志, 2020, 36(11): 1098-1104. |
| [5] |
中华医学会妇科肿瘤学分会. 宫颈癌微创手术的中国专家共识[J]. 中国医学前沿杂志: 电子版, 2019, 11(11): 27-29. |
| [6] |
张军. 宫颈癌治疗的现状及问题: 从临床指南到真实世界研究[J]. 中国全科医学, 2022, 25(3): 259-263. DOI:10.12114/j.issn.1007-9572.2021.02.105 |
| [7] |
专业委员会中国医师协会微无创医学专业委员会妇科肿瘤学组, 中国妇幼保健协会生育力保存专业委员会. 早期子宫颈癌保留生育功能手术的中国专家共识[J]. 中国微创外科杂志, 2021, 21(8): 673-679. DOI:10.3969/j.issn.1009-6604.2021.08.001 |
| [8] |
Bhatla N, Berek JS, Cuello FM, et al. Revised FIGO staging for carcinoma of the cervix uteri[J]. Int J Gynaecol Obstet, 2019, 145(1): 129-135. DOI:10.1002/ijgo.12749 |
| [9] |
Ramirez PT, Frumovitz M, Pareja R, et al. Minimally invasive versus abdominal radical hysterectomy for cervical cancer[J]. N Engl J Med, 2018, 379(20): 1895-1904. DOI:10.1056/NEJMoa1806395 |
| [10] |
Landoni F, Zanagnolo V, Lovato-Diaz L, et al. Ovarian metastases in early-stage cervical cancer (ⅠA2-ⅡA): a multicenter retrospective study of 1 965 patients (a Cooperative Task Force study)[J]. Int J Gynecol Cancer, 2007, 17(3): 623-628. DOI:10.1111/j.1525-1438.2006.00854.x |
| [11] |
Frumovitz M, Querleu D, Gil-Moreno A, et al. Lymphadenectomy in locally advanced cervical cancer study (LiLACS): phase Ⅲ clinical trial comparing surgical with radiologic staging in patients with stages ⅠB2-ⅣA cervical cancer[J]. J Minim Invasive Gynecol, 2014, 21(1): 3-8. DOI:10.1016/j.jmig.2013.07.007 |
| [12] |
Gouy S, Morice P, Narducci F, et al. Prospective multicenter study evaluating the survival of patients with locally advanced cervical cancer undergoing laparoscopic para-aortic lymphadenectomy before chemoradiotherapy in the era of positron emission tomography imaging[J]. J Clin Oncol, 2013, 31(24): 3026-3033. DOI:10.1200/JCO.2012.47.3520 |
| [13] |
Frumovitz M, Plante M, Lee PS, et al. Near-infrared fluorescence for detection of sentinel lymph nodes in women with cervical and uterine cancers (FILM): a randomised, phase 3, multicentre, non-inferiority trial[J]. Lancet Oncol, 2018, 19(10): 1394-1403. DOI:10.1016/S1470-2045(18)30448-0 |
| [14] |
Koh WJ, Greer BE, Abu-Rustum NR, et al. Cervical cancer, version 2. 2015[J]. J Natl Compr Canc Netw, 2015, 13(4): 395-404. DOI:10.6004/jnccn.2015.0055 |
| [15] |
Noh JM, Park W, Kim YS, et al. Comparison of clinical outcomes of adenocarcinoma and adenosquamous carcinoma in uterine cervical cancer patients receiving surgical resection followed by radiotherapy: a multicenter retrospective study (KROG 13-10)[J]. Gynecol Oncol, 2014, 132(3): 618-623. DOI:10.1016/j.ygyno.2014.01.043 |
| [16] |
Parra-Herran C, Taljaard M, Djordjevic B, et al. Pattern-based classification of invasive endocervical adenocarcinoma, depth of invasion measurement and distinction from adenocarcinoma in situ: interobserver variation among gynecologic pathologists[J]. Mod Pathol, 2016, 29(8): 879-892. DOI:10.1038/modpathol.2016.86 |
| [17] |
Roma AA, Mistretta TA, Diaz de Vivar A, et al. New pattern-based personalized risk stratification system for endocervical adenocarcinoma with important clinical implications and surgical outcome[J]. Gynecol Oncol, 2016, 141(1): 36-42. DOI:10.1016/j.ygyno.2016.02.028 |
| [18] |
Ryu SY, Kim MH, Nam BH, et al. Intermediate-risk grouping of cervical cancer patients treated with radical hysterectomy: a Korean Gynecologic Oncology Group study[J]. Br J Cancer, 2014, 110(2): 278-285. DOI:10.1038/bjc.2013.716 |
| [19] |
Cibula D, Abu-Rustum NR, Fischerova D, et al. Surgical treatment of "intermediate risk" lymph node negative cervical cancer patients without adjuvant radiotherapy-A retrospective cohort study and review of the literature[J]. Gynecol Oncol, 2018, 151(3): 438-443. DOI:10.1016/j.ygyno.2018.10.018 |
| [20] |
Kitagawa R, Katsumata N, Shibata T, et al. Paclitaxel plus carboplatin versus paclitaxel plus cisplatin in metastatic or recurrent cervical cancer: The open-label randomized phase Ⅲ trial JCOG0505[J]. J Clin Oncol, 2015, 33(19): 2129-2135. DOI:10.1200/JCO.2014.58.4391 |
| [21] |
Marabelle A, Fakih M, Lopez J, et al. Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study[J]. Lancet Oncol, 2020, 21(10): 1353-1365. DOI:10.1016/S1470-2045(20)30445-9 |
| [22] |
Colombo N, Dubot C, Lorusso D, et al. Pembrolizumab for persistent, recurrent, or metastatic cervical cancer[J]. N Engl J Med, 2021, 385(20): 1856-1867. DOI:10.1056/NEJMoa2112435 |
 2022, Vol. 37
2022, Vol. 37