文章信息
- 叶显宗, 齐兴峰, 江碧兰, 熊喜生, 郑智勇, 余英豪, 曲利娟
- 口腔梭形细胞鳞状细胞癌二例临床病理分析
- 实用肿瘤杂志, 2021, 36(4): 352-354
基金项目
- 福建省自然科学基金(2019J01522);联勤保障部队第九〇〇医院临床应用研究专项基金(2019L12)
-
通信作者
- 曲利娟, E-mail: qljuan6516@sina.com
-
文章历史
- 收稿日期:2020-04-06
梭形细胞鳞状细胞癌(spindle cell squamous cell carcinoma,SCSCC)是一种相对少见的头颈部恶性肿瘤,口腔是除喉部以外该区域的另一好发部位;SCSCC在口腔肿瘤中所占比例 < 1%[1-4]。此类肿瘤常表现为恶性肉瘤样成分与鳞癌混合存在,根据其特征性的病理形态,辅以必要的免疫组织化学染色,可以正确诊断。本文回顾性分析2例口腔SCSCC并作文献复习,以期加深对此类肿瘤临床病理特征、诊断和预后评估的认识。
1 病例资料收集联勤保障部队第九〇〇医院病理科2014年1月至2019年12月期间诊断的SCSCC 2例,复阅病理切片,按照2017年美国癌症联合委员会(American Joint Committee on Cancer,AJCC)发布的第8版唇与口腔肿瘤TNM分期手册进行重新评估分期[5],查阅临床资料并随访。
1.1 临床特点病例1,女性,61岁,以右颊部肿物渐进性增大8个月余来院就诊,病变位于右侧颊部黏膜。术前影像学检查提示肿物最大径为3.3 cm,患者既往未曾罹患肿瘤,无射线暴露史,无吸烟饮酒史。
病例2,男性,35岁,以发现口腔无痛性肿块4个月来院就诊,病变位于舌缘。术前,影像学检查提示肿物的最大径为1.8 cm。患者有长期吸烟史,既往未曾罹患肿瘤,无射线暴露史。
1.2 病理形态特点2例口腔SCSCC按照AJCC第8版TNM分期重新评估[5],最大浸润深度分别为9 mm和13 mm,均存在多个淋巴结转移,但无淋巴结外侵犯,转移淋巴结最大径 < 3 cm,具体病理TNM分期及预后分期见表 1。光学显微镜下,2例SCSCC都包含鳞状细胞癌和肉瘤样成分,肉瘤样成分与典型鳞癌或黏膜表面原位鳞状细胞癌成分存在延续过渡。典型鳞状细胞癌成分肿瘤细胞胞质嗜酸性,核大深染,可见角化珠或细胞间桥(图 1A)。2例肉瘤样成分均 > 50%,病例1的梭形细胞成分达90%(图 1B),病例2呈明显多形性弥漫生长,可见奇异形细胞和瘤巨细胞散在分布(图 1C)。病例2肿瘤表面黏膜可见灶性坏死及炎性渗出物附着。
| 病例 | 部位 | 肿物大小 | 最大浸润深度(mm) | T分期 | N分期 | 预后分期 |
| 1 | 颊黏膜 | 3 cm×1.5 cm×1.5 cm | 13 | 3 | 2b | 4a |
| 2 | 舌缘 | 2.5 cm×2 cm×1.2 cm | 9 | 2 | 2b | 4a |
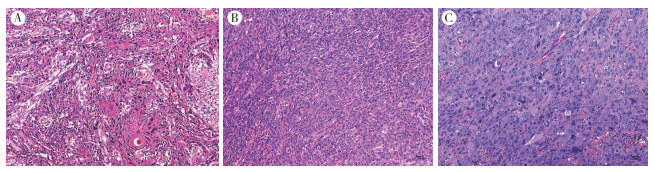
|
| 注 A:病例1,鳞状细胞癌区域与肉瘤样成分过渡区域,可见典型的“角化珠”形成;B:病例1,肉瘤样成分以梭形细胞为主;C:病例2,肿瘤的主体成分呈明显多形性,核分裂象易见,并见瘤巨细胞 图 1 梭形细胞鳞状细胞癌形态学特点(HE×100) |
2例患者肉瘤样成分及鳞状细胞癌区域均表达CKpan和p63(图 2A~2B),不表达SMA、S-100和p16。鳞状细胞癌成分呈EMA强表达,肉瘤样成分EMA表达减弱或仅灶性表达,肉瘤样癌成分呈Vimentin弥漫阳性(图 2C)。p53蛋白在病例1呈高表达(图 2D),病例2呈阴性。病例1和病例2的Ki-67增殖指数分别为40%和80%。
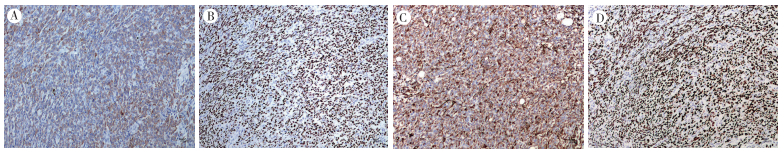
|
| 注 A:肉瘤样成分表达CKpan;B:肉瘤样成分表达p63;C:肉瘤样成分表达Vimentin;D:肉瘤样成分表达p53 图 2 病例1免疫组织化学表型特点(EliVision×100) |
2例SCSCC行肿物切除及颈部淋巴结清扫术后,病例1在本院继续辅以放化疗,2018年5月10日始行三维适形调强放疗,原瘤床为2.0 Gy/次,5次/周,照射总剂量56 Gy/28次;右颈部淋巴结引流区为1.8 Gy/次,5次/周,照射总剂量50.4 Gy/28次;于2018年5月12日给予洛铂50 mg d1(21d为1个周期)同步化疗1个周期,于2018年8月5日给予多西他赛100 mg d1+洛铂40 mg d2(21 d为1个周期)辅助化疗1个周期,2次化疗过程顺利,但均出现不同程度骨髓抑制,转往当地医院对症治疗后好转。病例2患者术后治疗情况不详。随访截止2019年12月,病例2于术后6个月死于肿瘤进展(未行影像学检查)。病例1目前生存。该患者于术后9个月(放化疗结束后5个月)出现颈部转移,而后于外院接受姑息化疗(具体方案不详)。
2 讨论发生于口腔的SCSCC是鳞状细胞癌的一种特殊亚型,具有侵袭性强和预后差的特点,过去也曾被称为肉瘤样癌、癌肉瘤和梭形细胞癌等,并在2017年世界卫生组织头颈部肿瘤新分类中被命名为SCSCC[6]。口腔SCSCC一般发生在中老年人群,平均年龄为50~65岁;男性发病率高于女性,男女比例甚至可高达12∶1[3-4]。常见发病部位包括唇、舌、牙龈和颊黏膜,其中牙龈及颊黏膜被认为口腔SCSCC相对高发部位[3, 7]。本研究的2个病例发病部位分别位于颊黏膜和舌缘。临床上,多数表现为口腔内包块伴或不伴表面黏膜溃疡,有时会出现吞咽、说话和咀嚼功能障碍[1]。> 95%的病例就诊前病程≤1年[1]。吸烟饮酒史及射线暴露被认为是肉瘤样转化的重要因素,也有研究从危险因素的角度分析这可能是造成男女比例差别巨大的原因;该病与人类乳头瘤病毒的感染无关[1, 3, 7]。本研究所报道的2例SCSCC,只有1例有明确的吸烟史,另1例无明确危险因素暴露史。
SCSCC在形态上含有传统的鳞状细胞癌和肉瘤样变梭形细胞的成分。一方面,这些鳞状细胞癌成分可以多种形态和分化程度存在,有时甚至难以辨识。这种情况下,应注意多取材,寻找可能存在的癌、原位癌、异性增生或2种成分移行的证据,这是SCSCC诊断的金标准[8]。如果充分取材后,鳞状细胞癌成分的证据依然不充分,就需要借助免疫组织化学染色来辅助诊断,部分病例甚至需要超微结构观察和分子克隆技术来证明肉瘤样成分也是上皮来源[2-3]。另一方面,肉瘤样变成分可以由梭形细胞和(或)多形性(上皮样)细胞所构成[1]。本文中就有1例含有明显多形性的细胞成分。SCSCC中的鳞状细胞癌成分表达经典鳞癌标志物,多数病例肉瘤样癌成分可表达上皮标志物CKpan、EMA和CAM5.2,但有40%的病例会丢失上皮标志物的表达,这种情况下仍不能完全排除SCSCC的可能[1]。但在反复取材无鳞癌证据,同时缺乏上皮标志物表达的病例,需要排除软组织肉瘤可能才考虑SCSCC[8]。p63和p40这2个标志物多数情况下与上皮标志物的表达相对应,但在部分不表达上皮标志物的SCSCC也可呈阳性[1]。Vimentin在所有病例中呈弥漫阳性,黑色素瘤/神经标志物S-100、肌源性标志物SMA和p16蛋白一般呈阴性。
尽管口腔内出现梭形细胞肉瘤样成分多数是SCSCC[7],但SCSCC仍然需要与口腔内发生的其他梭形细胞肿瘤作鉴别,特别是鳞癌成分不明显的时候。这些肿瘤的类型包括黏膜梭形细胞黑色素瘤、平滑肌肉瘤和肌上皮癌等。(1)黏膜梭形细胞黑色素瘤,部分可无色素颗粒,与SCSCC存在部分形态学重叠,但黑色素瘤的核仁更为明显,并可通过S-100、HMB45和MelanA的免疫组织化学染色加以鉴别;(2)平滑肌肉瘤,发生于口腔少见,形态上以平行束状或交织束状排列的嗜酸性梭形细胞为主,细胞核两端平钝或呈雪茄样,再结合SMA、Calponin和H-Caldesmon等肌源性标志物的弥漫阳性表达可以鉴别;(3)肌上皮癌,是一种发生于口腔小涎腺的涎腺来源肿瘤,可呈实性、巢状和束状等多种生长方式,肿瘤细胞可呈梭形、浆样和上皮样形态,总体而言,间变性不如SCSCC明显[7];免疫组织化学上,肌上皮癌既表达CKpan、CK5/6和p63,也表达肌源性标志物SMA、S-100和CD10;鉴别诊断需要综合形态及免疫组织化学特征;(4)具有明显多形性的病例,还需要多形性横纹肌肉瘤鉴别[2]。
口腔SCSCC的预后比传统型鳞状细胞癌差,已报道的病例多数处于晚期,5年生存率 < 16%[4, 7]。头颈部的淋巴引流管网较密集,被认为是SCSCC容易发生淋巴结及远处转移的重要因素[4];故而,SCSCC患者就诊时,就存在较高比例的淋巴结转移[7]。而本文2例病例术后病理均提示存在淋巴结转移。治疗上,目前临床采取类似于传统型鳞状细胞癌的方案,即以肿物切除,辅以术后放化疗[4]。而颈部淋巴结的处理可以术前应用多种影像学方法充分评估,早期口腔癌先行活检,组织定性后再进一步制定治疗方案。以程序性死亡受体配体1/程序性死亡受体1为代表的免疫治疗是近年来肿瘤领域的新突破,也有学者试图研究应用包括化疗和免疫治疗在内手段对SCSCC进行系统治疗的效果[9-10];希望更加丰富的治疗手段能改善SCSCC患者的预后。
总之,口腔SCSCC是极为少见的肿瘤,好发于老年男性,常在就诊时已发生淋巴结转移,给治疗带来很大挑战。针对SCSCC的诊断,需要重视取材的充分性,结合免疫组织化学的辅助手段;其他临床病理参数,如肿瘤的大小、最大浸润深度和淋巴结状态等,可以为肿瘤的预后判断提供依据。目前关于此类肿瘤的具体驱动机制尚不清楚,有待进一步阐明。
| [1] |
Wenig BM. Atlas of head and neck pathology[M]. 3rd ed.. Philadelphia: Elsevier Health Sciences, 2015: 747-756.
|
| [2] |
毛美玲, 邢莉, 杨冬梅, 等. 喉梭形细胞鳞状细胞癌临床病理分析[J]. 临床与实验病理学杂志, 2018, 34(7): 752-756. |
| [3] |
Liu J, Xiao M, Wang Y. Oral sarcomatoid squamous cell carcinoma: a retrospective study based on 14 cases[J]. Histol Histopathol, 2019, 35(4): 18176. |
| [4] |
Chang NJ, Kao DS, Lee LY, et al. Sarcomatoid carcinoma in head and neck: a review of 30 years of experience——clinical outcomes and reconstructive results[J]. Ann Plast Surg, 2013, 71(Suppl 1): S1-7. |
| [5] |
丁洁, 韩伟, 孙国文. 第八版美国癌症联合委员会唇与口腔肿瘤TNM分期更新解读[J]. 中华口腔医学杂志, 2017, 52(8): 504-509. DOI:10.3760/cma.j.issn.1002-0098.2017.08.011 |
| [6] |
El-Naggar AK, Chan JK, Grandis JR, et al. WHO classification of head and neck tumours[M]. 4th ed.. Lyon: IARC Press, 2017: 109-111.
|
| [7] |
Viswanathan S, Rahman K, Pallavi S, et al. Sarcomatoid (spindle cell) carcinoma of the head and neck mucosal region: a clinicopathologic review of 103 cases from a tertiary referral cancer centre[J]. Head Neck Pathol, 2010, 4(4): 265-275. DOI:10.1007/s12105-010-0204-4 |
| [8] |
侯德法, 孟刚, 郝大海. 肉瘤样癌形态学及免疫组化观察[J]. 安徽医科大学学报, 2008, 43(6): 627-630. |
| [9] |
李思毅, 吴开柳, 陆伟, 等. 早期口腔癌颈部淋巴结处理[J]. 实用肿瘤杂志, 2015, 30(1): 8-11. |
| [10] |
Tan E, Mody MD, Saba NF. Systemic therapy in non-conventional cancers of the larynx[J]. Oral Oncol, 2018, 82: 61-68. |
 2021, Vol. 36
2021, Vol. 36


