文章信息
- 杨琴燕, 何俊, 沈忠, 杨关根
- Yang Qinyan, He Jun, Shen Zhong, Yang Guangen
- 基于SEER数据库回顾性分析老年结直肠癌伴淋巴结转移患者的预后
- A retrospective analysis on prognosis of elderly colorectal cancer patients with lymph node metastasis based on SEER database
- 实用肿瘤杂志, 2022, 37(1): 60-66
- Journal of Practical Oncology, 2022, 37(1): 60-66
基金项目
- 浙江省医药卫生科技计划项目(2020KY721)
-
通信作者
- 杨关根,E-mail:yangguangen88@126.com
-
文章历史
- 收稿日期:2021-07-12
结直肠癌是全世界第四大致命癌症,每年因此病死亡患者近90万例[1-2],是女性第二常见癌症,男性第三常见癌症[3]。据统计,随着发展中国家的患病率不断增高,预计到2035年,全球结直肠癌发病率将增至250万例[1, 4]。流行病学研究显示,年龄增长一直是该疾病发病的强影响因素[5]。随着我国新生儿出生率的降低,人口老龄化问题越发严重,研究并应对老年疾病显得尤为必要。
此外,淋巴结转移对结直肠的诊疗具有十分重要的意义[6]。虽然目前出现的多种新的治疗方案使伴淋巴结转移的结直肠癌患者的总生存期有所提高,但未发生转移的结直肠癌患者的生存期仍然是该疾病当中最好的。另外,目前国际抗癌联盟(Union for International Cancer Control,UICC)/美国癌症联合会(American Joint Committee on Cancer,AJCC)TNM分期虽然经多次修订,但单纯运用该分期对肿瘤诊疗及预后进行评估仍具有一定的局限性。本研究提取美国监测、流行病学和最终结果(Surveillance,Epidemiology,and End Results,SEER)数据库中≥65岁且伴有淋巴结转移的结直肠癌患者资料,进行影响预后的相关因素分析,以期为我国应对及诊疗老年结直肠癌提供借鉴意义。
1 资料与方法 1.1 一般资料选取SEER数据库1992-2017年确诊为结直肠癌的患者共计256 726例,统计不同年龄人群比例。选取SEER数据库中2004-2017年确诊为结直肠癌伴淋巴结转移的老年患者共计17 893例。提取变量包括年龄、性别、种族、确诊年份、肿瘤原发部位、组织学分型、分级、TNM分期、肿瘤大小、检出淋巴结数(examined lymph node,ELN)、阳性淋巴结数(positive lymph node,PLN)、肿瘤数量、生存时间及生存状态。
1.2 方法利用SEER*Stat 8.3.8软件选取变量并提取病例,筛选条件为:年龄≥65岁,排除未知种族,确诊年份为2004~2017年,原发部位为结肠或直肠,排除组织学分型未知,排除未知分级,排除N0及NX,排除肿瘤大小、ELN、PLN、生存时间及生存状态未知。种族中,亚洲、太平洋岛民、阿拉斯加土著和美洲印第安人纳入亚洲及其他;组织学类型为腺癌、乳头状腺癌、黏液腺癌、印戒细胞癌、类癌及其他类型(包括未分化癌、大细胞癌、腺鳞癌和鳞癌等);直、乙交界为直肠乙状结肠交界;TNM分期使用AJCC第七版TNM分期[7];根据X-tile软件选取ELN、PLN及肿瘤大小的最佳截断值;按照PLN分为低风险、中风险及高风险组。利用单因素及多因素Cox回归分析影响预后危险因素。
1.3 统计学分析利用Prism 8软件进行人群比例统计。使用R软件进行提取人群的基线资料统计。使用SPSS 18软件进行单因素及多因素(前向:LR法)Cox比例风险回归模型分析。以P<0.05为差异具有统计学意义。
2 结果 2.1 年龄分布1992-2017年SEER数据库中结直肠癌患者不同年龄段的人群比例分析显示,老年患者占比持续>50%。其中1992-1995年、1996-1999年、2000-2003年、2004-2007年、2008-2011年、2012-2015年和2016-2017年分别为71.3%、69.9%、66.6%、62.5%、58.6%、55.7%和55.7%(图 1)。
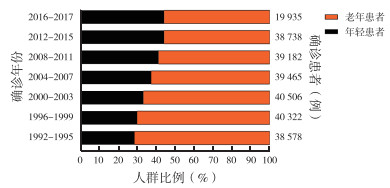
|
| 图 1 SEER数据库1992-2017年老年结直肠癌患者年龄分布情况 Fig.1 Age distribution of elderly patients with colorectal cancer from 1992 to 2017 in SEER database |
所提取病例多数为白人(75.5%)、结肠部位(64.5%)、Ⅱ级(中分化,66.2%)、T3期(63.8%)、M0期(71.6%)和腺癌(80.4%)。X-tile分析所提资料ELN最佳截断值为<12枚、12~17枚及>17枚;PLN最佳截断值为<3枚(低风险)、3~7枚(中风险)及>7枚(高风险);肿瘤大小最佳截断值为<35 mm、35~59 mm及>59 mm(图 2)。其中ELN>17枚、PLN<3枚和肿瘤大小35~59 mm的患者占比较高,分别为44.7%、44.3%和45.2%(表 1)。
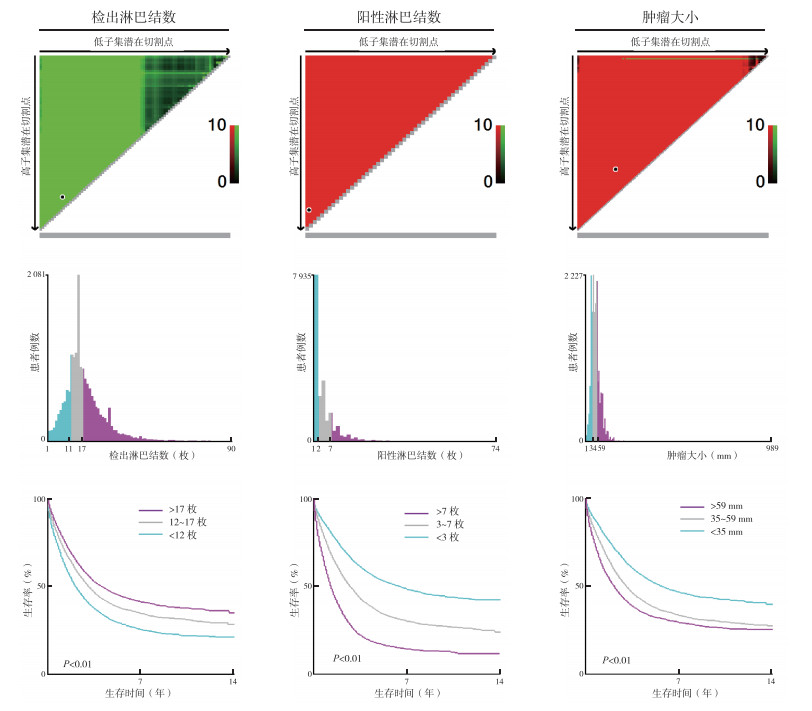
|
| 图 2 X-tile软件分析ELN、PLN及肿瘤大小最佳截断值 Fig.2 Optimal cut-off values of ELN, PLN and tumor size by X-tile software |
| 变量 | 例数(%) | 变量 | 例数(%) | |
| 性别 | 种族 | |||
| 女性 | 9 714(54.3) | 黑人 | 1 691(9.45) | |
| 男性 | 8 179(45.7) | 白人 | 13 512(75.5) | |
| 分级 | 亚洲及其他 | 2 690(15.0) | ||
| Ⅱ级 | 11 844(66.2) | 原发部位 | ||
| Ⅲ级 | 5 203(29.1) | 结肠 | 11 554(15.0) | |
| Ⅳ级 | 846(4.73) | 乙状结肠 | 3 429(19.2) | |
| T分期 | 直乙交界 | 1 242(6.9) | ||
| T1 | 379(2.1) | 直肠 | 1 668(9.3) | |
| T2 | 1 188(6.64) | 组织学分型 | ||
| T3 | 11 421(63.8) | 腺癌 | 14 383(80.4) | |
| T4 | 4 905(27.4) | 黏液腺癌 | 1 701(9.5) | |
| N分期 | 乳头状腺癌 | 979(5.5) | ||
| N1 | 10 112(56.5) | 印戒细胞癌 | 309(1.7) | |
| N2 | 7 781(43.5) | 其他 | 521(2.9) | |
| M分期 | ELN | |||
| M0 | 12 813(71.6) | <12枚 | 3 642(20.4) | |
| M1 | 4 903(27.4) | 12~17枚 | 6 245(34.9) | |
| Mx | 177(1.0) | >17枚 | 8 006(44.7) | |
| 肿瘤大小 | PLN | |||
| <35 mm | 4 158(23.2) | <3枚 | 7 935(44.3) | |
| 35~59 mm | 8 089(45.2) | 3~7枚 | 6 746(37.7) | |
| >59 mm | 5 646(31.6) | >7枚 | 3 212(18.0) | |
| 注 ELN:检出淋巴结数(examined lymph node);PLN:阳性淋巴结数(positive lymph node) | ||||
通过单因素Cox回归分析排除性别因素,患者预后在种族、原发部位、组织学分型、分级、TNM分期、ELN、PLN及肿瘤大小方面差异均具有统计学意义(均P<0.05),纳入多因素Cox回归分析。结果显示,上述纳入变量均为影响预后的相关因素(均P<0.05),计算C-Index为0.751(表 2)。其中,使老年结直肠癌伴淋巴结转移患者死亡风险增加的因素包括组织学分型为其他分型、Ⅲ/Ⅳ级、T2/T3/T4、N2、M1/MX、PLN 3~7枚/>7枚和肿瘤大小35~59 mm/>59 mm;而人种为白人/亚洲及其他、部位为乙状结肠/直乙交界、ELN 12~17枚/>17枚与对照比较为使患者死亡风险降低的影响因素(表 2)。
| 变量 | 单因素分析 | 多因素分析 | |||
| P值 | Exp(B) | P值 | Exp(B) | ||
| 性别 | NA | ||||
| 女性 | 1 | ||||
| 男性 | 0.886 | 0.997 | |||
| 种族 | |||||
| 黑人 | 1 | 1 | |||
| 白人 | 0.013 | 0.920 | 0.019 | 0.924 | |
| 亚洲及其他 | <0.01 | 0.722 | <0.01 | 0.768 | |
| 原发部位 | |||||
| 结肠 | 1 | 1 | |||
| 乙状结肠 | <0.01 | 0.800 | <0.01 | 0.822 | |
| 直乙交界 | <0.01 | 0.792 | <0.01 | 0.799 | |
| 直肠 | <0.01 | 0.828 | 0.113 | 0.945 | |
| 组织学分型 | |||||
| 腺癌 | 1 | 1 | |||
| 黏液腺癌 | <0.01 | 1.126 | 0.697 | 0.987 | |
| 乳头状腺癌 | 0.001 | 0.849 | 0.287 | 1.052 | |
| 印戒细胞癌 | <0.01 | 1.744 | 0.073 | 1.134 | |
| 其他 | <0.01 | 1.814 | <0.01 | 1.327 | |
| 分级 | |||||
| Ⅱ级 | 1 | 1 | |||
| Ⅲ级 | <0.01 | 1.612 | <0.01 | 1.295 | |
| Ⅳ级 | <0.01 | 1.814 | <0.01 | 1.329 | |
| T分期 | |||||
| T1 | 1 | 1 | |||
| T2 | 0.048 | 1.289 | 0.197 | 1.180 | |
| T3 | <0.01 | 3.409 | <0.01 | 2.296 | |
| T4 | <0.01 | 6.467 | <0.01 | 3.283 | |
| N分期 | |||||
| N1 | 1 | 1 | |||
| N2 | <0.01 | 2.023 | <0.01 | 1.180 | |
| M分期 | |||||
| M0 | 1 | 1 | |||
| M1 | <0.01 | 3.667 | <0.01 | 2.726 | |
| Mx | <0.01 | 2.025 | <0.01 | 1.720 | |
| ELN | |||||
| <12枚 | 1 | 1 | |||
| 12~17枚 | <0.01 | 0.767 | <0.01 | 0.708 | |
| >17枚 | <0.01 | 0.633 | <0.01 | 0.551 | |
| PLN | |||||
| <3枚 | 1 | 1 | |||
| 3~7枚 | <0.01 | 1.654 | <0.01 | 1.196 | |
| >7枚 | <0.01 | 2.887 | <0.01 | 1.693 | |
| 肿瘤大小 | |||||
| <35 mm | 1 | 1 | |||
| 35~59 mm | <0.01 | 1.466 | <0.01 | 1.149 | |
| >59 mm | <0.01 | 1.810 | <0.01 | 1.248 | |
| 注 ELN:检出淋巴结数(examined lymph node);PLN:阳性淋巴结数(positive lymph node);NA:不适用(not applicable) | |||||
将所提资料按PLN高、中和低风险进行分组并统计基线资料(表 3)。高风险组与低和中风险组比较,组织学类型中印戒细胞癌(4.5% vs 0.8%、1.5%)、T4期(41.9% vs 20.9%、28.2%)、ELN<12枚(7.6% vs 22.8%、23.6%)和肿瘤大小>59 mm(42.7% vs 27.5%、31.0%)患者占比更高(表 3)。高风险组患者肿瘤分级多为Ⅲ/Ⅳ级,而低和中风险组多为Ⅱ级。
| 变量 | 低风险组(<3枚) | 中风险组(3~7枚) | 高风险组(>7枚) |
| 总例数 | 7 935 | 6 746 | 3 212 |
| 种族 | |||
| 黑人 | 783(9.9) | 660(9.8) | 248(7.7) |
| 白人 | 5 933(74.8) | 5 061(75.0) | 2 518(78.4) |
| 亚洲及其他 | 1 219(15.4) | 1 025(15.2) | 446(13.9) |
| 原发部位 | |||
| 结肠 | 4 945(62.3) | 4 386(65.0) | 2 223(69.2) |
| 乙状结肠 | 1 685(21.2) | 1 258(18.6) | 486(15.1) |
| 直乙交界 | 516(6.5) | 511(7.6) | 215(6.7) |
| 直肠 | 789(9.9) | 591(8.8) | 288(9.0) |
| 组织学分型 | |||
| 腺癌 | 6 527(82.3) | 527(81.9) | 2 366(73.7) |
| 黏液腺癌 | 654(8.2) | 626(9.3) | 421(13.1) |
| 乳头状腺癌 | 550(6.9) | 318(4.7) | 111(3.5) |
| 印戒细胞癌 | 62(0.8) | 101(1.5) | 146(4.5) |
| 其他 | 142(1.8) | 174(2.6) | 168(5.2) |
| 分级 | |||
| Ⅱ级 | 5 949(75.0) | 4 420(65.5) | 1 475(45.9) |
| Ⅲ级 | 1 765(22.2) | 1 979(29.3) | 1 459(45.4) |
| Ⅳ级 | 221(2.8) | 347(5.1) | 278(8.7) |
| T分期 | |||
| T1/T2 | 1 129(13.2) | 381(5.6) | 57(1.8) |
| T3 | 5 147(64.9) | 4 464(66.2) | 1 810(56.4) |
| T4 | 1 659(20.9) | 1 901(28.2) | 1 345(41.9) |
| M分期 | |||
| M0 | 6 517(82.1) | 4 616(68.4) | 1 680(52.3) |
| M1 | 1 348(17.0) | 2 060(30.5) | 1 495(46.5) |
| Mx | 70(0.9) | 70(1.0) | 37(1.2) |
| ELN | |||
| <12枚 | 1 808(22.8) | 1 589(23.6) | 245(7.63) |
| 12~17枚 | 2 785(35.1) | 2 395(35.5) | 1 065(33.2) |
| >17枚 | 3 342(42.1) | 2 762(40.9) | 1 902(59.2) |
| 肿瘤大小 | |||
| <35 mm | 2 261(28.5) | 1 477(21.9) | 420(13.1) |
| 35~59 mm | 3 491(44.0) | 3 178(47.1) | 1 420(44.2) |
| >59 mm | 2 183(27.5) | 2 091(31.0) | 1 372(42.7) |
| 注 ELN:检出淋巴结数(examined lymph node) | |||
对分层资料进一步Cox回归分析显示(表 4),低风险组中,种族为白人/亚洲及其他、原发部位为乙状结肠和ELN为12~17枚/>17枚为降低死亡风险的影响因素(均P<0.05);而肿瘤分级为Ⅲ级、T3/T4、M1/MX和肿瘤大小为35~59 mm/>59 mm为增加死亡风险的影响因素(均P<0.05)。中风险组中,种族为白人/亚洲及其他、原发部位为乙状结肠/直乙交界、ELN为12~17枚/>17枚为降低死亡风险的影响因素(均P<0.05);而肿瘤分级为Ⅲ/Ⅳ级、T3/T4、M1/MX和肿瘤大小为35~59 mm/>59 mm为增加死亡风险的影响因素(均P<0.05)。高风险组中,种族为亚洲及其他、原发部位为乙状结肠/直乙交界、组织学分型为其他和ELN为12~17枚/>17枚为降低死亡风险的影响因素(均P<0.05);而肿瘤分级为Ⅲ/Ⅳ级、T3/T4和M1为增加死亡风险的影响因素(均P<0.05)。
| 变量 | 低风险组(<3枚) | 中风险组(3~7枚) | 高风险组(>7枚) | |||||
| P值 | Exp(B) | P值 | Exp(B) | P值 | Exp(B) | |||
| 种族 | ||||||||
| 黑人 | 1 | 1 | 1 | |||||
| 白人 | 0.027 | 0.885 | 0.046 | 0.902 | 0.572 | 1.044 | ||
| 亚洲及其他 | 0.002 | 0.803 | <0.01 | 0.725 | 0.037 | 0.824 | ||
| 原发部位 | ||||||||
| 结肠 | 1 | 1 | 1 | |||||
| 乙状结肠 | 0.001 | 0.864 | <0.01 | 0.751 | 0.002 | 0.831 | ||
| 直乙交界 | 0.096 | 0.886 | <0.01 | 0.726 | 0.007 | 0.793 | ||
| 直肠 | 0.352 | 0.947 | 0.261 | 0.939 | 0.121 | 0.892 | ||
| 组织学分型 | NA | NA | ||||||
| 腺癌 | 1 | |||||||
| 黏液腺癌 | 0.972 | 1.002 | ||||||
| 乳头状腺癌 | 0.170 | 0.853 | ||||||
| 印戒细胞癌 | 0.130 | 1.158 | ||||||
| 其他 | 0.001 | 1.356 | ||||||
| 分级 | ||||||||
| Ⅱ级 | 1 | 1 | 1 | |||||
| Ⅲ级 | <0.01 | 1.179 | <0.01 | 1.312 | <0.01 | 1.476 | ||
| Ⅳ级 | 0.643 | 1.049 | <0.01 | 1.350 | <0.01 | 1.688 | ||
| T分期 | ||||||||
| T1/T2 | 1 | 1 | 1 | |||||
| T3 | <0.01 | 2.192 | <0.01 | 1.614 | 0.004 | 1.763 | ||
| T4 | <0.01 | 3.438 | <0.01 | 2.266 | <0.01 | 2.369 | ||
| M分期 | ||||||||
| M0 | 1 | 1 | 1 | |||||
| M1 | <0.01 | 3.416 | <0.01 | 2.684 | <0.01 | 2.180 | ||
| Mx | <0.01 | 1.957 | <0.01 | 1.741 | 0.082 | 1.362 | ||
| ELN | ||||||||
| <12枚 | 1 | 1 | 1 | |||||
| 12~17枚 | <0.01 | 0.693 | <0.01 | 0.705 | 0.030 | 0.984 | ||
| >17枚 | <0.01 | 0.510 | <0.01 | 0.547 | <0.01 | 0.798 | ||
| 肿瘤大小 | NA | |||||||
| <35 mm | 1 | 1 | ||||||
| 35~59 mm | 0.010 | 1.126 | <0.01 | 1.198 | ||||
| >59 mm | <0.01 | 1.137 | <0.01 | 1.327 | ||||
| 注 ELN:检出淋巴结数(examined lymph node);NA:不适用(not applicable) | ||||||||
世界人口的增加和预期寿命的提高使老年人口数量不断攀升,从而导致人口老龄化。根据联合国人口基金(United Nations Population Fund,UNFPA)的数据,在过去的20年里,全世界的预期寿命从64.8岁上升到70岁。预计到2050年,>60岁人口将达到20亿以上,占世界人口的近22%[8]。本研究提取SEER数据库资料也显示,虽然老年结直肠癌患者的比例逐年下降,但是仍旧超过总患病例数的50%。研究显示,结直肠癌主要影响老年人群[9-10]。
淋巴结转移为结直肠癌转移的主要途径,并且发生淋巴结转移后对患者术后生存率有着较为重要的影响,也是选择手术方式及辅助治疗的重要参考[11-12]。现今,根治性手术仍然是结直肠癌主要临床治疗手段,但基于多数患者发现时已是晚期,在术前已发生淋巴结转移,且术后死亡率高,一般要进行大范围淋巴结清扫[13-14]。再结合上述全球人口老龄化的事实,对影响老年结直肠癌伴淋巴结转移的患者预后的相关因素分析就显得尤为必要。
Cox分析发现,使结直肠癌死亡风险增加的因素包括组织学分型为其他的分型、Ⅲ/Ⅳ级、T2/T3/T4、N2、M1/MX、PLN 3~7枚/>7枚和肿瘤大小35~59 mm/>59 mm;而人种为白人/亚洲及其他、部位为乙状结肠/直乙交界和ELN 12~17枚/>17枚为患者死亡风险降低的影响因素。研究显示,结直肠癌为>65岁女性癌症发病率的首要原因,为危害老年妇女健康的主要威胁[15-16]。结直肠癌进展受雌激素和孕激素受体的影响,肿瘤细胞的雌激素和孕激素受体表达越少,结直肠癌侵袭性越强,生存时间越短,而老年女性雌激素和孕激素均降低,可能为老年女性预后更差的原因[17]。然而该研究并未说明激素与淋巴结转移的相关性,并且多数学者研究显示,性别与结直肠癌淋巴结转移无相关。本研究未发现结直肠癌伴淋巴结转移患者性别与预后有关联。
通过对PLN分层后继续进行Cox分析发现,在低和中风险组,亚洲及其他/白人预后好于黑人,在高风险组亚洲及其他人种相较于黑人预后要好,黑人与白人之间差异无统计学意义(P>0.05);在各分组中,原发部位为乙状结肠的预后都要比结肠预后好,可能由于乙状结肠比其他部分结肠更靠近肛门,出现临床症状较早有关,另外也有基于SEER数据库目标变量为原发部位的研究显示,乙状结肠较近端结肠有更早的分期和更低的分级,与近端肿瘤比较,乙状结肠肿瘤有更低的癌症特异死亡率[18];组织学类型中印戒细胞癌原发于腺上皮细胞,属于黏液分泌型,恶性程度较高并且分化较低,侵袭性较强,而在本研究人群各风险分组中,只有高风险组其他分型为增加死亡的危险因素,更深入的研究需要对该分型进行更细致划分[19];对于分级和TNM分期对预后的影响基本符合目前的共识,即更高的分级或TNM分期,结直肠癌患者的预后更差;目前虽然对于到底要检出多少淋巴结数存在争议,但普遍接受的最佳ELN为≥12枚,这也与本研究通过X-tile软件计算出的截断值相符,研究也显示ELN>12枚要比ELN<12枚预后更好[20-21];肿瘤体积的大小可间接体现出肿瘤潜在的侵袭性生物学特征,本研究显示在中和低风险组中,肿瘤较大组较肿瘤较小组预后要差,而在高风险组中,肿瘤大小不是影响结直肠癌预后的因素。
本研究存在一定的局限性:(1)研究所选取的病例资料均来自于美国SEER数据库,存在一定的地域特性级选择偏倚;(2)关于原发部位与组织学分型变量仍需要进行更细致的划分从而进行更加深入的研究及相关因素的筛选;(3)虽然本研究纳入SEER数据库变量较多,但是该数据库仍缺乏手术操作者、复发和辅助转移等相关资料的记录。
总之,本研究筛选出种族、原发部位、组织学分型、分级、TNM分期、ELN、PLN以及肿瘤大小为影响老年结直肠癌伴淋巴结转移患者预后的相关因素;进一步按照PLN分层分析后显示,组织学分型不是低风险组及中风险组预后影响因素,肿瘤大小不是高风险组预后影响因素。本研究可为临床诊疗老年结直肠癌伴淋巴结转移患者提供参考。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
张丽娜, 孔祥兴, 梅彦侠, 等. 结直肠癌pT4期诊断的难点及辅助诊断方案的研究进展[J]. 实用肿瘤杂志, 2021, 36(1): 6-10. |
| [3] |
陈佳琦, 董彩霞, 袁瑛. 2018年结直肠癌治疗研究进展[J]. 实用肿瘤杂志, 2019, 34(1): 1-6. |
| [4] |
Arnold M, Sierra MS, Laversanne M, et al. Global patterns and trends in colorectal cancer incidence and mortality[J]. Gut, 2017, 66(4): 683-691. DOI:10.1136/gutjnl-2015-310912 |
| [5] |
Dekker E, Tanis PJ, Vleugels JLA, et al. Colorectal cancer[J]. Lancet, 2019, 394(10207): 1467-1480. DOI:10.1016/S0140-6736(19)32319-0 |
| [6] |
Jin M, Frankel WL. Lymph node metastasis in colorectal cancer[J]. Surg Oncol Clin N Am, 2018, 27(2): 401-412. DOI:10.1016/j.soc.2017.11.011 |
| [7] |
Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6): 1471-1474. DOI:10.1245/s10434-010-0985-4 |
| [8] |
Tai S, Li X, Zhu Z, et al. Hyperuricemia is a risk factor for one-year overall survival in elderly female patients with acute coronary syndrome[J]. Cardiovasc Ther, 2020, 2020: 2615147. |
| [9] |
Kim JH. Chemotherapy for colorectal cancer in the elderly[J]. World J Gastroenterol, 2015, 21(17): 5158-5166. DOI:10.3748/wjg.v21.i17.5158 |
| [10] |
Souwer ETD, Bastiaannet E, Steyerberg EW, et al. A prediction model for severe complications after elective colorectal cancer surgery in patients of 70 years and older[J]. Cancers (Basel), 2021, 13(13): 13-14. |
| [11] |
Ge Y, Xiang R, Ren J, et al. A nomogram for predicting multiple metastases in metastatic colorectal cancer patients: A large population-based study[J]. Front Oncol, 2021, 11: 633995. DOI:10.3389/fonc.2021.633995 |
| [12] |
Yang Z, Liu Z. The efficacy of 18F-FDG PET/CT-based diagnostic model in the diagnosis of colorectal cancer regional lymph node metastasis[J]. Saudi J Biol Sci, 2020, 27(3): 805-811. DOI:10.1016/j.sjbs.2019.12.017 |
| [13] |
Itatani Y, Kawada K, Sakai Y. Treatment of elderly patients with colorectal cancer[J]. Biomed Res Int, 2018, 2018: 2176056. |
| [14] |
Akagi T, Inomata M. Essential advances in surgical and adjuvant therapies for colorectal cancer 2018-2019[J]. Ann Gastroenterol Surg, 2020, 4(1): 39-46. DOI:10.1002/ags3.12307 |
| [15] |
Jung KW, Won YJ, Kong HJ, et al. Cancer statistics in Korea: Incidence, mortality, survival, and prevalence in 2016[J]. Cancer Res Treat, 2019, 51(2): 417-430. DOI:10.4143/crt.2019.138 |
| [16] |
Park HC, Shin A, Kim BW, et al. Data on the characteristics and the survival of korean patients with colorectal cancer from the Korea central cancer registry[J]. Ann Coloproctol, 2013, 29(4): 144-149. DOI:10.3393/ac.2013.29.4.144 |
| [17] |
De Jong ME, Van Tilburg SB, Nissen LHC, et al. Long-term risk of advanced neoplasia after colonic low-grade dysplasia in patients with inflammatory bowel disease: A nationwide cohort study[J]. J Crohns Colitis, 2019, 13(12): 1485-1491. DOI:10.1093/ecco-jcc/jjz114 |
| [18] |
Jodal HC, Helsingen LM, Anderson JC, et al. Colorectal cancer screening with faecal testing, sigmoidoscopy or colonoscopy: A systematic review and network meta-analysis[J]. BMJ Open, 2019, 9(10): e032773. DOI:10.1136/bmjopen-2019-032773 |
| [19] |
Arifi S, Elmesbahi O, Amarti Riffi A. Primary signet ring cell carcinoma of the colon and rectum[J]. Bull Cancer, 2015, 102(10): 880-888. DOI:10.1016/j.bulcan.2015.07.005 |
| [20] |
Renshaw AA, Gould EW. How many lymph nodes are enough in a colorectal resection?[J]. Am J Surg Pathol, 2020, 44(9): 1290-1292. |
| [21] |
Hanicinec V, Brynychova V, Rosendorf J, et al. Gene expression of cytokinesis regulators PRC1, KIF14 and CIT has no prognostic role in colorectal and pancreatic cancer[J]. Oncol Lett, 2021, 22(2): 598. DOI:10.3892/ol.2021.12859 |
 2022, Vol. 37
2022, Vol. 37


