文章信息
- 刘熠晗, 谢英华, 韩曦瑶, 胡新新, 周佳楠, 朱晓宇
- Liu Yihan, Xie Yinghua, Han Xiyao, Hu Xinxin, Zhou Jianan, Zhu Xiaoyu
- 不同剂量地塞米松联合硼替佐米及沙利度胺治疗老年多发性骨髓瘤的疗效观察
- Effect of different doses of dexamethasone combined with bortezomib and thalidomide in treatment of elderly patients with multiple myeloma
- 实用肿瘤杂志, 2022, 37(3): 244-247
- Journal of Practical Oncology, 2022, 37(3): 244-247
-
通信作者
- 谢英华,E-mail:xieyh.5@163.com
-
文章历史
- 收稿日期:2021-09-06
多发性骨髓瘤(multiple myeloma,MM)是血液系统第二常见的恶性肿瘤,约占血液肿瘤的13%[1-2]。特征为克隆性浆细胞在骨髓中异常增殖,并分泌单克隆免疫球蛋白或其片段,导致高钙血症、肾功能损害、贫血和骨质破坏等终末器官损害[3-4]。该病好发于老年人,化疗仍是目前主要的治疗方法,老年患者因其特殊的临床特点,对治疗耐受性差,化疗引起的严重不良反应成为影响患者生存的重要因素[5]。因此,如何降低老年患者的治疗风险、提高长期生存率和改善生活质量显得尤为重要[6]。地塞米松作为MM治疗的基础用药,随着用药剂量和时间的增加,发生感染等不良反应的概率会随之上升。本研究旨在比较不同剂量地塞米松联合化疗治疗老年MM患者的疗效和不良反应,以期为临床应用提供参考。
1 资料与方法 1.1 一般资料选取2014年8月至2019年8月本院收治的初发老年MM患者共33例。所有患者诊断符合《血液病诊断及疗效标准(第4版)》[7];患者均对本研究知情且签署同意书。依据治疗方案中地塞米松的剂量不同分为试验组(小剂量地塞米松)和对照组(大剂量地塞米松)。试验组17例;男性10例,女性7例;年龄60~88岁,(70.88±8.63)岁;分型:IgG型11例,IgA型4例,IgD型1例,轻链型1例;Durie-Salmon分期:ⅢA期10例,ⅢB期5例,ⅡA期2例。对照组16例;男性9例,女性7例;年龄60~85岁,(69.13±6.14)岁;分型:IgG型9例,IgA型5例,IgD型2例;Durie-Salmon分期:ⅢA期9例,ⅢB期4例,ⅡA期2例,ⅠA期1例。两组患者在性别、年龄、分型和Durie-Salmon分期方面比较,差异均无统计学意义(均P > 0. 05)。
1.2 治疗方法两组均给予硼替佐米+沙利度胺+地塞米松(BTD)联合方案:硼替佐米1.3~1.6 mg/m2第1、8和15天皮下注射;沙利度胺100 mg每晚1次口服;地塞米松试验组为20 mg/d第1~4和11~14天静脉滴注,对照组为40 mg/d第1~4、9~12和17~20天静脉滴注。28 d为1个疗程,4个疗程后进行疗效和安全性评估。
1.3 观察指标 1.3.1 疗效观察根据国际骨髓瘤工作组(International Myeloma Working Group,IMWG)疗效标准[8]分为:严格意义的完全缓解(stringent complete response,sCR)、完全缓解(complete response,CR)、非常好的部分缓解(very good partial response,VGPR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。总有效率(overall response rate,ORR)=[(sCR例数+CR例数+VGPR例数+PR例数)/总例数]×100%。
1.3.2 不良反应观察并记录两组治疗期间的不良反应发生情况,包括3~4级血液学毒性、3~4级周围神经病变、3~4级消化道反应、肺部感染、血栓、带状疱疹、乏力、水肿、血糖升高和血压升高。所有不良反应按照美国国家癌症研究所常见不良事件评价标准(National Cancer Institute Common Terminology Criteria for Adverse Exents,NCI CTCAE)判定[9]。
1.4 随访随访截止时间为2021年6月30日,中位随访时间为28个月(4~69个月)。随访方式主要为门诊就诊及电话随访。随访内容为复发和生存情况等。失访率为6.1%(2/33)。总生存期(overall survival,OS)定义为疾病确诊至末次随访或者发生死亡。
1.5 统计学分析采用SPSS软件进行统计学分析。计量资料均符合正态分布,以均数±标准差(x±s)表示,组间比较采用t检验。计数资料以频数(百分比)表示,采用Fisher精确检验。生存分析采用Kaplan-Meier法和Log-rank检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 疗效试验组和对照组ORR分别为82.4%和87.5%,差异无统计学意义(P=0.973,表 1)。
| 组别 | 例数 | sCR+CR | VGPR | PR | SD | PD | ORR |
| 试验组 | 17 | 8 (47.1) | 2 (11.8) | 4 (23.5) | 2 (11.8) | 1 (5.9) | 14 (82.4) |
| 对照组 | 16 | 9 (56.3) | 2 (12.5) | 3 (18.8) | 1 (6.3) | 1 (6.3) | 14 (87.5) |
| 注sCR:严格意义的完全缓解(stringent complete response);CR:完全缓解(complete response);VGPR:非常好的部分缓解(very good partial response);PR:部分缓解(partial response);SD:疾病稳定(stable disease);PD:疾病进展(progressive disease);ORR:总有效率(overall response rate) | |||||||
试验组患者肺部感染和血糖升高的发生率均低于对照组,差异均具有统计学意义(均P < 0.05)。两组在3~4级血液学毒性、3~4级周围神经病变、3~4级消化道反应、血栓、带状疱疹、乏力、水肿和血压升高发生率方面比较,差异均无统计学意义(均P > 0.05,表 2)。
| 组别 | 例数 | 3~4级血液学毒性 | 3~4级周围神经病变 | 3~4级消化道反应 | 肺部感染 | 血栓 | 带状疱疹 | 乏力 | 水肿 | 血糖升高 | 血压升高 |
| 试验组 | 17 | 2(11.8) | 6(35.3) | 3(17.6) | 6(35.3) | 3(17.6) | 2(11.8) | 2(11.8) | 2(11.8) | 1(5.9) | 0(0.0) |
| 对照组 | 16 | 5(31.3) | 5(31.3) | 3(18.8) | 12(75.0) | 4(25.0) | 3(18.8) | 3(18.8) | 4(25.0) | 6(37.5) | 3(18.8) |
| P值 | 0.171 | 0.805 | 0.935 | 0.022 | 0.606 | 0.576 | 0.576 | 0.325 | 0.026 | 0.061 |
试验组与对照组患者中位OS比较,差异无统计学意义(58个月vs 61个月,χ2=0.032,P=0.859,图 1)。
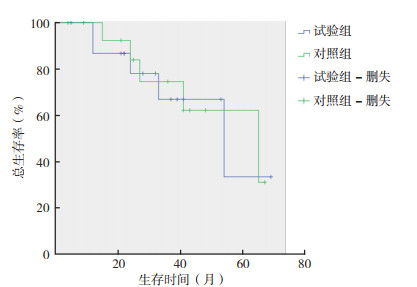
|
| 图 1 试验组和对照组患者总生存曲线比较 Fig.1 Comparison of overall survival between the observation and control groups |
MM是一种浆细胞恶性肿瘤,由于MM的发病较为隐匿,且缺乏特异性临床症状,早期不易发现,易造成误诊而延误治疗,严重影响患者生活质量[10],对个人、家庭以及社会影响巨大,尤其是老年患者。目前,临床上对MM的治疗仍以化疗为主。最新指南显示现阶段初发MM诱导治疗的标准一线方案为蛋白酶体抑制剂联合免疫调节剂及地塞米松的三药联合方案[11-12],其中地塞米松属于糖皮质激素。既往研究表明,MM对糖皮质激素有较高的敏感性[13]。地塞米松可以通过抑制淋巴系统的肿瘤细胞,使该类细胞溶解,从而达到抗肿瘤的效果[14]。
但由于MM患者本身就存在免疫功能缺陷,容易出现感染,大剂量激素及化疗和免疫抑制剂的应用会导致感染的发生率增加,病死率增高。除此以外,MM好发于老年人,在我国中位发病年龄约58岁[1]。由于老年MM患者独特的生理状态、基础疾病多且对治疗的耐受性差,治疗相关毒性仍是造成老年MM患者死亡的重要因素。既往有研究表明对于体能较差的老年MM患者,标准剂量的化疗方案,因死亡及疾病进展以外因素导致的治疗中断率高达34.9%,3年OS率 < 50%[15]。因此,较低的不良反应发生率可能会带来更高的治疗依从性,降低严重不良反应引起的死亡率。
目前有关对比不同剂量地塞米松治疗MM的研究并不是很多。有研究随机将445例初发MM患者分入来那度胺联合不同剂量地塞米松组显示,大剂量组4周内达到缓解率更高,但小剂量组1年及2年OS率均更高,考虑与大剂量组不良反应导致的死亡率增加有关,且大剂量组生存结局在 > 65岁老年患者中更差[16]。另一项有关泊马度胺联合不同剂量地塞米松治疗复发难治MM的研究,小剂量地塞米松组同样显示出更好的无进展生存时间(progression-free survival,PFS)和OS[17]。此外,研究发现,对于适合移植的初发MM患者,与大剂量地塞米松联合硼替佐米和多柔比星(PAD)的诱导治疗方案比较,应用小剂量地塞米松的PAD方案在保持相同疗效的情况下,展现出了更好的安全性[18]。
本研究显示,不同剂量的地塞米松联合化疗治疗老年MM患者ORR分别为82.4%和87.5%(P > 0.05),ORR均较高且疗效相当。两组患者中位OS比较,差异无统计学意义(P > 0.05)。观察两组患者不良反应的发生情况,试验组肺部感染及血糖升高的发生率均低于对照组(均P < 0.05)。此外,试验组在3~4级血液学毒性、水肿和血压升高的发生率方面也有降低的趋势,但差异均无统计学意义(均P > 0.05),可能与样本量不足所带来的结果偏倚有关。以上与既往相关研究结论基本一致[16-18]。
综上所述,不同剂量地塞米松联合硼替佐米和沙利度胺治疗老年MM均有确切疗效。但小剂量地塞米松所带来的不良反应相对较少,对于老年患者来说,耐受性更好,从而可以进一步提高患者生活质量,同时减少治疗相关并发症的医疗费用,值得临床推广应用。由于本研究样本量所限,结论存在一定的局限性,需进一步扩大样本量进行研究,对不同方案的疗效及不良反应作出更全面和客观的评价,进而为临床方案的选择提供依据。
| [1] |
Wang SF, Xu L, Feng JN, et al. Prevalence and incidence of multiple myeloma in urban area in China: a national population-based analysis[J]. Front Oncol, 2020, 9: 1513. DOI:10.3389/fonc.2019.01513 |
| [2] |
del Giudice ML, Gozzetti A, Antonioli E, et al. Real-life experience with pomalidomide plus low-dose dexamethasone in patients with relapsed and refractory multiple myeloma: a retrospective and prospective study[J]. Medicina (Kaunas), 2021, 57(9): 900. DOI:10.3390/medicina57090900 |
| [3] |
Tremblay G, Daniele P, Breeze J, et al. Quality of life analyses in patients with multiple myeloma: results from the Selinexor (KPT-330) Treatment of Refractory Myeloma (STORM) phase 2b study[J]. BMC Cancer, 2021, 21(1): 993. DOI:10.1186/s12885-021-08453-9 |
| [4] |
黄菊, 韩艳霞, 王宙政, 等. 多发性骨髓瘤髓外复发患者二例[J]. 实用肿瘤杂志, 2020, 35(5): 469-472. |
| [5] |
Delgado J, Zienowicz M, van Hennik PB, et al. EMA review of isatuximab in combination with pomalidomide and dexamethasone for the treatment of adult patients with relapsed and refractory multiple myeloma[J]. Oncologist, 2021, 26(11): 983-987. DOI:10.1002/onco.13892 |
| [6] |
Onishi Y, Yokoyama H, Katsuoka Y, et al. Low-dose lenalidomide and dexamethasone therapy after melphalan-prednisolone induction in elderly patients with newly diagnosed multiple myeloma[J]. Ann Hematol, 2020, 99(10): 2351-2356. DOI:10.1007/s00277-020-04240-x |
| [7] |
沈悌, 赵永强, 周道斌, 等. 血液病诊断及疗效标准[M]. 第4版. 北京: 科学出版社, 2018: 290-294.
|
| [8] |
Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma[J]. Lancet Oncol, 2014, 15(12): e538-e548. DOI:10.1016/S1470-2045(14)70442-5 |
| [9] |
Cancer N. Common Terminology Criteria for Adverse Events (CTCAE) v5.0[EB/OL]. (2017-11-27)[2021-09-01]. https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm#ctc_50
|
| [10] |
陈青骁, 蔡真. 组蛋白去乙酰化酶及其抑制剂在多发性骨髓瘤溶骨性病变中的研究进展[J]. 实用肿瘤杂志, 2018, 33(5): 397-401. |
| [11] |
中国医师协会血液科医师分会, 中华医学会血液学分会, 中国医师协会多发性骨髓瘤专业委员会. 中国多发性骨髓瘤诊治指南(2020年修订)[J]. 中华内科杂志, 2020, 59(5): 341-346. DOI:10.3760/cma.j.cn112138-20200304-00179 |
| [12] |
Moreau P, Dimopoulos MA, Yong K, et al. Isatuximab plus carfilzomib/dexamethasone versus carfilzomib/dexamethasone in patients with relapsed/refractory multiple myeloma: IKEMA Phase Ⅲ study design[J]. Future Oncol, 2020, 16(2): 4347-4358. DOI:10.2217/fon-2019-0431 |
| [13] |
de Waal EGM, de Munck L, Hoogendoorn M, et al. Combination therapy with bortezomib, continuous low-dose cyclophosphamide and dexamethasone followed by one year of maintenance treatment for relapsed multiple myeloma patients[J]. Br J Haematol, 2015, 171(5): 720-725. DOI:10.1111/bjh.13653 |
| [14] |
Kehrer M, Koob S, Strauss A, et al. Multiple myeloma- current status in diagnostic testing and therapy[J]. Z Orthop Unfall, 2017, 155(5): 575-586. DOI:10.1055/s-0043-110224 |
| [15] |
Zhong YP, Zhang YZ, Liao AJ, et al. Geriatric assessment to predict survival and risk of serious adverse events in elderly newly diagnosed multiple myeloma patients: a multicenter study in China[J]. Chin Med J (Engl), 2017, 130(2): 130-134. |
| [16] |
Rajkumar SV, Jacobus S, Callander NS, et al. Lenalidomide plus high-dose dexamethasone versus lenalidomide plus low-dose dexamethasone as initial therapy for newly diagnosed multiple myeloma: an open-label randomised controlled trial[J]. Lancet Oncol, 2010, 11(1): 29-37. DOI:10.1016/S1470-2045(09)70284-0 |
| [17] |
San Miguel JF, Weisel KC, Song KW, et al. Impact of prior treatment and depth of response on survival in MM-003, a randomized phase 3 study comparing pomalidomide plus low-dose dexamethasone versus high-dose dexamethasone in relapsed/refractory multiple myeloma[J]. Haematologica, 2015, 100(10): 1334-1339. DOI:10.3324/haematol.2015.125864 |
| [18] |
Mai EK, Hielscher T, Bertsch U, et al. Bortezomib-based induction therapy with high or low-dose dexamethasone in newly diagnosed, transplant-eligible multiple myeloma[J]. Leukemia, 2019, 33(1): 258-261. DOI:10.1038/s41375-018-0195-9 |
 2022, Vol. 37
2022, Vol. 37


