文章信息
- 于军, 张莺, 任东栋, 陈聪, 李洋, 任春玲, 蔡君
- Yu Jun, Zhang Ying, Ren Dongdong, Chen Cong, Li Yang, Ren Chunling, Cai Jun
- PET/MR与PET/CT对18F-FDG PET阳性肝转移瘤病灶检出能力的比较
- Comparison of detection ability between PET/MR and PET/CT in 18F-FDG PET-positive liver metastases
- 实用肿瘤杂志, 2021, 36(4): 342-348
- Journal of Practical Oncology, 2021, 36(4): 342-348
-
通信作者
- 张莺, E-mail: zhangying5401@zju.edu.cn
-
文章历史
- 收稿日期:2020-01-01
2. 宁波明州医院 PET 中心, 浙江 宁波 315100
2. PET Center, Ningbo Mingzhou Hospital, Ningbo 315100, China
肝脏是人体最大的实质脏器,由肝动脉及门静脉双重供血,为癌细胞通过丰富的血流扩散至肝脏带来有利条件[1-2]。肝转移瘤是肝脏最常见的恶性肿瘤,发病率远高于肝脏原发肿瘤[2-3]。全身各脏器的恶性肿瘤多数可转移至肝脏,其中以消化道肿瘤发生转移的概率最高,结直肠癌在世界及我国都是最常见的消化道系统恶性肿瘤之一,> 50%的结直肠癌患者有肝转移瘤[4-8]。肝转移瘤的早期检出及准确定位对肿瘤患者选择合适的治疗方案以及提高患者生存率具有重要价值[2, 5, 8-10]。18F-氟脱氧葡萄糖(18F-fluorodeoxyglucose, 18F-FDG)PET/CT在肝转移瘤患者中的临床应用已经得到广泛认可,并认为是检测肝转移瘤最敏感的无创影像学检查,但对于肝脏微小转移灶,其检出率较低[11-12]。MR以其较高的软组织分辨率,能分辨 < 1 cm的病灶,对肝转移瘤的检出具有较高价值[2, 9-12],但仍有部分病灶由于特征不典型而无法确诊[1, 12]。近年来出现PET/MR,将MR高软组织分辨率、多参数和多序列成像的优势与PET高敏感度的优势相结合,具有更低的辐射剂量,又能很好地保留两者独立的诊断能力[13],对肝转移瘤病灶的检出有着独特的优势。本研究比较同一患者18F-FDG PET/MR与18F-FDG PET/CT显像资料,比较2种检查方式对PET阳性肝转移瘤病灶的检出能力,探讨PET/MR在肝转移瘤患者中的临床应用价值。
1 资料和方法 1.1 一般资料回顾性分析2018年10月至2019年9月于宁波明州医院PET中心接受全身18F-FDG PET/CT显像及上腹部18F-FDG PET/MR局部显像的54例肝脏转移瘤患者的相关资料。其中男性33例,女性21例;年龄40~79岁,(65.3±9.1)岁。原发肿瘤未手术36例,已手术18例。原发肿瘤中结直肠癌14例,胰腺癌12例,肺癌9例,胃癌7例,胆囊癌5例,乳腺癌2例,腮腺癌1例,食管癌1例,十二指肠癌1例,黑色素瘤1例,原因肿瘤不明1例(肝病灶穿刺证实为转移性腺癌,但未找到原发灶)。本研究得到医院伦理委员会批准。所有患者在PET/CT和PET/MR检查前知悉检查流程及注意事项,并签署知情同意书。
1.2 18F-FDG PET/CT显像采用德国Siemens公司Biograph mCT扫描仪进行PET/CT检查。显像剂18F-FDG为南京江原安迪科正电子研究发展有限公司提供,放射化学纯度 > 95%。所有受检者禁食 > 6 h,空腹血糖水平 < 11.1 mmol/L。按体质量注射18F-FDG 3.7~5.55 MBq/kg,安静平躺休息60 min,期间可随时排尿。PET/CT扫描前饮水500 mL并排尿,扫描范围从股骨中段至颅顶。先行CT扫描,电压120 kV,电流采用自动毫安秒技术(30~210 mAs),螺距0.8,球管单圈螺旋时间为0.5 s,层厚为3.0 mm。PET发射扫描采用3D模式采集,采集7~10个床位,每个床位1.5 min。图像采集完成后,采用有序子集最大期望值迭代法(ordered subset expectation maximization,OSEM)进行图像重建,用CT数据进行衰减校正。CT图像采用标准法重建,重建层厚为2.0 mm。将PET和CT图像传送到Syngo MMWP工作站,进行帧对帧图像对位融合。
1.3 18F-FDG PET/MR显像PET/MR显像紧跟PET/CT扫描后进行,采用美国GE公司Signa PET/MR(3.0T)行上腹部显像,扫描范围从肝脏上缘到肾脏下缘水平。基于MR的衰减矫正(MR attenuation correction, MRAC)序列与PET采集同时开始,MR扫描序列包括:轴位弥散加权成像(diffusion weighted imaging, DWI)(b值为800 s/mm2及0 s/mm2),轴位T2,轴位T1,T2序列采用呼吸门控轴位T2扫描,T1序列采用屏气轴位可变容积加速肝脏采集(liver acquisition with volume acceleration flexible, LAVA-Flex),用于降低图像呼吸运动伪影,提高图像质量。冠状位采用T2单次激发快速自旋回波(single-shot fast spin echo, SSFSE)进行上腹部扫描。PET图像采用时间飞行(time of flight, TOF)技术重建,选择OSEM算法,SharpIR以及Scatter均被设置为开启状态,用于提供更好的PET图像分辨率和信噪比,从而提供更准确的半定量参数。PET 3D采集与MR检查同步进行,从而确保PET和MR数据具有最佳的时间和解剖位置配准,采集时长10 min。
1.4 图像和数据分析采用Syngo MMWP和Advantage工作站分别对PET/CT和PET/MR数据进行图像后处理。PET/CT图像由2名经验丰富的核医学医师采用独立阅片,且不参考PET/MR图像。PET/MR图像由2名放射科医师及2名核医学医师进行阅片,且不参考PET/CT图像;意见不同时经协商达成一致。PET阳性病灶定义为病灶FDG摄取高于周围正常肝组织[14-16]。以目测法评估并比较2种设备的PET阳性病灶,在T1WI图像上测量并记录病灶最长径(the maximum diameter, Dmax),若T1WI图像上不可测量,则在T2WI或DWI图像上测量。每例患者最多测量10个病灶,若 > 10个病灶,则选择PET/CT或PET/MR图像上能识别的最大10个病灶。比较2种检查方法对肝转移瘤患者及病灶的检出数量。并根据转移瘤病灶的大小进行分组,评价各组中2种检查方法的各自检出数量。
1.5 统计学分析运用SPSS 24.0统计学软件分析数据。采用Fisher精确检验比较2种检查方法病灶检出率的差异。以P < 0.05为差异具有统计学意义。
2 结果 2.1 PET/MR与PET/CT图像比较PET/MR图像较PET/CT图像对比度更好,噪声更低,病灶放射性浓聚更明显,信噪比更高(图 1~4)。PET/MR对于肝顶部病灶的融合显像较PET/CT更为精确(图 4)。MR具有较高的软组织分辨率,不受肝内高致密灶的影响,病灶形态轮廓观察更为清晰。
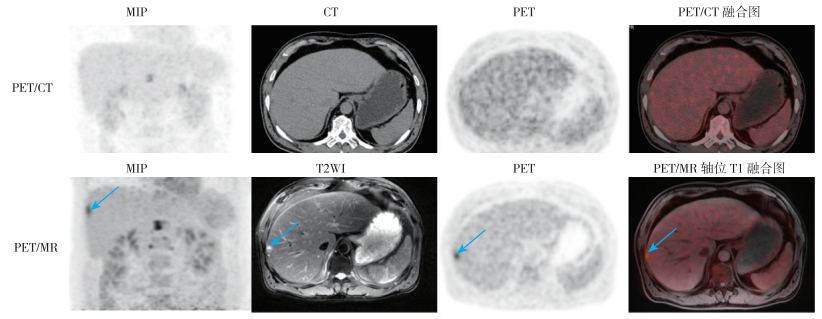
|
| 注 PET/CT示肝右前叶稍低密度灶,边界欠清,FDG代谢未见增高;PET/MR示肝右前叶T2WI高信号病灶,FDG代谢增高,考虑肝转移瘤(箭头示);MIP:最大密度投影(maximum intensity projection) 图 1 右上肺癌患者(男性61岁)肝右前叶转移瘤PET/CT及PET/MR显像图 Fig.1 PET/CT and PET/MR images of liver metastasis in a 61-year-old male patient with upper right lung cancer in right upper lobe |
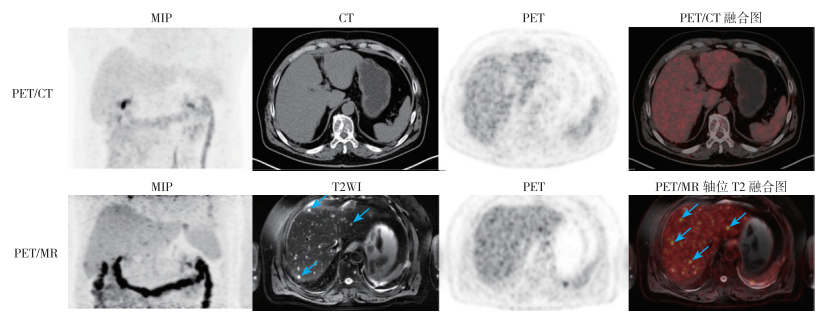
|
| 注 PET/CT示肝脏未见明显异常密度灶及FDG代谢增高灶;PET/MR示肝脏多发T2WI高信号病灶,FDG代谢增高,考虑多发肝转移瘤(箭头示);MIP:最大密度投影(maximum intensity projection) 图 2 左肺癌术后患者(男性59岁)肝转移瘤PET/CT及PET/MR显像图 Fig.2 Postoperative PET/CT and PET/MR images of liver metastasis in a 59-year-old male patient with left lung cancer |
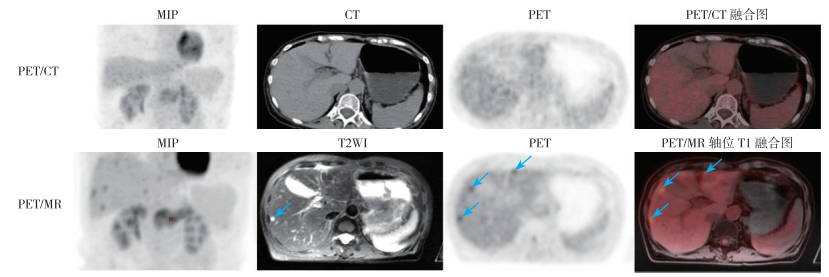
|
| 注 PET/CT示肝脏未见明显异常密度灶及FDG代谢增高灶;PET/MR示肝脏多发T2WI高信号病灶,FDG代谢增高,考虑多发肝转移瘤(箭头示);MIP:最大密度投影(maximum intensity projection) 图 3 胰腺癌患者(女性73岁)肝转移瘤PET/CT及PET/MR显像图 Fig.3 PET/CT and PET/MR images of liver metastasis in a 73-year-old female patient with pancreatic cancer |
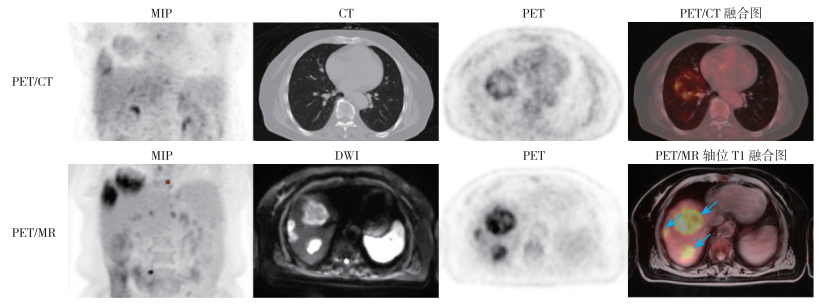
|
| 注 PET/CT示肺内多发FDG代谢增高灶,CT示肺内无病灶,肝内多发稍低密度灶,实为呼吸运动导致PET及CT图像融合出现偏差;PET/MR示肝脏多发占位,且病灶FDG代谢增高,考虑多发肝转移瘤(箭头示),PET/MR中PET与MR图像融合较好;MIP:最大密度投影(maximum intensity projection) 图 4 直肠癌术后患者(女性69岁)肝转移瘤PET/CT及PET/MR显像图 Fig.4 Postoperative PET/CT and PET/MR images of liver metastasis in a 69-year-old female patient with rectal cancer |
54例患者中,肝脏单个PET阳性转移瘤13例,2~9个转移瘤25例,≥10个转移瘤16例。48例患者在2种检查方法中均呈阳性。另外6例在PET/CT呈阴性,而在PET/MR呈阳性(图 1~3)。PET/MR对肝转移瘤患者检出数量高于PET/CT,差异具有统计学意义(54例vs 48例,P < 0.05,表 1)。
| 检查方式 | 总例数 | 病灶(个) | 病灶长径分组 | ||
| < 1 cm | 1~2 cm | ≥2 cm | |||
| PET/CT | 48 | 193 | 15 | 61 | 117 |
| PET/MR | 54 | 286 | 92 | 77 | 117 |
| P值 | 0.027 | < 0.01 | < 0.01 | < 0.01 | 1.000 |
54例患者中,共检出286个PET阳性病灶。193个病灶在2种检查方法中均呈阳性,PET/CT检出的阳性病灶在PET/MR上均被检出。另有93个病灶在PET/CT呈阴性,而在PET/MR呈阳性。PET/MR对肝转移瘤病灶检出数量高于PET/CT,差异具有统计学意义(286个vs 193个,P < 0.05,表 1)。
2.4 按病灶长径进行分组比较286个PET阳性病灶按照长径 < 1 cm、1~2 cm和≥2 cm进行分组。对于长径 < 1 cm的病灶,PET/MR检出数量高于PET/CT,差异具有统计学意义(92个vs 15个,P < 0.01)。对于1~2 cm的病灶,PET/MR检出数量高于PET/CT,差异具有统计学意义(77个vs 61个,P < 0.01)。对于长径≥2 cm的病灶,两者的检出数量均为117个。
2.5 PET/MR与PET/CT对肝转移瘤患者原发肿瘤的定位能力比较54例肝转移瘤患者中,除18例已手术患者,36例未手术患者原发肿瘤在PET/CT上显示34例,在PET/MR上显示20例,有14例原发肿瘤在PET/CT上显示,但位于PET/MR扫描视野外。2例患者未能找到明确的原发肿瘤病灶,但肝病灶穿刺证实为转移性腺癌1例及黑色素瘤肝转移瘤1例。
3 讨论肝脏具有门静脉及肝动脉双重血供,成为肝外恶性肿瘤易转移的器官,中晚期恶性肿瘤约有25%~50%会转移至肝脏[17]。18F-FDG是葡萄糖的同分异构体,是目前应用最广的正电子显像剂,可被组织细胞摄取,其代谢过程与葡萄糖类似,在己糖激酶作用下磷酸化生成FDG-6-磷酸盐,不能参与下一步代谢而滞留在细胞中,从而在PET图像上显示为放射性异常浓集影[17]。肝脏转移瘤由于癌细胞去磷酸化水平较低,18F-FDG大量滞留于肝转移瘤细胞内,代谢水平高于周围正常肝细胞[18],18F-FDG PET/CT对于肝转移瘤显像阳性率较高,具有较高的敏感度,是临床早期寻找肝转移瘤的重要检查手段。
有研究显示,PET/CT诊断肝转移瘤的敏感度为94%~97.0%[18-20]。本研究中PET/CT对肝转移瘤患者的检出率略低,为88.9%(48/54),可能由于PET/MR检出较多肝脏小转移灶,而这些病灶在PET/CT上呈假阴性。尽管PET/CT在肝转移瘤患者中具有较高的敏感度,但是对长径 < 1 cm的肝转移瘤检出率相对较低。既往一些研究显示,PET/CT对长径 < 1 cm的肝转移瘤病灶敏感度为30%~36%[11, 21-22]。本研究中,PET/CT在长径 < 1 cm的肝转移瘤病灶中检出率仅为16.3%(15/92),可能的原因有:(1)PET/CT仪器本身的空间分辨率较低,并且PET的采集时间较短;(2)转移灶内的坏死及黏液成分影响FDG的摄取[12, 22-23];(3)由于正常肝组织对18F-FDG呈中等程度的生理性摄取,相对于其他组织摄取较高,小病灶在PET图像上仅表现为点状放射性浓聚,容易被正常肝组织的生理性摄取所掩盖;(4)呼吸运动伪影和部分容积效应影响小病灶的检出;(5)部分肝转移瘤在CT平扫上呈等密度灶,通过CT图像无法识别。
PET/MR作为新型影像技术结合PET的功能影像信息及MR较高的软组织分辨率及解剖定位信息,在肿瘤影像的临床应用中有良好的前景[19-20]。随着PET/MR越来越多地应用于临床,大量研究表明,PET/MR能提供可靠的且与PET/CT相似的半定量诊断信息[10, 13, 24-25]。程勇等[16]研究显示,PET/CT及PET/MR对肝脏局灶性病变的检出率分别为79.7%(55/69)及100%(69/69)。Tian等[14]研究比较PET/CT及PET/MR对上腹部(肝脏、胆和脾脏)良恶性病灶的检出率分别为81.4(48/59)及100%(59/59)。本研究结果与既往研究结果类似,均显示在肝转移瘤中PET/MR较PET/CT具有更高的检出率,并且PET/MR图像较PET/CT图像对比度更好,信噪比更高,PET/MR对肝顶部病灶的融合较PET/CT更为精确,可能得益于:(1)MR较CT具有更高的软组织分辨率,可多参数和多序列成像,小病灶在MR图像上即可显示异常信号;(2)PET/MR探测器轴向长度更长,采用TOF技术,系统敏感度与空间分辨率更高[26],可明显改善PET图像信噪比,从而提高对病变的检出率;(3)PET/MR中PET的采集时间(10 min)高于PET/CT(1.5 min),采集时间越长,探测到带有病灶信息的正电子越多[26],PET图像质量越好,靶区/本底(tumor/background,T/B)比值越大[27];(4)PET/MR显像在PET/CT显像之后,有研究显示,恶性肿瘤的最大标准摄取值(maximum standardized uptake value,SUVmax)随着时间的推延而增高,而良性病变中没有这种现象[28];(5)PET/MR采集为同步采集,不受呼吸运动的影响,有助于肝顶部病灶的检出。
对于肝转移瘤患者原发肿瘤定位能力的比较,本研究中,在PET/MR视野内,两者均检出20例原发肿瘤病灶,另外PET/CT在PET/MR视野外检出14例原发肿瘤病灶,说明在上腹部PET/MR对原发肿瘤定位能力与PET/CT相当。由于本研究中PET/MR检查局限于上腹部,对于上腹部之外的原发肿瘤定位能力无法进一步评价。
本研究仍存在较多不足:(1)设计方法为回顾性研究,存在一定程度的选择偏倚,对PET/CT或PET/MR图像中出现异常病灶的患者进行随访,可能会遗漏一些假阴性病例;(2)病例数量有限,得出的结果可能存在偏差,需要更大样本作进一步探讨;(3)本研究中,PET/MR显像均在PET/CT显像后进行,并且在PET/MR中PET的采集时间高于PET/CT,未能排除延迟显像病灶SUV值增高,本底摄取减低及采集时间越长导致PET图像质量越好的影响。
综上所述,PET/MR对肝转移瘤病灶具有较高的检出率,尤其是在长径 < 1 cm的病灶中,可以弥补PET/CT在肝内小转移灶中检出率较低的不足,同时PET/MR对受检者的辐射剂量也较PET/CT小,表明其对肝脏病灶的检出具有良好的应用前景。未来仍需大样本前瞻性研究进一步证实PET/MR的使用价值。
| [1] |
魏君臣, 孙新海, 卞婷婷, 等. 磁共振动态增强扫描对肝转移瘤的诊断价值研究[J]. 社区医学杂志, 2015, 13(21): 13-16. |
| [2] |
Renzulli M, Clemente A, Ierardi AM, et al. Imaging of colorectal liver metastases: new developments and pending issues[EB/OL]. (2020-01-06)[2020-09-12]. https://www.mdpi.com/2072-6694/12/1/151/htm.
|
| [3] |
Ozaki K, Harada K, Terayama N, et al. FDG-PET/CT imaging findings of hepatic tumors and tumor-like lesions based on molecular background[EB/OL]. (2020-04-03)[2020-09-12]. https://doi.org/10.1007/s11604-020-00961-1.
|
| [4] |
Dueland S, Grut H, Syversveen T, et al. Selection criteria related to long-term survival following liver transplantation for colorectal liver metastasis[J]. Am J Transplant, 2020, 20(2): 530-537. DOI:10.1111/ajt.15682 |
| [5] |
Suarez-Weiss KE, Herold A, Gervais D, et al. Hybrid imaging of the abdomen and pelvis[EB/OL]. (2020-05-18)[2020-09-12]. https://doi.org/10.1007/s00117-020-00661-x.
|
| [6] |
赵为民, 金博, 于震, 等. MACC1对裸鼠移植HT-29细胞所致结肠癌复发及肝转移的影响[J]. 实用肿瘤杂志, 2020, 35(3): 217-223. |
| [7] |
黄春妍, 陆艳, 王临池, 等. 苏州市结直肠癌死亡时空分布特征分析[J]. 实用肿瘤杂志, 2019, 34(4): 362-366. |
| [8] |
Lee DH, Lee JM, Hur BY, et al. Colorectal cancer liver metastases: diagnostic performance and prognostic value of PET/MR imaging[J]. Radiology, 2016, 280(3): 782-792. DOI:10.1148/radiol.2016151975 |
| [9] |
Niekel MC, Bipat S, Stoker J. Diagnostic imaging of colorectal liver metastases with CT, MR imaging, FDG PET, and/or FDG PET/CT: a meta-analysis of prospective studies including patients who have not previously undergone treatment[J]. Radiology, 2010, 257(3): 674-684. DOI:10.1148/radiol.10100729 |
| [10] |
Beiderwellen K, Geraldo L, Ruhlmann V, et al. Accuracy of 18F FDG PET/MRI for the detection of liver metastases[J]. PLoS One, 2015, 10(9): e0137285. DOI:10.1371/journal.pone.0137285 |
| [11] |
Donati OF, Hany TF, Reiner CS, et al. Value of retrospective fusion of PET and MR images in detection of hepatic metastases: comparison with 18F-FDG PET/CT and GdEOB-DTPA-enhanced MRI[J]. J Nucl Med, 2010, 51(5): 692-699. DOI:10.2967/jnumed.109.068510 |
| [12] |
Hazhirkarzar B, Khoshpouri P, Shaghaghi M, et al. Current state of the art imaging approaches for colorectal liver metastasis[J]. Hepatobiliary Surg Nutr, 2020, 9(1): 35-48. DOI:10.21037/hbsn.2019.05.11 |
| [13] |
许远帆, 梁江涛, 王芳晓, 等. 18F-FDG PET/MR与PET/CT在乳腺肿瘤诊断中的初步对比研究[J]. 临床放射学杂志, 2019, 27(5): 815-820. |
| [14] |
Tian J, Fu L, Yin D, et al. Does the novel integrated PET/MRI offer the same diagnostic performance as PET/CT for oncological indications?[J]. PLoS One, 2014, 9(6): e90844. |
| [15] |
王洋洋, 王振光, 李大成, 等. 18F-FDG PET/CT诊断原发性肝癌和肝转移瘤的价值[J]. 中国医学影像技术, 2015, 31(1): 77-81. |
| [16] |
程勇, 白乐, 尚靖杰, 等. 肝脏局灶性病变18F-FDG PET/CT与PET/MR比较分析[J]. 中国医学影像技术, 2017, 33(1): 61-65. |
| [17] |
代学杨. 18F-FDG PET/CT与动态增强CT对肝脏占位性病变诊断价值的比较[D]. 天津: 天津医科大学研究生院. 2015.
|
| [18] |
洪建平, 左长京, 张健, 等. PET/CT在转移性肝癌中的价值探讨[J]. 实用医学影像杂志, 2013, 14(2): 119-121. DOI:10.3969/j.issn.1009-6817.2013.02.012 |
| [19] |
D'Souza MM, Sharma R, Mondal A, et al. Prospective evaluation of CECT and 18F-FDG-PET/CT in detection of hepatic metastases[J]. Nucl Med Commun, 2009, 30(2): 117-125. DOI:10.1097/MNM.0b013e32831ec57b |
| [20] |
陈小莉, 刘海峰, 黎金葵, 等. 18F-FDG PET/CT对肝转移瘤诊断价值的Meta分析[J]. 中国CT和MRI杂志, 2019, 17(1): 91-95. |
| [21] |
Coenegrachts K, Geeter FD, Beek LT, et al. Comparison of MRI (including SS SE-EPI and SPIO-enhanced MRI) and FDG-PET/CT for the detection of colorectal liver metastases[J]. Eur Radiol, 2009, 19(2): 370-379. DOI:10.1007/s00330-008-1163-y |
| [22] |
Tirumani SH, Kim KW, Nishino M, et al. Update on the role of imaging in management of metastatic colorectal cancer[J]. Radiographics, 2014, 34(7): 1908-1928. DOI:10.1148/rg.347130090 |
| [23] |
Morsing A, Hildebrandt MG, Vilstrup MH, et al. Hybrid PET/MRI in major cancers: a scoping review[J]. Eur J Nucl Med Mol I, 2019, 46(10): 2138-2151. DOI:10.1007/s00259-019-04402-8 |
| [24] |
Heusch P, Buchbender C, Beiderwellen K, et al. Standardized uptake values for 18F FDG in normal organ tissues: Comparison of whole-body PET/CT and PET/MRI[J]. Eur J Radiol, 2013, 82(5): 870-876. DOI:10.1016/j.ejrad.2013.01.008 |
| [25] |
李灿, 徐白萱, 刘家金, 等. PET-MR与PET-CT显像中不同器官18F-FDG阳性病变SUVmax的比较[J]. 中国医学影像学杂志, 2019, 27(5): 379-384. |
| [26] |
Grant AM, Deller TW, Khalighi MM, et al. NEMA NU 2-2012 performance studies for the SiPM-based ToFPET component of the GE SIGNA PET/MR system[J]. Med Phys, 2016, 43(5): 2334-2343. |
| [27] |
孙洪赞, 杜思瑶, 辛军, 等. PET/CT与PET/MR诊断恶性肿瘤的临床对照研究[J]. 中国临床医学影像杂志, 2018, 29(9): 655-659. |
| [28] |
Zytoon AA, Murakami K, El-Kholy MR, et al. Dual time point FDG-PET/CT imaging. Potential tool for diagnosis of breast cancer[J]. Clin Radiol, 2008, 63(11): 1213-1227. |
 2021, Vol. 36
2021, Vol. 36


