文章信息
- 黄通村, 黄品同
- Huang Tongcun, Huang Pintong
- 吲哚菁绿在乳腺癌肿瘤坏死模型中的光学成像研究
- Optical imaging study of indo cyanine green in tumor necrosis model of breast cancer
- 实用肿瘤杂志, 2022, 37(6): 508-513
- Journal of Practical Oncology, 2022, 37(6): 508-513
-
通信作者
- 黄品同,E-mail:huangpintong@zju.edu.cn
-
文章历史
- 收稿日期:2022-01-31
乳腺癌在全球及中国女性恶性肿瘤发病率及死亡率中都位居前列[1]。随着科学技术的发展,诸如免疫治疗和新辅助化疗等技术广泛地应用于临床,保乳手术的应用日渐增多,乳腺癌治疗获得了更好的疗效[2]。
坏死是一种由理化因素引起的非程序性和非生理性过程[3],是生物体中一个重要的过程,广泛出现于疾病自然发展或人为干预的治疗过程中,是如肿瘤和心肌梗死等诸多疾病的重要的病理生理过程[4-6]。其发展过程中部分的分子变化可作为标志物被一些物质识别,具有这样可以靶向识别坏死细胞性质的物质可被称为坏死亲和性化合物(necrosis avid compound)[7-8]。部分坏死亲和性化合物还可以被一些如小动物活体荧光成像仪和MRI等成像设备识别而用于对细胞坏死进行可视化成像。相较于其他一些主流的靶向策略,这些能被成像设备识别的坏死亲和性化合物在诸多方面具有明显的优势,使其成为临床和科研工作者研究的重要方向之一[9-10]。
吲哚菁绿(indo cyanine green,ICG)是一种在研究及临床上被广泛应用的荧光染料,在特定波长光源的照射激发下可发出特定波长的荧光,通过一些光学成像设备可完成体内外的荧光成像,使得被标记的物质或组织与周围物质或组织产生区分[11]。目前,ICG已应用于肝癌等一些肿瘤的荧光导航手术中[12]。此外,在一些研究中还发现其可在烧伤和坏死的组织中特异性聚集,具有坏死亲和性,是一种优秀的具有荧光成像效果的坏死亲和性化合物[13]。
考布他汀A4磷酸脂(combretastatin A4 phosphate,CA4P)是一种小分子破坏肿瘤血管系统的人血管阻断剂,属于微管解聚物类。该类血管阻断剂可结合血管内皮细胞微管蛋白β亚基的秋水仙碱结合位点,导致微管解聚、肌动蛋白和微管蛋白分离,破坏血管内皮细胞骨架和细胞间的连接,进而使内皮细胞形态发生快速改变和血管通透性升高,又由于肿瘤血管内皮细胞增殖快、缺乏周细胞及平滑肌细胞、基底膜异常、血管通透性增加、结构紊乱、扭曲、壁薄、血流缓慢甚至双向流动等的特点,因此其可以相对选择性地作用于肿瘤组织的血管,造成血管的破坏,从而造成肿瘤组织的缺血坏死[14-15]。本研究利用CA4P对荷瘤小鼠进行治疗,造成肿瘤组织坏死,同时利用其血管破坏效果造成肿瘤组织的通透性增加,在两者的共同作用下,增强ICG在组织中的富集效果,从而达到治疗及成像的效果。同时该方法还可以为荧光下手术导航乳腺癌切除提供可能性,为乳腺的诊疗提供更多思路[16-17]。
1 材料与方法 1.1 材料人乳腺癌MDA-MB-231荧光素酶基因稳转细胞株MDA-MB-231-Luc购于上海中科院细胞所。DMEM高糖培养液和胎牛血清(fetal bovine serum,FBS)均购于美国Gibco公司。磷酸盐缓冲液(phosphate buffer solution,PBS)购于杭州吉诺生物医药技术有限公司。含0.25%乙二胺四乙酸二钠(ethylene diamine tetraacetic acid,EDTA)胰酶和青链霉素混合抗生素购于美国HyClone公司。Cell Counting Kit-8(CCK-8)Cell Counting Kit购于南京诺维赞公司。ICG购于东港丹东医创药业有限责任公司。细胞培养皿和培养板等耗材均购于美国Corning公司。
1.2 细胞培养MDA-MB-231-Luc细胞培养条件:乳腺癌细胞株MDA-MB-231-Luc在37℃ 5% C02的培养箱中培养,使用含有10% FBS及1%青链霉素的DMEM培养液,隔天更换培养液。当细胞生长至对数生长期时进行传代。细胞使用含0.02% EDTA的0.25%胰蛋白酶消化收集后,于离心机中用800 r/min转,离心5 min后弃去上清液并使用上述培养液重悬。将细胞悬液接种于所需培养皿中,观察生长状态,等细胞生长至对数生长期即状态良好并融合至80%~90%时使用。细胞采用细胞计数板人工计数。
1.3 乳腺癌荷瘤小鼠模型的建立BALB/c裸鼠(6周龄,雌性)于浙江大学医学院附属第二医院SPF级动物实验室饲养。将MDA-MB-231-Luc细胞株置于37℃ 5% CO2的培养箱、含有10%FBS及1%青链霉素的DMEM培养液中培养,待其至对数生长期后,消化并离心于PBS中重悬[18],取5×107个/mL用1 mL注射器取10 μL细胞悬液,接种于裸鼠右侧腋下。注射前后分别用75%乙醇对接种部位皮肤进行消毒。隔天观察裸鼠并用游标卡尺测量肿瘤的最长径(A,单位为mm)及最宽径(B,单位为mm),根据公式V=A×B2/2记录肿块大小(V),待肿瘤生长至1 cm3时,用于进一步行荧光活体成像实验。
1.4 ICG坏死亲和效果验证BALB/c裸鼠(6周龄,雌性)于浙江大学医学院附属第二医院SPF级动物实验室饲养。取3只于其腋下局部注射1 μL 95%的无水乙醇,造成局部组织坏死。后给予尾静脉注射0.5 mg/kg ICG 100 μL,后使用小动物麻醉机调节氧流量为0.5 L/min,混合1%~3%异氟烷对裸鼠进行实时麻醉;裸鼠进入深麻醉状态后,摆置为俯卧位,后置于荧光活体成像系统(in vivo imaging system,IVIS;Caliper Life Sciences,美国)内,分别于2 h和24 h后设置激发波长780 nm和发射波长831 nm行近红外荧光成像。
1.5 荧光活体成像取1.3处构建的乳腺癌荷瘤小鼠6只,于尾静脉注入100 mg/kg CA4P 100 μL 24 h后,再于尾静脉注入0.5 mg/kg ICG 100 μL,以构建荧光活体成像实验小鼠,对该实验小鼠行光学成像。使用小动物麻醉机调节氧流量为0.5 L/min,混合1%~3%异氟烷对小鼠进行实时麻醉;小鼠进入深麻醉状态后,摆置为俯卧位,置于IVIS内,分别于2 h和24 h在780 nm激发光和831 nm接受光模式下进行成像。在该成像同时,因实验小鼠具有荧光素酶标记,分别在2 h和24 h于腹腔注射荧光素酶底物后,立刻在自体荧光成像模式下,获得肿瘤自体荧光成像图片。
1.6 CA4P肿瘤治疗效果评估将小鼠分为对照组、ICG组和ICG+CA4P组,各组均设立小鼠6只。ICG+CA4P组即为1.5处的荧光活体成像实验小鼠,对照组为与ICG+CA4P组同样建模后仅给予尾静脉注射生理盐水100 μL但未注射ICG及CA4P的小鼠,ICG组为与ICG+CA4P组同样建模后仅于尾静脉注入0.5 mg/kg ICG 100 μL但未给予CA4P的小鼠。分别于给药后0、3、7和10 d用游标卡尺测量肿瘤的最长径(A,单位为mm)及最宽径(A,单位为mm),根据公式V=A×B2/2记录肿块大小(V)。
1.7 统计学分析采用GraphPad Prism 7软件进行数据分析。数据描述为3次实验的均数±标准差(x±s)。组间比较采用t检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 动物模型的建立结果BALB/c裸鼠接种MDA-MB-231-Luc细胞后,成瘤率为100%(18/18)。在接种后7~10 d后,可明显触及肿瘤,约在2周后进入快速生长期。处死小鼠后,可见肿瘤表面包膜较为完整,包块切面呈灰白色。
2.2 ICG坏死亲和效果验证在局部腋下注射1 μL 95%无水乙醇后,注射点皮下发白,局部皮下软组织出现坏死表现。1 d后,于尾静脉注射ICG后2 h在IVIS下见ICG主要分布于肝脏及无水乙醇局部注射点。在注射ICG后24 h,随着肝脏内的ICG逐渐代谢排出,而注射点ICG在坏死亲和性的作用下,聚集并潴留在坏死组织中,在光学成像系统下坏死区域呈现出高信号(图 1),提示ICG具有良好的坏死亲和性。

|
| 注 空白成像图中局部发白处为95%无水乙醇造成局部坏死组织。荧光成像下见注射ICG后2 h ICG主要分布于肝脏及坏死组织,随着ICG在小鼠体内代谢排出,注射后24 h见肝脏内ICG基本代谢清除,坏死组织出ICG潴留在光学成像中表现出高信号 图 1 95%无水乙醇造成的局部坏死小鼠模型中ICG的光学成像效果 Fig.1 Optical imaging of ICG in a mouse model of local necrosis induced by 95% absolute alcohol |
在注射CA4P 24 h作用下,乳腺癌组织中出现缺血坏死,完成坏死乳腺癌坏死肿瘤模型的构建。利用该小鼠模型,于尾静脉注射ICG。利用IVIS观测注射ICG后2 h和24 h时ICG在小鼠体内的分布情况。在观测结果可见,2 h时主要分布于肝脏及肿瘤区域;在24 h时,随着ICG在小鼠体内代谢排出,表现出在肿瘤区域富集的现象。在注射荧光素酶底物后,肿瘤区域成像结果与ICG成像结果重合,进一步验证了这一结果(图 2A)。
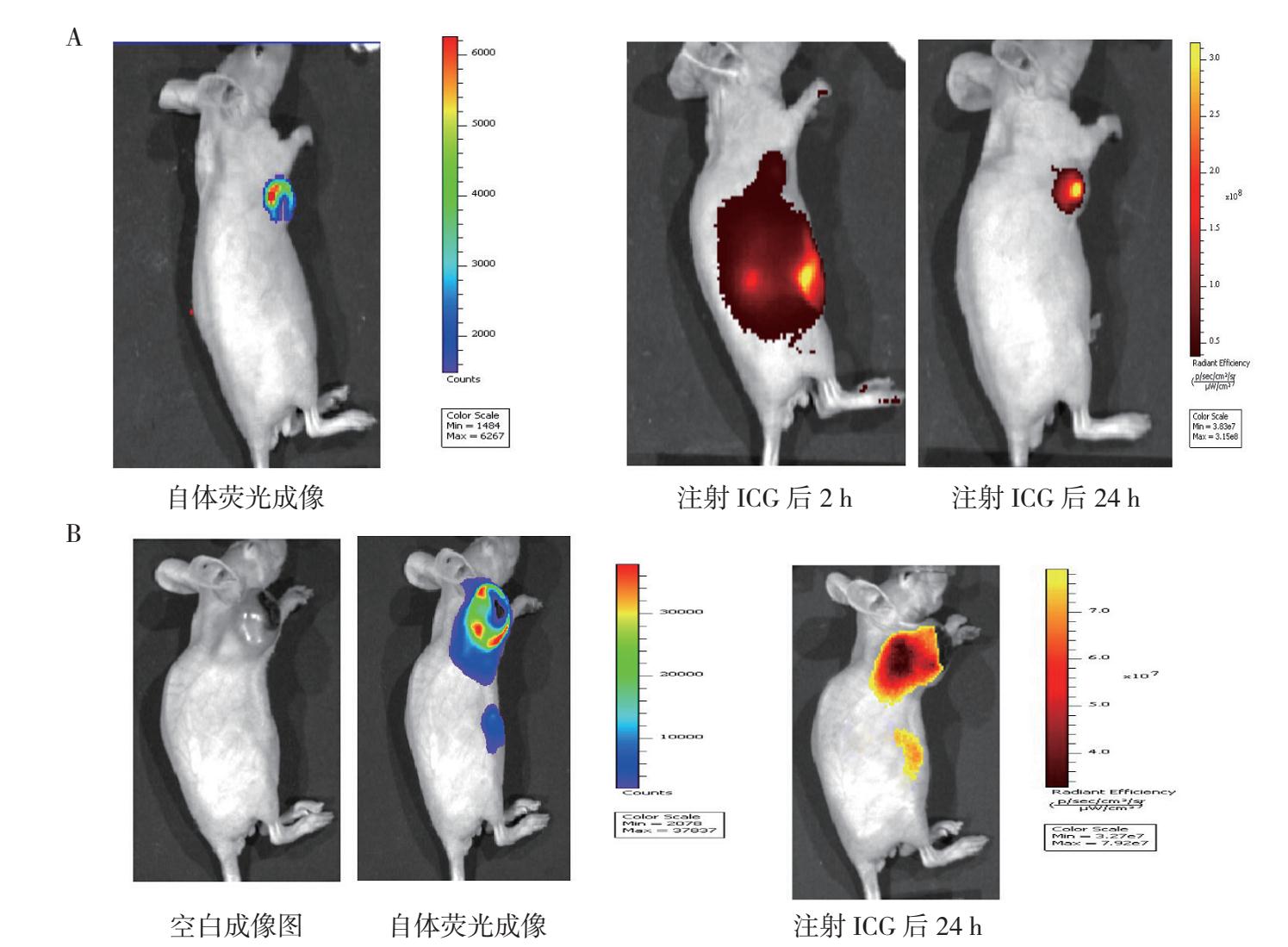
|
| 注 A:肿瘤坏死小鼠模型在自体荧光成像及注射ICG后2 h和24 h成像情况;B:在培养过程中发生自发转移的肿瘤坏死小鼠模型在注射ICG后24 h成像情况 图 2 CA4P造成的肿瘤坏死小鼠模型的荧光活体成像效果 Fig.2 In vivo fluorescence imaging in a mouse model of tumor necrosis induced by CA4P |
在实验小鼠后续饲养过程中,1只小鼠出现自发的转移表现,自体荧光成像显示转移肿瘤情况。为了验证该方法对转移肿瘤是否同样具有良好的成像效果,在该转移小鼠上重复上述成像步骤。结果显示,在注射ICG后24 h,原发肿瘤及转移肿瘤均具有良好的成像效果(图 2B)。
2.4 CA4P肿瘤治疗效果经过不同处理后,在持续10 d的肿瘤体积监测结果中可以看出。在对照组及ICG组中肿瘤呈现出快速的生长趋势。而在ICG+CA4P组中,肿瘤的生长受到抑制。ICG+CA4P组与对照组比较,肿瘤生长在3、7和10 d时差异均具有统计学意义(均P < 0.05);与ICG组比较,在7和10 d时差异均具有统计学意义(均P < 0.05,图 3)。
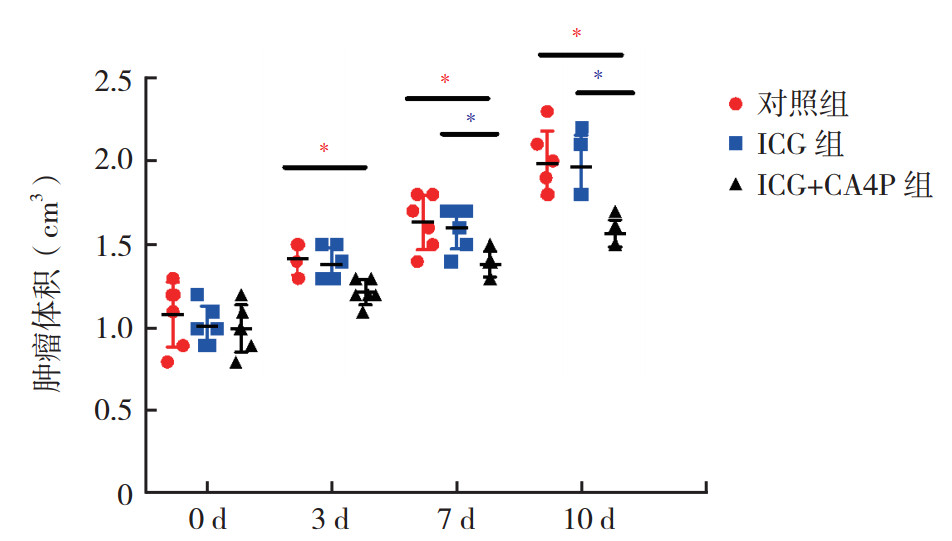
|
| 注 不同治疗组的乳腺癌荷瘤小鼠在给药后分别于0、3、7和10 d的肿瘤体积变化情况;*P < 0.05 图 3 CA4P对乳腺癌荷瘤小鼠的肿瘤治疗效果 Fig.3 Therapeutic effect of CA4P on breast cancer-bearing mice |
ICG是美国食品药品管理局(Food and Drug Administration,FDA)目前唯一认证可用于临床的荧光探针。ICG在经由静脉进入人体后,可与血浆中的栽脂蛋白结合,随着血液循环分布到全身血管中,后由肝细胞选择性摄取代谢,并以游离的形式排泄到胆汁之中,后经胆管随着粪便排出体外。其毒性小,是一种十分安全的药物。目前在临床上已经广泛应用于肝脏功能测定,也用于多种肿瘤的术中实时显像[11]。相较于其他成像方式,具有可以活体成像、操作简单和无放射性等特点。
早在1924年,卟啉类衍生物被发现可以选择性地积聚于肿瘤组织中。基于这一特性及卟啉的光敏作用,研究将其用于肿瘤光动力学治疗。经过在多种坏死动物模型(如急性心肌梗死和乙醇诱导肝坏死等)中的验证,发现这种选择性聚集主要来自卟啉的坏死亲和性。于是这些能够利用生物体内坏死组织作为靶点,特异性聚集于坏死组织并产生特异性结合的对比剂被称之为坏死亲和剂[19]。许多光学成像探针如金丝桃素、5-羟基异喹诺酮(5-hydroxyisoquinolones,HQ5)和IR Dye 800CW也被发现并被用于坏死组织的识别及成像。基于相关的研究,这些染料的坏死亲和性被认为来自失去完整性的细胞膜上的细胞质蛋白[20-22]。同时,ICG在一些研究中也被发现具有选择性与坏死细胞中脂蛋白和磷脂相互作用而对坏死组织具有亲和性[13]。放化疗可用于诱导异种移植肿瘤坏死模型,其中血管破坏剂CA4P诱导肿瘤坏死模型最为常用[23-25]。
相较于其他一些主流的靶向策略,这些能被成像设备识别的坏死亲和性化合物在一些方面存在明显优势。有机金属框架、量子点和胶束等多种纳米材料具有良好的高渗透长滞留效应(enhanced permeability and retention,EPR),同时还可以借助一些如抗体和配体等多种主动靶向策略进一步完善靶向效果[26-27]。但其在体内代谢过程中,大量地潴留在肝脏和脾脏等多个正常脏器之中,从而产生巨大的潜在毒性[28],这也是其在迈入临床应用的过程中难以又不得不跨越的鸿沟。放射性核素标记也可以借助小分子靶向物质实现肿瘤的成像。但其具有放射性,同时价格昂贵,并不具有实时性,使其在临床上的应用也受到限制。
本研究中通过无水乙醇制备相关坏死动物模型。通过观察24 h代谢后,ICG在该模型中的分布情况,验证了ICG的坏死亲和性。并进一步在活体成像实验中,使用在裸鼠腋窝皮下接种MDA-MB-231-Luc乳腺癌细胞株建立裸鼠人乳腺癌皮下移植瘤模型。通过尾静脉注射CA4P,造成肿瘤组织的坏死,完成肿瘤坏死模型制备。随后,通过尾静脉注射ICG,并经过24 h的代谢分布,活体荧光成像实验结果示瘤区可见明显的荧光信号增强。该实验结果显示,ICG在注射后,在CA4P制备的肿瘤坏死模型中,ICG可以通过与坏死物质的亲和在到达肿瘤组织后,被肿瘤细胞特异性地摄取并长期停留,由于在其肿瘤区长时间高度富集,获得良好的荧光成像效果。同时在实验过程中发现的转移癌模型中同样具有优秀的成像效果。该结果显示,在通过CA4P制备乳腺癌肿瘤坏死模型中,具有良好的肿瘤靶向成像效果。其为乳腺癌新辅助化疗、诊疗一体、多发与转移癌的发现及乳腺癌荧光手术导航提供了更多的思路及可行性。
| [1] |
Rebecca LS, Kimberly DM, Hannah EF, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71: 7-33. DOI:10.3322/caac.21654 |
| [2] |
黄佳欢, 雷蕾, 王晓稼. 白蛋白结合型紫杉醇治疗晚期乳腺癌的研究进展[J]. 实用肿瘤杂志, 2021, 36(6): 496-501. DOI:10.13267/j.cnki.syzlzz.2021.099 |
| [3] |
Galluzzi L, Vitale I, Aaronson SA, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018[J]. Cell Death Differ, 2018, 25(3): 486-541. DOI:10.1038/s41418-017-0012-4 |
| [4] |
Okada H, Mak TW. Pathways of apoptotic and non-apoptotic death in tumour cells[J]. Nat Rev Cancer, 2004, 4(8): 592-603. DOI:10.1038/nrc1412 |
| [5] |
Heusch G. Myocardial ischaemia-reperfusion injury and cardioprotection in perspective[J]. Nat Rev Cardiol, 2020, 17(12): 773-789. DOI:10.1038/s41569-020-0403-y |
| [6] |
Jamiel A, Ebid M, Ahmed AM, et al. The role of myocardial viability in contemporary cardiac practice[J]. Heart Fail Rev, 2017, 22(4): 401-413. DOI:10.1007/s10741-017-9626-3 |
| [7] |
Zhang DJ, Jiang CH, Feng YB, et al. Molecular imaging of myocardial necrosis: an updated mini-review[J]. J Drug Target, 2020, 28(6): 565-573. DOI:10.1080/1061186X.2020.1725769 |
| [8] |
Smith BA, Smith BD. Biomarkers and molecular probes for cell death imaging and targeted therapeutics[J]. Bioconjug Chem, 2012, 23(10): 1989-2006. DOI:10.1021/bc3003309 |
| [9] |
Chen QW, Wen J, Li HJ, et al. Recent advances in different modal imaging-guided photothermal therapy[J]. Biomaterials, 2016, 106: 144-166. DOI:10.1016/j.biomaterials.2016.08.022 |
| [10] |
Liang JJ, Sun ZP, Zhang DJ, et al. First evaluation of radioiodinated flavonoids as necrosis-avid agents and application in early assessment of tumor necrosis[J]. Mol Pharm, 2018, 15(1): 207-215. DOI:10.1021/acs.molpharmaceut.7b00781 |
| [11] |
Reinhart MB, Huntington CR, Blair LJ, et al. Indocyanine green: historical context, current applications, and future considerations[J]. Surg Innov, 2016, 23(2): 166-175. DOI:10.1177/1553350615604053 |
| [12] |
Purich K, Dang JT, Poonja A, et al. Intraoperative fluorescence imaging with indocyanine green in hepatic resection for malignancy: a systematic review and meta-analysis of diagnostic test accuracy studies[J]. Surg Endosc, 2020, 34(7): 2891-2903. DOI:10.1007/s00464-020-07543-2 |
| [13] |
Fang C, Wang K, Zeng CT, et al. Illuminating necrosis: from mechanistic exploration to preclinical application using fluorescence molecular imaging with indocyanine green[J]. Sci Rep, 2016, 6: 21013. DOI:10.1038/srep21013 |
| [14] |
付鲜花, 李军, 张苏展. 小分子肿瘤血管阻断剂研究进展[J]. 实用肿瘤杂志, 2011, 26(4): 427-431. DOI:10.13267/j.cnki.syzlzz.2011.04.028 |
| [15] |
Liang WJ, Ni YC, Chen F. Tumor resistance to vascular disrupting agents: mechanisms, imaging, and solutions[J]. Oncotarget, 2016, 7(13): 15444-15459. DOI:10.18632/oncotarget.6999 |
| [16] |
Egloff-Juras C, Bezdetnaya L, Dolivet G, et al. NIR fluorescence-guided tumor surgery: new strategies for the use of indocyanine green[J]. Int J Nanomedicine, 2019, 14: 7823-7838. DOI:10.2147/IJN.S207486 |
| [17] |
Nguyen QT, Tsien RY. Fluorescence-guided surgery with live molecular navigation: a new cutting edge[J]. Nat Rev Cancer, 2013, 13(9): 653-662. DOI:10.1038/nrc3566 |
| [18] |
Cao FY, Huang TC, Wang YF, et al. Novel lanthnide-polymer complexes for dye-free dual modal probes for MRI and fluorescence imaging[J]. Polym Chem, 2015, 6(46): 7949-7957. DOI:10.1039/C5PY01011J |
| [19] |
Cona MM, Oyen R, Ni YC. Necrosis avidity of organic compounds: a natural phenomenon with exploitable theragnostic potentials[J]. Curr Med Chem, 2015, 22(15): 1829-1849. DOI:10.2174/0929867322666150227153550 |
| [20] |
Jiang BH, Wang JC, Ni YC, et al. Necrosis avidity: a newly discovered feature of hypericin and its preclinical applications in necrosis imaging[J]. Theranostics, 2013, 3(9): 667-676. DOI:10.7150/thno.6650 |
| [21] |
Xie BW, Stammes MA, van Driel PB, et al. Necrosis avid near infrared fluorescent cyanines for imaging cell death and their use to monitor therapeutic efficacy in mouse tumor models[J]. Oncotarget, 2015, 6(36): 39036-39049. DOI:10.18632/oncotarget.5498 |
| [22] |
Dasari M, Lee S, Sy J, et al. Hoechst-IR: an imaging agent that detects necrotic tissue in vivo by binding extracellular DNA[J]. Org Lett, 2010, 12(15): 3300-3303. DOI:10.1021/ol100923d |
| [23] |
Li JJ, Sun ZP, Zhang J, et al. A dual-targeting anticancer approach: soil and seed principle[J]. Radiology, 2011, 260(3): 799-807. DOI:10.1148/radiol.11102120 |
| [24] |
Li JJ, Oyen R, Verbruggen A, et al. Small molecule sequential dual-targeting theragnostic strategy (SMSDTTS): from preclinical experiments towards possible clinical anticancer applications[J]. J Cancer, 2013, 4(2): 133-145. DOI:10.7150/jca.5635 |
| [25] |
Cona MM, Koole M, Feng YB, et al. Biodistribution and radiation dosimetry of radioiodinated hypericin as a cancer therapeutic[J]. Int J Oncol, 2014, 44(3): 819-829. DOI:10.3892/ijo.2013.2217 |
| [26] |
Freund R, Zaremba O, Arnauts G, et al. The current status of MOF and COF applications[J]. Angew Chem Int Ed Engl, 2021, 60(45): 23975-24001. DOI:10.1002/anie.202106259 |
| [27] |
Shi JJ, Kantoff PW, Wooster R, et al. Cancer nanomedicine: progress, challenges and opportunities[J]. Nat Rev Cancer, 2017, 17(1): 20-37. DOI:10.1038/nrc.2016.108 |
| [28] |
Chen LJ, Liu J, Zhang YL, et al. The toxicity of silica nanoparticles to the immune system[J]. Nanomedicine (Lond), 2018, 13(15): 1939-1962. DOI:10.2217/nnm-2018-0076 |
 2022, Vol. 37
2022, Vol. 37


