文章信息
- 隆琦, 王金湖, 张婷, 马鸣
- Long Qi, Wang Jinhu, Zhang Ting, Ma Ming
- 序贯式营养治疗在儿童胰腺肿瘤术后的应用效果
- Effect of sequential nutritional support on children with pancreatic tumor after operation
- 实用肿瘤杂志, 2021, 36(2): 129-134
- Journal of Practical Oncology, 2021, 36(2): 129-134
基金项目
- 浙江省教育厅项目(Y201635973);横向科研项目(491040-C51601)
-
通信作者
- 马鸣, E-mail: maming73@zju.edu.cn
-
文章历史
- 收稿日期:2020-09-15
2. 国家儿童健康与疾病临床医学研究中心, 浙江大学医学院附属儿童医院肿瘤外科, 浙江 杭州 310052
2. Department of Surgical Oncology, the Children's Hospital, Zhejiang University School of Medicine, National Clinical Research Center for Child Health, Hangzhou 310052, China
儿童胰腺肿瘤非常罕见,发病率仅为0.18/10万,其最常见的病理类型为胰母细胞瘤和胰腺实性假乳头状瘤[1]。胰母细胞瘤多发生在10岁以前,而实性假乳头状瘤多发生在青春期[2-3]。手术是治疗儿童胰腺肿瘤的主要方法[4],由于胰腺周围解剖结构复杂,术后常见并发症有胰瘘、术后出血和胃排空延迟等,其发生率高达30%~60%[5]。胰腺肿瘤患者术前普遍存在体质量下降等营养问题,术后并发症更加重其营养状况的恶化[6]。因此,保证术后营养物质的合理供给对于围手术期的管理及患儿的生长发育至关重要。
目前成人胰腺肿瘤多学科综合治疗已涵盖放射科、放疗科、化疗科、病理科、营养科和疼痛科等众多专业[7],其中营养支持的重要性已得到证实[8-10],而儿童则鲜有报道。和成年患者比较,儿童对手术创伤应激耐受性更差,对营养素的需求更高,故难以完全按照成人指南对儿童胰腺肿瘤术后的营养管理进行指导。本院自2016年起对具有营养风险的胰腺肿瘤患儿开展序贯式营养治疗,并对如何给予规范的营养支持做了初步探索,旨在将营养支持纳入儿童胰腺肿瘤围手术期治疗以及建立规范化管理流程提供依据。
1 资料与方法 1.1 一般资料回顾性收集2016年1月至2018年12月在本院肿瘤外科行胰腺肿瘤切除且有完整随访数据的患儿的临床资料。纳入标准:(1)年龄0~18岁;(2)胰腺肿瘤接受外科手术治疗;(3)STRONGkids营养风险筛查≥1分;(4)术后病理诊断为胰母细胞瘤或者胰腺实性假乳头状瘤。排除标准:(1)其他部位肿瘤伴胰腺转移;(2)严重心肺功能不全患者;(3)肝肾功能异常者。资料包括年龄、性别、术前营养状况、手术方式、术后营养状况、营养支持方案和并发症发生率。本研究获浙江大学医学院附属儿童医院伦理委员会审批通过,伦理审批号为2020-IRB-020。
1.2 序贯式营养支持术后患儿常规使用抗生素和生长抑素,待血流动力学稳定、水电解质和酸碱平衡后,启动序贯式营养支持。临床营养科医师参与全程的营养评估、营养方案制定和疗效评价。
1.2.1 全肠外营养(total parenteral nutrition,TPN)术后48~72 h启动TPN,依据患儿的年龄和体质量制定相应能量、蛋白质、脂肪和葡萄糖量。能量:1~7岁为314~376 kJ/(kg·d);7~12岁为251~314 kJ/(kg·d);12~18岁为125~251 kJ/(kg·d)。氨基酸2~3 g/(kg·d)。脂肪2~3 g/(kg·d)。总的热氮比为100~150:1,糖脂比为1~1.5:1。3 d达到目标能量。
1.2.2 肠内营养(enteral nutrition,EN)监测患儿腹部体征和血尿淀粉酶水平,当腹胀缓解、听到肠鸣音、肛门排便排气和血尿淀粉酶水平降至正常时,启动EN。肠内营养制剂选用含有中链甘油三脂(medium chain triglycerides,MCT)的全营养素配方(MCT占总脂肪的57%)。(1)鼻空肠组:术中放置鼻空肠喂养管患儿术后经鼻空肠管喂养,肠内营养制剂以1 mL/(kg·h)起步,24 h持续泵入。根据患儿耐受程度,每日以1 mL/(kg·h)的速度递增,直至达到目标能量。(2)经口饮食组:术后经口饮入肠内营养制剂,根据耐受性,3~5 d达目标能量,如患儿出现消化道不耐受、血尿淀粉酶增加、胰腺炎和胰腺假性囊肿予胃镜下放置鼻空肠管。两组EN达到目标能量时,肠外营养(parenteral nutrition,PN)停用,患儿行全肠内营养(total enteral nutrition,TEN)。
1.2.3 特殊膳食鼻空肠组和经口饮食组达目标量后,消化道耐受,血尿淀粉酶水平正常,无胰腺炎和胰腺假性囊肿,可过渡至特殊膳食,即低脂高MCT膳食,能量需求依据2013版《中国居民膳食营养素推荐摄入量》制定[11];脂肪占供能比20%~30%,MCT占总脂肪的40%~50%,含有MCT的全营养素配方或MCT油是MCT的来源;糖类占供能比55%~65%;蛋白质占供能比10%~15%。
1.2.4 正常膳食低脂高MCT饮食持续约6周,患儿无临床症状后,恢复到与年龄相适应的常规饮食。
1.3 营养状况评估采用WHO Anthm和WHO Anthm Plus软件对患儿营养状况进行评价,包括年龄别身高(height-for-age,HAZ)、< 5岁计算身高别体质量(weight-for-height,WHZ)、≥5岁计算年龄别体质量指数(body mass index-for-age,BAZ)。依据美国肠外肠内营养学会制定的营养不良定义[12]:WHZ/BAZ值-1~-1.9时为轻度营养不良,-2~-2.9为中度营养不良,≤-3为重度营养不良。
1.4 统计学分析采用SPSS 20.0软件进行数据分析。计量资料采用均数±标准差(x±s)或中位数(M)表示,采用t检验进行比较。计数资料采用频数(百分比)表示,采用Fisher精确检验进行比较。以P < 0.05为差异具有统计学意义。术后各时间点BAZ和HAZ的比较采用单因素重复测量方差分析法,满足球形假性,采用Mauchly’s检验;不满足球形假性,采用Greenhouse-Geisser检验。
2 结果 2.1 一般临床资料本研究共纳入13例胰腺肿瘤患儿,其中男性3例,女性10例,手术时中位年龄为6岁(3~14岁)。7例为胰母细胞瘤,6例为胰腺实性假乳头状瘤,其中胰头肿瘤8例,胰体肿瘤3例,胰尾肿瘤2例。13例患儿均手术成功。5例胰头部肿瘤行保留十二指肠及胆总管的胰腺肿瘤切除,3例胰头部肿瘤、1例胰尾部肿瘤以及1例胰体部肿瘤行肿瘤剜除术,1例胰尾部肿瘤和1例胰体部肿瘤行胰腺肿瘤切除+脾切除术,1例胰体部肿瘤行胰腺肿瘤切除+脾静脉重建术。术中置入鼻空肠管9例。7例胰母细胞瘤术后接受4~6次化疗,化疗方案为长春地辛+吡柔比星+卡铂,胰腺实性假乳头状瘤术后均未接受化疗(表 1)。
| 患者序号 | 年龄(岁) | 性别 | 肿瘤部位 | 病理类型 | 手术方式 | 术中鼻空肠管置入 | 肠内营养启动时间(d) | 并发症 | 术后住院时间(d) |
| 1 | 5 | 女 | 头部 | 胰母细胞瘤 | 胰头肿瘤切除+胰腺空肠吻合 | 是 | 7 | 十二指肠梗阻 | 26 |
| 2 | 6 | 女 | 头部 | 胰腺实性假乳头状瘤 | 胰头肿瘤切除+胰腺空肠吻合 | 是 | 5 | 无 | 23 |
| 3 | 3 | 女 | 体部 | 胰母细胞瘤 | 胰体肿瘤切除+脾静脉重建术 | 是 | 6 | 无 | 28 |
| 4 | 11 | 女 | 头部 | 胰腺实性假乳头状瘤 | 胰头肿瘤剜除术 | 是 | 4 | 无 | 29 |
| 5 | 8 | 女 | 头部 | 胰腺实性假乳头状瘤 | 胰头肿瘤剜除术 | 是 | 4 | 无 | 18 |
| 6 | 9 | 女 | 尾部 | 胰腺实性假乳头状瘤 | 腹腔镜胰尾肿瘤切除术 | 否 | 4 | 无 | 9 |
| 7 | 14 | 女 | 头部 | 胰腺假性乳头状瘤 | 胰头肿瘤切除+胰腺空肠吻合 | 是 | 5 | 无 | 33 |
| 8 | 9 | 女 | 头部 | 胰母细胞瘤 | 胰头肿瘤切除+胰腺空肠吻合 | 是 | 6 | 无 | 25 |
| 9 | 4 | 男 | 头部 | 胰母细胞瘤 | 胰头肿瘤切除+胰腺空肠吻合 | 是 | 5 | 无 | 26 |
| 10 | 8 | 女 | 头部 | 胰腺实性假乳头状瘤 | 胰头肿瘤剜除术 | 否 | 7 | 急性胰腺炎 | 33 |
| 11 | 4 | 男 | 尾部 | 胰母细胞瘤 | 胰尾部肿瘤切除+脾脏部分切除 | 否 | 11 | 胰腺假性囊肿 | 16 |
| 12 | 3 | 女 | 体部 | 胰母细胞瘤 | 胰体肿瘤剜除术 | 否 | 14 | 急性胰腺炎 | 33 |
| 13 | 5 | 男 | 体部 | 胰母细胞瘤 | 胰体肿瘤切除+副脾切除术 | 是 | 5 | 无 | 30 |
营养支持情况:鼻空肠管组(n=9)和经口喂养组(n=4)PN支持天数分别为(8.33±5.22)d和(13.00±7.62)d,术后EN启动时间分别为(5.22±0.77)d和(9.00±4.40)d;鼻空肠管组空肠管留置时间为(25.56±7.60)d。营养监测:1例患者在PN期间发生导管相关脓毒血症,2例有腹胀和腹痛不耐受情况,其余患者均无不适情况,耐受性好。
2.2 临床转归术后并发症的发生率为30.8%(4/13)。这4例患儿中,3例(75.0%)为经口喂养组:其中1例胰腺实性假乳头状瘤患儿术后经口饮食后出现胰腺假性囊肿,予胃镜下放置鼻空肠管,同时行胰腺假性囊肿外引流术后治愈;另外1例胰腺实性假乳头状瘤和1例胰母细胞瘤患儿术后经口饮食后,并发急性胰腺炎,再次行胃镜下放置鼻空肠管,予肠内营养治疗后好转。另1例胰母细胞瘤患儿术中虽放置鼻空肠管,但术后1个月,并发十二指肠梗阻,予空肠-空肠侧侧吻合+鼻空肠管置入,后予肠内营养治疗好转。
2.3 营养状况术前营养不良发生率为30.8%(4/13),其中重度、中度和轻度营养不良发生率分别为7.7%(1/13)、7.7%(1/13)和15.4%(2/13),术后1个月营养不良发生率为15.4%(2/13),均为轻度营养不良,营养不良的发生率下降(P=0.045)。白蛋白和前白蛋白水平在术后1个月升高(P < 0.05);患儿BAZ、HAZ以及血红蛋白水平术后1个月与术前比较,差异均无统计学意义(均P > 0.05,表 2)。
| 营养指标 | 术前1 d | 术后1个月 | t值 | P值 |
| WHZ/BAZ | -0.58±1.23 | -0.48±0.89 | -0.453 | 0.659 |
| HAZ | -0.47±0.78 | -0.40±0.85 | -0.826 | 0.425 |
| 白蛋白(g/L) | 34.26±5.76 | 42.32±4.14 | -3.190 | 0.011 |
| 前白蛋白(g/L) | 0.11±0.03 | 0.22±0.048 | -5.060 | 0.001 |
| 血红蛋白(g/L) | 107.00±18.09 | 109.50±14.68 | -0.575 | 0.580 |
| 注 WHZ:身高别体质量(weight-for-height);BAZ:年龄别体质量指数(body mass index-for-age);HAZ:年龄别身高(height-for-age) | ||||
7例胰母细胞瘤患儿术前1 d以及术后1、3和6个月的WHZ/BAZ和HAZ评分变化趋势见图 1。各时间点WHZ/BAZ渐升高,分别为(-1.01±1.44)、(-0.63±0.77)、(-0.19±0.59)和(-0.08±0.70),差异具有统计学意义[F(3,18)=3.225,P=0.046];HAZ分别为(-0.74±0.96)、(-0.70±1.11)、(-0.79±1.07)和(-0.86±1.03),各时间点之间比较,差异无统计学意义[F(1.856,11.135)=0.591,P=0.558]。
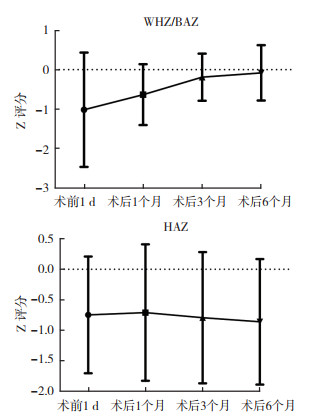
|
| 注 WHZ:身高别体质量(weight-for-height);BAZ:年龄别体质量指数(body mass index-for-age);HAZ: 年龄别身高(height-for-age) 图 1 7例胰母细胞瘤术后患儿WHZ/BAZ和HAZ评分各时间点的变化趋势 Fig.1 The trend of WHZ/BAZ and HAZ in 7 children with pancreatoblastoma after operation |
胰腺手术作为外科最复杂的手术之一,改变胃肠道的生理结构和功能,对处于生长发育关键时期的儿童营养素的吸收是一个巨大挑战。我国对儿童围手术期的营养管理越来越重视,科学合理的营养管理不仅能降低手术并发症,且有利于胃肠功能早期恢复[13]。
过去,胰腺术后通常采用TPN以保障能量供给[14]。近年来加速康复外科(enhanced recovery after surgery,ERAS)理念提倡消化道重建术后尽早建立EN,保护胃肠道黏膜,防止肠道细菌移位[15]。但现有证据表明,胰腺术后仅通过口服营养补充(oral nutrition supplement,ONS)并不能提供足够的能量和营养[16]。胰十二指肠切除术(pancreatoduodenectom,PD)是腹部外科最复杂和风险最高的手术[17]。研究发现,PD后早期经鼻肠管进行TEN的术后并发症高于TPN,所以不推荐PD术后较早应用TEN代替TPN[18]。也有学者发现胰腺肿瘤术后早期PN联合EN的营养方案在肠内营养的耐受性和连续性上优于单纯EN[19]。基于以上结果,笔者对鼻空肠管组患儿采用TPN-PN+EN-TEN-特殊膳食-正常膳食,未置管组采用经口EN-特殊膳食,并最终过渡到正常饮食的的序贯式营养支持治疗,以保证足够的能量摄入。
本研究中术后并发症发生率为30.8%,鼻空肠管置入组较未置入组并发症发生率低(11.1% vs 75.0%),说明通过鼻空肠管给予EN能减少术后并发症发生。2018年国际胰腺研究小组发表指南中指出对胰瘘高风险患者、严重的术前营养不良以及腹腔并发症需要再次手术者,放置肠内营养管是合理的,但术中常规放置鼻空肠管并无必要[8]。但本研究中,术后经口喂养的4例患儿中有3例出现急性胰腺炎或胰腺假性囊肿,胃镜下重新置入鼻空肠管,予以营养治疗后治愈。这或许提示儿童胰腺肿瘤术中应常规放置鼻空肠管,从而保障患儿尽快达到肠内营养的目标摄入量和减少手术并发症。
儿童营养状况的评估主要包括实验室检查及人体测量等方法[13]。本研究中患儿术后1个月白蛋白和前白蛋白水平较术前升高,术后营养不良发生率下降,提示序贯式营养支持治疗可保障蛋白及能量供给。Z值评分法为儿童应用最广泛的人体测量学营养评定方法。本研究中7例胰母细胞瘤患儿在术后半年的随访中,BAZ呈上升趋势,提示良好的营养支持可以促使患儿术后实现追赶性生长。HAZ变化虽不明显,但亦在正常区间内(-2~+2),提示对于胰腺肿瘤手术的患儿,早期进行营养支持,给予足量的能量和蛋白质的补充,可以促进儿童正常的线性生长,防止因为手术原因造成慢性的营养不良。分析原因可能与本研究采用保留十二指肠的肿瘤切除术或肿瘤剜除术有关,其对胰腺内外分泌和胃肠功能影响较小,有利于患儿术后胃肠道功能的早期恢复[20-22]。此外,本研究选用的肠内营养配方,每100 mL提供418 kJ热量和3.0 g蛋白质,可满足患儿术后能量和蛋白需求;胰腺肿瘤术后由于胰腺细胞和胰管均受到明显损伤,往往影响到胰酶分泌不足,从而导致脂肪吸收不良,本研究选择的肠内营养制剂的MCT占总脂肪的57%,而MCT的代谢可以不依赖胰酶和胆汁酸的作用,直接吸收入血,有助于改善肿瘤患者的营养状况[23]。
综上所述,本研究首次总结儿童胰腺肿瘤术后的序贯式营养支持治疗,即术中放置鼻空肠管,术后采用TPN-PN+EN-TEN-特殊膳食-正常膳食。这样可以有效保障营养吸收的连续性和耐受性,减少并发症,保障生长发育。但本研究为回顾性研究,且样本量较小,随访时间较短,结果存在一定局限性,后期可进一步扩大样本量进行深入研究。
| [1] |
Perez EA, Gutierrez JC, Koniaris LG, et al. Malignant pancreatic tumors: incidence and outcome in 58 pediatric patients[J]. J Pediatr Surg, 2009, 44(1): 197-203. DOI:10.1016/j.jpedsurg.2008.10.039 |
| [2] |
Ellerkamp V, Warmann SW, Vorwerk P, et al. Exocrine pancreatic tumors in childhood in Germany[J]. Pediatr Blood Cancer, 2012, 58(3): 366-371. DOI:10.1002/pbc.23211 |
| [3] |
Jaksic T, Yaman M, Thorner P, et al. A 20-year review of pediatric pancreatic tumors[J]. J Pediatr Surg, 1992, 27(10): 1315-1317. DOI:10.1016/0022-3468(92)90284-E |
| [4] |
张虹, 董蒨, 郝希伟, 等. 儿童胰腺肿瘤精准手术切除策略探讨(附15例报告)[J]. 中华小儿外科杂志, 2016, 37(9): 658-661. DOI:10.3760/cma.j.issn.0253-3006.2016.09.005 |
| [5] |
Petzel MQB, Hoffman L. Nutrition implications for long-term survivors of pancreatic cancer surgery[J]. Nutrit Clin Pract, 2017, 32(5): 588-598. DOI:10.1177/0884533617722929 |
| [6] |
Gilliland TM, Villafane-Ferriol N, Shah KP, et al. Nutritional and metabolic derangements in pancreatic cancer and pancreatic resection[J]. Nutrients, 2017, 9(3): 243. DOI:10.3390/nu9030243 |
| [7] |
郑雷. 走出胰腺癌认识五大误区, 优化胰腺癌个体治疗[J]. 实用肿瘤杂志, 2020, 35(5): 383-386. |
| [8] |
Gianotti L, Besselink MG, Sandini M, et al. Nutritional support and therapy in pancreatic surgery: A position paper of the International Study Group on Pancreatic Surgery (ISGPS)[J]. Surgery, 2018, 164(5): 1035-1048. DOI:10.1016/j.surg.2018.05.040 |
| [9] |
Berry AJ. Pancreatic surgery: indications, complications, and implications for nutrition intervention[J]. Nutrit Clin Pract, 2013, 28(3): 330-357. DOI:10.1177/0884533612470845 |
| [10] |
张冲, 张蓬波, 张易, 等. 胰腺癌患者术后的营养状况及特征分析[J]. 中华普外科手术学杂志: 电子版, 2019, 13(4): 347-349. DOI:10.3877/cma.j.issn.1674-3946.2019.04.009 |
| [11] |
程义勇. 《中国居民膳食营养素参考摄入量》2013修订版简介[J]. 营养学报, 2014, 36(4): 313-317. |
| [12] |
Mehta NM, Corkins MR, Lyman B, et al. Defining pediatric malnutrition: a paradigm shift toward etiology-related definitions[J]. JPEN, 2013, 37(4): 460-481. DOI:10.1177/0148607113479972 |
| [13] |
中华医学会肠外肠内营养学分会儿科学组, 中华医学会小儿外科学分会新生儿外科学组, 中华医学会小儿外科学分会肛肠学组, 等. 儿童围手术期营养管理专家共识[J]. 中华小儿外科杂志, 2019, 40(12): 1062-1070. DOI:10.3760/cma.j.issn.0253-3006.2019.12.002 |
| [14] |
Cooperman AM, Chivati J, Chamberlain RS. Nutritional and metabolic aspects of pancreatic cancer[J]. Curr Opin Clin Nutrit Metab Care, 2000, 3(1): 17-21. DOI:10.1097/00075197-200001000-00004 |
| [15] |
Lassen K, Coolsen MM, Slim K, et al. Guidelines for perioperative care for pancreaticoduodenectomy: Enhanced Recovery After Surgery (ERAS(R)) Society recommendations[J]. World J Surg, 2013, 37(2): 240-258. DOI:10.1007/s00268-012-1771-1 |
| [16] |
Lassen K, Coolsen MM, Slim K, et al. Guidelines for perioperative care for pancreaticoduodenectomy: Enhanced Recovery After Surgery (ERAS(R)) Society recommendations[J]. World J Surg, 2013, 37(2): 240-258. DOI:10.1007/s00268-012-1771-1 |
| [17] |
洪德飞. 腹腔镜胰十二指肠切除术治疗胰头癌的技术策略和疗效评价[J]. 实用肿瘤杂志, 2019, 34(4): 285-288. |
| [18] |
Perinel J, Mariette C, Dousset B, et al. Early enteral versus total parenteral nutrition in patients undergoing pancreaticoduodenectomy: a randomized multicenter controlled trial (Nutri-DPC)[J]. Ann Surg, 2016, 264(5): 731-737. DOI:10.1097/SLA.0000000000001896 |
| [19] |
Nagata S, Fukuzawa K, Iwashita Y, et al. Comparison of enteral nutrition with combined enteral and parenteral nutrition in post-pancreaticoduodenectomy patients: a pilot study[J]. Nutr J, 2009, 8(24): 1-8. DOI:10.1186/1475-2891-8-24 |
| [20] |
Wang J, Zheng Z, Qiu Y, et al. Primary mixed germ cell tumor arising in the pancreatic head[J]. J Pediatr Surg, 2013, 48(1): e21-24. DOI:10.1016/j.jpedsurg.2012.10.054 |
| [21] |
Zampieri N, Schiavo N, Capelli P, et al. Pseudopapillary tumor in pediatric age: clinical and surgical management[J]. Pediatr Surg Int, 2011, 27(12): 1271-1275. DOI:10.1007/s00383-011-2947-8 |
| [22] |
王金湖, 茅君卿, 蔡嘉斌, 等. 保留十二指肠的胰头肿瘤切除术在儿童胰头肿瘤治疗中的应用[J]. 浙江医学, 2019, 41(18): 1989-1991. DOI:10.12056/j.issn.1006-2785.2019.41.18.2019-2700 |
| [23] |
Wang X, Pan L, Zhang P, et al. Enteral nutrition improves clinical outcome and shortens hospital stay after cancer surgery[J]. J Invest Surg, 2010, 23(6): 309-313. DOI:10.3109/08941939.2010.519428 |
 2021, Vol. 36
2021, Vol. 36


