0 引言
在石油和天然气行业,腐蚀相关故障占安全事故总数的25%以上[1-2]。油田环境中的腐蚀问题主要与CO2和H2S等储层盐水中溶解的酸性气体有关[2],CO2和H2S共同作用下造成的腐蚀及点腐蚀仍然是油田生产中遇到的腐蚀相关故障的主要模式,占所有油田腐蚀事件的12%[1],并对生产经济产生重大影响[1-2]。在暴露于CO2、H2S含盐水的石油和天然气管道中可能会遇到点腐蚀故障事件[3-4]。碳钢材料中腐蚀坑的产生与金属表面的夹杂物[5-6]和初始溶解的铁离子[7]相关,但是在CO2和H2S腐蚀环境中,腐蚀坑的引发和生长还将受到环境和物理因素的组合以及腐蚀膜的影响[8]。
影响CO2和H2S腐蚀行为的重要因素除了两者各自分压外,温度和流速也是重要的因素[9-10]。温度升高时,气体(CO2、H2S)在介质中的溶解度降低,抑制腐蚀的发生,同时增强气体分子在介质的运动,从而导致腐蚀速率加快。流速增大会加速离子碰撞,促进反应进行,而较大的流速又会使金属表面切应力增大,破坏腐蚀产物膜,加速腐蚀。因此,探究油气管道中不同温度、流速和CO2/H2S分压作用下对钢管腐蚀行为的影响,对于分析石油管道的腐蚀主因以及制定防腐措施具有指导意义。
1 实验条件和方法实验所用材料为Q235B钢试片,质量分数如下。C:≤0.22%,Si:0.12%~0.30%,Mn:0.03%~0.65%,S:0.045%,P:0.045%。试片外形尺寸为76.0 mm×13.0 mm×1.5 mm。
CO2/H2S分压比、温度和流速变量的腐蚀实验在3L C276磁力驱动反应釜中进行。实验介质采用含Cl-质量浓度9 798 mg/L的NaCl水溶液。在温度为50、60、70、80和90 ℃,流速为1.0、1.5和2.0 m/s,CO2/H2S分压比为15、150、450和550条件下(其中CO2分压为1.4 MPa,H2S分压分别为93.0、9.3.0、3和2.5 kPa),实验周期为10 d。实验前腐蚀介质用高纯氮N2除氧12 h,升温至设定温度,并通入H2S和CO2至所需分压,调节转速至所需流速数值。用失重法测试平均腐蚀速率,并用扫描电子显微镜(SEM)观察腐蚀产物膜表面形貌,用X射线衍射仪(XRD)对腐蚀产物膜的相结构进行定性分析。
2 实验结果及分析 2.1 平均腐蚀速率不同温度、流速和CO2/H2S分压比等多因素共同作用对平均腐蚀速率的影响情况如表 1和图 1所示。
| 流速/(m·s-1) | CO2/H2S分压比 | 腐蚀速率/(mm·a-1) | ||||
| 温度50 ℃ | 温度60 ℃ | 温度70 ℃ | 温度80 ℃ | 温度90 ℃ | ||
| 15 | 0.928 14 | 0.928 17 | 1.062 40 | 0.787 76 | 0.522 82 | |
| 1.0 | 150 | 1.564 10 | 1.564 10 | 1.784 00 | 0.860 89 | 0.750 72 |
| 450 | 1.006 90 | 1.134 00 | 1.471 80 | 0.837 66 | 0.612 59 | |
| 550 | 0.504 05 | 1.353 60 | 1.596 20 | 1.514 50 | 0.756 40 | |
| 15 | 1.056 60 | 1.490 30 | 1.632 90 | 1.050 60 | 0.973 57 | |
| 1.5 | 150 | 1.066 10 | 1.312 60 | 1.616 60 | 1.171 00 | 0.906 24 |
| 450 | 0.306 14 | 1.033 80 | 1.240 60 | 0.676 93 | 0.676 93 | |
| 550 | 0.244 78 | 1.207 30 | 1.221 70 | 0.911 25 | 0.911 25 | |
| 15 | 1.206 30 | 1.633 30 | 1.709 30 | 1.058 40 | 1.058 40 | |
| 2.0 | 150 | 0.473 46 | 0.871 05 | 1.698 70 | 1.156 20 | 1.156 20 |
| 450 | 0.478 83 | 1.258 10 | 1.928 10 | 1.427 40 | 1.427 40 | |
| 550 | 0.301 12 | 0.416 47 | 1.637 90 | 1.102 00 | 1.102 00 | |
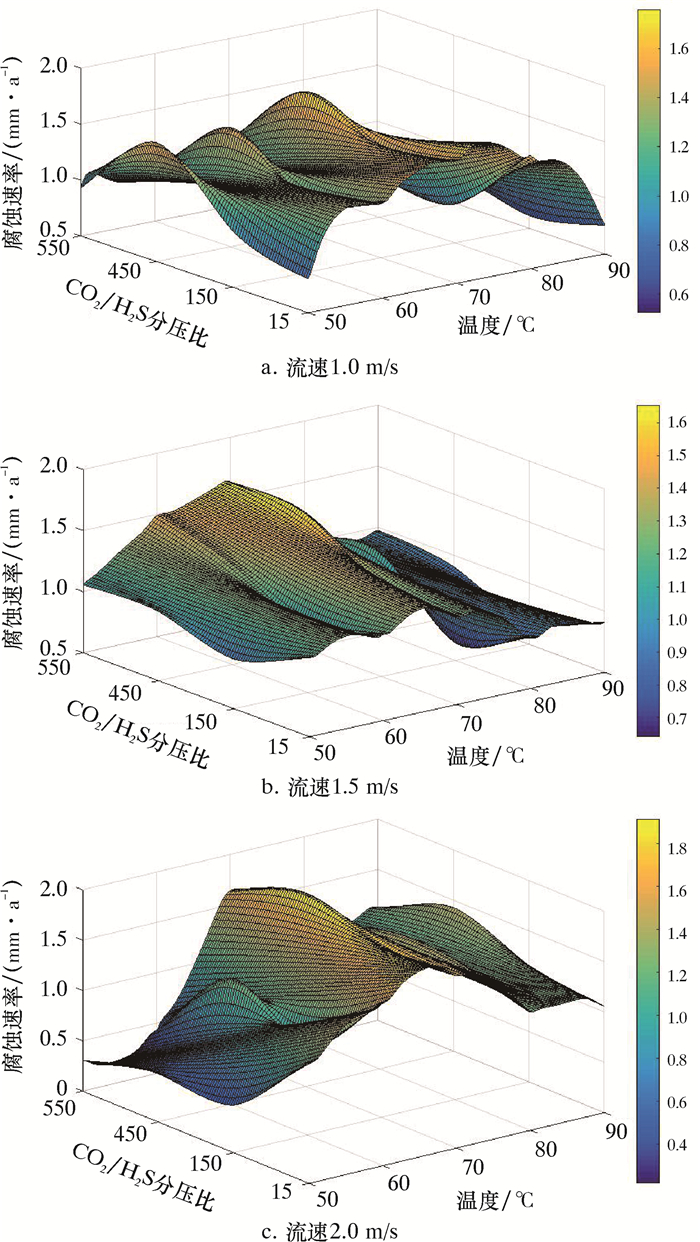
|
| 图 1 不同温度、流速、CO2/H2S分压比下的腐蚀速率 Fig.1 Corrosion rates at different temperatures, flow rates, and CO2/H2S partial pressure ratios |
2.1.1 温度
温度可以提高化学反应活化能,加剧分子碰撞,使腐蚀速率增加,流速和CO2/H2S分压比在改变过程中都受温度的直接影响。当温度为50~60 ℃时,试样表面有一层较薄的腐蚀产物膜,此时的腐蚀速率相对较低。温度在70~80 ℃之间时,金属表面产生较厚的黑色膜层,且腐蚀产物膜层有龟裂现象,并且在流速的冲刷下分布不均,构成良好的腐蚀环境,加速腐蚀,清洗后金属表面腐蚀严重。当温度为90 ℃时,腐蚀产物膜变厚,此时腐蚀产物膜具有一定的保护作用而使腐蚀速率降低。由此可见温度在70~80 ℃之间,腐蚀速率达到最大值,并且温度的升高会使CO2/H2S分压条件下的腐蚀产物膜逐渐变厚。
2.1.2 CO2/H2S分压比CO2/H2S分压比增大的过程中,腐蚀速率逐渐增大。由此可见,在实验室范围内,H2S的存在能够一定程度上抑制Q235B钢的腐蚀,并且CO2/H2S分压比大于150时,受温度与流速影响较大,当其分压比小于150时,受温度与流速影响较小。
2.1.3 流速流速增加会加速分子内离子碰撞,促进腐蚀反应正向进行,流速的增加也会改变金属表面腐蚀产物膜,通过其增大的切应力破坏腐蚀产物膜,使金属腐蚀加剧。当流速为1.5 m/s时,随着CO2/H2S分压比增大会显著增加其腐蚀速率,并达到最大值。同时,流速在增加过程中,会对50~60 ℃温度范围内,CO2/H2S分压下的腐蚀影响较为明显;当分压比低于150时,腐蚀速率随流速增加而增大;当分压比高于150时,腐蚀速率随流速增加而降低。
2.2 腐蚀膜微观形貌和成分分析S.SRINIVASAN等[11-13]研究指出,CO2、H2S共存时的腐蚀机理具有竞争与协同效应。由静态腐蚀试验可知,当油田回注水温度为70 ℃,流速为1.5 m/s时,对CO2、H2S腐蚀影响最为显著,探究此条件下,不同CO2/H2S分压比的腐蚀微观形貌,如果如图 2所示。

|
| 图 2 Q235B钢腐蚀产物膜表面SEM像 Fig.2 SEM morphology of the surface of Q235B steel corrosion product film |
由图 2可以看出:当CO2/H2S分压比为15时,腐蚀产物膜分层,内部主要为柱状结晶体,为铁的硫化物,吸附在金属表面,对金属表面起到保护作用。因此,在H2S含量较高时,腐蚀速率有所下降,外层为颗粒状结晶,疏松且不均匀,此时腐蚀主要以H2S控制为主。当CO2/H2S分压比为150时,腐蚀产物膜表面疏松且不均匀,为不同形态晶体混杂而成,可以观察到腐蚀产物膜有鼓起破损的现象,不易形成稳定的保护膜,因此腐蚀速率有所增加,受H2S和CO2混合控制。当CO2/H2S分压比为450时,主要为颗粒状晶体,结构较为疏松,龟裂的腐蚀产物膜极易将晶体暴露在腐蚀环境中。因此,对金属的保护作用较差,腐蚀较为严重。当CO2/H2S分压比为550时,主要为片状腐蚀产物膜,可以紧紧地吸附在金属表面形成致密的保护膜,在一定程度上起到保护作用,主要由CO2控制。
当温度为70 ℃、流速为1.5 m/s时,不同CO2/H2S分压比下的腐蚀产物XRD分析结果如图 3所示。
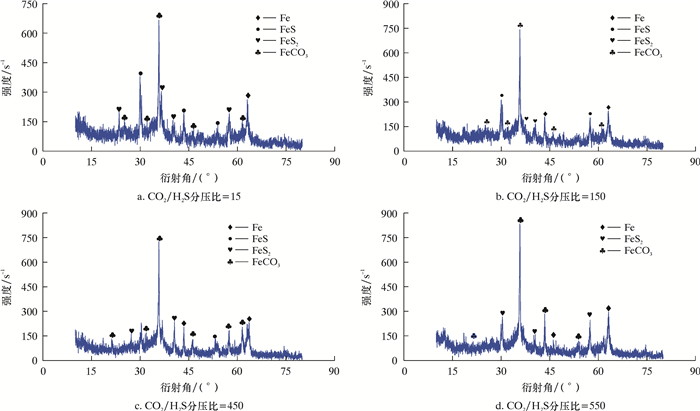
|
| 图 3 Q235B钢腐蚀产物膜表面XRD谱 Fig.3 XRD spectrum of the surface of Q235B steel corrosion product film |
由图 3a和图 3b可知,当H2S含量较高时,腐蚀产物主要由FexSy组成,并检测到含有少量FeCO3。在实验过程中,腐蚀挂片Q235B在H2S含量较高时会迅速生成一层黑色产物覆盖在金属表面,结合图 3可知,其主要为FeS和FeS2,对金属起到保护作用。因此,H2S的存在能够一定程度上抑制Q235B钢的腐蚀。结合图 1可知,随着温度的升高,会加速金属表面形成致密的保护膜,起到保护作用,但随着流速增大,金属表面的切应力也增大,从而破坏金属表面的腐蚀产物膜,加剧腐蚀,因此流速1.5 m/s、温度为70 ℃时,腐蚀速率较大。由图 3可知,随着CO2/H2S分压比增大,铁的硫化物含量逐渐降低,FeCO3含量逐渐增大,腐蚀反应过程由H2S控制逐渐转为CO2控制。而FeCO3具有负的溶度系数,温度在50~70 ℃时,为非稳定态,随着流速增加,腐蚀加剧。当温度在80~90 ℃时,过渡到稳定态,可以形成致密的保护膜,起到保护作用,所以腐蚀速率降低。
2.3 CO2/H2S分压下的腐蚀危害CO2/H2S分压下Q235B金属腐蚀形貌如图 4所示。由图 4可知,随着CO2/H2S分压比增大,点蚀孔径、孔深逐渐减小,说明在H2S含量高的CO2/H2S分压体系中,点蚀严重。当H2S含量较高时,在不同流速下,形成的FeS分布不均,而FeS的不均匀分布可能是诱导微电池作为该阶段在钢表面点腐蚀的驱动力。特别是一旦形成FeS,FeS的电子导电性质也被认为能够支持在凹坑和微凹坑出现之前的电化学过程[14],这使得FeS层可以支持阴极反应。从本研究中记录的腐蚀产物鉴定和点蚀形貌的结果可以看出,FeS形成对于点腐蚀的演化很重要,而H2S腐蚀环境中CO2的存在促进均匀腐蚀,协同促进FeS形成。CO2、H2S腐蚀系统中,在Fe溶解过程中产生的大多数亚铁离子由CO2腐蚀和温度驱动,由此被消耗以形成不同形式的FeS,从而在图 3a中可以看到,H2S含量高时,FeCO3含量很少。将温度从50 ℃提高到70 ℃时腐蚀加重。这是由于温度升高对FeS形成的动力学有明显的影响。而温度在80~90 ℃时,生成的FeCO3较稳定,主要为均匀腐蚀,点蚀降低。
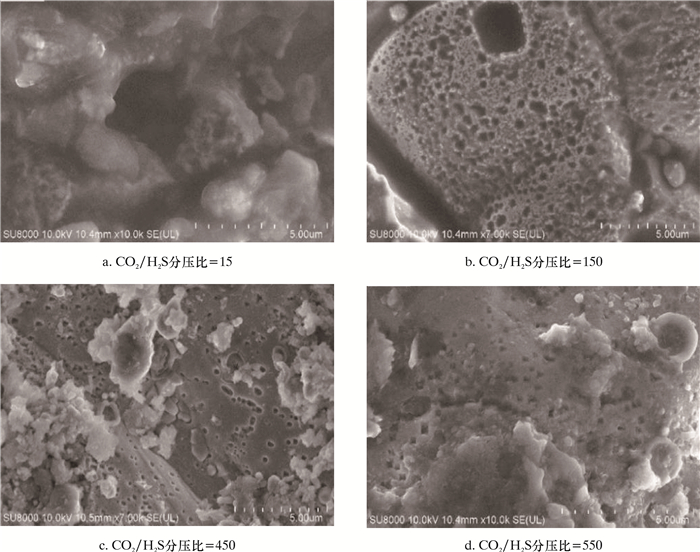
|
| 图 4 Q235B钢腐蚀形貌 Fig.4 Q235B steel corrosion morphology |
3 结论
(1) CO2、H2S混合情况下,温度为70 ℃,流速为1.5 m/s时,腐蚀动力学过程十分剧烈。在CO2占比增大的过程中,腐蚀速率逐渐增大, 由此可见,在实验室范围内,H2S能够在一定程度上抑制Q235B钢的腐蚀。在低含H2S的腐蚀环境中,腐蚀为CO2主导,当温度升高时,腐蚀速率减小。流速在增加的过程中,会对50~60 ℃范围内,CO2/H2S分压下的腐蚀影响较为明显:分压比低于150时,腐蚀速率随流速增加而增大;分压比高于150时,腐蚀速率随流速增加而降低。
(2) 含H2S的环境中点腐蚀受到FeS腐蚀产物和温度的影响。H2S的存在能够增加点蚀的程度,通过形成FeS腐蚀产物层而吸附在钢表面。在CO2和H2S共同影响下,凹坑的起始速率最高,CO2能够协同促进,在同一时间内提供更多的实质性FeS膜。在点腐蚀演化过程中,CO2和H2S的协同作用在70 ℃时最为显著,同时流速在增大的过程中,会使FeS分布不均,而FeS的不均匀分布会诱导微电池作为该阶段在钢表面点腐蚀的驱动力,加剧腐蚀。
| [1] |
PESSU F, BARKER R, NEVILLE A. Pitting and uniform corrosion of X65 carbon steel in sour corrosion environments:the influence of CO2, H2S and temperature[J]. Corrosion, 2017, 79(9): 1168-1183. |
| [2] |
KERMANI M B, MORSHED A B. Carbon dioxide corrosion in oil and gas production:a compendium[J]. Corrosion, 2003, 59(8): 659-683. DOI:10.5006/1.3277596 |
| [3] |
HERNANDEZ-ESPEJEL A, DOMINGUEZ-CRESPO M A, CABRERA-SIERRA R, et al. Investigation of corrosion films formed on APL-X52 pipeline steel in acid sour media[J]. Corrosion Science, 2010, 52(7): 2258-2267. DOI:10.1016/j.corsci.2010.04.003 |
| [4] |
PAPAVINASAM S, DOIRON A, REVIE R W. Model to predict internal pitting corrosion of oil and gas pipelines[J]. Corrosion Science, 2007, 66(3): 173-230. |
| [5] |
ZAFAR M N, RIHAN R, AL-HADHRAMI L. Evaluation of the Corrosion Resistance of SA-543 and X65 Steels in Emulsions Containing H2S and CO2 Using a Novel Emulsion Flow Loop[J]. Corrosion Science, 2015, 94(6): 275-287. |
| [6] |
ZHAO J, DUAN H, JIANG R. Synergistic corrosion inhibition effect of quinoline quaternary ammonium salt and gemini surfactant in H2S and CO2 saturated brine solution[J]. Corrosion Science, 2015, 91(5): 108-119. |
| [7] |
HUI-BIN W U, LIU L F, WANG L D, et al. Influence of chromium on mechanical properties and CO2/H2S corrosion behavior of P110 grade tube steel[J]. Desalination, 2011, 21(1): 340-347. |
| [8] |
PESSU F, BARKER R, NEVILLE A. Understanding pitting corrosion behavior of X65 carbon steel in CO2-saturated environments:the temperature effect[J]. Corrosion, 2016, 72(1): 78-79. |
| [9] |
ABAYARATHNA D, WANG S, NARAGHI A. The effect of surface films on corrosion of carbon steel in a CO2-H2S-H2O system[J]. Corrosion, 2005, 32(9): 387-404. |
| [10] |
LI Y, VAN SANTEN R A, WEBER T. High-temperature FeS-FeS2 Solid-state transitions:reactions of solid mackinawite with gaseous H2S[J]. Journal of Solid State Chemistry, 2008, 181(11): 3151-3162. DOI:10.1016/j.jssc.2008.08.024 |
| [11] |
SRINIVASAN S, KANA R D. Experimental simulation of multiphase CO2/H2S systems[C]//Corrosion/1999, Houston: NACE, 1999: 14.
|
| [12] |
EWING S P. Electrochemical studies of the hydrogen sulfide corrosion mechanism[J]. Corrosion, 2009, 6(11): 497-501. |
| [13] |
MURATA T, MATSUHASHI R, TANIGUCHI T, et al. The evaluation of H2S containing environments from the viewpoint of OCTG and linepipe for sour gas application[C]//Offshore Technology Conference/1979, Houston: NACE, 1979: 3507.
|
| [14] |
PEARCE C L, PATTRICK R A D, VAUGHAN D J. Electrical and magnetic properties of sulfides[J]. Reviews in Mineralogy and Geochemistry, 2006, 61(18): 127-180. |


