2. 宁夏盐池毛乌素沙地生态系统国家定位观测研究站, 751500, 宁夏盐池;
3. 林木资源高效生产全国重点实验室, 100083, 北京;
4. 电力规划总院有限公司, 100120, 北京;
5. 中国电力工程顾问集团有限公司, 100120, 北京
中国水土保持科学  2024, Vol. 22 2024, Vol. 22  Issue (6): 70-76. DOI: 10.16843/j.sswc.2022073 Issue (6): 70-76. DOI: 10.16843/j.sswc.2022073 |
枯草芽孢杆菌(Bacillus subtilis)是一种新型微生物治沙材料,具有增强风沙土抗蚀性,改良风沙土质量的重要作用,在防沙治沙领域具有较高的应用潜力和应用价值[1]。在增强风沙土抗蚀性方面,枯草芽孢杆菌可通过生命活动大量分泌胞外多糖有效胶结松散风沙土颗粒,增加风沙土团聚体含量,进而增强风沙土抗蚀性[2];同时,枯草芽孢杆菌还能够诱导碳酸钙沉淀,通过碳酸钙晶体胶结风沙土颗粒,增大风沙土团聚体稳定性,进而提高风沙土抗蚀能力[3]。在改良风沙土质量方面,枯草芽孢杆菌分泌的有机物质和菌体死亡分解产生的有机酸可以增加风沙土有机质含量,增强风沙土酶活性,降低风沙土容重和风沙土盐分含量,进而改善风沙土质量[4]。
枯草芽孢杆菌还是一种广泛存在于陆地生态系统的根际促生细菌[5],对于植物生长和病虫害防治具有重要作用。在促进植物生长方面,枯草芽孢杆菌可以诱导促生菌在植物根部定殖,并抑制致病菌的生长繁殖,进而促进植物的生长[6]。同时,枯草芽孢杆菌还能产生芽孢类脂肽,促进寄主植物自身的定殖,进一步提高植物的生长能力[7]。在病虫害防治方面,枯草芽孢杆菌可生成细菌素等拮抗物质,诱导寄主产生抗性防御反应,进而提高植物抗性[8]。枯草芽孢杆菌还可以通过非核糖体合成途径产生的表面活性素(surfactin)、伊枯草菌素(iturin)和丰原素(fengycin)3种抑菌肽抵御部分病原菌,并刺激生物膜的生成,从而减少病虫害的发生[9]。
近年来,国内外学者[2-4]利用枯草芽孢杆菌由最初固定松散沙土到改良沙土、提高沙土生产力,在防沙治沙工作中已取得阶段性成果。但是,作为一种根际促生菌,枯草芽孢杆菌对于沙生植物定殖和生长的影响并未得到充分关注和重视,相关研究仍然较为薄弱。沙冬青(Ammopiptanthu mongolicus)和柠条(Caragana korshinskii)是我国北方风沙区常见沙生植物。柠条具有较强适应性和抗逆性,有利于流动沙丘固定和草地生态系统恢复[10];沙冬青是亚洲中部荒漠地区分布的唯一的常绿阔叶灌木,是国家二级保护植物,也是集固沙、绿化和蒙医药用为一体的重要资源植物[11]。鉴于此,笔者以沙冬青和柠条为研究对象,开展室内控制试验,以期研究揭示枯草芽孢杆菌对沙生植物种子萌发和幼苗生长生理特征的影响,并为丰富和完善枯草芽孢杆菌防沙治沙技术提供理论参考。
1 材料与方法 1.1 试验材料2020年9月,在陕西省榆林市毛乌素沙地采集沙冬青和柠条种子,采收后置于室内黑暗干燥处,风干备用。2021年4—5月,在北京林业大学林业生态工程教育部工程研究中心开展室内控制试验。枯草芽孢杆菌菌剂购自国家微生物肥料技术研究推广中心,活菌数约为5亿cfu/g,以木屑、矿物质(硅藻页岩)为吸附剂,木屑(含菌株)与矿物质的质量比为1 ∶1。试验用土为风沙土,土壤过2 mm细筛去除枝叶、根系等杂质后,在高压灭菌锅中121 ℃灭菌30 min备用。试验栽培所需塑料花盆采用长、宽、高分别为14.90、9.50和5.50 cm的无菌透明方形塑料盒,底部均设5个排水孔,用灭菌纱布垫于容器底部,防止沙土渗漏。
1.2 试验方法 1.2.1 种子催芽及幼苗培养选择籽粒饱满,大小均匀无病害的沙冬青和柠条种子,清杂处理后用流水冲洗。将分拣过的沙冬青种子用体积分数为0.3%的高锰酸钾水溶液表面消毒5 min,柠条种子用0.5%的次氯酸钠水溶液消毒30 min。消毒结束后,用无菌湿纱布包裹后置于25 ℃恒温箱内遮光催芽,待种子露白时即可进行播种。
试验共设置6个微生物菌剂施用水平,枯草芽孢杆菌菌剂施用量(菌剂与土壤质量比)分别为0、1、3、5、7和10 g/kg,其中不施用菌剂的空白处理为对照组。
每盆内装0.40 kg(按干质量计)灭菌土壤,按菌剂施用量将菌剂与灭菌土均匀混合后,分别将25和20粒萌发的柠条和沙冬青种子均匀的播种在土壤表面后,表层覆土0.10 kg,并喷洒少量的无菌蒸馏水,在25.10 ℃和101 kP下培养1个月。完成上述步骤后进行称量记录,每24 h补充一次无菌蒸馏水,以确保每个试验盒的初始质量保持不变。为保证后期幼苗生长和生理指标具有足够样本,每个处理组各有3盆。
1.2.2 测定指标与方法参照GB3543—1995J测定计算萌芽特性指标为种子发芽率和发芽势。即发芽率为第10天发芽种子数/供试种子数×100%;发芽势为第5天发芽种子数/供试种子数×100%。在发芽结束后(5 d内发芽数不增加作为发芽结束的标准),每个处理中各随机挑选10株幼苗,分别测定其株高和冠幅,将幼苗南北和东西方向宽度的平均值作为冠幅。叶绿素含量采用分光光度法;脯氨酸含量采用酸性茚三酮比色法;丙二醛含量采用硫代巴比妥酸显色法[12]。
1.3 数据处理与分析利用SPSS 25.0软件对试验数据进行处理,所有数据均采用均值±标准差表示。对幼苗在不同菌剂施用量下的种子萌芽生长指标和生理生化指标分别进行One-way ANOVA分析和LSD检验(P < 0.05)。
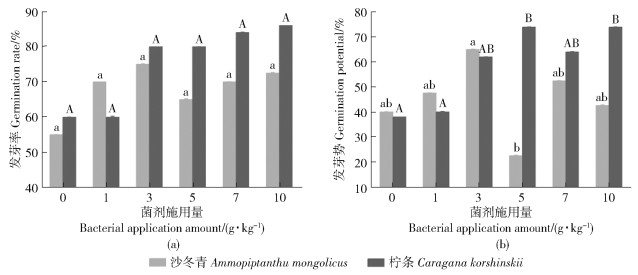
2 结果与分析 2.1 沙冬青和柠条种子萌发和幼苗生长特征枯草芽孢杆菌对沙冬青和柠条的发芽率无显著影响(P>0.05),二者分别在3和10 g/kg处理组发芽率达到最高,为75.00%±0.14%和86.00%±0.03%,且各处理组均与对照组无显著差异(P>0.05)(图 1a)。添加枯草芽孢杆菌对沙冬青发芽势无显著影响(P>0.05),随菌剂施用量增加,沙冬青和柠条种子发芽势呈先增加后下降趋势(图 1b)。沙冬青处理组发芽势均与对照组无差异(P> 0.05),在3 g/kg处理组发芽势达到最高为65.00%± 0.14%,5 g/kg处理组最低为22.50%±0.18%。添加5和10 g/kg枯草芽孢杆菌能显著增加柠条发芽势(P < 0.05),均达到最高,分别为74.00%±0.08%和74.00%±0.14%,对照组发芽势最低,为38.00%± 0.03%。
|
不同小、大写字母表示不同菌剂施用量种子发芽指标存在显著差异(P < 0.05),下同。 Different lowercase and capital letters indicated the significant differences in germination indexes with different dosage of bacteria agent (P < 0.05), the same below. 图 1 不同菌剂施用量对种子萌发的影响 Fig. 1 Effect of different bacterial application amount on seed germination |
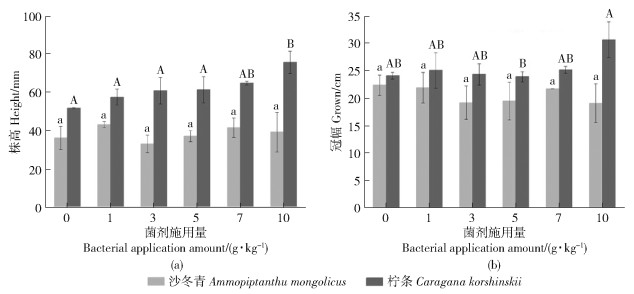
枯草芽孢杆菌对沙冬青株高无显著影响(P> 0.05),沙冬青在1 g/kg处理组株高最高(43.22 mm± 4.13 mm),然而在3 g/kg处理组株高仅为33.09 mm±6.98 mm,低于对照组(图 2a)。添加10 g/kg枯草芽孢杆菌能显著增加柠条幼苗的株高(P < 0.05),且株高达到最大值(75.82 mm±10.37 mm)。枯草芽孢杆菌对沙冬青和柠条幼苗的冠幅无显著影响(P>0.05),随菌剂施用量增加,柠条冠幅无明显变化,沙冬青冠幅呈下降趋势(图 2b)。10 g/kg处理组柠条冠幅达到最大(30.83 mm),而沙冬青对照组冠幅最大(22.51 mm),随着菌剂施用量增加冠幅逐渐下降。
|
图 2 不同菌剂施用量对幼苗株高冠幅的影响 Fig. 2 Effect of different bacterial application amount on seedling height and crown width |
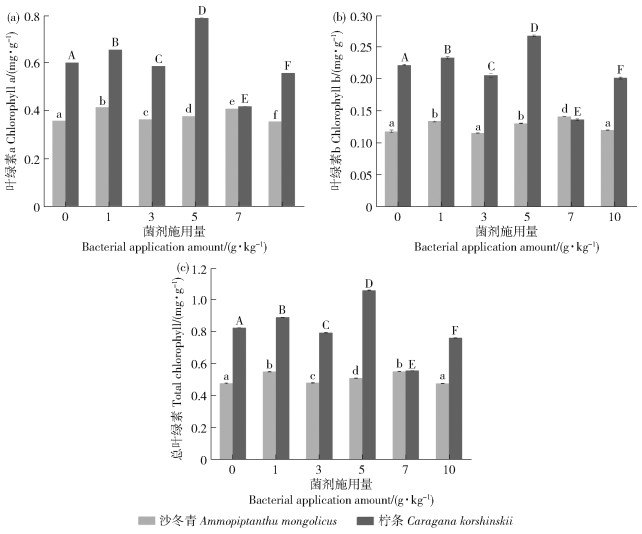
枯草芽孢杆菌显著影响沙冬青和柠条幼苗叶绿素含量(P < 0.05)。随菌剂施用量增加,叶绿素含量均呈增加趋势,但3 g/kg处理组对2种植物的总叶绿素、叶绿素a和叶绿素b含量均有抑制作用(图 3)。随着菌剂施用量增加,沙冬青幼苗叶绿素含量出现显著变化(P < 0.05),且总叶绿素和叶绿素b含量均在7 g/kg处理组达到最高。随着菌剂施用量增加,柠条幼苗叶绿素含量出现明显变化且各处理组叶绿素含量之间存在显著差异(P < 0.05),总叶绿素、叶绿素a和叶绿素b含量均在5 g/kg处理组达到最高在7 g/kg处理组达到最低。
|
图 3 不同菌剂施用量对幼苗叶绿素含量的影响 Fig. 3 Effect of different bacterial application amount on chlorophyll content of seedlings |
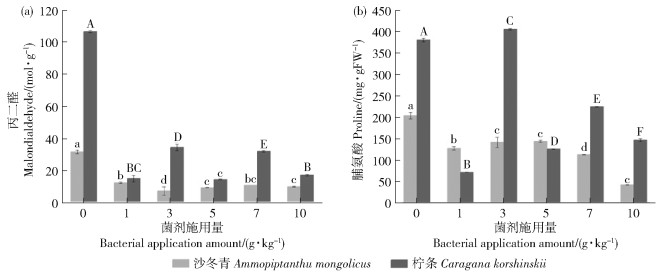
枯草芽孢杆菌能显著影响沙冬青和柠条幼苗丙二醛和脯氨酸含量(P < 0.05)。随菌剂施用量增加,沙冬青幼苗丙二醛和脯氨酸含量均呈下降趋势且均显著低于对照组(P < 0.05)。由图 4可见,沙冬青幼苗在3 g/kg处理组丙二醛含量达到最低,10 g/kg处理组脯氨酸含量达到最低。随菌剂施用量增加,柠条幼苗丙二醛和脯氨酸均呈显著下降趋势(P < 0.05)。除3 g/kg处理组的脯氨酸含量高于对照外,其余处理组二者含量均显著低于对照组(P < 0.05),且均在1 g/kg处理组最低。
|
图 4 不同菌剂施用量对幼苗丙二醛和脯氨酸含量的影响 Fig. 4 Effect of different bacterial application amount on malondialdehyde and proline contents in seedlings |
枯草芽孢杆菌对沙冬青和柠条种子萌发有促进作用。首先,枯草芽孢杆菌能产生影响种子萌发的α-淀粉酶,从而使淀粉水解成可溶性糖的速度加快,随后促进胚的吸收,以支持胚根的生长和突起,促进种子萌发[13]。其次,枯草芽孢杆菌还能使赤霉素(gibberellic acid,GA3)含量增加,脱落酸(abscisic acid,ABA)和乙烯等含量减少,而脱落酸和赤霉素通过调控α-淀粉酶基因的转录和拮抗效应调控种子萌发,从而对种子萌发有积极影响[14]。最后,枯草芽孢杆菌还可诱导生成吲哚乙酸(indole-3-acetic acid,IAA)和细胞分裂素(cytokinin,CTK)等生长激素,提高种子抗性,促进种子萌发[15]。
枯草芽孢杆菌仅对柠条幼苗株高的生长有一定促进作用,而对沙冬青幼苗株高冠幅以及柠条冠幅生长无明显作用(P>0.05)。柠条幼苗株高随菌剂施用量增大而增大,幼苗冠幅随菌剂施用量增大先增大后减小。这与前人研究[16]枯草芽孢杆菌对黑杨(Populus nigra)生长的影响结果一致。一方面枯草芽孢杆菌能产生如沙丁胺醇(albuterol)和1, 3丙二醇(1, 3-propanediole)等挥发性化合物激发生长素活性,促进植株的生长[14];另一方面能通过抑制乙烯生物合成基因ACO1的表达和分泌亚精胺(spermidine)诱导植物扩张素(expansin)的产生来降低乙烯含量,进而促进植株生长[17]。而本研究可能是由于试验时间较短,枯草芽孢杆菌对植物促生作用需要调控激素、基因表达等时间响应,因而在试验中仅在10 g/kg处理组观察到枯草芽孢杆菌对柠条幼苗株高生长有明显影响(P < 0.05)。
3.2 枯草芽孢杆菌对沙冬青和柠条生理生化特征的影响枯草芽孢杆菌对叶片叶绿素生成有一定的促进作用,能增加沙冬青和柠条叶片中叶绿素含量。枯草芽孢杆菌可促进生成吲哚乙酸并使叶片苯丙氨酸解氨酶和过氧化物酶的含量增加[18],进而促进叶绿素合成。另外,枯草芽孢杆菌具有溶磷功能,可提高植株抗贫瘠和吸收土壤养分的能力。但沙冬青和柠条幼苗均在5 g/kg处理组之后出现叶绿素含量随着菌剂施用量增加而减小现象,有可能是因为菌剂施用量过高,使幼苗光合作用受到抑制从而使叶绿素含量下降[19]。
枯草芽孢杆菌对提高植物抗逆性有促进作用,能使沙冬青和柠条幼苗叶片丙二醛和脯氨酸含量显著降低(P < 0.05)。水分对脯氨酸含量有重要影响,干旱胁迫能导致脯氨酸和丙二醛含量增加[20]。枯草芽孢杆菌能提高叶片组织的水分储存能力进而避免干旱胁迫,减少脯氨酸和丙二醛的生成。枯草芽孢杆菌还能促进过氧化物酶、超氧化物歧化酶和多酚氧化酶等相关防御酶含量提高,提高植物氧化应激能力、减少逆境对植株造成的伤害,从而诱导降低丙二醛和脯氨酸生成[21]。此外,脯氨酸对植物生长有抑制作用[22],枯草芽孢杆菌能够降低脯氨酸含量,进而缓解脯氨酸对植物生长的抑制作用。
4 结论枯草芽孢杆菌对沙冬青和柠条种子萌发无显著影响,仅在10 g/kg处理组对柠条株高生长有显著促进作用。枯草芽孢杆菌对沙冬青和柠条幼苗生理生化特性有显著影响,可以增加叶绿素含量,降低丙二醛和脯氨酸含量,有利于增强植物抗逆性。枯草芽孢杆菌通过植株生理生化过程影响植株生长,但植物生长的响应存在滞后性。此外,枯草芽孢杆菌对沙冬青的影响弱于柠条。此研究结果可为丰富和完善枯草芽孢杆菌人工培育生物土壤结皮及防沙治沙技术研发提供理论参考。
| [1] |
居炎飞, 邱明喜, 朱纪康, 等. 我国固沙材料研究进展与应用前景[J]. 干旱区资源与环境, 2019, 33(10): 138. JU Yanfei, QIU Mingxi, ZHU Jikang, et al. Research progress and application prospect of sand-fixing materials in China[J]. Journal of Arid Land Resources and Environment, 2019, 33(10): 138. |
| [2] |
杜宇佳, 高广磊, 陈丽华, 等. 土壤微生物膜对风沙土固沙保水特性的影响[J]. 农业工程学报, 2020, 36(17): 98. DU Yujia, GAO Guanglei, CHEN Lihua, et al. Effects of soil microbial membrane on sand fixation and water retention of aeolian soil[J]. Transactions of the CSAE, 2020, 36(17): 98. |
| [3] |
HSU C M, HUANG Y H, NIMJE V R, et al. Comparative study on the sand bioconsolidation through calcium carbonate precipitation by Sporosarcina pasteurii and Bacillus subtilis[J]. Crystals, 2018, 8(5): 189. DOI:10.3390/cryst8050189 |
| [4] |
刘帅, 赵西宁, 李钊, 等. 不同改良剂对旱地苹果园壤土团聚体和水分的影响[J]. 水土保持学报, 2021, 35(2): 193. LIU Shuai, ZHAO Xining, LI Zhao, et al. Effects of different modifiers on soil aggregate and water content in dryland apple orchards[J]. Journal of Soil and Water Conservation, 2021, 35(2): 193. |
| [5] |
PARK S A, BHATIA S K, PARK H A, et al. Bacillus subtilis: As a robust host for biochemical production utilizing biomass[J]. Critical Reviews in Biotechnology, 2021, 41(6): 827. DOI:10.1080/07388551.2021.1888069 |
| [6] |
XU Weifang, REN Huishuang, OU Ting, et al. Genomic and functional characterization of the endophytic Bacillus subtilis 7PJ-16 strain, a potential biocontrol agent of mulberry fruit sclerotiniose[J]. Microbial Ecology, 2018, 77(3): 651. |
| [7] |
ONGENA M, JACQUES P. Bacillus lipopeptides: Versatile weapons for plant disease biocontrol[J]. Trends in Microbiology, 2007, 16(3): 115. |
| [8] |
ZHANG Huihui, LIU Yunpeng, WU Gengwei, et al. Bacillus velezensis tolerance to the induced oxidative stress in root colonization contributed by the two-component regulatory system sensor ResE[J]. Plant Cell and Environment, 2021, 44(9): 3094. DOI:10.1111/pce.14068 |
| [9] |
PENHAR O, VANDENBERGHE L P S, FAULDS C, et al. Bacillus lipopeptides as powerful pest control agents for a more sustainable and healthy agriculture: Recent studies and innovations[J]. Planta, 2020, 251(3): 70. DOI:10.1007/s00425-020-03357-7 |
| [10] |
曹成有, 蒋德明, 阿拉木萨, 等. 小叶锦鸡儿人工固沙区植被恢复生态过程的研究[J]. 应用生态学报, 2000, 11(3): 349. CAO Chengyou, JIANG Deming, ALA Musa, et al. Ecological process of vegetation restoration in artificial sand fixation area of Caragana korshinskii[J]. Chinese Journal of Applied Ecology, 2000, 11(3): 349. DOI:10.3321/j.issn:1001-9332.2000.03.007 |
| [11] |
刘果厚. 阿拉善荒漠特有植物沙冬青濒危原因的研究[J]. 植物研究, 1998, 18(3): 341. LIU Guohou. Study on the endangered causes of Ilex mongolica endemic to Alxa desert[J]. Plant research, 1998, 18(3): 341. |
| [12] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2003: 134. LI Hesheng. Principles and techniques of plant physiological and biochemical experiments[M]. Beijing: Higher Education Press, 2003: 134. |
| [13] |
NEVHULAUDZI T, NTUSHELO K, KANU S A, et al. Effect of Bacillus subtilis and elevated temperature on seed germination indices of three cowpea genotypes[J]. South African Journal of Botany, 2018, 115: 302. |
| [14] |
VANSTRAELEN M, BENKOVA E. Hormonal interactions in the regulation of plant development[J]. Annual Review of Cell and Developmental Biology, 2012, 28: 463. |
| [15] |
刘鲁峰, 狄义宁, 何丽莲, 等. 内生枯草芽孢杆菌B9促生长效果及产生吲哚乙酸(IAA)能力研究[J]. 云南农业大学学报(自然科学), 2020, 35(2): 227. LIU Lufeng, DI Yining, HE Lilian, et al. Study on growth promoting effect of endophytic Bacillus subtilis B9 and its ability to produce indoleacetic acid (IAA)[J]. Journal of Yunnan Agricultural University (Natural Sciences), 2020, 35(2): 227. |
| [16] |
JANG J H, KIM S H, KHZINE I, et al. Physiological changes and growth promotion induced in poplar seedlings by the plant growth-promoting rhizobacteria Bacillus subtilis JS[J]. Photosynthetica, 2018, 56(4): 1188. |
| [17] |
XIE Shanshan, WU Huijun, ZANG Haoyu, et al. Plant growth promotion by spermidine-producing Bacillus subtilis OKB105[J]. Molecular Plant-Microbe Interactions, 2014, 27(7): 655. |
| [18] |
JAVARAJ J, YI H, LIANG G H, et al. Foliar application of Bacillus subtilis AUBS1 reduces sheath blight and triggers defense mechanisms in rice[J]. Journal of Plant Disease and Protection, 2004, 111(2): 115. |
| [19] |
裴斌, 张光灿, 张淑勇, 等. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报, 2013, 33(5): 1386. PEI Bin, ZHANG Guangcan, ZHANG Shuyong, et al. Effects of soil drought stress on photosynthesis and antioxidant enzyme activities in seabuckthorn leaves[J]. Acta Ecologica Sinica, 2013, 33(5): 1386. |
| [20] |
王竞红, 张秀梅, 陈艾, 等. 紫穗槐幼苗根系生理特性和解剖结构对PE G- 6000模拟干旱的响应[J]. 生态学报, 2018, 38(2): 511. WANG Jinghong, ZHANG Xiumei, CHEN Ai, et al. Responses of root physiological characteristics and anatomical structure of Robinia fruticosa seedlings to PE G- 6000 simulated drought[J]. Acta Ecologica Sinica, 2018, 38(2): 511. |
| [21] |
CHOWDAPPA P, KUMAR S P M, LAKSHMI M J, et al. Growth stimulation and induction of systemic resistance in tomato against early and late blight by Bacillus subtilis OTPB1 or Trichoderma harzianum OTPB3[J]. Biological Control, 2013, 65(1): 109. |
| [22] |
王翠平, 严莉, 乔改霞, 等. 脯氨酸通过活性氧信号抑制植物生长[J]. 植物生理学报, 2017, 53(9): 1788. WANG Cuiping, YAN Li, QIAO Gaixia, et al. Proline inhibits plant growth through reactive oxygen species signaling[J]. Plant Physiology Journal, 2017, 53(9): 1788. |