2. 内蒙古农业大学沙漠治理学院,010018,呼和浩特
-
项目名称
- 鄂尔多斯市科技重大专项项目“露采矿排土场高效植被建设关键技术研究与示范”2022EEDSKJZDZX012);内蒙古农业大学高层次/优秀博士引进人才科研启动项目“文冠果AM真菌多样性及其优势种对植株生长的影响”(NDYB2021-9)
-
第一作者简介
- 张月欣(1997—),女,硕士研究生。主要研究方向:水土保持与荒漠化防治。E-mail:1668681793@.qq.com
-
通信作者简介
- 麻云霞(1991—),女,博士,教授。主要研究方向:沙区植物资源保护与利用。E-mail:1572666975@qq.com
-
文章历史
-
收稿日期:2022-05-03
修回日期:2023-01-27
2. 内蒙古农业大学沙漠治理学院,010018,呼和浩特
2. College of Desert Control, Inner Mongolia Agricultural University, 010018, Hohhot, China
榆树(Ulmus pumila),又名春榆、白榆等,为榆科落叶乔木。榆树为阳性树种,其根系发达、生长迅速、耐干旱、耐贫瘠,对土壤条件的适应能力强。在保护环境、涵养水源、防风固沙、防治沙漠化等方面发挥着重要的作用,是干旱半干旱沙区造林的理想树种[1]。但近几十年来,由于全球气候变化、高强的砍伐、过度放牧等,导致榆树林生态系统严重退化[2]。
在外界环境胁迫的条件下,植物能够产生适应性的自我保护策略去抵御外界不良环境的压力,但植物自身的抵抗能力是有限的,植物之所以能够适应多变的环境,其中微生物在这个过程中扮演重要的角色[3]。丛枝菌根(arbusular mycorrhizal,AM)真菌能与宿主植物通过外延菌丝体交换植物的碳水化合物和土壤养分实现互利共生,对被破坏生态系统植被恢复和重建具有重要作用。近年来,菌根技术的应用使植物在干旱条件下更好地适应生存环境,并且利用菌根技术增强林木耐旱性的结论在许多寄主植物中已经得到证实[4]。但目前的研究主要针对经济林,对造林树种的研究较少,对于榆树接种AM真菌提高抗旱性的研究更是鲜为报道。鉴于此,笔者通过人工模拟干旱环境,探究AM真菌提高榆树抗旱性的生理机制,以及筛选耐旱菌种。为菌根技术在干旱半干旱地区植被恢复,改善生态环境提供前期的理论准备和技术支持。
1 研究方法 1.1 试验材料1) 供试植物。供试植物为榆树种子,挑选颗粒饱满的健康种子清洗干净,用0.5%高锰酸钾溶液浸泡30 min,用无菌水冲洗若干次后播种于灭菌土壤中培养。
2) 供试菌种。供试菌剂为摩西斗管囊霉(Funneliformis mosseae,F.m)、幼套近明球囊霉(Claroideoglomus etunicatum,C.e)、根内根孢囊霉(Rhizophagus intraradices,R.i)。菌种由北京农林科学院植物营养于资源研究“丛枝菌根种质资源库”(Bank of Glomeromycota in China,BGC)提供。
3) 基质与容器。培养基质为蛭石、砂土、营养土按1 ∶1 ∶1(体积比)混合而成,预先经0.11 MPa,121 ℃高压蒸汽灭菌1 h,杀死土著AMF和其他杂菌后摊晾备用。栽培容器为16.1 cm×11.9 cm×12 cm(盆口内径×盆底内径×高)规格的塑料盆,经1%高锰酸钾溶液浸泡24 h后晾干备用。
1.2 试验设计试验土壤的田间持水量为40.3%,采用盆栽试验,设置接种和水分2种因素。因素1为5种菌剂处理: 不接种对照(CK),单独接种F.m、C.e和R.i,混合接种3种菌剂(F.C.R);因素2为3种水分处理:正常供水(田间持水量70%±5%)、中度干旱(田间持水量50%±5%)、重度干旱(田间持水量30%±5%)。共15个处理,每个处理20株,共计300株。
1.3 试验实施将处理好的榆树种子播种于塑料盆中,待其根系长出侧根后进行AM真菌接种。每个塑料盆装入灭菌土2 kg,每盆定植1株幼苗,每株幼苗接种10 g菌剂,混合接种是等量称取F.m、C.e和R.i菌剂共10 g,对照组接种等量的灭菌菌剂,以保证除目的菌外其他的微生物组成一致。榆苗接种培养期间,所有处理正常供水,常规管理2个月后进行水分胁迫,用称量法保持土壤含水量恒定,持续处理60 d后取样测定各项指标。
1.4 指标测定与方法榆树幼苗的株高采用卷尺测量基部到植株最高部位的自然距离;根冠比为地下生物量与地上生物量的比值;利用曲利苯蓝染色法检测菌根结构并计算菌根侵染率;利用式(1)计算菌根依赖性;采用L i- 6400型便携式光合仪测定光合参数,并采集测定光和参数的同一榆树幼苗叶片,采用硫代巴比妥酸法测定丙二醛含量;采用愈创木酚法测定过氧化物酶;超氧化物歧化酶采用氮蓝四唑法测定[5];过氧化氢酶采用紫外吸收法[6]测定;
| $ M_{\mathrm{D}}=\frac{M_1}{M_0} \times 100 \% \text { 。} $ | (1) |
式中:MD为菌根依赖性,%;M1为接种菌根苗木的干质量,g;M0为接种菌根苗木的干质量,g。
1.5 数据处理利用Microsoft Excel 2012进行数据统计,SPSS23软件对数据进行双因素方差分析,对各指标在不同处理间的差异进行显著性分析,采用隶属函数模糊综合评价法[7]对不同菌种的抗旱性进行综合评价,最后用Origin 2018做图。
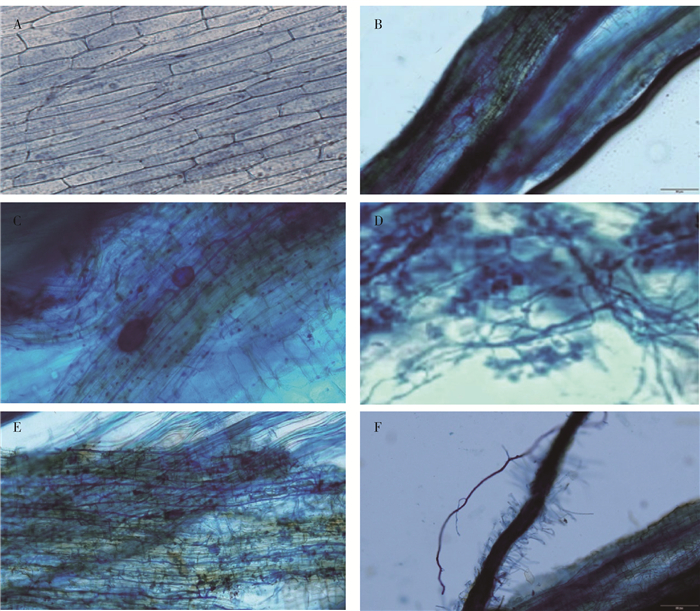
2 结果与分析 2.1 对干旱胁迫下榆树幼苗生长和根系发育的影响由表 1可知,榆树幼苗株高随着水分供应量的减少呈下降趋势,AM真菌的接种显著缓解这种情况,在3种水分条件下,接种处理的幼苗株高均显著高于对照(P<0.05)。双因素方差分析结果(表 2)表明,接种处理和水分处理对榆树幼苗株高的变化有极显著影响(P<0.01)。随着干旱程度的增强根冠比呈逐渐升高的趋势,3种水分条件下,接种AM真菌显著提高了榆树幼苗根冠比(P<0.05),接种处理和水分处理的交互作用对榆树幼苗根冠比的变化有显著影响(P<0.05)。榆树幼苗接种AM真菌培养60 d后,幼苗根系在体式显微镜下可以明显看到泡囊、孢子、菌丝和丛枝结构(图 1),说明F.m、C.e、R.i和F.C.R均能成功侵染榆树幼苗根系,未接种对照榆树幼苗根系未见丛枝结构,说明未被侵染。由表 1可知,幼苗菌根侵染率随着干旱胁迫的加剧显著降低(P<0.05)。接种处理和水分处理对榆苗菌根侵染率的变化有极显著影响(P<0.01)。榆树幼苗菌根依赖性随着干旱程度的增加而逐渐上升,在重度干旱胁迫下,菌根依赖性达到最大,接种处理和水分处理的交互作用对榆树幼苗菌根依赖性的变化有显著影响(P<0.05)。
| 表 1 不同水分条件下AM真菌对榆树幼苗生长和根系发育的影响 Tab. 1 Effects of AM fungi on the Ulmus pumila seedling growth and root development under different moisture conditions |
| 表 2 接种和干旱胁迫对榆苗生长和根系发育指标影响的双因素分析结果 Tab. 2 Two-factor analysis results of the influences of inoculation and drought stress on the growth and root development indexes of Ulmus pumila seedlings |
|
A.未接种榆树根;B.榆树幼苗菌根;C.泡囊;D. 丛枝;E.根内菌丝;F.根外菌丝。 A. Un-inoculated Ulmus pumila seedling roots. B. Mycorrhizal of Ulmus pumila seedlings. C. Vesicles. D. Arbuscular. E. Inner roots hyphae. F. Extra-root hyphae 图 1 接种丛枝菌根真菌后榆树幼苗根系的结构 Fig. 1 Root structures of Ulmus pumila seedlings inoculated with AM fungi |
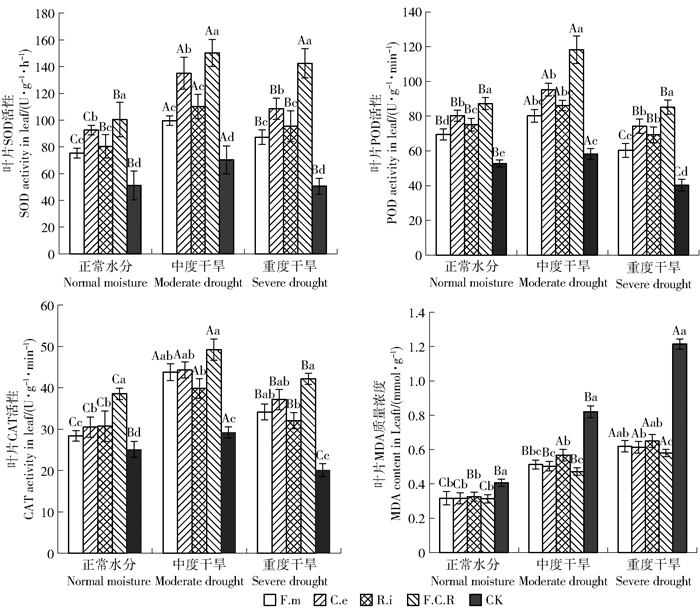
由图 2可以看出,随着水分供应量的减少过氧化物酶(peroxidase, POD)、超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)活性呈先上升后下降趋势。且无论是正常水分和干旱胁迫下接种处理POD、SOD和CAT酶活性均显著高于未接种处理(P<0.05)。双因素方差分析结果(表 3)表明,榆苗叶片POD、SOD和CAT酶活性在接种处理水分处理间具有显著的交互作用(P<0.05)。
|
图 2 接种AM真菌对榆树幼苗生理指标的影响 Fig. 2 Effects of inoculation of AM fungi on the physiological indicators of Ulmus pumila seedlings |
| 表 3 接种和干旱胁迫对榆苗生理指标影响的双因素分析结果 Tab. 3 Two-factor analysis of the effects of inoculation and drought stress on the physiological indices of Ulmus pumila seedlings |
3个水分条件下,接种AM真菌显著降低榆树幼苗叶片丙二醛(malondialdehyde,MDA)含量;随着干旱胁迫加剧MDA含量持续增加;接种处理MDA含量增加趋势明显低于对照处理,由表 3可知,接种处理对MDA含量的变化有显著影响(P<0.05),水分处理以及二者的交互效应对其有极显著影响(P<0.01)。
2.3 对干旱胁迫下榆树幼苗气体交换参数的影响由表 4可以看出,与正常供水条件相比,随着干旱胁迫程度的增加,幼苗的净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)逐渐降低,胞间CO2浓度(Gi)不断升高。双因素方差分析结果(表 5)表明,接种处理和水分处理对榆树幼苗气体交换参数的变化均有显著影响(P<0.05),接种×水分二者的交互效应对榆苗叶片净光合速率的变化有极显著影响(P<0.01)。
| 表 4 不同AM真菌对榆树幼苗叶片光合作用的的影响 Tab. 4 Effects of different AM fungi on the leaf photosynthesis of Ulmus pumila seedlings |
| 表 5 接种和干旱胁迫对榆苗光合指标影响的双因素分析结果 Tab. 5 Two-factor analysis of the effects of inoculation and drought stress on the photosynthetic indices of Ulmus pumila seedlings |
正常供水条件下,接种R.i和F.C.R处理的净光合速率显著高于其他3组处理(P<0.05);中度干旱胁迫下,接种C.e、R.i和F.C.R处理的净光合速率显著高于对照(P<0.05);重度干旱胁迫下,接种处理的净光合速率均显著高于对照处理(P<0.05)。榆树幼苗叶片蒸腾速率随着干旱胁迫的加剧逐渐降低,且3种水分之间存在显著差异(P<0.05)。正常水分条件下和中度干旱胁迫下,接种R.i和F.C.R处理的幼苗蒸腾速率显著高于其他处理(P<0.05);重度干旱胁迫下,接种F.C.R处理的幼苗蒸腾速率显著高于其他处理(P<0.05)。不同水分条件下,榆树幼苗叶片气孔导度差异显著(P<0.05),随着干旱程度的持续增强,叶片气孔导度逐渐降低。正常水分和干旱胁迫下,接种处理组幼苗气孔导度均显著高于对照(P<0.05)。结果显示AM真菌的接种降低胞间CO2浓度,无论是正常水分和干旱胁迫下榆树幼苗叶片胞间CO2浓度均显著低于对照(P<0.05)。
2.4 对干旱胁迫下榆树幼苗耐旱性综合能力评价基于榆苗叶片MDA含量、CAT、POD、SOD活性、净光合速率、蒸腾速率、气孔导度、胞间CO2浓度共8个常用抗旱指标在重度干旱条件下进行模糊隶属函数值综合评价结果表明:接菌处理综合耐旱能力强于未接菌组,接种混合菌种略强于接种幼套菌种,其耐旱能力从大到小为F.C.R>C.e>R.i>F.m>CK(表 6)。
| 表 6 榆树幼苗抗旱指标的抗旱系数 Tab. 6 Drought resistance coefficients for drought resistance indexes of Ulmus pumila seedlings |
本研究试验结果表明,接种AM真菌后,榆树幼苗株高显著增加,这主要由于植株形成菌根结构后扩大根系的吸收面积和范围,改善植株矿质营养,促进植物的生长发育。但在水分胁迫下,株高增长量呈逐渐降低的趋势,这是由于植物处于干旱胁迫环境中时,通过降低自身的生长速率达到减少水分消耗的目的,从而保证植物自身的存活。相同水分处理条件下,与对照组相比,AM真菌的接种能够显著的增加幼苗的根冠比,促进植物生长,引起植物各个器官营养物质的分配,使植物将更多的生物量分配到根系中以吸收水分,这与马坤等[8]对木棉幼苗的研究结果相同。菌根侵染率的大小反映菌根真菌与宿主植物亲和力的高低。本试验结果表明,不同菌种对水分胁迫的响应存在差异,表明不同菌种的抗逆性存在差异性[9]。虽然菌根侵染率随着干旱程度的增加呈下降趋势,但是菌根侵染率仍在44.66%~61.9%之间。可见即使在重度干旱胁迫下,4种AM真菌仍能达到一个较高的侵染水平,有效的与榆苗根系形成菌根结构。本试验中随着干旱胁迫的增强,榆树幼苗菌根依赖性明显上升,水分胁迫下榆树幼苗对菌根真菌的作用更明显,说明干旱环境中菌根的形成对榆树幼苗具有重要意义,这一结果与余洁[10]对荆条的研究结果一致。
MDA含量在不同接种处理下均随着水分的胁迫呈增加的趋势,这与唐明等[11]在研究AMF对沙棘抗旱性的影响得出的结果相似。在正常供水条件下,接种组与CK组MDA含量的差异不是很明显,随着水分胁迫程的加剧,植物活性氧迅速积累使质膜遭遇损害,MDA含量显著升高,接种组MAD含量显著低于对照组。可见AM真菌能够减轻干旱对榆苗细胞膜脂过氧化的伤害,提高抗旱性。
本研究中SOD、POD和CAT活性均随着干旱胁迫的加剧呈先升高后降低趋势。这与徐万茹[12]对白榆的研究结果较为一致。说明榆树幼苗受到水分胁迫时活性氧大量累积诱导植物体内抗氧化酶活性升高,及时发挥作用以保护植物免受伤害,但是胁迫超过一定范围后细胞抗氧化酶调节能力降低而酶活性会下降。在土壤处于中度和重度干旱时,接菌处理组SOD、POD和CAT活性均显著高于未接菌组,表明在水分胁迫下,接种AM真菌对植物体内3种酶活性具有显著促进作用,接种AM真菌能够提高植物的抗氧化酶活性,缓解植物因干旱胁迫造成膜系统的伤害。
本研究表明,干旱抑制榆树幼苗的光合作用,但接种AM真菌均提高了榆树幼苗的净光合速率、蒸腾速率、气孔导度,降低了胞间CO2浓度。与Kaya等[13]对西瓜的研究结果相同,说明菌根化植物能够更好的保持对干旱环境的适应性,保持光合能力的稳定。但接种AM真菌榆树幼苗的蒸腾速率和气孔导度的降低程度大于未接种处理,说明AM真菌通过调控榆树幼苗叶片的气孔运动来适应干旱环境,通过增大气孔导度,提高植株的蒸腾速率,从而提高榆树幼苗对水分的吸收和运输能力,进而提高榆树幼苗的抗旱性。
4 结论在水分胁迫下,接种AM真菌促进榆树幼苗的生长;增强植物体内抗氧化酶活性(SOD、POD和CAT),减少MDA的生成,保护细胞膜的完整性;提高幼苗光合能力,进而提高植物抗旱性。模糊隶属函数分析结果表明,接菌组的耐旱能力强于未接菌组,榆树幼苗混合接种效果优于单独接种。进一步说明AM真菌和宿主植物的共生关系存在一定的选择性和适应性。所以,筛选和培养优势菌种进行榆树人工接菌或菌根化育苗,是提高干旱条件下榆树抗旱性的关键问题。
| [1] |
赵思思, 梁海永, 王晓叶, 等. 榆树种质资源的研究进展[J]. 河北林果研究, 2017, 31(Z1): 232. ZHAO Sisi, LIANG Haiyong, WANG Xiaoye, et al. A study on the research progress of elm germplasm resources[J]. Hebei Forest Fruit Research, 2017, 31(Z1): 232. |
| [2] |
赵娜, 胡春元, 李钢铁, 等. 浑善达克沙地中部地区榆树分布密度与土壤养分状况关系的研究[J]. 现代农业, 2009(7): 61. ZHAO Na, HU Chunyuan, LI Gangtie, et al. Study on the relationship between the distribution density and soil nutrient status of elm trees in the central area of Hunshandak Sandy Land[J]. Modern Agriculture, 2009(7): 61. |
| [3] |
金思雨, 彭祚登. 刺槐和油松干旱胁迫研究进展[J]. 西北林学院学报, 2022, 37(4): 71. JIN Siyu, PENG Zuodeng. Research progess on drought stress on Robinia pseuduoacacia and Pinus tabiliformis[J]. Journal of Northwest Forestry University, 2022, 37(4): 71. |
| [4] |
喻志, 梁坤南, 黄桂华, 等. 丛枝菌根真菌对植物抗旱性研究进展[J]. 草业科学, 2021, 38(4): 640. YU Zhi, LIANG Kunnan, HUANNG Guihua, et al. Research progress on the mechanisms of arbuscular mycorrhizal fungi on drought resistance in plants[J]. Pratacultural Sciences, 2021, 38(4): 640. |
| [5] |
沈昱翔, 陈朝儒, 张雪妹, 等. 丛枝菌根对滇重楼幼苗生长及光合特性的影响[J]. 作物杂志, 2020(4): 170. SHEN Yuxiang, CHEN Zhaoru, ZHANG Xuemei, et al. Effects of arbuscular mycorrhizal fungi on seeding growth and photosynthetic characteristics of Paris polyphylla Smith var. yunnanensis[J]. Journal of Crops, 2020(4): 170. |
| [6] |
BEYER W F JR, FRIDOVICH I. Assaying for superoxide dismutase activity: Some large consequence of minor changes in conditions[J]. Analytical Biochemistry, 1987, 161(2): 559. |
| [7] |
庄丽, 陈亚宁, 陈明, 等. 模糊隶属函数法在塔里木河荒漠植物抗旱性评价中的应用[J]. 干旱区地理, 2005, 28(3): 367. ZHUANG Li, CHEN Yaning, CHEN Ming, et al. Application of fuzzy membership function method in drought resistance evaluation of desert plants in Tarim River[J]. Arid Land Geography, 2005, 28(3): 367. |
| [8] |
马坤, 杨建军, 李璐, 等. 接种丛枝菌根真菌对干旱胁迫下木棉地上部水分供应的影响[J]. 北方园艺, 2017(16): 95. MA Kun, YANG Jianjun, LI Lu, et al. Inoculation of arbuscular mycorrhizal fungi improved water supply in aboveground part of Bombaxceiba seedling under drought stress[J]. Northern Horticulture, 2017(16): 95. |
| [9] |
HUANG Z, ZOU Z, HE C, et al. Physiological responses of melon (Cucumis melo L.) seedlings to three Glomus species under water deficit[J]. Plant and Soil, 2011, 339(1/2): 391. |
| [10] |
余洁. 丛枝菌根真菌对荆条生长和抗旱性的影响[D]. 郑州: 河南农业大学, 2019: 4 YU Jie. Effects of arbuscular mycorrhizal fungi on growth and drought resistance of Vitex negundo seedings[D]. Zhengzhou: Henan Agricultural University, 2019: 4 |
| [11] |
唐明, 任嘉红, 胡景江, 等. AMF提高沙棘抗旱性的研究[J]. 西北林学院学报, 2003, 18(4): 29. TANG Ming, REN Jiahong, HU Jingjiang, et al. Mechanism of the promotion of drought resistance of Hioppophae rhamnoides with arbuscular mycorrhizal fungi[J]. Journal of Northwest Forestry College, 2003, 18(4): 29. |
| [12] |
徐万茹. 不同水分胁迫下接种印度梨形孢对白榆生理特性的影响[D]. 济南: 山东农业大学, 2021: 1. XU Wanru. Effects of Piriformis indiana inoculation on physiological characteristics of Ulmus pumila under different water stresses[D]. Jinan: Shandong Agricultural University, 2021: 1. |
| [13] |
KAYA C, D HIGGS, KIRNAK H, et al. Mycorrhizal colonization improves fruit yield and water use efficiency in watermelon (Citrullus lanatus Thunb.) grown under well-watered and water-stressed conditions[J]. Plant & Soil, 2003, 253(2): 287. |
 2024, Vol. 22
2024, Vol. 22 
