2. 生态环境部华南环境科学研究所, 510655, 广州;
3. 临沂市沂水县水利工程保障中心, 276000, 山东临沂;
4. 临沂大学, 276000, 山东临沂
中国水土保持科学  2022, Vol. 20 2022, Vol. 20  Issue (5): 47-55. DOI: 10.16843/j.sswc.2022.05.007 Issue (5): 47-55. DOI: 10.16843/j.sswc.2022.05.007 |
杨树具有适应性强、用途广、生长快和轮伐期短等特点,是我国营造用材林、防护林和四旁绿化的优良速生树种,其林分在风沙区防风固沙、平原区农田防护、山丘区涵养水源等方面具有重要水土保持地位与作用[1]。因林地资源的限制和栽培经营习惯的影响,我国杨树速生丰产林培育多实行短轮伐期和多代连作模式,由此导致林木生长缓慢,病虫害严重,木材蓄积量减少等现象。多年来,连作人工林地力衰退与化感效应之间的关系受到广泛关注[1-2]。有研究表明:杨树人工林生长衰退、生产力下降与土壤酚酸等化感物质的累积密切相关[3-4];土壤酚酸累积会明显抑制杨树苗木的根系发育和植株整体生长[5];酚酸类物质可以抑制杨树根系超氧化物歧化酶和过氧化物酶活性,降低根系活力[6];土壤酚酸类物质抑制氮素的固定及转化等过程,进一步导致植物缺乏氮元素而不能正常生长[7-8]。以上研究主要集中在土壤酚酸的累积效应、根际效应等方面,尚缺乏土壤中的酚酸类物质对杨树光合作用的影响等相关研究[9],尤其是系列酚酸质量浓度对杨树光合作用光响应特征、叶绿素荧光特征参数的影响,还需要深入研究和认识。
欧美杨107(Populus×euramericana cv.‘Neva’)是我国北方地区杨树人工林栽培中应用较多的优良无性系品种[10],尤其在黄淮海平原区栽植规模较大,是杨树人工林栽培中具有典型性和代表性的品种。笔者以盆栽1年生欧美杨107苗木为试验材料,通过土壤酚酸质量浓度处理,测定与分析杨树叶片气体交换和叶绿素荧光参数的变化,旨在揭示土壤酚酸胁迫对杨树光合作用效率的影响特征与机理,为深入认识土壤酚酸累积对杨树生长的抑制作用提供植物生理依据。
1 材料与方法 1.1 试验地概况试验地设置在山东农业大学泮河校区林学试验站(E 116°02′~117°59′,N 35°38~36°33′)。试验地位于泰安市泰山区,属暖温带半湿润大陆性季风气候,多年平均年降水量795 mm(多集中在7—9月),年均气温13.2 ℃,无霜期187 d。试验地土壤类型为棕壤,质地为沙壤土,土壤密度1.29 g/cm3,肥力中等,pH值为8.4。
1.2 试验设计试验材料为盆栽扦插培育的1年生欧美杨107植株,试验设置4个区组,每区组分7个小区。2020年4月上旬进行盆栽植株培育,2020年5月下旬进行盆栽土壤处理。土壤处理以杨树第二代林分(林龄为4 a,其第一代林分轮伐期为10 a)的土壤酚酸质量浓度[4]为参考值(1.0T)进行酚酸质量浓度梯度设置(表 1),分别为0.5T、1.0T、1.5T、2.0T、2.5T、3.0T和0T(对照)。
| 表 1 土壤酚酸质量浓度处理 Tab. 1 Soil phenol mass concentration treatment |
2020年7月下旬,测定不同酚酸质量浓度下杨树叶片的光响应参数和叶绿素荧光参数。
1) 光合作用光响应参数。各酚酸质量浓度下选取长势健壮的3株苗木,从每株苗木中上部选取3个生长成熟的叶片,应用光合测定仪(CIRAS-2)测定不同叶片对14个光合有效辐射下的光响应数据,测定时间在每天08:00—11:30,具体观测过程采用李辉[7]、郎莹等[11]报道的方法。光合测定仪自动记录净光合速率(Pn,μmol/(mol2·s))、气孔导度(Gs,mmol/(mol2·s))、胞间CO2摩尔分数(Ci,μmol/mol)、大气CO2摩尔分数(Ca,μmol/mol)和光合有效辐射(photosynthetically active radiation, PAR,μmol/(mol2·s))等。
绘制净光合速率对光合有效辐射的响应曲线(Pn~PAR曲线),由响应曲线判读得到光合作用的最大净光合速率(Pnmax,μmol/(mol2·s))和饱和光强(LSP,μmol/(mol2·s))范围[12]。利用弱光下(PAR≤200 μmol/(mol2·s))的Pn和PAR数据,经进行线性回归分析得到表观量子效率(Φ,mol/mol)、暗呼吸速率(Rd,μmol/(mol2·s))和光补偿点(light compensation point, LCP,μmol/(mol2·s))。
计算光合作用气孔限制值
| $ L_{\mathrm{s}}=1-C_{\mathrm{i}} / C_{\mathrm{a} }。$ |
2) 叶绿素荧光参数。叶绿素荧光参数利用调制式荧光仪(FMS-2型)进行测定(采用的样本叶片与光响应观测的相同),具体观测过程采用许大全[12]、朱英华等[13]报道的方法。测定的叶绿素基础荧光参数包括:叶片暗适应下的初始荧光(F0)和最大荧光产量(Fm),光适应下的初始荧光(F′0)、最大荧光(F′m)和稳态荧光产量(Fs)。
计算的叶绿素荧光参数包括:最大光化学效率(Fv/Fm)、实际光化学效率(ΦPS Ⅱ)、光化学猝灭系数(qP)和非光化学猝灭系数(qN)。计算公式为:
| $ \begin{gathered} F_{\mathrm{v}} / F_{\mathrm{m}}=\left(F_{\mathrm{m}}-F_0\right) / F_{\mathrm{m}} ; \\ \mathit{\Phi }_{\mathrm{PSII}}=\left(F_{\mathrm{m}}^{\prime}-F_{\mathrm{s}}\right) / F_{\mathrm{m}}^{\prime} ; \\ \mathrm{qP}=\left(F_{\mathrm{m}}^{\prime}-F_{\mathrm{s}}\right) /\left(F_{\mathrm{m}}^{\prime}-F_0^{\prime}\right) ; \\ \mathrm{qN}=\left(F_{\mathrm{m}}-F_{\mathrm{m}}^{\prime}\right) / F_{\mathrm{m} 0}^{\prime} 。\end{gathered} $ |
图 1表明,不同酚酸质量浓度下,杨树叶片净光合速率(Pn)的光响应过程具有明显差别,光响应曲线对酚酸质量浓度变化表现出一定的阈值响应特征。在低酚酸质量浓度(低于2.0T)时,低光强(光合有效辐射PAR<400 μmol/(mol2·s))下的Pn随PAR增加呈近似直线上升的趋势,高光强(如PAR>1 200 μmol/(mol2·s))下的Pn随PAR增大呈缓慢增加趋势。而在高酚酸质量浓度(大于2.0T)时,低光强下的Pn明显降低,高光强下Pn随PAR增加呈现明显下降的趋势。以上结果表明,土壤酚酸胁迫明显抑制杨树的光合作用,当酚酸质量浓度超过2.0T时,高光强下的光合作用会发生明显的光抑制。
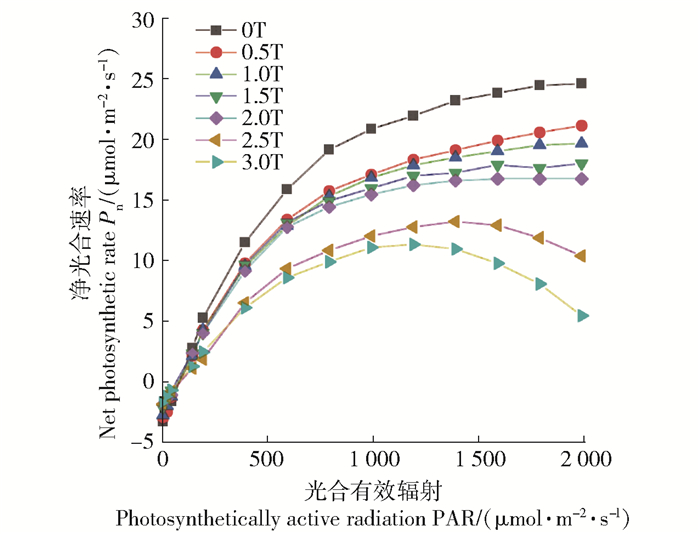
|
误差线为标准偏差(SD)。下同。 The error line is the standard deviation (SD). The same below. 图 1 杨树叶片净光合速率(Pn)光响应过程 Fig. 1 Photoresponse of net photosynthetic rate (Pn) of poplar (Populus×euramericana cv.'Neva') leaves |
图 2显示,在PAR=1 400 μmol/(mol2·s)光强下,低质量浓度(0.5T~1.5T)酚酸时,随酚酸质量浓度增加,杨树的胞间CO2摩尔分数(Ci)呈下降趋势,气孔限制值(Ls)呈上升趋势,由此根据光合作用限制因素判别准则[12, 14]表明,此时Pn降低的主要原因为气孔因素的限制,即气孔导度(Gs)减小引起光合机构的CO2供应受阻为主。在高质量浓度(超过1.5T)酚酸时,随酚酸质量浓度增加,杨树的Ci呈上升趋势,Ls呈下降趋势,表明此时Pn降低的主要原因为非气孔因素的限制,即光合机构受到胁迫伤害导致光合活性降低。综合上述,随土壤酚酸质量浓度增加,限制杨树光合速率的主要原因会由气孔因素转变为非气孔因素,发生这一转变的土壤临界酚酸质量浓度在1.5T左右。
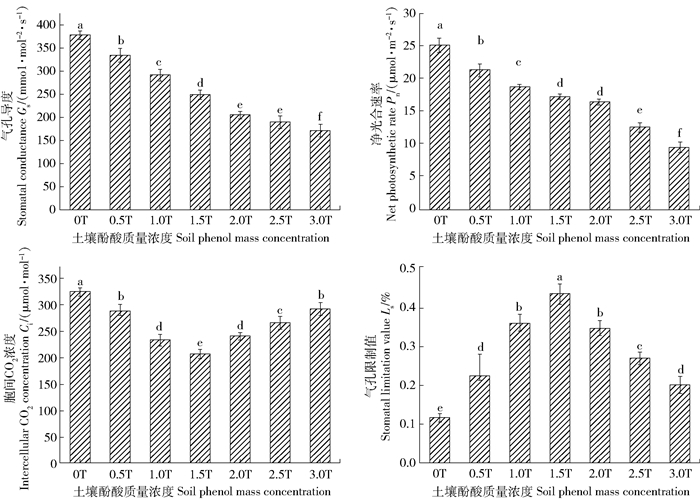
|
不同字母代表不同处理之间差异显著(P<0.05)。下同。 There are significant differences between different letters representing different treatments(P < 0.05). The same below. 图 2 杨树叶片光合气体交换参数(PAR=1 400 μmol/(mol2·s) Fig. 2 Gas exchange parameters of poplar leaves(PAR=1 400 μmol/(mol2·s)) |
表 2表明,随土壤酚酸质量浓度增加,杨树的最大净光合速率(Pnmax)、表观量子效率(Φ)、暗呼吸速率(Rd)、光饱和点(LSP)均呈减小趋势,而光补偿点(LCP)呈增大趋势。
| 表 2 杨树叶片光响应特征参数 Tab. 2 Characteristic parameters of light response of poplar leaves |
表观量子效率(Φ)可反映植物光合机构在弱光下吸收、转换和利用光能的效率[15]。由表 2看出,对照处理下杨树的Φ值在0.04 mol/mol以上,随酚酸质量浓度增加,Φ值明显减小。酚酸质量浓度增加至2.5T~3.0T时,Φ值显著降低至0.02 mol/mol左右,与对照组相比降低幅度达到约52%~62%。最大净光合速率(Pnmax)可表征植物实际的光合能力。表 2显示,杨树Pnmax随酚酸质量浓度增加明显下降,高酚酸质量浓度(2.5T~3.0T)下的Pnmax与对照组相比降低幅度达到约45%~60%。以上结果表明,高质量浓度酚酸胁迫会显著抑制杨树的光合能力以及对弱光的吸收转化利用效率。
光补偿点(LCP)和饱和光强(LSP)分别代表植物对弱光和强光的利用能力,在一定程度上反映植物对光环境的适应能力[16],表 2显示,随土壤酚酸质量浓度增加,杨树的LCP不断增大,LSP明显降低;在高酚酸质量浓度(2.5T~3.0T)下,LCP与对照组相比增大了12%~13%,LSP降低了40%~50%。这表明,在高质量浓度酚酸胁迫时,杨树光合作用对光能(弱光和强光)的利用能力会明显降低。暗呼吸速率(Rd)在一定程度上表征了植物叶片生理活性的高低[17],表 2显示,随酚酸质量浓度增加,杨树叶片的Rd逐渐降低,酚酸质量浓度增加至2.5T~3.0T时,与对照组相比Rd降低了48%~58%。表明高质量浓度酚酸胁迫会导致杨树叶片的生理活性明显降低。
2.3 土壤酚酸对杨树叶绿素荧光参数的影响由图 3看出,随着土壤酚酸质量浓度的增加,杨树叶绿素的最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSⅡ)、光化学猝灭系数(qP)和最大荧光(Fm)呈现减小趋势,非光化学猝灭系数(qN)和初始荧光(F0)呈现增大趋势。
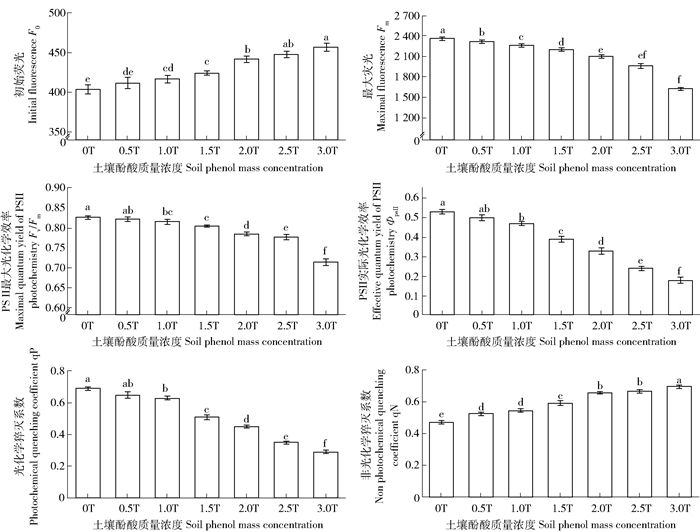
|
图 3 杨树叶片叶绿素荧光特征参数 Fig. 3 Fluorescence parameters of poplar leaves |
最大光化学效率(Fv/Fm)是植物在暗适应下光合机构全部PS Ⅱ反应中心都开放时的光化学效率或光能转换效率。非环境胁迫时不同植物的Fv/Fm都比较恒定,一般都在0.80~0.85之间[12, 18],但植物受到胁迫时Fv/Fm会明显下降。本研究(图 3)表明,杨树在非酚酸胁迫(0T)时的Fv/Fm为0.83左右,随土壤酚酸质量浓度增加,Fv/Fm持续降低,在酚酸质量浓度大于1.5T后,Fv/Fm的降低幅度增大。实际光化学效率(ΦPS Ⅱ)是植物在光适应下PS Ⅱ反应中心部分关闭时(光合作用达到稳态时)的光化学效率或光能转换效率[12, 18]。随着土壤酚酸质量浓度增大,杨树的ΦPS Ⅱ持续下降,当酚酸质量浓度大于1.0T后,ΦPS Ⅱ下降的幅度会显著增加。在相同酚酸胁迫质量浓度梯度下,ΦPS Ⅱ的下降幅度大于Fv/Fm的下降幅度。以上结果表明,土壤酚酸质量浓度增加,杨树光合机构最大光化学效率或光能转化效率受到抑制的程度增大。
初始荧光产量(F0)是植物在暗适应下光合机构全部PS Ⅱ反应中心都开放时的叶绿素荧光参数。F0升高,表征PS Ⅱ反应中心可能出现可逆的失活或遭到不易逆转的破坏[18, 12]。本研究(图 3)表明,随土壤酚酸质量浓度增加,杨树的F0持续升高,且当酚酸质量浓度大于1.5T后,F0的升高幅度增大。表明土壤酚酸质量浓度增加导致杨树PS Ⅱ反应中心失活或遭受破坏的程度增大。
最大荧光产量(Fm)是植物在暗适应下光合机构全部PS Ⅱ中心都关闭时的叶绿素荧光参数。Fm可反映通过PS Ⅱ电子传递的潜在最大能力[12, 19]。光化学猝灭系数(qP)是由PS Ⅱ光化学过程中能量转换所引起的荧光产量下降,反映PS Ⅱ将光能转化成化学能的效率。qP变小,表征PS Ⅱ的实际电子传递活性变小,电子流动受到抑制,参与CO2固定的电子减少[19-20]。本研究(图 3)表明,随土壤酚酸质量浓度增大,杨树的Fm和qP都持续下降;当酚酸质量浓度大于1.0T后,qP的下降程度显著增大。以上结果表明,土壤酚酸胁迫导致杨树PS Ⅱ潜在的电子传递能力和实际的电子传递活性明显降低;土壤酚酸质量浓度增大,PS Ⅱ实际电子传递活性降低的程度会显著增加。
非光化学猝灭系数(qN)是由PS Ⅱ非光化学过程引起的荧光产量降低,通常反映PS Ⅱ热耗散过剩光能的能力。非光化学猝灭是植物的一种自我保护机制[20-21],可在PS Ⅱ吸收过量光能时通过热耗散保护其光合机构;qN增大,表征PS Ⅱ向反应中心传递的光能减少,通过热耗散方式减少的过剩光能增加[21-22]。本研究(图 3)表明,随着土壤酚酸质量浓度增加,qN逐渐增大。表明在土壤酚酸胁迫增强时,杨树通过热耗散保护其光合机构的能力增大。
3 讨论本研究(表 2)表明,在不同土壤酚酸质量浓度(0T~3.0T)下,随酚酸质量浓度升高,杨树的最大光合速率(Pnmax)和表观量子效率(Φ)都呈现明显降低趋势。许楠等[23]研究表明,连作降低了烤烟叶片的Pnmax和Φ;李辉等[24]研究表明,随土壤酚酸质量浓度升高,垂柳(Salix babylonica)的Pnmax和Φ也显著降低;这与本试验研究结果相类似。有研究[25]发现,杨树在0T~1.0T酚酸质量浓度下,随酚酸质量浓度升高,叶片净光合速率(Pn)降低,而胞间CO2摩尔分数(Ci)升高,由此根据Farquhar等的光合作用限制因素判别准则[12, 14]表明,Pn降低的主要原因是非气孔因素的限制(即光合机构的光合反应活性降低);而本研究结果(图 2)显示,杨树在0T~1.5T处理下,土壤酚酸质量浓度升高时,杨树的Pn和Ci下降,气孔限制值(Ls)上升,表明Pn下降的主要原因是气孔因素的限制(即光合机构的CO2供应受阻);以上结果不同的具体原因有待进一步研究。本研究(图 2)发现,土壤酚酸质量浓度大于1.5T后,酚酸质量浓度增加,杨树的Pn和Ls下降,而Ci升高,表明杨树Pn降低主要的原因转变为非气孔因素的限制。由此可判定,土壤酚酸质量浓度大约在1.5T,是杨树光合作用降低原因由气孔限制为主转变为非气孔限制为主的转折质量浓度。
本研究(图 3)发现,随土壤酚酸质量浓度升高,杨树叶片光合作用的最大光化学效率(Fv/Fm)、实际光化学效率(ΦPS Ⅱ)、光化学猝灭系数qP和最大荧光(Fm)呈减小的趋势,初始荧光(Fo)和非光化学猝灭系数qN呈增大的趋势。这些叶绿素荧光参数对土壤酚酸质量浓度升高的变化响应,都表现出一定的质量浓度阈值特征;在土壤酚酸质量浓度超过大约1.0T后,Fv/Fm、ΦPS Ⅱ、Fm、qP降低的幅度和F0升高的幅度都明显增大。由此推断认为,可能杨树在第二代林分时,林木的光合作用已经受到土壤酚酸累积(本试验处理质量浓度1.0T)的明显制约,表现为叶片净光合速率、表观量子效率、光化学效率等光合效率参数都明显降低。
相关研究表明,酚酸类物质主要来源于植物根系分泌,被土壤和植物根系吸收后产生化感作用[26-27],通过影响细胞膜透性、保护酶活性、养分吸收和光合作用等多种途径抑制植物生长[28-29]。酚酸类物质对光合作用影响的重要方面是造成植物叶绿素减少和光合效率降低[30-31]。光合作用效率是表征光合机构运转状况的重要指标,也是植物生产力和作物产量高低的根本性因素[12, 18]。杨树连作栽培会引起土壤酚酸物质不断积累,导致林分生产力明显下降[1, 4],本研究结果可为深入了解林分生产力下降的程度与原因提供光合生理生态依据。
4 结论1) 土壤酚酸胁迫对杨树光合作用有明显抑制作用。酚酸质量浓度增加,光合速率明显降低,高质量浓度(超过1.5T)时发生光抑制;光合速率下降的原因,低质量浓度(0.5T~1.5T)时以气孔因素限制为主,光合机构的CO2供应受阻;高质量浓度时转变为非气孔因素限制为主,光合机构的光合反应活性降低。
2) 土壤酚酸质量浓度增大时,杨树光合机构的光能转换效率和电子传递活性下降,光合机构向反应中心传递光能的能力降低。在土壤酚酸胁迫环境下,杨树光合机构可通过增加热耗散释放过剩的光能,以此避免或减轻光损伤实施光保护,这是杨树光合作用适应土壤酚酸胁迫的一种生理策略。
| [1] |
赵娟, 郑智礼, 郭斌. 杨树连作障碍及生产力维持研究进展[J]. 世界林业研究, 2020, 33(1): 14. ZHAO Juan, ZHENG Zhili, GUO Bin. Research progress in continuous cropping obstacle and productivity maintenance of poplar[J]. World Forestry Research, 2020, 33(1): 14. DOI:10.13348/j.cnki.sjlyyj.2019.0095.y |
| [2] |
王文波, 马雪松, 董玉峰, 等. 杨树人工林连作与轮作土壤酚酸降解细菌群落特征及酚酸降解代谢规律[J]. 应用与环境生物学报, 2016, 22(5): 815. WANG Wenbo, MA Xuesong, DONG Yufeng, et al. Community characteristics and degradation metabolism regulation of soil phenolic acid degrading bacteria in poplar plantations under continuous cropping and crop rotation[J]. Chinese Journal of Applied and Environmental Biology, 2016, 22(5): 815. |
| [3] |
JEFFREY D W, JOHN T R. Allelochemicals of Polygonella myriophylla: Chemistry and soil degradation[J]. J. Chem. Ecol, 2004, 30(5): 1067. DOI:10.1023/B:JOEC.0000028468.97851.7a |
| [4] |
谭秀梅, 王华田, 孔令刚, 等. 杨树人工林连作土壤中酚酸积累规律及对土壤微生物的影响[J]. 山东大学学报(理学版), 2008, 43(1): 14. TAN Xiumei, WANG Huatian, KONG Linggang, et al. Accumulation of phenolic acids in soil of a continuous cropping poplar plantation and their effects on soil microbes[J]. Journal of Shandong University (Natural Science), 2008, 43(1): 14. |
| [5] |
杨阳. 外源酚酸对欧美杨Ⅰ-107水培幼苗形态与生理生化特性的影响[D]. 山东泰安: 山东农业大学, 2010: 81. YANG Yang. Effects of exogenous phenolic acids on morphological and physiological-biochemical characteristics of hydroponic cuttings of Populus×euramericana'Neva'[D]. Tai'an, Shandong: Shandong Agricultural University, 2010: 81. |
| [6] |
李冠喜, 吴小芹, 叶建仁. 杨树根际土自毒物质的积累、毒害及生物修复[J]. 南京林业大学学报(自然科学版), 2013, 37(3): 71. LI Guanxi, WU Xiaoqin, YE Jianren. Accumulation, toxic properties and bioremediation of autotoxic substance in poplar rhizosphere soil[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2013, 37(3): 71. |
| [7] |
李辉. 酚酸浓度和铵硝配比对杨树光合作用及氮代谢的影响[D]. 山东泰安: 山东农业大学, 2016: 57. LI Hui. Theof phenolic acids concentration and ammonium to nitrate ratio on photosynthesis and nitrogenous metabolism of Populus×euramericana'Neva'[D]. Tai'an, Shandong: Shandong Agricultural University, 2016: 57. |
| [8] |
CASTALDI S, CARFORA A, FIORENTINO A, et al. Inhibition of net nitrification activity in a Mediterranean woodland: Possible role of chemicals produced by Arbutus unedo[J]. Plant and Soil, 2009, 315(1/2): 273. |
| [9] |
谢东锋, 张光灿, 夏宣宣, 等. 不同浓度酚酸对欧美杨Ⅰ-107苗木生长和光合特性的影响[J]. 生态学报, 2018, 38(5): 1789. XIE Dongfeng, ZHANG Guangcan, XIA Xuanxuan, et al. Effects of phenolic acids on the growth and photosynthesis of Populus×euramericana 'Neva'[J]. Acta Ecologica Sinica, 2018, 38(5): 1789. |
| [10] |
亓玉飞, 尹伟伦, 夏新莉. 修枝对欧美杨107杨水分生理的影响[J]. 林业科学, 2011, 47(3): 33. QI Yufei, YIN Weilun, XIA Xin1i. Effects of on water physiology of poplar clone Populus×euramericaua cv.'74/76'[J]. Scientia Silvae Sinicae, 2011, 47(3): 33. DOI:10.3969/j.issn.1006-2505.2011.03.010 |
| [11] |
郎莹, 张光灿, 张征坤, 等. 不同土壤水分下山杏光合作用光响应过程及其模拟[J]. 生态学报, 2011, 31(16): 4499. LANG Ying, ZHANG Guangcan, ZHANG Zhengkun, et al. Light response of photosynthesis and its simulation in leaves of Prunus sibirica L. under different soil water conditions[J]. Acta Ecologica Sinica, 2011, 31(16): 4499. |
| [12] |
许大全. 光合作用效率[M]. 北京: 科学出版社, 2002: 29, 86. XU Daquan. Photosynthetic efficiency[M]. Beijing: Science Press, 2002: 29, 86. |
| [13] |
朱英华, 屠乃美, 肖汉乾, 等. 硫对成熟期烤烟叶绿素荧光参数的影响[J]. 生态学报, 2011, 31(13): 3796. ZHU Yinghua, TU Naimei, XIAO Hanqian, et al. Effect of sulfur on chlorophyll fluorescence of flue-cured tobacco at maturation stage[J]. Acta Ecologica Sinica, 2011, 31(13): 3796. |
| [14] |
FARQUHAR G D, SHARKEY T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology, 1982, 33: 317. |
| [15] |
吴晓龙, 吴毅, 张斌, 等. 7种北美橡树的光合生理特性分析[J]. 中南林业科技大学学报, 2018, 38(3): 34. WU Xiaolong, WU Yi, ZNANG Bin, et al. Comparative analysis on photosynthesis characteristics of seven north American oaks[J]. Journal of Central South University of Forestry & Technology, 2018, 38(3): 34. |
| [16] |
CRAINE J M, REICH P B. Functional-structural plant modelling ‖ leaf-level light compensation points in shade-tolerant woody seedlings[J]. New Phytologist, 2005, 166(3): 710. |
| [17] |
伍维模, 李志军, 罗青红, 等. 土壤水分胁迫对胡杨、灰叶胡杨光合作用-光响应特性的影响[J]. 林业科学, 2007, 43(5): 30. WU Weimo, LI Zhijun, LUO Qinghong, et al. Effects of soil water stress on light response curves of photosynthesis of Populus euphratica and Populus pruinosa[J]. Scientia Silvae Sinicae, 2007, 43(5): 30. |
| [18] |
许大全, 张玉忠, 张荣铣. 植物光合作用的光抑制[J]. 植物生理学通讯, 2002, 28(4): 237. XU Daquan, ZHANG Yuzhong, ZHANG Rongxian. Photoinhibition of photosynthesis in plants[J]. Plant Physiology Journal, 2002, 28(4): 237. |
| [19] |
周娜娜, 冯素萍, 高新生, 等. 植物光合作用的光抑制研究进展[J]. 中国农学通报, 2019, 35(15): 116. ZHOU Nana, FENG Suping, GAO Xinsheng, et al. Photoinhibition of plants photosynthesis: Research progress[J]. Chinese Agricultural Science Bulletin, 2019, 35(15): 116. |
| [20] |
王强, 温晓刚, 张其德. 光合作用光抑制的研究进展[J]. 植物学通报, 2003, 20(5): 539. WANG Qiang, WEN Xiaogang, Zhang Qide. Progress in studies on photoinhibition[J]. Chinese Bulletin of Botany, 2003, 20(5): 539. |
| [21] |
冯志立, 冯玉龙, 曹坤芳. 光强对砂仁叶片光合作用光抑制及热耗散的影响[J]. 植物生态学报, 2002, 26(1): 77. FENG Zhili, FENG Yulong, CAO Kunfang. Effects of light intensity on photoinhibition of photosynthesis and thermal dissipation in Amomum villosum Lour.[J]. Chinese Journal of Plant Ecology, 2002, 26(1): 77. |
| [22] |
张涛. 杨树苗木光合作用对土壤酚酸胁迫的响应[D]. 山东泰安: 山东农业大学, 2020: 37. ZHANG Tao. Response of poplar seedling photosynthesis to phenolic acid stress in soil[D]. Tai'an, Shandong: Shandong Agricultural University, 2020: 37. |
| [23] |
许楠, 张会慧, 李鑫, 等. 连作对烤烟生长特性和光合能力的影响[J]. 草业科学, 2012, 29(9): 1435. XU Nan, ZHANG Huihui, LI Xin, et al. Effects of continuous cropping on plant growth and photosynthetic capacity of flue-cured tobacco[J]. Pratacultural Science, 2012, 29(9): 1435. |
| [24] |
李辉, 张光灿, 谢会成, 等. 苯酚废水对垂柳叶片光合生理参数的影响[J]. 植物学报, 2016, 51(1): 31. LI Hui, ZHANG Guangcan, XIE Huicheng, et al. The effect of phenol concentration on photosynthetic physiological parameters of Salix babylonicaa[J]. Chinese Bulletin of Botany, 2016, 51(1): 31. |
| [25] |
LI Hui, XIE Huicheng, DU Zilong, et al. The effects of phenolic acid on nitrogen metabolism in Populus×euramericana 'Neva'[J]. Journal of Forestry Research, 2018, 29(1): 1. |
| [26] |
尹淇淋, 谢越. 酚酸类物质导致植物连作障碍的研究进展[J]. 安徽农业科学, 2011, 39(34): 20977. YI Qilin, XIE Yue. Research on the continuous cropping obstacles of plants caused by phenolic acids[J]. Journal of Anhui Agricultural Sciences, 2011, 39(34): 20977. |
| [27] |
黄容, 王永豪, 王昌全, 等. 凉攀区植烟土壤酚酸类物质的含量分布和变异特征[J]. 土壤, 2021, 53(4): 794. HUANG Rong, WANG Yonghao, WANG Changquan, et al. Content distributions and variations of phenolic acids in tobacco-planting soils of Liangpan region, Sichuan province[J]. Soils, 2021, 53(4): 794. |
| [28] |
李孙玲, 景跃波, 卯吉华, 等. 外源酚酸类物质对檀香幼苗生长和光合特性的影响[J]. 西部林业科学, 2020, 49(5): 104. LI Sunling, JING Yuebo, MAO Jihua, et al. Effects of exogenous phenolic acids on growth and photosynthesis characteristics of Santalum album seedlings[J]. Journal of West China Forestry Science, 2020, 49(5): 104. |
| [29] |
陈冉, 姜伟涛, 赵蕾, 等. 贝莱斯芽孢杆菌XC1对苹果连作土壤酚酸含量及平邑甜茶幼苗生长的影响[J]. 植物生理学报, 2021, 57(10): 1974. CHEN Ran, JIANG Weitao, ZHAO Lei, et al. Effects of Bacillus velezensis XC1 on phenolic acid content and the growth of Malus hupehensis seedlings under replant condition[J]. Plant Physiology Journal, 2021, 57(10): 1974. |
| [30] |
梁薇薇. 阔叶红松林林隙中凋落物酚酸释放及其对红松种子萌发与苗木生长的影响[D]. 哈尔滨: 东北林业大学, 2021: 66. LIANG Weiwei. The phenolic acids release of litter in Korean pine and broadleaved species mixed forest gaps and its effect on seed germination and seedlings growth of Korean pine[D]. Harbin: Northeast Forestry University, 2021: 66. |
| [31] |
梁薇薇, 陈立新, 段文标, 等. 酚酸物质对红松种子萌发及苗木生长和生理特性的影响[J]. 生态学报, 2021, 41(4): 1583. LIANG Weiwei, CHEN Lixin, DUAN Wenbiao, et al. Effects of phenolic acids on seed germination and seedling growth and physiological characteristics of Pinus koraiensis[J]. Acta Ecologica Sinica, 2021, 41(4): 1583. |