2. 江西农业大学林学院, 330045, 南昌
-
项目名称
- 江西省土壤侵蚀与防治重点实验室开放研究基金"基于草本-苔藓复合体的土质工程创面生态恢复技术"(KFJJ202004);江西省水利科技项目"生物结皮的水土保持效益及其人工快速培育技术"(201921YBKT05);江西省博士后择优资助项目"生物结皮覆盖下红壤侵蚀劣地水沙异源及侵蚀响应"(2019KY49);江西省水利科技项目"江西省典型堤防植草护坡生态控高技术研究与示范"(201922ZDKT10)
-
第一作者简介
- 沈发兴(1987—), 男, 博士研究生, 高级工程师。主要研究方向: 水土保持与生态修复。E-mail: 1423539235@qq.com
-
通信作者简介
- 喻荣岗(1977—), 男, 硕士, 正高级工程师。主要研究方向: 水土保持。E-mail: 3432596687@qq.com
-
文章历史
-
收稿日期:2021-06-09
修回日期:2022-06-06
2. 江西农业大学林学院, 330045, 南昌
2. College of Forestry, Jiangxi Agricultural University, 330045, Nanchang, China
稀土尾矿是稀土矿山经营对生态系统的遗留物,尾矿蓄水能力差,氮、磷养分和有机质等含量低,以及高浓度的有毒金属,致使稀土尾矿区自然植物定植缓慢,生态系统结构和功能重建延迟[1]。
生物结皮(biological soil crusts)是苔藓、地衣、藻类、细菌、真菌等生物组份及其代谢产物与土壤颗粒物胶结而成的复合体,约占全球陆地表面面积的12%[2]。苔藓植物是一类结构相对简单,能在其他陆地植物难以生存的环境中生长繁殖的高等植物,覆盖于土壤表面植被之间的裸露斑块,是我国南方生物结皮的主要组分。它可有效地丰富土壤养分,提高土壤稳定性,减少水土流失,具有重要的生态功能[3-4]。苔藓植物的形成和生态功能具有明显的时空分异,根据赣南离子型稀土矿区苔藓植物调查,共鉴定苔藓植物36科67属118种,其中优势科6科,依次为丛藓科(Pottiaceae)、叶苔科(Jungermanniaceae)、灰藓科(Hypnaceae)、牛毛藓科(Ditrichaceae)、凤尾藓科(Fissidentaceae)和真藓科(Bryaceae),优势属依次为真藓属(Bryum)、凤尾藓属(Fissidens)和牛毛藓属(Ditrichum)[5],可选择作为矿山尾矿生态修复的物种。
物种的存活、繁殖和扩散能力主要有内因、外因2个驱动因子[6]。内因是指植物体通过调节自身的生理过程来适应环境。外因有种间竞争等生物因子,水分、光照、温度、养分等因素的非生物因子,其中,水分和光照是影响其生存能力的重要因子[7]。苔藓植物通常高度依赖水,只有少数物种可以通过各种机制抵御一定程度的干旱[8]。作为小型、相对原始的陆地植物,苔藓植物缺少维管植物所具有的根系和外层蜡质表皮及气孔等保护性结构,虽然能够直接吸收其生长基质表面或空气中的营养物质和水分,但植物机体缺少水分保持能力,是典型的变水植物(poikilohydric plant)。所以它们比大多数高等植物对环境变化更敏感。一些研究探讨了过高的光照强度和干旱可以诱导植物的氧化或渗透胁迫,并影响其初级和次级代谢[9],但目前对亚热带稀土尾矿区苔藓植物的形成和发育机理尚缺乏认识,对它们同时暴露于过量光照强度和干旱环境下的存活与扩繁能力也知之甚少;因此,需要进一步了解光照与水分对苔藓植物净生产力的交互效应,从而对苔藓植物在恶劣的稀土尾矿环境下开展人工培育进行强有力的评估。
笔者通过室内稀土尾矿苔藓植物培育,分析在稀土尾矿裸地上苔藓植物培育过程中的主要影响因素,旨在了解稀土尾矿区苔藓植物的形成和发育特征。
1 材料与方法 1.1 尾矿来源尾矿于2018年9月采自江西省宁都县黄陂稀土整合矿区尾矿堆(中心坐标E 115°49′25″、N 26°44′18″)。稀土矿开采工艺为硫铵堆浸法,尾矿堆形成时间为2007年。尾矿堆土壤酸性大、贫瘠,水蚀严重,维管束植物生长稀疏,仅少量芒萁(Dicranopteris dichotoma)、芒(Miscanthus sinensis)、湿地松(Pinus elliottii)等(图 1)。为消除地表散落繁殖体和种子及植物根系的影响,去除地表 0~5 cm土层后,取5~15 cm土层。采集土壤运至实验室自然晾干,放置阴凉处备用。为模拟自然条件下稀土尾矿的土壤特性以保证苔藓培育效果,对试验土壤不过筛不研磨。稀土尾矿机械组成为:砂粒(sand)65.05%,粉粒(silt)34.05%,黏粒(clay)0.90%,pH值4.23,土壤有机碳2.11 g/kg,土壤密度1.31 g/cm3。

|
图 1 黄陂稀土整合矿区尾矿堆实景 Fig. 1 Actual scene of Huangpi rare earth integrated mine tailings pile |
接种的苔藓植物采自江西省九江市德安县江西水土保持生态科技园(E 115°23′~115°53′,N 29°10′~29°35′)的自然坡面。采样点苔藓植物的盖度为95%,平均厚度为(12.71±1.15) mm(n=12)。铲取苔藓结皮层,厚度为15 mm,装入样品袋带回实验室。经鉴定供试苔藓植物结皮主要由丛藓科和真藓科构成,包括毛口藓(Trichostomum brachydontium)、卷叶毛口藓(Trichostomum involutum)、扭叶丛本藓(Anoectangium stracheyanum)和纤枝短月藓(Brachymenium exile)等,以毛口藓为优势种。采集的苔藓结皮在室内通风阴凉处晒干并去除异物后,用植物粉碎机(DA MAI-TQ-500,电机转速28 000 RPM)粉碎20 s,制备成接种所需的苔藓植物种子土。
1.3 培育过程与方法试验中所用培育箱规格为380 mm×380 mm×150 mm(长×宽×高),底板均匀分布640个直径为2.76 mm的小孔。首先,在底部铺1层纱布,其次,将晾干的稀土尾矿矿渣以1.31 g/cm3的密度填入培育箱中,填土深度为100 mm。最后,将备制的苔藓植物种子土均匀铺植于基质上,铺植厚度为5 mm。
苔藓培育试验于2019年11月—2020年7月在江西水土保持生态科技园内的温室大棚内进行。采用光照强度、土壤含水量2个因素3水平全排列组合试验设计,共9个处理(表 1),每个处理5个重复。光照强度通过不同覆盖方式控制:无覆盖, 高光照强度10 100 lx;20 g/m2无纺布覆盖, 中光照强度5 900 lx;3纬线/25.4 mm遮阳网覆盖,低光照强度1 900 lx。土壤含水量分别为高土壤含水量28%~30%、中土壤含水量13%~15%和低土壤含水量5%~8%进行对比试验。
| 表 1 处理的因素及水平 Tab. 1 Factors and levels of treatments |
调控微喷设备(流量为3.5 L/h)实现不同处理表面土壤含水量。培育初期(0~20 d)每隔1 d测定1次土壤含水量,培育中期(21~60 d)及培育末期(61 d~试验结束)每隔10 d测定1次,并根据每个处理测定的含水量,适当调整预定喷水量,以确保土壤含水量在设定的范围内。整个培育实验过程中,苔藓的覆盖度和植株密度每10 d测定1次,当苔藓植株密度趋于平稳时试验结束,试验结束时测定苔藓生物量。为防止温湿度波动过大影响苔藓植物生长,通过温室温控系统以及湿帘系统对温室内的温度和空气湿度进行调控,培育试验期间,土壤地表温度在18.2~23.5 ℃之间,空气湿度控制在55%~65%之间。
1.4 观测指标及方法植株密度:每个培养框中随机选取1个20 mm×20 mm的小框,数出小框内的苔藓植株数(株/cm2),每10 d测定1次。
覆盖度:采用Li等[10]的点针样框法。
苔藓生物量:用打孔器在培育箱中取面积0.9 cm2的苔藓植物,放入0.1 mm土壤筛中清水冲洗,将收集的苔藓植物放入量杯置于烘箱中80 ℃杀青30 min后,65 ℃烘至恒质量,计算单位面积苔藓植物生物量[11](mg/cm2)。
土壤水分和土壤温度:采用便携式土壤多参数速测仪测定(TDR150,美国,Spectrum)各培养框内5 cm土层的土壤水分(%)和温度(℃)。
光照强度:采用TES-1332A(台湾)测定(lx)。
1.5 数据分析采用一般线性模型单变量多因素方差分析方法,对培育的苔藓植物覆盖度、植株密度、生物量进行统计分析;运用Excel 2013进行数据处理与绘图,数据表达为平均值±标准误(Mean ±SD),利用SPSS22.0对不同处理指标进行方差分析。
2 结果与分析 2.1 人工培育的苔藓覆盖度动态特征图 2为处理T2在第0、20、60和100天苔藓的表观动态。可以看出在各培育阶段苔藓发育明显。图 3为处理T1、T2、T3、T4、T5和T6在第100天苔藓的覆盖度,各处理间的差异表观。苔藓覆盖度随时间变化(图 4)表明,不同处理间苔藓覆盖度差异较大。第70天处理T1、T2和T4的覆盖度均高于94%,处理T3覆盖度为54.07%,而处理T5和T6最高的仅16.15%,处理T7、T8和T9在极低水平(<0.02%)。处理T2的覆盖度在第20~70天的培育期内均高于其他处理,且在第70天率先达到100%。T1与T4的覆盖度在第80天也达到100%。在第100天,所有处理的覆盖度趋于平稳。

|
图 2 处理T2在第0、20、60和100天苔藓的表观动态 Fig. 2 Apparent dynamics of bryophytes under treatment T2 at day 0, 20, 60 and 100 |

|
图 3 处理T1~T6在第100天苔藓的覆盖度 Fig. 3 Bryophytes coverage on day 100 under treatment T1-T6 |
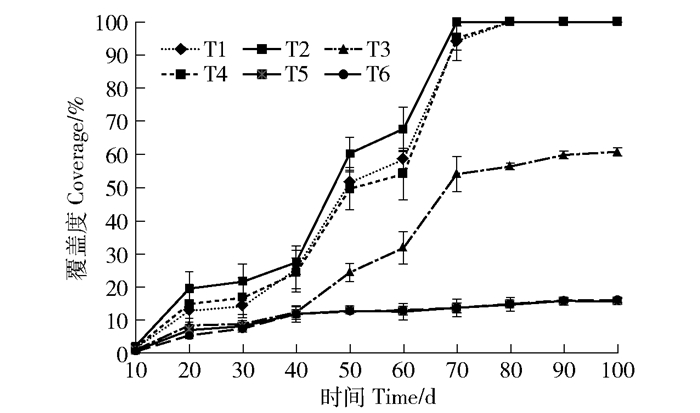
|
图 4 各处理苔藓覆盖度随时间变化 Fig. 4 Bryophytes coverage of each treatment changed with time |
多重比较和方差分析表明(图 5),在培育初期和培育中期,处理T2苔藓覆盖度显著高于其他处理,处理T1和T4显著高于处理T5和T6,处理T7、T8和T9显著低于其他处理(P<0.05)。在培育末期,处理T1、T2和T4覆盖度显著高于其他处理,处理T3覆盖度显著高于处理T5和T6,处理T7、T8和T9显著低于其他处理(P<0.001)。处理T7、T8和T9的覆盖度均<0.02%。
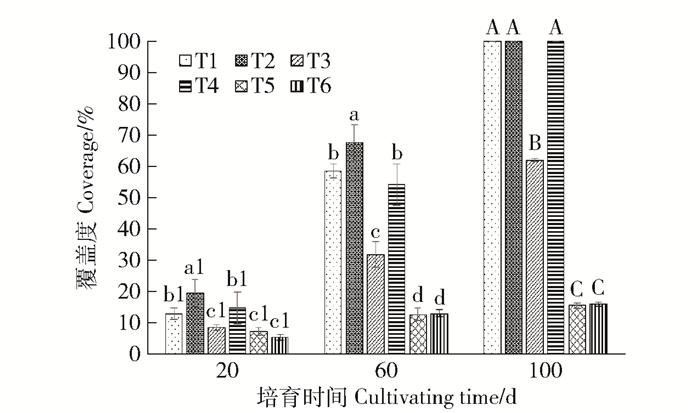
|
a1~c1为第20天各处理间的差异;a~d为第60天各处理间的差异;A~C为第100天各处理间的差异;P<0.05。 a1-c1 was the difference between different treatments on day 20. a-d is the difference between each treatment on day 60; A-C is the difference between each treatment at day 100; P < 0.05. 图 5 苔藓植物在第20、60和100天的覆盖度 Fig. 5 Coverage of bryophytes at day 20, 60 and 100 |
图 6反映稀土尾矿上苔藓人工培育期植株密度随着时间变化。随着培养时间的延长,处理T1、T2、T3和T4苔藓植物的密度逐渐增加,在0~40 d缓慢增加,41~100 d迅速增加,第120天后趋于平稳。在整个培育过程中,处理T5和T6的苔藓植物的密度都处于较低水平,至培育末期,植株密度均小于11.75株/cm2。处理T7、T8和T9的苔藓植株密度在整个培育期保持在极低水平(<0.25株/cm2, 图中无体现)。处理T2苔藓植株密度在整个培育期都处在最高水平,在第140天达到59.45株/cm2,处理T1和T4植株密度也均大于54.8株/cm2,处理T3植株密度为31.9株/cm2。多重比较(图 7)显示在培育末期,处理T1、T2和T4的苔藓植株密度都显著高于其他处理(P<0.05),处理T3的苔藓植株密度显著高于T5和T6。处理T7、T8和T9极显著低于其他处理(P<0.001)。

|
图 6 各处理苔藓植株数随时间变化 Fig. 6 Number of bryophytes varied with time |

|
a1~c1为第20天处理间的差异;a~c为第60天处理间的差异;A~C为第140天处理间的差异;P<0.05。 a1-c1 is the difference between treatments of day 20; a-c is the difference between treatments of day 60; A-C was the difference between treatments of day 140; P < 0.05. 图 7 苔藓植物在第20、60、140天的植株密度 Fig. 7 Plant densities of bryophytes at day 20, 60 and 140 |
从图 8可以看出,培育试验末期(第140天),不同处理间苔藓植物生物量差异显著(P<0.01),处理T2的生物量显著高于其他处理,达到86.79 mg/cm2,处理T1次之(70.15 mg/cm2),处理T4为36.18 mg/cm2,处理T3为24.46 mg/cm2;处理T5、T6处在极低水平(<3.23 mg/cm2),显著低于T1、T2、T3和T4;处理T7、T8和T9无生物量数据(图中无体现)。

|
a~e为处理间的差异; P<0.05。 a-e are the differences between treatments; P < 0.05. 图 8 试验末期(第140天)各处理苔藓生物量 Fig. 8 At the end of the experiment (day 140), bryophytes biomass of each treatment |
水分含量、光照强度及其交互作用对各培育期苔藓植物生长影响分析(表 2)表明,土壤水分对稀土尾矿苔藓植物培育初期、培育中期和培育末期的覆盖度和植株密度都具有极显著的作用(P<0.001)。光照强度对稀土尾矿苔藓植物培育初期、培育中期和培育末期的覆盖度都具有显著的作用(P<0.05);除培育初期外,光照强度对稀土尾矿苔藓培育中期、培育末期的植株密度都具有显著的作用(P<0.05);土壤水分和光照强度的交互作用,除培育初期外,对培育中期和末期的苔藓覆盖度和植株密度均具有显著影响(P<0.05)。土壤水分和光照强度及其交互作用,对培育末期苔藓植物生物量具有极显著影响(P<0.001)。
| 表 2 水分含量、光照强度及其交互作用对各培育期苔藓植物覆盖度、植株密度、生物量的显著性分析 Tab. 2 Significance analysis of moisture content, light intensity and their interactions on the coverage, plant density and biomass of bryophytes in each cultivation period |
苔藓植物对水的反应可分为内水性类型和外水性类型,内水性类型(如真藓科)的茎中央具有良好的输水组织中轴,茎中央多具小型后壁细胞束,经假根吸取水分和养料后,向植物体上部输送;外水性类型(如丛藓科)的茎中央多无组织上的明显分化,当生境中缺少雨水或者着生基质中的水分丧失后,苔藓植物会随之迅速失去水分,进入处于生理干旱的状态,当雨水或者其他外来水资源恢复时,苔藓植物个体可进行全面水分吸收,恢复包括光合作用在内的各项生理功能[12]。
尾矿区植被稀疏,降雨后快速形成地表径流并发育大量沟壑,土壤入渗减少, 最终永久丧失土地生产力。水分成为稀土尾矿区生态系统恢复功能和结构的关键因子之一,对植物生长具有重要影响。本研究显示,地表土壤含水量是影响稀土尾矿苔藓植物发育的最主要因素,对苔藓植物的覆盖度、植株密度和生物量均有着显著作用。在培育期内,随着地表土壤含水量的增加,苔藓植物的覆盖度、植株密度和生物量均呈增加趋势;当地表土壤含水量在140 d内一直处于低水平时,苔藓植物的覆盖度、植株密度和生物量均处于极低的水平,这与已有研究结论[13]相似。可解释如下:首先,苔藓植物的繁殖主要依靠配子体实现,接种材料中的苔藓植物茎叶碎片在充分吸水后进入复活状态,复活后的苔藓植物体在茎的叶腋部分萌发新的配子体,之后产生新生小植株。这些小植株在充分水分条件下,细胞分裂产生原丝体,进一步扩大苔藓植物植株密度和覆盖度。其次,苔藓植物缺乏输导和蒸发系统,植株体内水分难以通过自身结构控制,极易失去水分[14]。同时,苔藓植物在长期的进化过程中形成了许多特殊的生理特征和形态结构来适应干旱胁迫,使其具有在干旱—复水交替环境下存活的能力。苔藓植物体在干燥的环境中体内含水量很低。一旦环境变湿,它们就能迅速吸收水分,恢复正常的新陈代谢[15]。这可能与苔藓植物体内保护酶活性、丙二醛、渗透调节物质等相关[16]。但当着生基质得不到外来水源补充,苔藓植物便无以存活、繁殖和扩散(如处理T7、T8和T9), 原因在于水分是苔藓植物光合、呼吸作用的决定性因素, 只有当水分含量达到一定水平, 才有光合及呼吸的可能[17-18]。通过灌溉促进苔藓植物的营养繁殖,可使其成为植被恢复的理想成分。因此,进行苔藓植物培育必须要提高地表土壤含水量。
3.2 光照强度对稀土尾矿苔藓植物培育的作用苔藓植物的发育随着光照强度由高到底呈现出先增后减的趋势,光照强度过高或过低,都抑制苔藓植物的生长发育,与前人研究[19]类似,原因在于苔藓植物细胞内富含叶绿素,可进行光合作用来制造养分,提供植物体持续的生长直至产生新一代的个体[20],但苔藓植物的光合作用等代谢活动一般在中等光照强度范围内进行,适当的增加光照强度可以使苔藓植物的生长速率和生物量增加。随着光照强度从低光照增至中光照, 植物净光合速率逐渐增大, 当光照强度增大到光饱和点时, 净光合速率逐渐趋于稳定,但光照强度继续增大至高光照时, 植物净光合速率开始下降, 此时植物出现了光抑制现象[21]。同时,强光照会增加苔藓植物水分散失的速率进而间接抑制其光合作用[17]。在野外高等植被的冠层下、低洼地等中光照区,苔藓植物得以良好发育,而高等植被冠层郁闭度高、地表凋落物盖度高的弱光照区苔藓植物生长受到极大的制约,均可在一定程度上证实这一点[17, 22]。与本研究的结果不同,杨永胜[16]认为光照强度越低,苔藓植物发育越快,这是由于不同的苔藓植物种在生态特征和生物学上的差异以及周围生活环境的长期影响,导致不同苔藓植物种对光照强度的要求有很大的差异,在亚热带稀土尾矿区,矮丛集型和开放丛集型苔藓植物是矿区优势类群,适合用于矿区的生态修复。
3.3 稀土尾矿苔藓植物快速培育的可行性本研究的结果显示,在稀土尾矿上开展苔藓植物茎叶碎片接种培育,水分和光照是植物生长的重要资源,影响植物生长发育[23]。在低水分环境下(表层土壤含水量5%~8%),覆盖度、植株密度、生物量都极低,且各光照条件处理间差异不显著;在中水分环境下(表层土壤含水量13%~15%),中光照条件的覆盖度、植株密度、生物量都显著高于强光照和弱光照;在高水分环境下(表层土壤含水量28%~30%),光照强度为5 900 lx时,苔藓植物的覆盖度在70 d内可达100%,在实验末期生物量也最高,说明在这一条件下,开展稀土尾矿快速培育苔藓植物是可行的。值得注意的是,在自然条件下,可以通过试验中的无纺布覆盖方式进行光照条件的控制,然而持续的地表较高水平的表层土壤含水量相对难实现。
赣南稀土矿区年平均降雨量1 200 mm,每年4—6月的降雨量占到全年降雨量的56.4%,此时相对空气湿度较高,土壤水分也能得到较好保障。因此,建议在4月进入雨季前,在稀土尾矿中开展苔藓植物的人工培育,这样能够保证苔藓快速繁育期内有较好的表层土壤水分条件。Tian等[24]在腾格里沙漠固定沙丘开展的人工培养苔藓结皮研究表明,人工培育的苔藓植物在生长3—4个月后出现逐渐衰亡,因此,如何使人工苔藓植物在恶劣的稀土尾矿上长期可持续的生长是一个复杂的科学问题,在未来的研究中,要改进苔藓植物的培育方式,提高人工苔藓植物对干旱及强光的抵抗能力,使其能够在自然环境中持续健康发育。
4 结论1) 毛口藓、卷叶毛口藓、扭叶丛本藓、纤枝短月藓等苔藓植物种在稀土尾矿植被恢复过程中具有良好的适应性。
2) 土壤含水量和光照强度是苔藓植物生长发育的重要影响因素,对稀土尾矿苔藓植物的覆盖度、植株密度及生物量的变化有显著影响。水分含量越高,苔藓植物覆盖度、植株密度和生物量越大。高水分(28%~30%)条件下,80 d内苔藓植物覆盖度达到100%,第140天植株密度大于54.8株/cm2,不同光照强度间差异不显著;高水分条件下,不同光照强度间苔藓植物生物量差异显著,生物量自高到低依次为86.79 mg/cm2(中光照强度5 900 lx)、70.15 mg/cm2(高光照强度10 100 lx)、36.18 mg/cm2(低光照强度1 900 lx)。中水分(13%~15%)中光照强度条件下覆盖度为54.07%,中水分高光照强度、中水分低光照强度条件下,最高覆盖度仅为16.15%,前者与后两者间的差异显著。低水分条件(5%~8%)下,各光照强度苔藓植物均无法正常生长发育。
3) 培育稀土尾矿苔藓植物的最佳条件组合是地表土壤含水量28%~30%+光照强度5 900 lx(无纺布覆盖)。
本试验中的苔藓物种鉴定由南昌大学生命科学学院蔡奇英帮助完成。| [1] |
ZHENG Taihui, YANG Jie, HUANG Pengfei, et al. Comparison of trace element pollution, sequential extraction, and risk level in different depths of tailings with different accumulation age from a rare earth mine in Jiangxi province, China[J]. Journal of Soils and Sediments, 2018, 18(3): 992. DOI:10.1007/s11368-017-1853-7 |
| [2] |
EMILIO R, JAYNE B, BURKHARD B, et al. Dryland photoautotrophic soil surface communities endangered by global change[J]. Nature Geoscience, 2018, 11(3): 185. DOI:10.1038/s41561-018-0072-1 |
| [3] |
SONG Zhengshan, STEFFEN Seitz, LI Jian, et al. Tree diversity reduced soil erosion by affecting tree canopy and biological soil crust development in a subtropical forest experiment[J]. Forest Ecology and Management, 2019, 444: 69. DOI:10.1016/j.foreco.2019.04.015 |
| [4] |
HUA Peilei, WEI Zhanga, XIAO Lumei, et al. Moss-dominated biological soil crusts modulate soil nitrogen following vegetation restoration in a subtropical karst region[J]. Geoderma, 2019, 352: 70. DOI:10.1016/j.geoderma.2019.05.047 |
| [5] |
李斌, 蔡奇英, 刘以珍, 等. 赣南离子型稀土矿区苔藓植物区系及生活型分析[J]. 南昌大学学报(理科版), 2021, 45(1): 63. LI Bin, CAI Qiying, LIU Yizhen, et al. Flora and life form of bryophytes in ionic rare earth mines of southern Jiangxi[J]. Journal of Nanchang University (Natural Science), 2021, 45(1): 63. DOI:10.3969/j.issn.1006-0464.2021.01.011 |
| [6] |
成向荣, 邢文黎, 苑海静, 等. 披针叶茴香对变化光环境的表型可塑性[J]. 生态学报, 2019, 39(6): 1935. CHENG Xiangrong, XING Wenli, YUAN Haijing, et al. Phenotypic plasticity of Illicium lanceolatum in response to varied light environments[J]. Acta Ecologica Sinica, 2019, 39(6): 1935. |
| [7] |
GREGORY P, TENNANT D, BELFORD R. Root and shoot growth, and water and light use efficiency of barley and wheat crops grown on a shallow duplex soil in a Mediterranean-type environment[J]. Australian Journal of Agricultural Research, 1992, 43(3): 555. DOI:10.1071/AR9920555 |
| [8] |
CECILIA R, IMMA P S, VALENTINA C, et al. Differential contribution of individual dehydrin genes from Physcomitrella patens to salt and osmotic stress tolerance[J]. Plant Science, 2012, 190: 89. DOI:10.1016/j.plantsci.2012.03.009 |
| [9] |
MELVIN J O, JEFF V W, et al. Bryophytes as experimental models for the study of environmental stress tolerance: Tortula ruralis and desiccation-tolerance in mosses[J]. Plant Ecology, 2000(1): 151. |
| [10] |
LI Xinrong, HE Zhumin, STEFAN Z, et al. Micro-geomorphology determines community structure of biological soil crusts at small scale[J]. Earth Surface Process and Landform, 2010, 35(8): 932. DOI:10.1002/esp.1963 |
| [11] |
杨永胜, 冯伟, 袁方, 等. 快速培育黄土高原苔藓结皮的关键影响因子[J]. 水土保持学报, 2015, 29(4): 289. YANG Yongsheng, FENG Wei, YUAN Fang, et al. Key influential factors of rapid cultivation of moss crusts on Loess Plateau[J]. Journal of Soil and Water Conservation, 2015, 29(4): 289. |
| [12] |
吴鹏程, 贾渝, 王庆华, 等. 中国苔藓图鉴[M]. 北京: 中国林业出版社, 2018: 33. WU Pengcheng, JIA Yu, WANG Qinghua, et al. Chinese illustrated bryophytes[M]. Beijing: China Forestry Publishing House, 2018: 33. |
| [13] |
LAN Shubin, WU Li, ZHANG Delu, et al. Analysis of environmental factors determining development and succession in biological soil crusts[J]. Science of the Total Environment, 2015, 538: 492. DOI:10.1016/j.scitotenv.2015.08.066 |
| [14] |
吴玉环, 黄国宏, 高谦, 等. 苔藓植物对环境变化的响应及适应性研究进展[J]. 应用生态学报, 2001, 12(6): 943. WU Yuhuan, HUANG Guohong, GAO Qian, et al. Research advance in response and adaptation of bryophytes to environmental change[J]. Chinese Journal of Applied Ecology, 2001, 12(6): 943. DOI:10.3321/j.issn:1001-9332.2001.06.033 |
| [15] |
刘俊华, 包维楷. 冷杉天然林下地表主要苔藓斑块生物量及其影响因素[J]. 植物学通报, 2006, 23(6): 684. LIU Junhua, BAO Weikai. Major bryophyte patch biomass and relation with environmental factors in a coniferous forest of the eastern Qinghai-Tibetan Plateau[J]. Chinese Journal of Applied Ecology, 2006, 23(6): 684. DOI:10.3969/j.issn.1674-3466.2006.06.010 |
| [16] |
杨永胜. 黄土高原苔藓结皮的快速培育及其对逆境的生理响应研究[D]. 北京: 中国科学院研究生院(教育部水土保持与生态环境研究中心), 2015: 81. YANG Yongsheng. Study on rapid cultivation of moss-dominated crusts on Loess Plateau and their physiological response to stress[D]. Beijing: Research Center of Soil and Water Conservation and Ecological Environment, Chinese Academy of Sciences and Ministry of Education, 2015: 81. |
| [17] |
赵允格, 许明祥, JAYNE Belnap. 生物结皮光合作用对光温水的响应及其对结皮空间分布格局的解译: 以黄土丘陵区为例[J]. 生态学报, 2010, 30(17): 4668. ZHAO Yunge, XU Mingxiang, JAYNE B. Response of biocrusts photosynthesis to environmental factors: A possible explanation of the spatial distribution of biocrusts in the hilly Loess Plateau region of China[J]. Acta Ecologica Sinica, 2010, 30(17): 4668. |
| [18] |
ANTONINKA A, BOWKER M A, REED S C, et al. Production of greenhouse-grown biocrust mosses and associated cyanobacteria to rehabilitate dryland soil function[J]. Restoration Ecology, 2016(24): 324. |
| [19] |
XU Shujun, YIN Chunsheng, HE Ming, et al. A technology for rapid reconstruction of moss-dominated soil crusts[J]. Environmental Engineering Science, 2008, 25(8): 1129. DOI:10.1089/ees.2006.0272 |
| [20] |
HUI R, LI X R, JIA R L, et al. Photosynthesis of two moss crusts from the Tengger Desert with contrasting sensitivity to supplementary UV-B radiation[J]. Photosynthetica, 2014, 52(1): 36. DOI:10.1007/s11099-014-0003-3 |
| [21] |
CRAVEN D, DENT D, BRADEN D, et al. Seasonal variability of photosynthetic characteristics influences growth of eight tropical tree species at two sites with contrasting precipitation in Panama[J]. Forest Ecology and Management, 2010(10): 261. |
| [22] |
BERKELEY A, THOMAS A D, DOUGILL A J. Cyanobacterial soil crusts and woody shrub canopies in Kalahari rangelands[J]. African Journal Ecology, 2005(43): 137. |
| [23] |
ZHENG Y P, LI R Q, GUO L L, et al. Temperature responses of photosynthesis and respiration of maize (Zea mays) plants to experimental warming[J]. Russian Journal of Plant Physiology, 2018, 65(4): 524. DOI:10.1134/S1021443718040192 |
| [24] |
TIAN Guiquan, BAI Xueliang, XU Jie, et al. Experimental studies on the natural restoration and the artificial culture of the moss crusts on fixed dunes in the Tengger Desert, China[J]. Frontiers of Biology in China, 2006, 1(1): 13. DOI:10.1007/s11515-005-0006-3 |
 2022, Vol. 20
2022, Vol. 20 
