2. 宁夏盐池毛乌素沙地生态系统国家定位观测研究站,751500,宁夏盐池;
3. 巴彦淖尔市沙漠综合治理中心,015000,内蒙古巴彦淖尔;
4. 巴彦淖尔市封育飞播管理站, 015000, 内蒙古巴彦淖尔
中国水土保持科学  2022, Vol. 20 2022, Vol. 20  Issue (2): 65-71. DOI: 10.16843/j.sswc.2022.02.009 Issue (2): 65-71. DOI: 10.16843/j.sswc.2022.02.009 |
土地盐碱化是全球面临的重大环境问题,严重制约着农林业的发展。据不完全统计,全球盐碱化土地面积约为9.5亿hm2,占陆地总面积的7.23%[1]。我国西北干旱、半干旱沙区由于气候干旱,降水量远小于蒸发量,土壤盐碱化现象尤为严重。盐碱胁迫会对植物产生渗透胁迫、活性氧胁迫、离子毒害,也会影响植物渗透调节机制,造成植物生长受限甚至死亡[2]。
适沙耐盐植物的选育是土地盐碱化地区生态修复的重要环节。油沙豆(Cyperus esculentus)属禾本目莎草科莎草属多年生草本植物,具有耐寒耐盐碱的特性,且蛋白、油脂含量高,兼具生态和经济双重效益。近年来,为适宜性地开发和利用沙区土地,发展生态沙产业,油沙豆在北方风沙盐碱土上广泛引种[3]。现阶段国外对油沙豆的研究多集中在农业生产[4-5]和食品加工[6-7]等方面,对油沙豆逆境生理生长探究较少;国内有学者初步研究盐胁迫对油沙豆块茎萌发与幼苗生长的影响[8],但目前缺乏对油沙豆应对盐碱双因素胁迫的抗逆机制研究[9];因此,笔者模拟盐、碱双因素交叉胁迫对油沙豆生长和生理过程的影响,通过对油沙豆抗氧化酶系统活性、渗透调节和激素调节机制的探究,揭示其抗盐耐碱机制,从而为油沙豆在北方盐碱土的引种提供理论依据。
1 研究区概况本研究在北京林业大学水土保持学院宁夏盐池毛乌素沙地生态系统国家定位观测站进行,该观测站位于E 106°30′~107°41′,N 37°04′~38°10′,属半干旱气候区,白天气温和相对湿度(relative humidity,RH)介于-29.4~37.5℃和49%~55%之间。年平均降水量约为292mm,降水集中在7—9月,占年全年降水量的60%~75%。年潜在蒸发量为2024mm,约为年平均降水量的7倍。土壤类型是风成沙土,区内植被以沙生、旱生植物为主。
2 材料与方法 2.1 试验材料制备于2020年5月将油沙豆种子播种于盛有沙土的穴盘中,每穴播种1粒,待出苗15d后,选取长势一致的幼苗进行盆栽移植。于盆栽内缓苗10d后开始胁迫试验处理。
2.2 试验方法所有盆栽置于遮雨棚下,以消除降水影响。试验设置1个对照(C0),3个盐分梯度、2个碱性梯度共6个盐碱交叉胁迫处理,具体设置及对应pH(表 1),盐浓度以NaCl溶液为准,pH用NaCl和NaHCO3调节。每个处理设置12个重复,共处理植株84株。纯盐胁迫处理浇灌含有目标浓度NaCI溶液的1/2 Hoagland营养液;碱性盐胁迫浇灌含有目标浓度NaCl和NaHCO3混合溶液的1/2 Hoagland营养液。每48h浇灌相应梯度溶液以达到饱和含水率以上出现渗漏为准,以保持盆栽中胁迫液浓度恒定。胁迫处理15d后,测定各处理下植物生长参数及生理指标。
| 表 1 各处理组合盐胁迫对应pH Tab. 1 Corresponding pH of combined salt stress in each treatment |
用刻度尺(精度0.1mm)测量株高(沙面以上为株高)。将整株植物取出放入105℃的烘箱中杀青10min后,于80℃烘干至恒质量,分别称量地上与地下部分干质量,并计算幼苗根冠比(R/S)。
2.3.2 细胞电导率的测定采用浸泡法[10]测定植株叶片和根系相对电导率,每个处理重复测定3株。
2.3.3 抗逆生理生化指标的测定抗氧化酶系统中,超氧化物歧化酶(superoxide dismutase,SOD)活性采用氯化硝基四氮哩蓝(nitrotetrazolicem blue chloride,NBT)还原法[11]测定;过氧化物酶(peroxidase,POD)活性采用愈创木酚法[12]测定。渗透调节物质中,游离的脯氨酸(proline,Pro)含量的测定采用酸性茚三酮显色法测定[13];可溶性糖(soluble sugar,SS)含量测定采用蒽酮比色法[12];激素调节以脱落酸(abscisic acid,ABA)为主,ABA含量用酶联免疫法(enzyme linked immnosorbent assay,ELISA)[14]测定。以上指标每个处理随机选取3株试验植株作为重复,叶片与根系分别进行测定。
2.4 数据分析用SPSS软件进行ANOVA单因素方差分析和多重比较,检验各盐碱浓度梯度处理间的差异显著性;采用双因素方差分析法,检验盐和碱胁迫对油沙豆生长和生理生化指标是否具有交互效应。采用R package ggplot version 4.0.4制图。
3 结果与分析 3.1 对油沙豆生长的影响单盐胁迫下,轻度胁迫对油沙豆株高生物量影响不显著;随盐浓度升高,在中度和重度胁迫下,油沙豆植株的生长受到显著抑制,根冠比显著增大(表 2)。
| 表 2 盐碱交互胁迫对油沙豆生长指标的影响 Tab. 2 Effects of salt-alkali co-stress on the growth indexes of Cyperus esculentus |
碱性盐胁迫下,轻度胁迫对油沙豆生物量有促进作用。但在250mmol/L盐浓度下,碱性盐胁迫对植株生长的抑制作用显著大于单盐胁迫,表现为株高、生物量显著低于单盐胁迫,根冠比显著高于单盐胁迫。双因素方差分析表明,盐、碱2因素对油沙豆各生长指标的影响存在交互效应。
单盐胁迫和碱性盐胁迫在250mmol/L盐浓度下均有植株萎蔫死亡,单盐胁迫油沙豆植株死亡数为1株,死亡率为8.33%;碱性盐胁迫死亡数为2株,死亡率为16.67%。碱性盐胁迫下油沙豆的死亡率高于单盐胁迫。
3.2 对油沙豆生理生化的影响 3.2.1 叶片和根系细胞相对电导率随着盐胁迫浓度的增大,植物叶片和根系电导率不断上升(图 1),表明随着盐胁迫程度加重,植物细胞膜透性不断增大。双因素方差分析表明,盐、碱2因素对油沙豆叶片电导率的影响存在交互效应。
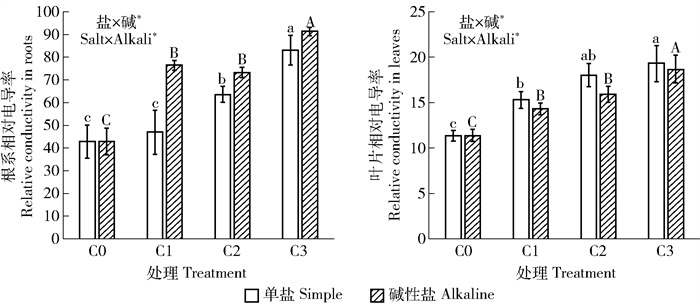
|
图 1 不同盐碱处理对油沙豆叶片和根系电导率的影响 Fig. 1 Effects of different saline-alkali treatments on the electrical conductivities of Cyperus esculentus leaves and roots |
与空白对照相比,单盐胁迫显著增大了植物叶片和根系的各类抗氧化酶活性(P < 0.05)。随着盐浓度的增大,POD和SOD活性呈现先升后降的趋势,分别在中度、轻度盐胁迫条件下达到最大值(图 2)。可见,适度盐胁迫对于激发植物抗氧化酶系统活性具有促进作用,重度盐胁迫反而会抑制抗氧化酶系统的功能活性。
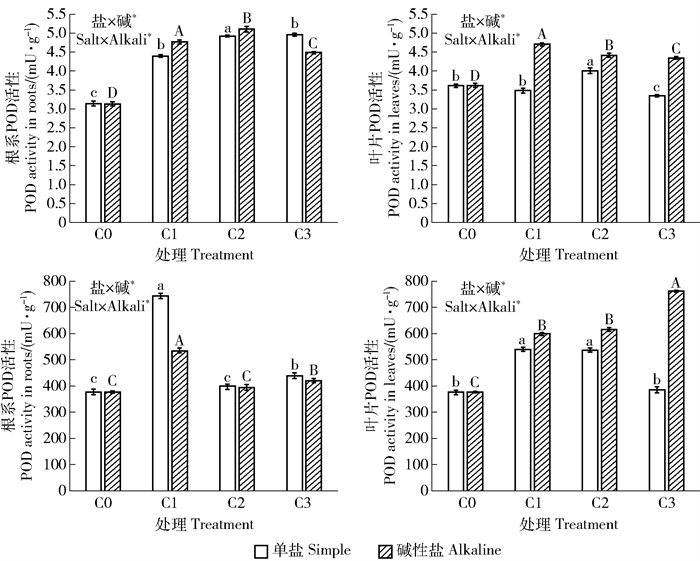
|
图 2 不同盐碱处理对油沙豆叶片和根系抗氧化酶活性的影响 Fig. 2 Effects of different saline-alkali treatments on the antioxidant enzyme activities of Cyperus esculentus leaves and roots |
与空白对照相比,碱性盐胁迫也显著提高植物叶片和根系的各类抗氧化酶活性(P < 0.05)。在叶片中,SOD活性均随着盐浓度的增大而持续上升。双因素方差分析表明,盐、碱2因素对油沙豆叶片和根系的抗氧化酶活性具有交互效应。
3.2.3 渗透调节物质含量与空白对照相比,单盐胁迫显著增大植物叶片和根系的各类渗透调节物质含量(P < 0.05)。渗透调节物质含量普遍在轻度和中度盐胁迫下达到最大值,即随着盐浓度的增大,渗透调节物质含量呈现先升后降的趋势(图 3)。可见,适度胁迫对于促进植物有机物的合成,重度胁迫反而会抑制该响应机制。
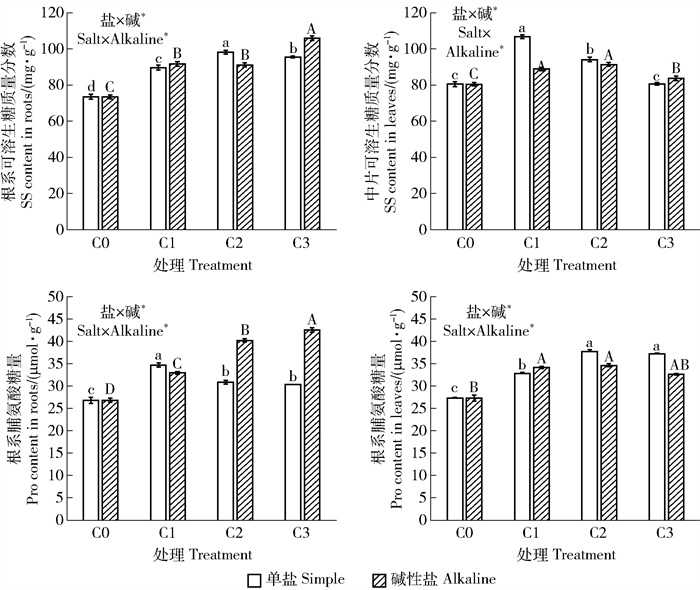
|
图 3 不同盐碱处理对油沙豆渗透调节物质含量的影响 Fig. 3 Effects of different saline-alkali treatments on the contents of osmotic adjustment substances in Cyperus esculentus |
与空白对照相比,碱性盐胁迫同样提升植物叶片和根系的各类渗透调节物质含量(P < 0.05)。除叶片中可溶性糖以外,其他叶片和根系中的渗透调节物质均随着盐浓度的增大而持续上升。相同盐浓度下,碱性盐胁迫的根系渗透调节物质含量高于单盐胁迫。双因素方差分析表明,盐、碱2因素对油沙豆叶片和根系的渗透调节物质含量的影响具有交互效应。
3.2.4 脱落酸含量随着盐胁迫浓度的增大,植物叶片和根系内ABA含量不断上升(图 4),表明在盐胁迫下,植物通过合成大量ABA来适应逆境的胁迫。在单盐和碱性盐胁迫下,叶片ABA含量均随盐浓度的增加呈现上升趋势;在单盐胁迫下,根系ABA含量与叶片规律一致;在碱性盐胁迫下,根系ABA含量在轻度和中度胁迫达到峰值,在重度胁迫下显著降低,这可能与该胁迫浓度造成植物根系永久性损害而丧失激素调节能力有关。双因素方差分析结果可知,盐、碱2因素对油沙豆ABA的影响存在交互效应。
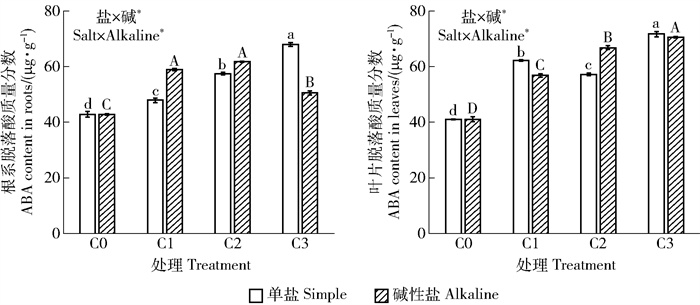
|
图 4 不同盐碱处理对油沙豆脱落酸(ABA)含量的影响 Fig. 4 Effects of different saline-alkali treatments on the contents of abscisic acid (ABA) in Cyperus esculentus |
植物生长指标是植物对外界环境响应的综合反映,盐碱胁迫通过提高土壤环境的渗透压,从而破坏植物细胞膜脂结构,影响植物吸收水分和营养元素,抑制植物的生长[15]。笔者发现盐碱胁迫显著增大植物叶片和根系的电导率,表明盐碱胁迫对油沙豆细胞膜的功能产生一定破坏。在单盐胁迫和碱性盐胁迫下,油沙豆的生长指标均随着盐浓度的增加而显著降低,这与杨鹭生等[8]研究结果一致。根冠比指标是植物应对逆境的一种常见表型响应,笔者发现盐碱胁迫显著增大油沙豆的根冠比,即植物通过增大根系生物量分配以适应土壤逆境。以往研究[16]表明,碱性条件的高pH会严重破坏植物根系,影响根系结构和功能。在本研究中也有类似规律,盐碱交互作用对油沙豆生长指标影响显著,pH升高加剧盐胁迫对油沙豆生长的抑制。
植物响应盐碱胁迫的机制通常有渗透调节、活性氧清除体系和内源激素调节3种途径。研究表明,脯氨酸和可溶性糖含量的增加会改变细胞内外渗透势,从而显著提高植物的抗逆性[17]。在盐碱胁迫下,油沙豆叶片和根系中的渗透调节物质含量显著升高,表明油沙豆通过启动其渗透调节机制,积累渗透调节物质来调整细胞渗透压以保证植物水分有效吸收来维持植株生长。这与翅碱蓬(Saline Seepweed)等典型沙区灌草植物受盐胁迫的响应一致[18]。在重度盐胁迫下,碱性盐条件的根系渗透调节物质含量显著高于单盐胁迫。该结果表明,碱性环境进一步激发了植物根系的渗透调节机制。
除了渗透调节以外,抗氧化酶系统作为植物重要的抗逆机制,对清除盐碱胁迫造成的活性氧起关键作用[15]。笔者发现油沙豆叶片和根系的抗氧化酶系统的活性在中度盐胁迫下达到峰值;碱性盐条件下,抗氧化酶活性显著低于单盐胁迫。该结果表明,抗氧化酶系统抗逆机制在中度胁迫下具有较好的效应,而高盐浓度和碱性条件会损害酶系统,抑制酶活性,引发代谢紊乱,从而削弱植物清除活性氧机制的有效性,该机制也在其他研究中得到证实[19]。
内源激素是植物应激反应中信号传导中的重要组成部分,其中,ABA是响应逆境的重要激素,ABA的合成能够调节气孔关闭,从而缓解植物由于盐碱胁迫造成的水分亏缺[20]。笔者发现单盐和碱性盐均会显著增加油沙豆叶片和根系ABA含量,且随着胁迫浓度的增大,叶片ABA含量持续升高;然而,碱性条件导致根系ABA含量在重度胁迫下出现骤减,结合双因素方差分析结果,碱胁迫加剧了高盐浓度下对根系的抑制,造成激素合成受阻。这与孙若峥等[20]研究结果一致,即油沙豆抵御盐碱胁迫的ABA激素调节受到抑制。
5 结论油沙豆对盐碱胁迫具有一定的耐受度,盐浓度低于150mmol/L的胁迫环境对油沙豆表型生长和生理过程影响不大;在>150mmol/L的中度和重度盐胁迫造成油沙豆细胞膜结构和功能的破坏,叶片和根系组织电导率增大,种苗的生长受到抑制。碱性条件对盐胁迫的影响有叠加效益,加剧植物的受胁迫程度。油沙豆植株通过增大根冠比以调节生物量分配以提高根系吸水效率,并通过增加渗透调节物质含量、提高抗氧化酶活性、合成内源脱落酸等生理生化机制来抵御盐碱胁迫。研究表明,油沙豆生态学的存活盐浓度阈值为250mmol/L。
| [1] |
王利民, 陈金林, 梁珍海, 等. 盐碱土改良利用技术研究进展[J]. 浙江林学院学报, 2010, 27(1): 143. WANG Limin, CHEN Jinlin, LIANG Zhenhai, et al. Research progress of improvement and utilization of saline and alkali soil[J]. Journal of Zhejiang Forestry College, 2010, 27(1): 143. |
| [2] |
李子英, 丛日春, 杨庆山, 等. 盐碱胁迫对柳树幼苗生长和渗透调节物质含量的影响[J]. 生态学报, 2017, 37(24): 8511. LI Ziying, CONG Richun, YANG Qingshan, et al. Effects of saline-alkali stress on growth and osmotic adjustment substances in willow seedlings[J]. Acta Ecologica Sinica, 2017, 37(24): 8511. |
| [3] |
王瑞元, 王晓松, 相海. 一种多用途的新兴油料作物——油沙豆[J]. 中国油脂, 2019, 44(1): 1. WANG Ruiyuan, WANG Xiaosong, XIANG Hai. A multi-purpose novel oil crop:Cyperus esculentus[J]. China Oils and Fats, 2019, 44(1): 1. DOI:10.3969/j.issn.1003-7969.2019.01.001 |
| [4] |
PASCUAL-SEVA N, PASCUAL B. Determination of crop coefficient for chufa crop (Cyperus esculentus L. var. sativus Boeck.) for sustainable irrigation scheduling[J]. Science of the Total Environment, 2021(768): 144975. |
| [5] |
NAU'URIA P S, ALBERTO S B, SALVADOR L G, et al. Influence of different drip irrigation strategies on irrigation water use efficiency on chufa (Cyperus esculentus L. var. sativus Boeck.) crop[J]. Agricultural Water Management, 2018(208): 406. |
| [6] |
ADELEKAN E O, ADEGUNWA M O, ADEBOWALE A A, et al. Quality evaluation of snack produced from black pepper (Piper nigrum L.), plantain (Musa paradisiaca L.), and tigernut (Cyperus esculentus L.) flour blends[J]. Cogent Food & Agriculture, 2019, 5(1): 1614285. |
| [7] |
ALAVA C, VERDU S, BARAT J M, et al. Enrichment of chips with fibre from a tiger-nut (Cyperus esculentus) milk co-product at 'source of fibre foods' and 'high fibre content foods' levels: Impact on processing, physico- chemical and sensory properties[J]. International Journal of Food Science & Technology, 2019, 54(3): 908. |
| [8] |
杨鹭生, 李国平. NaCl胁迫对油沙豆块茎萌发与幼苗生长的影响[J]. 资源开发与市场, 2014, 30(7): 771. YANG Lusheng, LI Guoping. Study on effects of NaCl stress on tuber germination and seedling growth of Cyperus esculentus[J]. Resource Development & Market, 2014, 30(7): 771. DOI:10.3969/j.issn.1005-8141.2014.07.002 |
| [9] |
胡涛, 张鸽香, 郑福超, 等. 植物盐胁迫响应的研究进展[J]. 分子植物育种, 2018, 16(9): 264. HU Tao, ZHANG Gexiang, ZHENG Fuchao, et al. Research progress in plant salt stress response[J]. Molecular Plant Breeding, 2018, 16(9): 264. |
| [10] |
史清华, 高建社, 王军, 等. 5个杨树无性系抗寒性的测定与评价[J]. 西北植物学报, 2003, 23(11): 1937. SHI Qinghua, GAO Jianshe, WANG Jun, et al. Determination and evaluation of cold resistance of 5 poplar clones[J]. Acta Botanica Boreali-Occidentalia Sinica, 2003, 23(11): 1937. DOI:10.3321/j.issn:1000-4025.2003.11.015 |
| [11] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 72. LI Hesheng. Principle and technology of plant physiological and biochemical experiments[M]. Beijing: Higher Educaiton Press, 2000: 72. |
| [12] |
王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006: 167. WANG Xuekui. Principle and technology of plant physiological and biochemical experiments[M]. Beijing: Higher Educaiton Press, 2006: 167. |
| [13] |
张殿忠, 汪沛洪, 赵会贤. 测定小麦叶片游离脯氨酸含量的方法[J]. 植物生理学通讯, 1990(4): 62. ZHANG Dianzhong, WANG Peihong, ZHAO Huixian. Determination of the content of free proline in wheat leaves[J]. Plant Physiology Communications, 1990(4): 62. |
| [14] |
吴颂如, 陈婉芬, 周燮. 酶联免疫法(ELISA)测定内源植物激素[J]. 植物生理学通讯, 1988(5): 53. WU Songru, CHEN Wanfen, ZHOU Xie. Enzyme linked immunosorbent assay for endogenous plant hormones[J]. Plant Physiology Communication, 1988(5): 53. |
| [15] |
王佺珍, 刘倩, 高娅妮, 等. 植物对盐碱胁迫的响应机制研究进展[J]. 生态学报, 2017, 37(16): 5565. WANG Quanzhen, LIU Qian, GAO Yani, et al. Review on the mechanisms of the response to salinity-alkalinity stress in plants[J]. Acta Ecologica Sinica, 2017, 37(16): 5565. |
| [16] |
郭瑞, 李峰, 周际, 等. 亚麻响应盐、碱胁迫的生理特征[J]. 植物生态学报, 2016, 40(1): 69. GUO Rui, LI Feng, ZHOU Ji, et al. Eco-physiological responses of linseed (Linum usitatissimum) to salt and alkali stresses[J]. 植物生态学报, 2016, 40(1): 69. |
| [17] |
杨升, 张华新, 刘涛. 盐胁迫对16种幼苗渗透调节物质的影响[J]. 林业科学研究, 2012, 25(3): 269. YANG Sheng, ZHANG Huaxin, LIU Tao. Effect of salt stress on osmotic ajustment substances in plants[J]. Forest Research, 2012, 25(3): 269. DOI:10.3969/j.issn.1001-1498.2012.03.002 |
| [18] |
李悦, 陈忠林, 王杰, 等. 盐胁迫对翅碱蓬生长和渗透调节物质浓度的影响[J]. 生态学杂志, 2011, 30(1): 72. LI Yue, CHEN Zhonglin, WANG Jie, et al. Effects of salt stress on Suaeda heteroptera Kitagawa growth and osmosis-regulating substance concentration[J]. Chinese Journal of Ecology, 2011, 30(1): 72. |
| [19] |
刘正祥, 张华新, 杨升, 等. NaCI胁迫对沙枣幼苗生长和光合特性的影响[J]. 林业科学, 2014, 50(1): 32. LIU Zhengxiang, ZHANG Huaxin, YANG Sheng, et al. Effects of NaCl stress on growth and photosynthetic characteristics of Elaeagnus angusttfolia seedlings[J]. Scientia Silvae Sinicae, 2014, 50(1): 32. |
| [20] |
孙若峥, 姜国斌, 吴祥云, 等. 2种杨树嫩茎质外体内源激素对盐胁迫的响应[J]. 甘肃农业大学学报, 2013, 48(2): 62. SUN Ruozheng, JIANG Guobin, WU Xiangyun, et al. Response of endogenous hormone in apoplast of two poplars to salt stress[J]. Journal of Gansu Agricultural University, 2013, 48(2): 62. DOI:10.3969/j.issn.1003-4315.2013.02.014 |