-
项目名称
- 国家自然科学基金“东北退化牧场恢复演替群落优势植物对去顶采食的生态适应机理研究”(31672471)
-
第一作者简介
- 潘林(1964—),男,硕士,高级实验师。主要研究方向:土壤生态。E-mail:plin@163.com
-
通信作者简介
- 焦德志(1970—),男,博士,教授。主要研究方向:湿地生态和恢复生态。E-mail: jdz_13909@163.com
-
文章历史
-
收稿日期:2020-05-13
修回日期:2021-09-20
随着世界经济的不断增长,石油的需求日益增加;然而,在石油生产和运输过程中因意外导致的石油泄露会对环境造成严重的破坏[1],并通过污染地下水系等间接方式危及人类健康[2]。石油中黏度较大的烃类化合物进入土壤后可导致土壤板结,并且石油中的大量疏水性化合物阻碍植物对水的吸收,影响植物生长发育,破坏植物根部固土作用,最终导致水土流失。石油可以增加土壤有机质含量,提高土壤碳氮元素的比值,然而石油中的碳元素与土壤原本的碳和植物光合作用所需要碳不同,因此虽然石油可以给土壤提供大量的碳元素,但依旧会造成土壤营养失调[3]。有学者在比较石油污染土壤理化性质影响时发现,石油污染能增加土壤中有机碳含量、pH、碳氮和碳磷比值,而总氮含量与电导率无显著变化[4]。石油污染能促进土壤中具有降解石油烃能力的真菌、细菌等微生物的生长,提高其在土壤中的丰度和多样性[5]。石油污染也会对土壤微生物的活性和数量有一定抑制作用,降低植物丛植菌根真菌的产孢能力[6]。这主要与石油污染物的组成和土壤中微生物群落结构有关[7]。石油污染会改变土壤营养成分的组成,会导致与硝化作用有关和厌氧类微生物数量降低,使有氧硝化细菌丰度升高。石油污染也会对固氮细菌和放线菌产生较大的影响[8-9]。
芦苇是湿地的重要植被,具有很强的抗逆性,并且是防治水土流失,用于湿地修复的主要植物材料。芦苇在适应高度异质性生境的过程中,其形态、生理、生活史策略等会发生改变,形成不同的生态型[10]。植物根际微生物可以通过固氮、解磷、降解土壤有害物质、抑制土壤中病原菌等方式促进植物生长,帮助植物抵抗毒害物质胁迫[11]。芦苇根系可以改善根际土壤物理性质和孔隙度,增加土壤渗透性和水源涵养能力[12]。
笔者以扎龙湿地芦苇及其原位土壤为材料,采用盆栽方式人工模拟石油污染,利用高通量测序技术分析和比较芦苇根际土壤中微生物的群落组成,揭示芦苇根际微生物群落结构的以及对石油污染的响应,有助于完善石油污染下芦苇-根际微生物-土壤三者的之间相互作用的生态学理论,并为芦苇在石油污染土壤中维持根系固土能力和恢复水土调控技术提供科学依据。
1 研究区概况芦苇根茎和土壤于采自扎龙湿地(E 124°9′1″、N 47°17′18″),样地年均气温3.2 ℃,年日照时间2 700~3 000 h,平均地温4.9 ℃。石油来自大庆油田。
2 材料与方法 2.1 模拟石油污染实验设计3个处理组,石油质量分数分别为T1(3 g/kg)、T2(6 g/kg)、T3(12 g/kg),对照组CK(0 g/kg),按照土壤质量(15 kg)称取石油于烧杯中,加入适量石油醚,使石油完全溶解后,混匀后置于塑料花盆中,加入1 L水,静置24 h,每盆横向定植5条新鲜芦苇根茎。培养60 d后,采用抖根法收集芦苇根际土壤,一部分4 ℃保存,用于土壤理化性质的测定,另一部分-20 ℃保存,用于高通量测序。
2.2 芦苇根际土壤理化性质的测定将采集的土壤风干后,研磨,过2 mm筛,土壤pH值、铵态氮、有效钾和速效磷含量采用土壤养分分析仪(比色法)测定,有机质质量分数利用重铬酸钾稀释热法测定[13]。
2.3 芦苇根际微生物DNA的提取和高通量测序Illumina Miseq高通量测序由生工生物工程(上海)公司完成,主要步骤为根据E.Z.N.A.Soil DNA Kit试剂盒操作步骤提取土壤中微生物总DNA,进行PCR扩增(341F引物:CCCTACACGACGCTCTTCCGATCTG;805R引物:GACTGGAGTTCCTTGGCACCCGAGAATTCCA;扩增条件见图 1), 经纯化回收以及定量混合后进行上机测序。

|
图 1 PCR扩增反应条件 Fig. 1 Conditions for PCR amplification |
使用FLASH(版本1.2.3)和Prinseq(版本0.20.4)软件对测序数据进行拼接和质量控制后,使用R(版本3.2)和MEGAN(版本5.7.1)软件进行分析。对比数据库为RDP classifier(16s fungal 28s), Silva(16s, 18s), Unite。
3 结果与分析 3.1 对土壤理化性质的影响土壤pH是土壤盐碱化程度的重要指标之一,土壤中有机质、铵态氮、有效钾,速效磷等含量与土壤肥力有着密切关系。3种质量分数石油处理60 d后,土壤理化性质如表 1所示,可知,各处理组(T1-T3)土壤的pH和有效钾含量与对照组(CK)间差异均未达到显著水平(P>0.05),各处理组的铵态氮、速效磷和有机质质量分数的均值分别显著(P < 0.05)高于对照组,分别提高41%、121%和141%。因此,不同质量分数的石油污染对土壤的pH和有效钾含量影响不大,但显著提高铵态氮、速效磷和有机质质量分数。
| 表 1 石油污染后土壤的理化性质 Tab. 1 Physicochemical properties of soil after petroleum pollution |
在97%的相似水平下,统计不同石油处理下芦苇根际土壤中操作分类单元(operational taxonomic units, OTU)数量,由图 2可知,4个实验组(CK、T1、T2和T3)的芦苇根际土壤样本中分别检测到3 482、2 844、3 311和3 336个OTU,其中共有的OTU为1 200个,特有的OTU分别为556、412、446和569,分别占CK、T1、T2、T3芦苇根系土壤样本总OTU的15.96%、14.48%、13.47%、17.05%。

|
图 2 不同石油处理后根际细菌OTU韦恩图 Fig. 2 OTU Venn profile of rhizosphere bacteria after different treatments of petroleum |
通过Illumina Miseq高通量测序分析芦苇根际细菌alpha多样性,结果如表 2所示,分别获得37 688~51 552条序列,OTU数为2 844~3 482个。Chao1指数在生态学中常用来估计物种总数,Shannon指数是用来估算样本中微生物多样性,Shannon值越大,说明群落多样性越高。结果显示T1处理的芦苇根际土壤中Chao1和Shannon指数最低,说明T1处理芦苇根际土壤中细菌总数最少,细菌多样性最低,T3处理的细菌数和多样性为最高。
| 表 2 不同石油处理根际细菌Alpha多样性指数 Tab. 2 Comparisons of α-diversity of rhizosphere bacteria after different treatments of petroleum |
芦苇根际土壤测序共获得33个门,不同石油处理芦苇根际土壤门分类水平下菌群组成和丰度情况如图 3所示。Proteobacteria是芦苇根际土壤的优势菌门,在CK、T1、T2、T3中的相对丰度分别为37.31%、45.97%、46.6%、46.26%。其次为Actinobacteria、Acidobacteria、Gemmatimonadetes、Bacteroidetes、Chloroflexi、Firmicutes、Planctomycetes、Verrucomicrobia在各处理组中这些门的细菌数合计占各处理组比例分别为50.53%、44.59%、39.5%、45.68%。

|
图 3 不同石油处理后根际土壤细菌门分类丰度统计 Fig. 3 Abundance statistics of bacterial phylum classification in rhizosphere soil after different treatments of petroleum |
由图 4可知,在属水平上,根际土壤中测得111属细菌,其中优势菌(相对丰度大于1%)有23种。优势菌中有些随着石油质量分数的增加相对丰度上升,例如:Pseudomonas(1.87%~6.34%)、Hydrogenophaga(0.11%~4.49%)、Nitriliruptor(0.58%~1.66%);有些细菌相对丰度随石油含量的升高而下降:Exiguobacterium(3.33%~1.88%)、Rhodoligotrophos(2.44%~1.09%)、Citrobacter(2.05%~0.93%)、Aridibacter(1.63%~0.72%)、Azoarcus(2.59%~0.61%)、Gp21(1.62%~0.23%)、Mongoliicoccus(1.48%~0.15%);Desulfuromonas、Bellilinea相对丰度随着石油质量分数的升高呈先上升后下降;Gp6,Gp16相对丰度无显著变化。
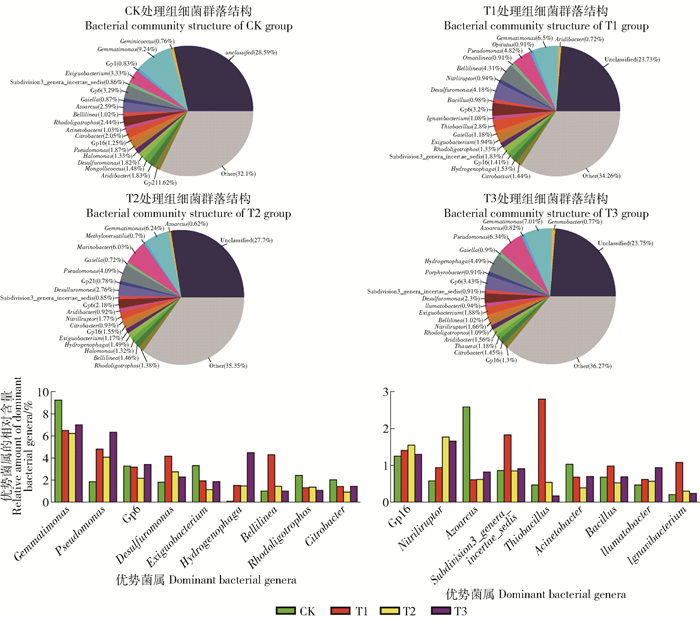
|
图 4 不同石油处理后根际微生物群落结构和相对丰度 Fig. 4 Community structures and relative abundances of rhizosphere bacteria after different treatments of petroleum |
通过主成分分析(PCA)比较不同质量分数石油污染下芦苇根际微生物群落Beta多样性,结果如图 5所示。其中主成分1(PCA1)可解释变量为68%,主成分2(PCA2)可解释变量为11%, 可见T1、T2、T3相互距离较近,能够聚集,CK与其他3组距离较远,并且随着加入石油质量分数的增加,各处理组距离CK越来越远。说明石油是改变各样本菌群Beta多样性主要因素,石油处理后的各样本菌群落多样性之前表现出相似性,而无石油处理的对照组与处理组存在明显差异。
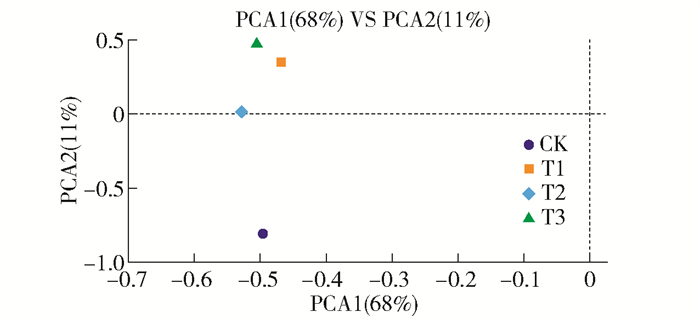
|
图 5 不同石油处理后根际细菌群落组成PCA分析 Fig. 5 PCA analysis of the microbial community in the rhizosphere after different treatments of petroleum |
土壤理化性质是植物和微生物生存的重要影响因子。土壤的酸碱性对土壤肥力、植物和微生物生长有显著影响,若土壤pH过低或过高,均会导致土壤结构性变差,使土壤黏重、板结、水、气热不协调,不利于耕作和植物生长[13]。石油污染会影响土壤理化性质,在研究安塞县8个类型油井周围土壤石油污染理化性质时发现,石油污染会导致pH值、速效磷、速效钾含量显著降低,有机质和铵态氮含量显著升高[14]。也有学者人研究发现,石油污染使土壤有机质含量增加,pH降低,而对速效磷,铵态氮,速效钾无显著影响[15]。石油污染引起土壤pH值变化的主要原因与微生物降解石油烃的酸性中间产物有关[16]。本研究土壤属于碱性较强土壤,经过不同质量分数石油污染后,pH值未发生显著差异。这可能是分解石油的微生物受到土壤碱性的影响,使分解石油烃的速率低,产生的酸性物质较少,而土壤具有一定的缓冲作用,芦苇根系也具有富集和吸收污染物的能力,因此使得土壤pH未能有显著变化。不同产地的石油组分存在差异,低硫高氮是中国油田所产石油的主要特点[17]。本实验结果显示铵态氮和速效磷含量在石油处理后显著升高,但在不同石油质量分数处理下无显著差异,有效钾含量不随石油质量分数升高而发生改变。这可能与实验所用石油组分中富含氮、磷元素,而钾元素含量较少有关。氮、磷元素是制约石油生物降解速率的关键因子之一,微生物通过消耗土壤中的氮、磷营养物质提高石油的降解效率,导致铵态氮和有效磷含量在不同石油质量分数处理下无显著变化[18-19]。本实验结果显示土壤中有机质含量随着石油质量分数的增加而升高,这是由于石油中含有大量烃类物质,当石油进入土壤后,烃类物质作为碳源,增加了土壤中有机质的含量。
4.2 对芦苇根际土壤中细菌多样性的影响细菌是土壤中重要组成部分,细菌的生长情况是评价土壤健康状态和生态学的重要指标。Illumina Miseq高通量测序可以更深层次地了解土壤中细菌群落结构及丰度。因此,常应用于分析土壤样品中微生物群落的多样性。结果显示,不同程度石油处理土壤中OTU丰度和细菌多样性随着石油质量分数的增加呈先下降后上升趋势。石油进入土壤后,为土壤提供丰富的碳源,增加了细菌的代谢底物,但是有些高分子石油烃对细菌也有一定危害作用,使细菌群落发生改变。因此,轻度石油污染的毒性导致非石油耐受细菌群落丰度下降,并且无法为石油耐受菌生长提供足够的碳源,导致总体细菌群落丰度降低。随着石油污染程度的增加,高质量分数的石油弥补了石油耐受菌生长碳源的不足,促进了石油耐受菌的生长,导致细菌丰度逐渐升高。这与初金美等人研究结果相似[20]。
4.3 对芦苇根际土壤细菌群落结构的影响不同种类的细菌对石油污染的耐受能力存在差异,因此分析土壤中细菌种群结构能更加深入了解石油污染对芦苇根际土壤细菌演化过程和耐受石油的优势菌属。由实验结果可知,石油污染改变了芦苇根际土壤中细菌群落的组成。Proteobacteria在土壤中占有绝对优势并且随着石油污染程度的升高,其相对丰度增加。这不仅与Proteobacteri作为细菌中最大的一门有关,还因为Proteobacteri中Alphaproteobacteria和Betaproteobacteria具有潜在的降解石油作用,而且Alphaproteobacteria和Gammaproteobacteria面对石油污染时会表现处很强的“阻抗”和“回弹能力”[21],更能适应石油污染并且利用石油烃进行代谢和繁殖。在属水平上,芦苇根际土壤细菌主要由23种优势菌控制,其相对比例随着石油污染程度而发生改变。Pseudomonas和Hydrogenophaga是高效降解石油烃能力的菌属,已被人们在石油污染区域或自然环境中被分离出来[21-23]。在本文结果中,Pseudomonas和Hydrogenophaga相对比例随着石油污染的加剧而升高,说明该这2种细菌能在自身免于石油毒害的同时还能以石油中有机物为代谢底物,进行大量繁殖。另外还有研究表明Pseudomonas具有明显的植物根际效应,在植物根际区域能显著提高该细菌活性和数量[24]。Exiguobacterium、Rhodoligotrophos、Citrobacter、Aridibacter、Azoarcus、Gp21、Mongoliicoccus的相对丰度与石油含量呈负相关,石油污染影响其生长和繁殖。Desulfuromonas和Bellilinea相对丰度在石油含量较低时升高,但是当石油含量升高时下降。导致其下降的原因可能与其对石油敏感性有关。
5 结论1) 石油污染可以改变土壤中部分理化性质,使土壤中铵态氮、速效磷和有机质含量显著升高,最高分别上升了41%、121%和141%,而pH值,有效钾含量无显著变化。
2) 石油污染对芦苇根际土壤细菌多样性有影响。α多样性分析显示,随着石油污染程度的增加,芦苇根际细菌丰度和多样性指数逐渐升高。β多样性分析显示无石油添加的对照组与石油处理组具有差异。
3) 石油污染改变芦苇根际土壤细菌群落组成,而不同的类型的细菌对石油的敏感程度不同。石油污染促进了Pseudomonas和Hydrogenophaga的生长,抑制Exiguobacterium、Rhodoligotrophos、Citrobacter、Aridibacter、Azoarcus、Gp21、Mongoliicoccus的生长。轻度石油污染会对Desulfuromonas和Bellilinea的生长有促进作用,重度石油污染抑制其生长。
| [1] |
ABOUSNINA R M, MANALO A, SHIAU J, et al. Effects of light crude oil contamination on the physical and mechanical properties of fine sand[J]. Soil & Sediment Contamination: An International Journal, 2015, 24(8): 833. |
| [2] |
ZAMANI J, HAJABBASI M A, ALAIE E, et al. The effect of Piriformospora indica on the root development of maize (Zea mays L.) and remediation of petroleum contaminated soil[J]. International Journal of Phytoremediation, 2016, 18(3): 278. DOI:10.1080/15226514.2015.1085831 |
| [3] |
CARAVACA F, ROLDÁN A. Assessing changes in physical and biological properties in a soil contaminated by oil sludges under semiarid Mediterranean conditions[J]. Geoderma, 2003, 117(1/2): 53. |
| [4] |
ZHOU E, Crawford R L. Effects of oxygen, nitrogen, and temperature on gasoline biodegradation in soil[J]. Biodegradation, 1995, 6(2): 127. DOI:10.1007/BF00695343 |
| [5] |
杨智, 陈吉祥, 周永涛, 等. 玉门油田污染荒漠土壤石油降解菌多样性[J]. 环境科学研究, 2017, 30(5): 799. YANG Zhi, CHEN Jixiang, ZHOU Yongtao, et al. Diversity of oil-degrading bacteria isolated from oil-contaminated desert soil of Yumen oilfield[J]. Research of Environmental Sciences, 2017, 30(5): 799. |
| [6] |
WYSZKOWSKA J, KUCHARSKI J. The influence of diesel oil contamination on soil microorganisms and oat growth[J]. Rostlinna Vyroba, 2002, 48(2): 51. |
| [7] |
REN S Z, GUO J, DENG S E, et al. Isolation and Identification of petroleum degrading strains and the diversity of microbes in petroleum-contaminated soils[J]. Acta Ecologica Sinica, 2005, 25(12): 3314. |
| [8] |
张秀霞, 张守娟, 张涵, 等. 固定化微生物对石油污染土壤理化性质的调控作用[J]. 石油学报(石油加工), 2014, 30(6): 1106. ZHANG Xiuxia, ZHANG Shoujuan, ZHANG Han, et al. Control effect of immobilized microorganisms on physical and chemical properties of petroleum-contaminated soil[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2014, 30(6): 1106. DOI:10.3969/j.issn.1001-8719.2014.06.022 |
| [9] |
谢月, 梁红, 宋立全, 等. 东北沼泽湿地土壤中氨氧化微生物活性和丰度研究[J]. 农业环境科学学报, 2018, 37(3): 546. XIE Yue, LIANG Hong, SONG Liquan, et al. Activity and abundance of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of marsh wetland soil in Northeast of China[J]. Journal of Agro-Environment Science, 2018, 37(3): 546. |
| [10] |
HANSEN D L, LAMBERTINI C, JAMPEETONG A, et al. Clone-specific differences in Phragmites australis: Effects of ploidy level and geographic origin[J]. Aquatic Botany, 2007, 86(3): 269. DOI:10.1016/j.aquabot.2006.11.005 |
| [11] |
麦靖雯, 黎瑞君, 张巨明. 根际微生物研究概况[J]. 现代农业科技, 2017(13): 135. MAI Jingwen, LI Ruijun, ZHANG Juming. Research summary on rhizospheric microorganisms[J]. Modern Agricultural Science and Technology, 2017(13): 135. |
| [12] |
桑凯新, 胡淦林, 黄超, 等. 黄河河岸带5种植物类型根系结构特征对土壤渗透性的影响[J]. 中国水土保持科学, 2020, 18(5): 1. SANG KaiQi, HU Ganlin, HUANG Chao, et al. Effects of root structure characteristics of 5 plant types on soil infiltration in the Yellow River riparian[J]. Science of Soil and Water Conservation, 2020, 18(5): 1. |
| [13] |
陈碧珊, 陈诗敏, 何炽鹏. 雷州半岛红树林湿地表层沉积物粒度分布特征[J]. 现代地质, 2019, 33(1): 200. CHEN Bishan, CHEN Shimin, HE Zhipeng. Grain size distribution features of surface sediments from mangrove wetland of Leizhou peninsula[J]. Geoscience, 2019, 33(1): 200. |
| [14] |
张雷, 赵奇, 武伟男, 等. 石油污染土壤生物修复技术现状与展望[J]. 现代化工, 2018(1): 18. ZHANG Lei, ZHAO Qi, WU Weinan, et al. Status and prospects on bioremediation technologies for petroleum contaminated soil[J]. Modern Chemical Industry, 2018(1): 18. |
| [15] |
吴伟林, 张秀霞, 单宝来, 等. 不同处置方式对石油污染土壤理化性质和生物学特性的影响[J]. 石油学报(石油加工), 2010, 26(5): 831. WU Weilin, ZHANG Xiuxia, SHAN Baolai, et al. Effect of different treatment methods on the physicochemical and biochemical properties of an oil polluted soil[J]. Acta Petrolei Sinica (Petroleum Processing Section), 2010, 26(5): 831. DOI:10.3969/j.issn.1001-8719.2010.05.029 |
| [16] |
唐利, 杨奇, 邱江平, 等. 芦苇、香蒲根际分泌物及其根际效应比较分析[J]. 哈尔滨商业大学学报(自然科学版), 2010, 26(4): 425. TANG Li, YANG Qi, QIU Jiangping, et al. Influence of root exudates from Phragmites australis, Typha orientalis[J]. Journal of Harbin University of Commerce(Natural Sciences Edition), 2010, 26(4): 425. DOI:10.3969/j.issn.1672-0946.2010.04.010 |
| [17] |
王拓, 唐璐, 栾玥, 等. 小黑麦对石油污染盐碱土壤细菌群落与石油烃降解的影响[J]. 生态学报, 2019, 39(24): 126. WANG Tuo, TANG Lu, LUAN Zhigao, et al. Effect of triticale (Triticale hexaploide L.)growth on the bacterial community and petroleum hydrocarbon degradation in petroleum-contaminated saline-alkali soil[J]. Acta Ecologica Sinica, 2019, 39(24): 126. |
| [18] |
王传远, 杨翠云, 孙志高, 等. 黄河三角洲生态区土壤石油污染及其与理化性质的关系[J]. 水土保持学报, 2010, 24(2): 214. WANG Chuanyuan, YANG Cuiyun, SUN Zhigao, et al. Contamination characteristics and its relationship with physico-chemical properties of oil polluted soils in the Yellow River delta swamp[J]. Journal of Soil and Water Conservation, 2010, 24(2): 214. |
| [19] |
刘健. 胜利油田采油区土壤石油污染状况及其微生物群落结构[D]. 济南: 山东大学, 2014: 16. LIU Jian. Petroleum pollution and the microbial community structure in the soil of Shengli Oilfield[D]. Jinan: Shandong University, 2014: 16. |
| [20] |
初金美, 李秀军, 刘兴土, 等. 非生物因子对松嫩平原西部石油污染湿草甸土壤微生物的影响[J]. 湿地科学, 2012, 10(4): 492. CHU Jinmei, LI Xiujun, LIU Xingtu, et al. The influence of abiotic factors on soil microorganism in wet meadows contaminated by petroleum in the West Songnen Plain[J]. Wetland Science, 2012, 10(4): 492. |
| [21] |
余素林, 汤岳琴, 吴晓磊. 土壤微生物群落对原油以及生物强化处理的响应[C]//第五次全国土壤生物和生物化学学术研讨会论文集. 重庆, 2009: 6. YU Sulin, TANG Yueqin, WU Xiaolei. Response of soil microbial community to crude oil and bioenhanced treatment[C]//The Fifth National Symposium on Soil Biology and Biochemistry, Chongqing, 2009: 6. |
| [22] |
郝婧, 高磊, 吴春旭, 等. 石油降解菌Pseudomonas stutzeri TH-31的分离与降解条件优化[J]. 环境工程学报, 2015, 9(4): 1771. HAO Jing, GAO Lei, WU Chunxu, et al. Isolation and optimization of a crude-oil-degrading bacteria Pseudomonas stutzeri TH-31[J]. Chinese Journal of Environmental Engineering, 2015, 9(4): 1771. |
| [23] |
孟建宇, 李蘅, 唐凯, 等. 两株氢噬胞菌的萘降解特性分析[J]. 化工环保, 2017, 37(3): 300. MENG Jianyu, LI Heng, TANG Kai, et al. Analysis on naphthalene degradation characteristics of two Hydrogenophaga sp. strains[J]. Environmental Protection of Chemical Industry, 2017, 37(3): 300. |
| [24] |
周际海, 袁颖红, 朱志保, 等. 土壤有机污染物生物修复技术研究进展[J]. 生态环境学报, 2015, 24(2): 343. ZHOU Jihai, YUAN Yinghong, ZHU Zhibao, et al. A Review on bioremediation technologies of organic pollutants contaminated soils[J]. Ecology and Environmental Sciences, 2015, 24(2): 343. |
 2022, Vol. 20
2022, Vol. 20 
