-
项目名称
- 国家自然科学基金"水力学构造与PIP基因表达对杨树叶导水阻力的调控机制"(31400527);山西农业大学青年拔尖创新人才支持计划"大气CO2浓度升高与干旱交互下小麦叶片生长的碳氮水耦合机制"(BJRC201602)
-
第一作者简介
- 高钿惠(1996-), 女, 硕士研究生。主要研究方向: 杨树抗旱生理生态。E-mail: gaoth1996@163.com
-
通信作者简介
- 王卫锋(1985-), 男, 博士, 副教授。主要研究方向: 树木抗逆生物学。E-mail: wangwf2020@163.com
-
文章历史
-
收稿日期:2021-06-04
修回日期:2021-11-09
干旱是全球范围内树木死亡的重要原因[1]。随着全球降雨不均匀性逐渐增大,干旱半干旱地区的干旱发生频率、持续时间以及严重程度都将进一步增加[2]。杨树(Populus spp.)是树木生理学及分子生物学研究的模式树种[3],其作为三北地区防护林主要树种,在改善生态环境方面发挥重要作用,但由于长期干旱,该地区的大面积杨树林形成“小老树”,甚至死亡[4]。
干旱胁迫作为植物所受逆境胁迫中最重要的非生物因素,严重限制植物的生长发育及分布[5]。干旱处理下根系合成ABA(abscisic acid)信号并运输至茎和叶器官[6],进而通过一系列结构和生理生化变化以适应干旱,如促进细根发育、增加根冠比、提高渗透调节物质浓度以增强根系吸水能力[7],增厚叶片、关闭气孔以减少水分散失[8]。但干旱胁迫也会诱发活性氧积累进而导致光合色素降解、Rubisco酶活性降低等光合机构破坏[9]。树木在干旱环境中的存活不仅体现在干旱过程中的响应与适应性,干旱解除后复水期间光合速率等生理指标的恢复能力也很重要[10]。而目前研究多集中在对干旱胁迫的适应变化,却忽略了旱后复水的恢复能力[11]。有研究发现,植物在适度干旱后复水会产生补偿效应,光合速率提高,生物量积累加快,表明旱后复水可提高植物生产力[12]。
小叶杨(Populus simonii)具耐旱、耐寒、耐盐碱等特性,是我国北方重要的乡土树种,三北防护林营造过程中广泛应用。笔者以小叶杨扦插幼苗为实验材料,通过盆栽称量法控制土壤水分,研究干旱及复水对其生长、气体交换、叶绿素质量分数和荧光、叶解剖结构及生物量与非结构性碳水化合物(non-structural carbohydrate,NSC)的积累与分配的影响,研究结果有助于阐明干旱环境下小叶杨的响应与适应机制,并可为北方半干旱地区杨树人工林可持续发展提供理论依据。
1 实验地概况实验地位于山西晋中山西农业大学林业站,E 112°34′44″、N 37°25′47″,海拔796 m,属暖温带大陆性气候。该地年均温10.4 ℃,有效积温3 250~3 500 ℃,无霜期160~190 d,年均降水量397 mm,年均潜在蒸发量1 765.9 mm。
2 研究方法 2.1 实验设计2020年4月1日于山西农业大学林业站选用高35 cm、直径30 cm的塑料桶,每桶装风干过筛土18 kg,桶底铺2层直径2~3 cm的石子,石子上覆一层300目的尼龙布使之与土壤隔离。通过插入桶底的硬质塑料管浇水,以使土壤均匀吸水而避免板结。土壤取自林业站附近地表土,土壤质地为砂质壤土,其基本理化性质为pH 8.29,全氮1.06 g/kg,有效氮48.76 mg/kg,有效磷9.57 mg/kg,速效钾123.3 mg/kg,有机质14.64 g/kg,全盐量0.097%,田间持水量26.94%。将小叶杨插条扦插入土壤中,正常供水(土壤含水量为田间持水量的75%±5%),缓苗2个月。6月1日选取长势良好且一致的幼苗30株,随机分为3组,对照6株,中度干旱和重度干旱各12株,采用单因素方差分析保证各组间初始株高和地径无显著差异;并设置3个水分梯度,分别为CK(对照,田间持水量的75%±5%),MS(中度干旱,田间持水量的50%±5%)、SS(重度干旱,田间持水量的25%±5%);3个月后随机选取中度干旱和重度干旱各6株,复水至田间持水量的75%±5%。每日17:00以盆栽称量法称量补水。复水前测定一次气体交换参数、叶绿素质量分数及荧光参数等指标,复水1月后再次测定气体交换参数、叶绿素荧光参数、叶片解剖结构等指标并收获植株。
2.2 指标测定叶片气体交换参数测定:每处理6株重复,每株各随机选取2片健康功能叶。于晴朗天气上午10:00~11:00使用便携式光合仪(Li-6400XT,Li-COR,USA)测定,参数设定为叶温25 ℃,红蓝光源光强1 500 μmol/(m2 ·s),流速500 μmol/s,测定叶片净光合速率(Pn, μmol/(m2 ·s))、气孔导度(Gs, mol/(m2 ·s))、胞间CO2浓度(Ci, μmol/mol)、大气CO2浓度(Ca,μmol/mol)和蒸腾速率(Tr, mmol/(m2 ·s)),并计算瞬时水分利用效率(water utilization efficiency, WUE=Pn/Tr, μmol/mmol)和Ci/Ca[5]。
叶绿素a荧光参数测定:每处理6株重复,每株各随机选取1片健康功能叶,叶片暗适应30 min后,用叶绿素荧光仪(PAM-2500,德国,WALZ)先测定初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv);打开活化光约5 min至荧光值稳定后,再测定稳态荧光(Fs)、最大荧光(F′ m)、最小荧光(F′ o);计算得到光系统Ⅱ(PSⅡ)的最大光化学量子产量(Fv/Fm)、实际光化学量子产量(ΦPSⅡ)、光化学猝灭系数(qP)、非光化学猝灭系数(non photochemical quenching coefficient, NPQ)、电子传递速率(electron transport rate, ETR)。
叶绿素质量分数测定:每处理6株重复,每株各随机选取1片健康功能叶,使用乙醇提取比色法测定[13]。
叶片形态及解剖结构测定:每处理6株重复,每株各随机选取3片健康功能叶用于单叶面积、单叶干质量及相对含水量(relative water content, RWC)测定,再选取1片用于叶片解剖及气孔特性测定。取回叶片先称量鲜质量,然后用扫描仪(DS-50000,EPSON,Japan)扫描图片并用ImageJ软件测量单叶面积,让其吸水至饱和后称量其饱和质量,再于105 ℃杀青1 h后75 ℃烘至恒质量,称量干质量,RWC=((鲜质量-干质量)/(饱和质量-干质量)) ×100%,比叶质量(leaf mass per area, LMA)=叶干质量/叶面积。采用指甲油印迹法测定上下表皮气孔密度与气孔长度,并于叶片中部切取1 cm×1 cm方块,FAA固定后采用石蜡切片法,在生物显微镜(CX31,日本,Olympus)下拍照并测量叶片厚度、栅栏组织厚度、海绵组织厚度等参数。
器官生物量及NSC质量分数测定:分别用卷尺和游标卡尺测量株高和地径。收获植株后将其分为根、茎、叶3部分并将根系冲洗干净,105 ℃杀青1 h后75 ℃烘至恒质量并称量干质量,粉碎过200目筛。用苯酚-硫酸法测定NSC质量分数[14]。并计算整株总干质量及各器官生物量分配比例。
2.3 数据分析使用Excel 2013进行数据整理及绘图。用SPSS 13.0的one-way ANOVA中Duncan多重比较(P < 0.05)进行显著性分析。
3 结果与分析 3.1 干旱胁迫下小叶杨幼苗光合特性的变化中度干旱下Pn未显著下降,而重度干旱下Pn较CK显著降低了9.00%。Gs、Ci和Tr均随干旱胁迫的加剧呈下降趋势,且SS处理下降幅度较大。SS下WUE由于Gs显著降低导致Tr大幅下降而显著上升,Ci /Ca由于Gs显著降低导致Ci下降而显著降低(图 1)。
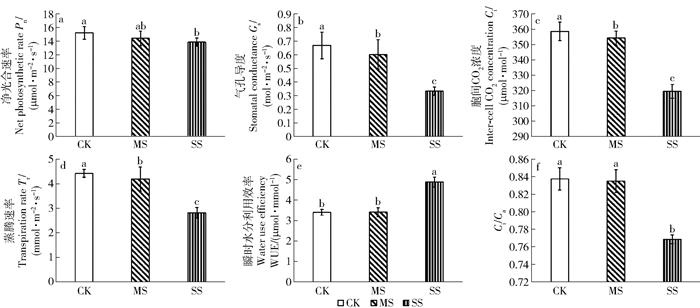
|
同一小图中不同小写字母表示在0.05水平差异显著。CK(对照,田间持水量的75%±5%),MS(中度干旱,田间持水量的50%±5%),SS(重度干旱,田间持水量的25%±5%)。下同。 Different letters in the same figure represent significant difference at 0.05 level. CK (control, 75%±5% of field capacity), MS (moderate drought, 50%±5% of field capacity) and SS(severe drought, 25%±5% of field capacity). The same below. 图 1 干旱胁迫下小叶杨幼苗气体交换参数的变化 Fig. 1 Changes of gas exchange parameter in Populus simonii seedlings under drought stress |
MS处理的叶绿素a、b质量分数显著下降,而SS处理的叶绿素a、b质量分数则显著上升(表 1)。Fv/Fm、ΦPSⅡ及ETR均随干旱胁迫程度加剧呈降低趋势,而NPQ和qP无显著变化(表 2)。
| 表 1 干旱胁迫下小叶杨幼苗叶绿素质量分数的变化 Tab. 1 Changes of chlorophyll content in Populus simonii seedlings under drought stress |
| 表 2 干旱胁迫下小叶杨幼苗叶绿素荧光参数的变化 Tab. 2 Changes of chlorophyll fluorescence parameter in Populus simonii seedlings under drought stress |
单叶面积与单叶干质量随干旱胁迫加剧呈下降趋势,LMA则随干旱加剧先升后降,而RWC无显著变化。MS处理下除上表皮气孔长度显著增加外,上、下表皮气孔密度及下表皮气孔长度均显著降低;而SS处理上、下表皮气孔长度均显著降低且低于CK,气孔密度均显著增加且高于CK(表 3)。
| 表 3 干旱胁迫下小叶杨幼苗叶片形态的变化 Tab. 3 Changes of leaf morphology in Populus simonii seedlings under drought stress |
复水1月后,MS处理的Pn显著低于CK,而SS处理的Pn显著上升且与CK无显著差异。MS处理下Gs与Tr未明显下降,Ci与Ci/Ca显著上升,WUE则显著降低;而SS处理的Gs、Tr、Ci与Ci/Ca较CK显著降低,WUE则显著升高。复水处理的Pn、Gs与Tr较干旱处理均显著上升,除RM处理的Pn与CK无显著差异外,其余均显著高于CK,且RS处理的Pn较CK增加41.98%。RM处理的Ci、Ci/Ca与WUE较MS处理未发生显著变化,而RS处理的Ci较SS显著升高,WUE则显著降低(图 2)。
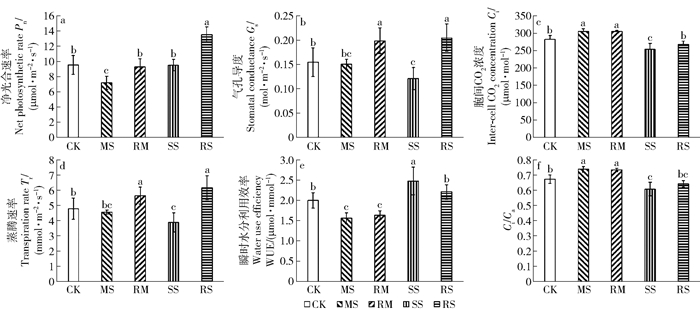
|
RM(中度干旱后复水,复水至田间持水量的75%±5%),RS(重度干旱后复水,复水至田间持水量的75%±5%),下同。 RM (moderate drought followed by re-water, re-watering to 75%±5% of field capacity) and RS (severe drought followed by re-water, re-watering to 75%±5% of field capacity). The same below. 图 2 干旱及复水对小叶杨幼苗气体交换参数的影响 Fig. 2 Effects of drought and re-watering on the gas exchange parameter of Populus simonii seedlings |
复水1月后,MS处理的Fv/Fm、ΦPSⅡ及ETR显著降低,NPQ显著升高;而SS处理的Fv/Fm、ΦPSⅡ及ETR则显著上升,NPQ显著降低,且SS处理的Fv/Fm、ΦPSⅡ、ETR及NPQ较CK均无显著差异。但1个月的复水处理未对叶绿素荧光参数产生显著影响(表 4)。
| 表 4 干旱及复水对小叶杨幼苗叶绿素荧光参数的影响 Tab. 4 Effects of drought and re-watering on the chlorophyll fluorescence parameter of Populus simonii seedlings |
复水1月后,干旱处理的单叶面积与单叶干质量依然随干旱胁迫加剧呈下降趋势,而LMA显著上升。上表皮与栅栏组织厚度随干旱胁迫加剧呈下降趋势,MS处理下海绵组织与叶片厚度显著升高,栅海比与紧密度显著降低;而SS处理的海绵组织、下表皮及叶片厚度显著下降且显著低于CK,栅海比与紧密度显著升高且显著高于CK。1个月的复水处理未对单叶面积、单叶干质量以及LMA产生显著影响,但复水处理的上表皮与栅栏组织厚度较干旱处理则显著上升。RM处理的海绵组织厚度较MS处理显著降低,栅海比与紧密度显著升高;而RS处理的海绵组织厚度较SS处理则显著升高,栅海比与紧密度显著降低(表 5)。
| 表 5 干旱及复水对小叶杨幼苗叶形态解剖的影响 Tab. 5 Effects of drought and re-watering on the leaf morphological anatomy of Populus simonii seedlings |
干旱胁迫下植株生长受到抑制,株高、地径、叶片数以及根、茎、叶干质量和单株总干质量均随干旱加剧呈降低趋势,而根冠比增加。干旱胁迫下,小叶杨株高与地径生长均受抑制,但MS和SS处理的株高较CK分别下降了34.54%和50.24%,而地径较CK分别下降了20.24%和31.59%,表明干旱胁迫下小叶杨对纵向生长的抑制强于横向生长。1个月的复水处理未对植株生长及干物质积累产生显著影响(表 6)。
| 表 6 干旱及复水对小叶杨幼苗生长状况及干物质积累的影响 Tab. 6 Effects of drought and re-watering on growth and dry matter accumulation of Populus simonii seedlings |
图 3进一步量化干旱及复水下小叶杨幼苗各器官间生物量分配的变化。根生物量分配比例因干旱胁迫显著增加,但MS与SS间无显著差异。茎生物量分配比例显著降低,叶生物量分配比例无显著变化。复水处理较干旱处理无显著变化(图 3)。
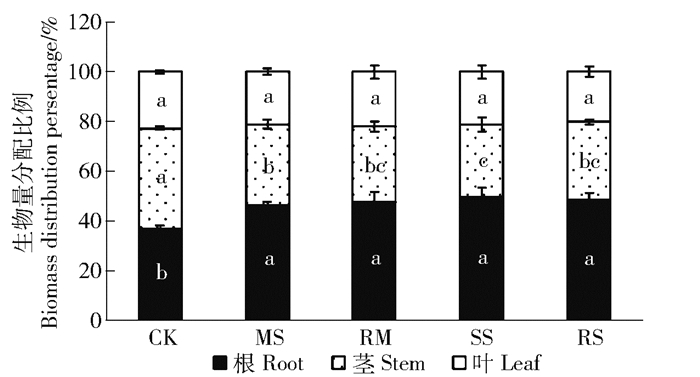
|
相同条柱不同小写字母表示在0.05水平差异显著,下同。 Different letters in the same figure and column represent significant difference at 0.05 level. The same below. 图 3 干旱及复水对小叶杨幼苗根茎叶生物量分配比例的影响 Fig. 3 Effects of drought and re-watering on biomass distribution percentage of Populus simonii seedlings |
干旱胁迫后,小叶杨幼苗各器官可溶性糖与总NSC质量分数显著上升,茎木材中淀粉质量分数显著降低。MS处理下,上部叶淀粉质量分数降低而根中淀粉质量分数升高;在SS处理下,上部叶淀粉质量分数升高且高于CK,而根中淀粉质量分数则降低且与CK无显著差异。1个月的复水处理未对淀粉质量分数产生显著影响,上部功能叶的可溶性糖与总NSC质量分数较干旱处理则显著上升,而茎和根中可溶性糖与总NSC质量分数则降低(图 4)。
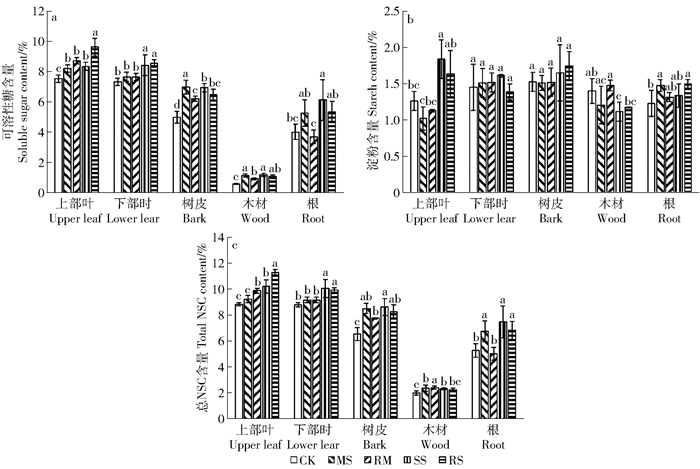
|
图 4 干旱及复水对小叶杨幼苗根茎叶NSC质量分数的影响 Fig. 4 Effects of drought and re-watering on the content of NSC of Populus simonii seedlings |
重度干旱下小叶杨幼苗Gs显著降低,Pn与Tr下降,WUE显著升高,表明小叶杨通过关闭气孔降低Gs,以牺牲碳固定为代价,减少水分散失,提高水分利用效率,从而抵御干旱,为典型的节水型抗旱,这与群众杨(Populus×popularis‘35-44’)[4]表现相似;同时,PS Ⅱ反应中心开放比例及光合电子传递速率下降、光化学活性减弱也是Pn降低的原因。Pn的降低将导致光能过剩而损伤光合机构,小叶杨则通过NPQ的上升增强热耗散而保护光合机构。
随干旱强度的增加,叶绿素a、b质量分数表现出先降后升的趋势,且SS处理的叶绿素质量分数显著高于CK,这与在侧柏(Platycladus orientalis)[15]的研究中相似。MS处理下光合色素质量分数降低,其一可以防止叶片过量吸收光能,减少光抑制对光合机构的损伤,其二可以减少叶绿素合成中叶片氮素的消耗,将多余的氮素用于Rubisco酶的合成,提高Rubisco酶含量[16];而SS处理下光合色素质量分数的上升,这可能是由于干旱胁迫导致叶片生长受抑制而产生的浓缩效应所致[17],也可能是由于小叶杨在极端干旱下逐渐适应干旱胁迫并做出相应生理响应,但2种水分条件下响应差异的具体分子生理机制尚需进一步研究。
干旱下叶片变小且数量降低,有利于叶片减少水分消耗和散热[18]。中度干旱下LMA显著上升,海绵组织增厚,可增加叶片中水分传输阻力与距离;同时,较厚的海绵组织也可增加叶内散射光,减少光量子透射损失,从而提高叶片光能利用率[19]。重度干旱下栅栏组织、海绵组织及叶片总厚度均显著降低,可能是由于过度水分亏缺导致叶肉细胞生长受阻,细胞体积减小。但该处理下LMA却显著增加,其原因可能是细胞壁密度增加[20],也有可能是细胞壁增厚。重度干旱下叶片气孔变小变密有利于减少蒸腾作用并能提高水分利用效率,从而提高幼苗抗旱能力[21]。
复水未对Fv/Fm、ΦPSⅡ、ETR和NPQ产生显著影响,而显著增加了Gs与Tr以及Pn,且RS处理的Pn产生了明显的补偿作用,其原因可能是复水前重度干旱处理的叶绿素质量分数和栅海比高于正常供水。1个月的复水未对单叶面积、单叶干质量及LMA产生明显影响,而促进上表皮和栅栏组织生长;复水后海绵组织厚度趋向于CK,即MS处理海绵组织变厚而在复水后变薄,SS处理海绵组织变薄而在复水后变厚。
4.2 干旱及复水对小叶杨幼苗生长与干物质分配的影响小叶杨幼苗遭受干旱胁迫后株高降低,地径变细,叶片变小甚至脱落,各器官生物量积累减小而可溶性糖及总NSC质量分数均有不同程度的增加,表明干旱胁迫下小叶杨通过牺牲植株生长,尤其是地上部生长,从而将更多光合产物以可溶性糖等非结构性碳水化合物形式储存,一方面,抑制地上部生长可减少水分及同化物消耗,另一方面,较多的NSC储存有利于植株在干旱等逆境下的生存;同时,在干旱下小叶杨将更多光合产物投资于根中,有利于根获取更多的矿质营养及水分,这也符合植物的最优分配理论[22]。干旱胁迫下,小叶杨茎木材和根中淀粉质量分数降低而可溶性糖质量分数升高,一方面有利于提高其茎的栓塞修复能力,以应对干旱胁迫下频发的导管栓塞[23];另一方面增加根中可溶性糖质量分数可降低细胞渗透势,有利于增强根系的吸水能力[7]。
复水后小叶杨树皮和根系中可溶性糖及总NSC浓度降低,这表明小叶杨导管栓塞修复及形成层恢复活动更多消耗的是树皮和根系中储存的可溶性糖[24]。且复水后小叶杨光合速率显著增加,光合固碳能力增强,从而提高上部叶的可溶性糖及淀粉质量分数。
5 结论干旱下小叶杨叶片小而厚、气孔小而密,以减少蒸腾;根系生物量分配与可溶性糖质量分数增加,以增强根系吸水,同时地上部生长降低以减少水分和能量消耗;茎中可溶性糖与总NSC储量增加,可能有助于提高茎栓塞修复能力。中度干旱下小叶杨通过叶绿素质量分数降低、NPQ增加的策略减少光抑制对光合机构的损伤,并通过增厚海绵组织提高叶片光能利用率及储水能力;而重度干旱下则通过关闭气孔降低Gs与Tr,以降低Pn牺牲碳固定为代价维持叶片水分状况。重度干旱复水后小叶杨的叶片光合作用产生了明显的补偿作用,原因可能是重度干旱下叶绿素含量和栅海比增加。复水后树皮和根系中的可溶性糖明显降低。虽然光合速率完全恢复或超过正常对照,但1个月内整株生物量积累与分配并未发生显著变化。
| [1] |
CHOAT B, JANSEN S, BRODRIBB T J, et al. Global convergence in the vulnerability of forests to drought[J]. Nature, 2012, 491(7426): 752. DOI:10.1038/nature11688 |
| [2] |
DESOTO L, CAILLERET M, STERCK F, et al. Low growth resilience to drought is related to future mortality risk in trees[J]. Nature Communications, 2020, 11(1): 1. DOI:10.1038/s41467-019-13993-7 |
| [3] |
GALVEZ D A, LANDHÄUSSER S M, Tyree M T. Root carbon reserve dynamics in aspen seedlings: Does simulated drought induce reserve limitation?[J]. Tree physiology, 2011, 31(3): 250. DOI:10.1093/treephys/tpr012 |
| [4] |
赵瑜琦, 高苗琴, 李涛, 等. 干旱胁迫对群众杨光合特性与器官干物质分配的影响[J]. 生态学报, 2002, 40(5): 1683. ZHAO Yuqi, GAO Miaoqin, LI Tao, et al. Effects of water stress on leaf gas exchange and biomass allocation of Populus×popularis '35-44' cuttings[J]. Acta Ecologica Sinica, 2002, 40(5): 1683. |
| [5] |
SCHINDLBACHER A, WUNDERLICH S, BORKEN W, et al. Soil respiration under climate change: Prolonged summer drought offsets soil warming effects[J]. Global Change Biology, 2012, 18(7): 1. |
| [6] |
牛素贞, 宋勤飞, 樊卫国, 等. 干旱胁迫对喀斯特地区野生茶树幼苗生理特性及根系生长的影响[J]. 生态学报, 2017, 37(21): 7333. NIU Suzhen, SONG Qinfei, FAN Weiguo, et al. Effects of drought stress on leaf physiological characteristics and root growth of the clone seedlings of wild tea plants[J]. Acta Ecologica Sinica, 2017, 37(21): 7333. |
| [7] |
王德福. 干旱与水淹胁迫对樟树幼苗生理生态特征的影响[D]. 南昌: 南昌工程学院, 2018: 13. WANG Defu. The effect of drought and water-logging stress on eco-physiology of Cinnamomum camphora seedlings[D]. Nanchang: Nanchang Institute of Technology, 2018: 13. |
| [8] |
CHARTZOULAKIS K, PATAKAS A, KOFIDIS G, et al. Water stress affects leaf anatomy, gas exchange, water relations and growth of two avocado cultivars[J]. Scientia Horticulturae, 2002, 95(1): 39. |
| [9] |
CHAVES M M, FLEXAS J, PINHEIRO C. Photosynthesis under drought and salt stress: regulation mechanisms from whole plant to cell[J]. Annals of Botany, 2009, 103(4): 551. DOI:10.1093/aob/mcn125 |
| [10] |
杨彪生, 单立山, 马静, 等. 红砂幼苗生长及根系形态特征对干旱-复水的响应[J]. 干旱区研究, 2021, 38(2): 469. YANG Biaosheng, SHAN Lishan, MA Jing, et al. Response of growth and root morphological characteristics of Reaumuria soongorica seedlings to drought-rehydration[J]. Arid Zone Research, 2021, 38(2): 469. |
| [11] |
陈梦园, 李迎超, 王利兵, 等. 2个种源栓皮栎对干旱及复水的光合生理响应[J]. 生态学杂志, 2019, 38(10): 2950. CHEN Mengyuan, LI Yingchao, WANG Libing, et al. Photosynthetic responses to drought and subsequent re-watering in seedlings from two different provenances of Quercus variabilis BI[J]. Chinese Journal of Ecology, 2019, 38(10): 2950. |
| [12] |
张玉玉. 旱后复水对侧柏幼苗生长生理补偿效应的研究[D]. 陕西杨凌: 西北农林科技大学, 2020: 8. ZHANG Yuyu. Compensatory effects of rewatering after drought on growth and physiology of Platycladus orientalis[D]. Yangling, Shaanxi: Northwest A&F University, 2020: 8. |
| [13] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 134. LI Hesheng. Principle and technology of plant physiological and biochemical experiments[M]. Beijing: Higher Educaiton Press, 2000: 134. |
| [14] |
LANDHÄUSSER S M, CHOW P S, DICKMAN L T, et al. Standardized protocols and procedures can precisely and accurately quantify non-structural carbohydrates[J]. Tree Physiology, 2018, 38(12): 1764. DOI:10.1093/treephys/tpy118 |
| [15] |
初江涛, 王进鑫, 邹朋, 等. 干旱和铅胁迫对生长初期的国槐和侧柏叶绿素的影响[J]. 西北林学院学报, 2012, 27(4): 19. CHU Jiangtao, WANG Jinxin, ZHOU Peng, et al. Effects of drought and pb stress on the contents of chlorophyls of Sophor japonica and Platycladus orientalis in their initial growth stages[J]. Journal of Northwest Forestry University, 2012, 27(4): 19. DOI:10.3969/j.issn.1001-7461.2012.04.04 |
| [16] |
GU Junfei, ZHOU Zhenxiang, LI Zhikang, et al. Rice (Oryza sativa L.) with reduced chlorophyll content exhibit higher photosynthetic rate and efficiency, improved canopy light distribution, and greater yields than normally pigmented plants[J]. Field Crops Research, 2017(200): 58. |
| [17] |
何宝龙. 五种园林植物光合作用系统对干旱胁迫的响应研究[D]. 杭州: 浙江农林大学, 2013: 25. HE Baolong. The response of photosynthesis system to drought stress of five species of landscape plants[D]. Hangzhou: Zhejiang A&F University, 2013: 25. |
| [18] |
麻雪艳, 周广胜. 夏玉米叶片气体交换参数对干旱过程的响应[J]. 生态学报, 2018, 38(7): 2372. MA Xueyan, ZHOU Guangsheng. Effect of drought on leaf gas exchange in summer maize[J]. Acta Ecologica Sinica, 2018, 38(7): 2372. |
| [19] |
张向娟. 干旱胁迫下棉花叶片光合特性的适应机制研究[D]. 新疆石河子: 石河子大学, 2014: 39. ZAHNG Xiangjuan. Photosynthetic acclimated mechanism of leaf in cotton under drought stress[D]. Shihezi, Xinjiang: Shihezi University, 2014: 39. |
| [20] |
SHIPLEY B, LECHOWICZ M J, WRIGHT I, et al. Fundamental trade-offs generating the worldwide leaf economics spectrum[J]. Ecology, 2006, 87(3): 535. DOI:10.1890/05-1051 |
| [21] |
温国胜, 张明如, 张国胜, 等. 干旱条件下臭柏的生理生态对策[J]. 生态学报, 2006, 26(12): 4059. WEN Guosheng, ZHANG Mingru, ZAHNG Guosheng, et al. Ecophysiological strategy of Sabina vulgaris under drought stress[J]. Acta Ecologica Sinica, 2006, 26(12): 4059. DOI:10.3321/j.issn:1000-0933.2006.12.019 |
| [22] |
IWASA Y, ROUGHGARDEN J. Shoot/root balance of plants: Optimal growth of a system with many vegetative organs[J]. Theoretical Population Biology, 1984, 25(1): 78. DOI:10.1016/0040-5809(84)90007-8 |
| [23] |
HACKE U G, SPERRY J S. Limits to xylem refilling under negative pressure in Laurus nobilis and Acer negundo[J]. Plant Cell and Environment, 2003, 26(2): 303. DOI:10.1046/j.1365-3040.2003.00962.x |
| [24] |
王林, 代永欣, 郭晋平, 等. 刺槐苗木干旱胁迫过程中水力学失败和碳饥饿的交互作用[J]. 林业科学, 2016, 52(6): 1. WANG Lin, DAI Yongxin, GUO Jinping, et al. Interaction of hydraulic failure and carbon starvation on Robinia pseudoacacia seedlings during drought[J]. Scientia Silvae Sinicae, 2016, 52(6): 1. |
 2021, Vol. 19
2021, Vol. 19 
