2. 北京林业大学 水土保持国家林业局重点实验室, 100083, 北京;
3. 北京农业职业学院, 102442, 北京
中国水土保持科学  2021, Vol. 19 2021, Vol. 19  Issue (1): 60-68. DOI: 10.16843/j.sswc.2021.01.008 Issue (1): 60-68. DOI: 10.16843/j.sswc.2021.01.008 |
植被恢复是恢复不断退化的生态系统和改善恶劣环境的最有效方法之一,是我国北方地区防治荒漠化的重要手段[1], 植被恢复的应用可以有效地防止风蚀,提高土壤肥力,改变土壤理化性质,促进土壤形成[2]。然而,以植物固沙为主要措施的生态重建与恢复工程仍处于初步恢复阶段,自我调节能力较弱,稳定性较差极易出现反复[3];因此,及时有效地监测和评价不同沙区固沙植被的稳定性是确保人工固沙效果实现沙区生态恢复的重要工作。
近年来,随着地下生态学的深入发展,土壤真菌在植被恢复与重建过程中的作用备受关注[4-5]。一方面,在荒漠生态系统中,土壤真菌具有良好的抗压性和抗旱性,可以很好地适应严酷的环境条件,在贫瘠干旱的土壤中表现出高度多样性和广泛分布性[6],并在生物多样性保护和维持生态系统功能方面发挥着重要作用[7-8]。另一方面,土壤真菌作为土壤生态系统重要的分解者,分解转化土壤有机质、释放养分、参与土壤物质循环和能量流动,能敏感的反应土壤环境变化[9];因此,对荒漠化地区生态恢复过程中土壤真菌群落结构及多样性的深入研究,将有助于荒漠生态系统生物多样性的研究与保护,为评价植被恢复与重建过程中土壤质量和土壤肥力变化提供科学依据。
土壤真菌与植物群落关系密切,土壤真菌可提高土壤养分利用率、降低水分消耗、调节植物多样性和生产力。植物可通过根系分泌物和脱落物等物质为真菌提供生长所需的碳源和能源,进而影响真菌的种类和数量[10]。同时,土壤真菌多样性及其组成依赖于土壤性质,如土壤水分、养分和pH值[11-12],植物还可以通过改变土壤理化性质间接影响土壤真菌多样性。尽管植物对土壤真菌具有重要的生态作用,但相对于土壤细菌群落,特别是在荒漠生态系统中,植物种类对土壤真菌组合的影响仍然知之甚少,对于荒漠化地区不同固沙植物下是否存在特定的土壤真菌组合,目前的认识非常有限。本研究拟采用高通量18SrRNA基因测序技术对呼伦贝尔沙地3种固沙植物差巴嘎蒿(Artemisia halodendron)、小叶锦鸡儿(Caragana microphylla)和樟子松(Pinus sylvestris var. mongolica)下土壤真菌群落结构和多样性进行研究,探究土壤真菌群落对不同固沙植物的响应,并确定哪种固沙植物更适合重建退化的呼伦贝尔沙地。
1 研究区概况研究地点位于内蒙古自治区呼伦贝尔沙地,地理坐标为E 119°54′、N 48°50.4′。海拔670 m左右。该地区为温带半干旱大陆性气候,多年平均降雨量为307.7 mm,主要降雨事件发生在6—9月。土壤类型以风沙土为主,土壤结构性较差,易受风蚀。2006年以来,该地区通过人工种植固沙植被的方式,防止土壤进一步沙化。植被恢复前,该地区为半固定沙地(植被覆盖率 <15%),干旱植被稀疏。本研究在该地区选取优势物种分别为差巴嘎蒿、小叶锦鸡儿、和樟子松的3种植被恢复区作为研究样地,且恢复年限均为8年左右,植被覆盖率均在60%以上(表 1)。
| 表 1 样地植物的基本信息 Tab. 1 Basic information of the sampled vegetation |
2015年6月,在每个样地内,随机设置3个20 m×20 m的样方,各样方间距为20 m。在每个样方内随机选择3株植物,分别在植物的东西南北4个方向采集土壤样品,采样前去除土壤表层枯落物,使用灭菌土钻采集0~10 cm的表层土样,并将每个样地采集的土壤样品混合为1个混合样,用便携式冰箱保鲜带回实验室。土壤样品过2 mm筛,一部分用于土壤理化分析,另一部分放置-40 ℃超低温冰箱保存,用于高通量测序送检。共采集土壤混合样品9个(3种植物×3个重复)。
2.2 土壤理化性质分析土壤水分采用烘干法(105 ℃干燥24 h)。土壤pH值采用土水比为1∶2.5的土壤浸提液进行测定。土壤有机碳、全氮、水解性氮、全磷和有效磷分别采用重铬酸钾氧化外加热法、半微量凯氏法、碱解扩散法、酸溶-钼锑抗比色法和NaHCO3浸提-钼锑抗比色法测定。土壤酶活性使用过1 mm筛的风干土进行测定,蔗糖酶活性、脲酶活性、过氧化氢酶活性和磷酸酶活性分别采用菲林滴定法、苯酚钠-次氯酸钠比色法、KMnO4滴定法和磷酸苯二钠比色法测定。
2.3 土壤DNA提取和高通量测序称取0.2 g新鲜土壤样品,使用E.Z.N.A.Soil DNA Kit试剂盒,按照说明书要求提取土壤微生物的DNA,并使用Qubit2.0荧光计检测DNA浓度,琼脂糖凝胶检测DNA完整性。使用PCR扩增仪,对土壤真菌18SrRNA基因V4区进行PCR扩增。PCR所用的引物为V43NDF(CCCTACACGACGCTCTTCCGATCTN (barcode) GGCAAGTCTGGTGCCAG)和Euk_V4_R(GTGACTGGAGTTCCTTGGCACCCGAG-AATTCCAACGGTATCTRATCRTCTTCG)。PCR产物检测合格后,使用Miseq测序平台进行测序。对测序原始数据进行质控、筛选和拼接,以97%的相似性将所有样品的有效序列数据聚类为OTUs(操作分类单元,operational taxonomic units)。使用RDP classifier软件和Silva数据库获取OTUs的物种注释信息。对所有样品数据进行均一化处理,得到OUT丰度数据以及微生物多样性数据。测序服务委托上海生工生物工程股份有限公司完成。
2.4 数据处理使用JMP(11.0.0)统计分析软件,对数据进行相关性分析和单因素方差分析;使用OriginPro 2015绘制土壤真菌群落组成图;使用OmicShare Tools云平台进行冗余分析。
3 结果与分析 3.1 土壤理化性质及酶活性分析不同固沙植物下土壤理化性质表明,除土壤含水量无显著差异外,其他土壤性质均有显著差异(表 2)。土壤全氮和碱解氮在樟子松和小叶锦鸡儿下的质量分数显著高于差巴嘎蒿(P < 0.05),土壤有机碳和速效磷在樟子松下的质量分数显著高于小叶锦鸡儿和差巴嘎蒿(P < 0.05),而土壤全磷在差巴嘎蒿下的质量分数和pH值显著高于樟子松。此外,不同固沙植物下土壤酶活性亦存在显著差异(P < 0.05)。樟子松下土壤磷酸酶和土壤过氧化氢酶的活性显著高于小叶锦鸡儿和差巴嘎蒿。小叶锦鸡儿下蔗糖酶活性显著高于其他固沙植物,土壤脲酶活性在3种固沙植物下无显著差异。
| 表 2 不同固沙植物土壤理化性质和土壤酶活性 Tab. 2 Soil chemical properties and enzyme activity under different sand-fixing plants |
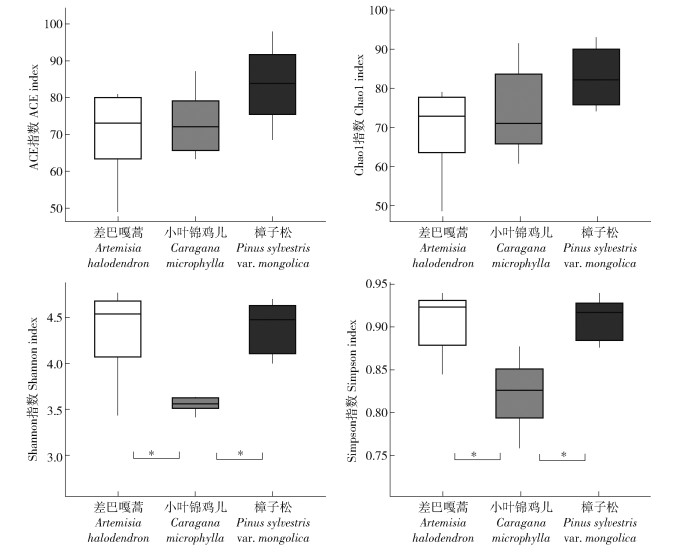
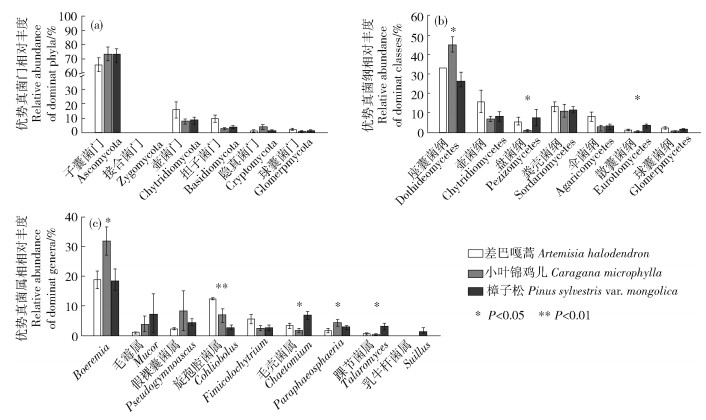
对12个样地的土壤样品所得测序序列,以97%相似性阀值进行OUT聚类,获得151条真菌群落结构组成信息。通过分类鉴定可知,真菌包含9门22纲44目55科63属。用ACE和Chao1指数估计真菌的分类学丰富度即物种数量多少,用Shannon和Simpson指数分析真菌群落的多样性(图 1)。结果表明3种植被类型的分类学丰富度无明显差异(P < 0.05),但小叶锦鸡儿的多样性比差巴嘎蒿和樟子松的低(P < 0.05)。土壤真菌在门分类水平下,主要类群有子囊菌门(Ascomycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)、担子菌门(Basidiomycota)、隐真菌门(Cryptomycota)和球囊菌门(Glomeromycota),其中子囊菌门在3种固沙植物下的相对丰度均>65%(图 2a),且在门水平上不同固沙植物间土壤真菌的相对丰度无显著差异。在纲分类水平下,主要类群有座囊菌纲(Dothideomycetes)、壶菌纲(Chytridiomycetes)、盘菌纲(Pezizomycetes)、粪壳菌纲(Sordariomycetes)、伞菌纲(Agaricomycetes)、散囊菌纲(Eurotiomycetes)、球囊菌纲(Glomeromycetes),在小叶锦鸡儿下座囊菌纲的相对丰度显著高于樟子松,而盘菌纲和散囊菌纲的相对丰度显著低于樟子松(P < 0.05;图 2b)。在属水平上,相对丰度>1%的优势属有9个(图 2c)。其中樟子松下相对丰度最高的属是踝节菌属(Talaromyces)和毛壳菌属(Chaetomium),小叶锦鸡儿下丰度最高的属是Boeremia和Paraphaeosphaeria,差巴嘎蒿下相对丰度最高的属是旋孢腔菌属(Cochliobolus)。不同固沙植物间无显著差异的属有毛霉属(Mucor)、假裸囊菌属(Pseudogymnoascus)、Fimicolochytrium、乳牛肝菌属(Suillus)。
|
图 1 不同固沙植物土壤真菌群落多样性 Fig. 1 Diversities of fungi community under different sand-fixing plants |
|
图 2 不同固沙植物土壤真菌群落组成 Fig. 2 Composition of fungi community under different sand-fixing plants |
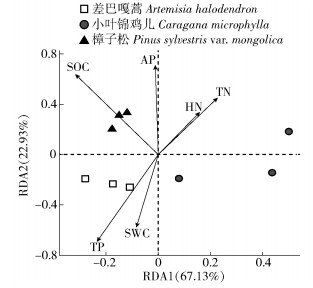
如图 3所示,通过冗余分析(redundancy analysis,RDA)发现,所有的环境变量共可解释90.06%(RDA1: 67.13%; RDA2: 22.93%)的土壤真菌群落结构的变化。土壤有机碳与第1排序轴相关性最大(相关系数为-0.446 13),土壤速效磷与第2排序轴相关性最大(相关系数为0.999 85),表明土壤有机碳和速效磷是解释土壤真菌群落结构的主要环境因子。差巴嘎蒿主要分布在第3象限,各样品组内之间距离较近,与土壤含水量和全磷呈正相关,表明该样地中土壤含水量和全磷是驱动土壤真菌群落结构的主要因素;樟子松主要分布在第2象限,各样品组内之间距离较近,与土壤有机碳和速效磷呈正相关,表明该样地中土壤有机碳和速效磷是驱动土壤真菌群落结构的主要因素;小叶锦鸡儿样品主要分布在第1和第4象限,各样品组内之间距离较远,表明该样地土壤真菌的生态位较为分化,受多种土壤养分的影响。结合组间相似性分析表明,3种固沙植物土壤真菌群落结构具有显著差异(P < 0.05;表 3)。
|
SWC: 土壤含水量Soil moisture content. SOC: 有机碳Soil organic carbon. TN: 全氮Total nitrogen. TP: 全磷Total phosphorus. HN: 碱解氮Hydrolytic nitrogen. AP: 速效磷Available phosphorus. 图 3 土壤性质与真菌关系冗余分析的二维排序 Fig. 3 Ordination diagram for redundancy analysis of relationship between soil properties and fungi |
| 表 3 组间相似性分析 Tab. 3 Analysis of similarities between different groups |
土壤真菌具有良好的抗压性和抗旱性,可以很好地适应荒漠生态系统等土壤养分和水分受限制的环境条件[6-7]。植被恢复重建后,土壤水分状况得到改善,根系分泌物及枯落物分解促使土壤有机质增加,有利于增加土壤真菌数量及多样性[13]。本研究中不同固沙植物建设后,樟子松下的土壤全氮、碱解氮、有机碳和速效磷等表征土壤养分的指标均高于小叶锦鸡儿和差巴嘎蒿,表明樟子松在沙区植被恢复中更利于土壤养分恢复及土壤肥力的提高。然而,不同固沙植物下土壤真菌丰富度并无显著差异(图 1),可能因为土壤真菌具有较宽的生态位,不同固沙植物间土壤养分的差异并未造成真菌物种数量的改变,只是改变了物种的多样性(图 1)。
呼伦贝尔沙地土壤中主要的真菌类群有子囊菌门、接合菌门、壶菌门、担子菌门、隐真菌门和球囊菌门,其中子囊菌门在3种固沙植物下的相对丰度均>65%(图 2a),这与毛乌素沙地、库布齐沙漠、腾格里沙漠和乌兰布和沙漠的调查结果一致[14-15]。大约98%的已知真菌种类属于子囊菌门或担子菌门,由于子囊菌比担子菌具有更快的进化速度和更丰富的物种[16],且子囊菌的进化主要受建立者效应的影响具有较强的抗压性,因此在干旱、缺水生存条件恶劣的沙地,子囊菌比担子菌更适于生存。
子囊菌门中相对丰度较高的4个纲为座囊菌纲、散囊菌纲、盘菌纲和粪壳菌纲(图 2b)。这4种真菌类群多数是腐生菌,具有较强的耐受性且在生态系统碳循环过程中起着重要的作用,是植物生物量的降解者[7],但有研究表明4种真菌类群的进化速率不同,粪壳菌纲最快,散囊菌纲次之,座囊菌纲和盘菌纲最慢[16]。本研究中,在樟子松下散囊菌纲和盘菌纲的相对丰度最高,小叶锦鸡儿下座囊菌纲的相对丰度最高,粪壳菌纲的相对丰度在三者间无显著差异(图 2b),表明樟子松下土壤真菌具有更快的进化速率,能促进土壤有机质分解,加快土壤碳循环过程,促进土壤有机碳的积累。
从属水平来看樟子松下相对丰度较高的属有踝节菌属和毛壳菌属(图 2c)。其中踝节菌属是一种重要的真菌拮抗剂即土壤病原菌的生物防治剂,同时它具有产生磷酸酶和可溶性色素的能力[17];毛壳菌是一种土壤病原菌生物防治剂,亦是一种常见的土壤殖民者和纤维素生产者,具有降解纤维素和其他有机物质的能力[18]。其他具有显著差异的属有Boeremia、Paraphaeosphaeria和旋孢腔菌属(图 2c)。其中,Boeremia和旋孢腔菌属是一类病原菌[19];Paraphaeosphaeria属能产生抗真菌物质和溶菌作用,杀死病原菌的菌丝体和菌核,在植物菌核病的生物防治方面发挥重要作用[20]。以上结果表明,从属水平来看樟子松下的真菌群落组合有利于磷酸酶的产生及纤维素等土壤有机质的降解。
土壤酶直接参与着土壤中许多重要的生物化学循环,土壤酶活性可以反映土壤肥力状况及微生物数量[21]。分析比较不同固沙植物下土壤酶活性发现,樟子松下土壤磷酸酶和过氧化氢酶的活性显著高于小叶锦鸡儿和差巴嘎蒿。土壤磷酸酶活性影响着土壤有机磷的分解转化及其生物有效性,土壤过氧化氢酶影响土壤有机质的转化体现了土壤腐殖质化水平[22]。结合上述结果,樟子松下相对丰度较高的踝节菌属具有产生磷酸酶的能力、毛壳菌具有降解纤维素和其他有机物质的能力以及散囊菌纲和盘菌纲具有较快的进化速率使土壤磷含量增加,表明樟子松下土壤真菌群落在土壤磷的转化与利用和土壤有机质的分解与利用两个方面优于小叶锦鸡儿和差巴嘎蒿,且踝节菌属可能是产生磷酸酶的主要类群。此外,有研究表明人工固沙植被建立后土壤酶活性恢复速率不同,不同土壤酶恢复速率依次为多酚氧化酶、过氧化氢、淀粉酶、酸性磷酸酶、纤维素酶、蔗糖酶和尿酶[23-24]。因此,土壤磷酸酶和过氧化氢酶活性较高,亦能表明樟子松下土壤恢复的效果更好。
分析影响土壤真菌群落结构的因素发现,不同固沙植物下的样品距离较近且不同固沙植物样品间具有显著差异(图 3,表 3),这一结果进一步证实不同固沙植物的建设会影响土壤真菌群落组成及结构。以往研究表明,与受土壤参数影响较大的细菌不同,真菌的组成与植物的关系更为密切。一方面,由于真菌体积较大,移动性差,群落分布明显受到空间限制,土壤真菌活性常常与根系或大营养斑块紧密联系[25]。另一方面,真菌多数作为分解者且多数的植物残体分解酶由真菌产生,其数量和结构易于受到植物残体的影响[26]。此外,本研究表明土壤有机碳和速效磷是影响土壤真菌群落结构的主要环境因子。以往研究发现,土壤碳储量的变化取决于土壤真菌群落组成的变化,而不是碳含量影响真菌群落[27]。土壤真菌作为土壤微生物的重要组成部分,其本身生物量就是土壤有机碳库的重要组成部分[28]。土壤真菌及其庞大的菌根菌丝亦是土壤呼吸的主要贡献者之一,并且它们还可通过保护团聚体中的有机碳不被侵蚀,从而抑制土壤碳的释放,促进土壤碳的积累[29-30]。因此,本研究中不同固沙植物下土壤有机碳含量的不同,可能是由于它们具有不同的真菌组合,而樟子松下的土壤真菌组合更利于土壤有机碳的积累。土壤中磷的移动性很差,只能通过扩散过程到达根系表面,导致根际磷胁迫[31],丛枝菌根真菌与植物根系建立共生关系后,菌丝通过分泌有机酸、磷酸酶和铁载体等方式提高根际有效磷浓度以满足植物对磷的需求[32]。因此,不同的真菌组合会影响土壤磷的转化和利用,而不同植物种会影响真菌组合的数量和多样性,本研究中樟子松下较高的土壤速效磷的含量表明樟子松下的土壤真菌组合具有较高的磷元素的转化能力,可提高土壤磷的植物利用率。由此可见,本研究中土壤有机碳与土壤速效磷对土壤真菌群落结构的解释,实则为不同固沙植物下不同的土壤真菌组合具有不同的碳转化和磷转化能力,使土壤有机碳和速效磷含量发生变化,表明土壤真菌群落结构对不同的植被类型表现出明显的敏感性,具有调控土壤碳磷循环的潜力。然而,不同固沙植物下具体是哪些真菌组合在发挥着促进碳循环和磷循环的功能特性,还需要未来通过宏基因组测序技术和同位素标记等技术进一步探究。
5 结论呼伦贝尔沙地不同固沙植物下的优势真菌类群有子囊菌门、接合菌门、壶菌门、担子菌门、隐真菌门和球囊菌门,植被类型的不同显著影响真菌群落的相对丰度。呼伦贝尔沙地3种不同固沙植物中,樟子松下土壤磷酸酶和土壤过氧化氢酶的活性约为差巴嘎蒿和小叶锦鸡儿的2倍,具有较强的土壤有机磷和有机质的分解转化能力。另外,樟子松下散囊菌纲(0.032 4%)、盘菌纲(0.074 4%)、踝节菌属(0.030 7%)和毛壳菌属(0.068 7%)的相对丰度显著高于差巴嘎蒿(0.009 4%、0.054 9%、0.008 5%和0.033 1%)和小叶锦鸡儿(0.003 2%、0.008 9%、0.002 5%和0.019 8%),具有较好的碳循环潜力;因此,从土壤真菌群落结构的角度来看,樟子松在固定移动沙丘和提高土壤肥力方面是较为适宜的树种。
| [1] |
李新荣, 周海燕, 王新平, 等. 中国干旱沙区的生态重建与恢复: 沙坡头站60年重要研究进展综述[J]. 中国沙漠, 2016, 36(2): 247. LI Xinrong, ZHOU Haiyan, WANG Xinping, et al. Ecological restoration and recovery in arid desert regions of China: A review for 60-year research progresses of Shapotou Desert Research and Experiment Station, Chinese Academy of Sciences[J]. Journal of Desert Research, 2016, 36(2): 247. |
| [2] |
左小安, 赵学勇, 赵哈林, 等. 沙地退化植被恢复过程中灌木发育对草本植物和土壤的影响[J]. 生态环境学报, 2009, 18(2): 643. ZUO Xiaoan, ZHAO Xueyong, ZHAO Halin, et al. Effects of shrub on understory herbaceoous plants and soil properties in the restoration processes of degraded vegetation in Horqin Sand Land[J]. Ecology and Environmental Sciences, 2009, 18(2): 643. |
| [3] |
赵媛媛, 高广磊, 秦树高, 等. 荒漠化监测与评价指标研究进展[J]. 干旱区资源与环境, 2019, 33(5): 83. ZHAO Yuanyuan, GAO Guanglei, QIN Shugao, et al. Desertification detection and the evaluation indicators: A review[J]. Journal of Arid Land Resources and Environment, 2019, 33(5): 83. |
| [4] |
李敏, 闫伟. 海拔对乌拉山油松根围真菌群落结构的影响[J]. 菌物学报, 2019, 38(11): 1992. LI Min, YAN Wei. Effects of altitude on rhizosphere fungal community structure of Pinus tabulaeformis in Wula Mountain, China[J]. Mycosystema, 2019, 38(11): 1992. |
| [5] |
郑欢, 张芝元, 韩燕峰, 等. 刺槐树洞悬土可培养真菌群落组成及其多样性分析[J]. 菌物学报, 2017, 36(5): 625. ZHENG Huan, ZHANG Zhiyuan, HAN Yanfeng, et al. Community composition and diversity of culturable fungi from the soil suspended in tree holes of Robinia pseudoacacia[J]. Mycosystema, 2017, 36(5): 625. |
| [6] |
MAKHALANYANE T P, VALVERDE A, GUNNOGLE E, et al. Microbial ecology of hot desert edaphic systems[J]. FEMS Microbiology Reviews, 2015, 39(2): 203. DOI:10.1093/femsre/fuu011 |
| [7] |
MURGIA M, FIAMMA M, BARAC A, et al. Biodiversity of fungi in hot desert sands[J]. Microbiologyopen, 2019, 8(1): e00595. DOI:10.1002/mbo3.595 |
| [8] |
WARDLE D A, LINDAHL B D. Disentangling global soil fungal diversity[J]. Science, 2014, 346(6213): 1052. DOI:10.1126/science.aaa1185 |
| [9] |
LORANGER M G, BARTHES L, GASTINE A, et al. Rapid effects of plant species diversity and identity on soil microbial communities in experimental grassland ecosystems[J]. Soil Biology & Biochemistry, 2006, 38(8): 2336. |
| [10] |
MARTIN F M, UROZ S, BARKER D G. Ancestral alliances: Plant mutualistic symbioses with fungi and bacteria[J]. Science, 2017, 356(6340): eaad4501. DOI:10.1126/science.aad4501 |
| [11] |
LIU Junjie, Sui Yueyu, YU Zhenhua, et al. Soil carbon content drives the biogeographical distribution of fungal communities in the black soil zone of northeast China[J]. Soil Biology & Biochemistry, 2015(83): 29. |
| [12] |
WANG Juntao, ZHENG Yuanming, HU Hangwei, et al. Soil pH determines the alpha diversity but not beta diversity of soil fungal community along altitude in a typical Tibetan forest ecosystem[J]. Journal of Soils & Sediments, 2015, 15(5): 1224. DOI:10.1007/s11368-015-1070-1 |
| [13] |
张树萌, 黄懿梅, 倪银霞, 等. 宁南山区人工林草对土壤真菌群落的影响[J]. 中国环境科学, 2018, 38(4): 1449. ZHANG Shumeng, HUANG Yimei, NI Yinxia, et al. Effects of artificial forest and grass on soil fungal community at southern Ningxia mountain[J]. China Environmental Science, 2018, 38(4): 1449. |
| [14] |
郭成瑾, 张丽荣, 沈瑞清, 等. 宁夏境内腾格里沙漠固沙植物根际土壤真菌多样性研究[J]. 菌物学报, 2017, 36(5): 552. GUO Chengjin, ZHANG Lirong, SHEN Ruiqing, et al. Diversity of rhizosphere soil fungi in sand-fixation plants in Tengger Desert of Ningxia Autonomous Region[J]. Mycosystema, 2017, 36(5): 552. |
| [15] |
孙蔷. 荒漠植被土壤真菌群落结构与多样性研究[D]. 呼和浩特: 内蒙古大学, 2019: 56. SUN Qiang. Research on the structure and diversity of soil fungi community in desert vegetation[D]. Huhehot: Inner Mongolia University, 2019: 56. |
| [16] |
WANG Haiying, GUO Shouyu, HUANG Manrong, et al. Ascomycota has a faster evolutionary rate and higher species diversity than Basidiomycota[J]. Science China (Life Sciences), 2010, 53(10): 1163. DOI:10.1007/s11427-010-4063-8 |
| [17] |
YILMAZ N, VISAGIE C M, HOUBRAKEN J, et al. Polyphasic taxonomy of the genus Talaromyces[J]. Studies in Mycology, 2014(78): 175. |
| [18] |
ASHWINI C. A review on Chaetomium globosum is versatile weapons for various plant pathogens[J]. Journal of Pharmacognosy and Phytochemistry, 2019, 8(2): 946. |
| [19] |
JAYASIRI S C, HYDE K D, JONES E B G, et al. Taxonomy and multigene phylogenetic evaluation of novel species in Boeremia and Epicoccum with new records of Ascochyta and Didymella (Didymellaceae)[J]. Mycosphere, 2017, 8(8): 1080. DOI:10.5943/mycosphere/8/8/9 |
| [20] |
NICOT P C, AVRIL F, DUFFAUD M, et al. Differential susceptibility to the mycoparasite Paraphaeosphaeria minitans among Sclerotinia sclerotiorum isolates[J]. Tropical Plant Pathology, 2018, 44(1): 82. DOI:10.1007/s40858-018-0256-7 |
| [21] |
闫丽娟, 王海燕, 李广, 等. 黄土丘陵区4种典型植被对土壤养分及酶活性的影响[J]. 水土保持学报, 2019, 33(5): 190. YAN Lijuan, WANG Haiyan, LI Guang, et al. Effects of four typical vegetations on soil nutrient and enzymes activities in loess hilly region[J]. Journal of Soil and Water Conservation, 2019, 33(5): 190. |
| [22] |
闫德仁, 张胜男, 黄海广, 等. 沙地樟子松人工林土壤养分和酶活性变化研究[J]. 西部林业科学, 2019, 48(3): 10. YAN Deren, ZHANG Shengnan, HUANG Haiguang. Changes of soil nutrients and enzyme activities for Pinus sylvestris var. mongolica plantation in sandy land[J]. Journal of West China Forestry Science, 2019, 48(3): 10. |
| [23] |
ZHANG Z S, DONG X J, LIU Y B, et al. Soil oxidases recovered faster than hydrolases in a 50-year chronosequence of desert revegetation[J]. Plant and Soil, 2012, 358(1/2): 275. DOI:10.1007/s11104-012-1162-2 |
| [24] |
马晓俊, 李云飞. 腾格里沙漠东南缘植被恢复过程中土壤微生物量及酶活性[J]. 中国沙漠, 2019, 39(6): 159. MA Xiaojun, LI Yunfei. Soil microbial biomass and enzyme activities during revegetation process in the southeastern fringe of the Tengger Desert[J]. Journal of Desert Research, 2019, 39(6): 159. |
| [25] |
BALDRIAN P, KOLARÍK M, ŠTURSOVÁM S, et al. Active and total microbial communities in forest soil are largely different and highly stratified during decomposition[J]. ISME Journal Multidisciplinary Journal of Microbial Ecology, 2012, 6(2): 248. |
| [26] |
BAI Z, BODÉ S, HUYGENS D, et al. Kinetics of amino sugar formation from organic residues of different quality[J]. Soil Biology & Biochemistry, 2013(57): 814. |
| [27] |
CLEMMENSEN K E, FINLAY R D, DAHLBERG A, et al. Carbon sequestration is related to mycorrhizal fungal community shifts during long-term succession in boreal forests[J]. New Phytologist, 2015, 205(4): 1525. DOI:10.1111/nph.13208 |
| [28] |
CLEMMENSEN K E, BAHR A, OVASKAINEN O, et al. Roots and associated fungi drive long-term carbon sequestration in boreal forest[J]. Science, 2013, 339(6127): 1615. DOI:10.1126/science.1231923 |
| [29] |
ZHU Y G, MILLER R M. Carbon cyclin by arbuscular mycorrhizal fungi in soil-plant systems[J]. Trends in Plant Science, 2003, 8(9): 407. DOI:10.1016/S1360-1385(03)00184-5 |
| [30] |
ZHANG Bingwei, LI Shan, CHEN Shiping, et al. Arbuscular mycorrhizal fungi regulate soil respiration and its response to precipitation change in a semiarid steppe[J]. Scientific Reports, 2016, 6(1): 1. DOI:10.1038/s41598-016-0001-8 |
| [31] |
SMITH S E, SMITH F A. Fresh perspectives on the roles of arbuscular mycorrhizal fungi in plant nutrition and growth[J]. Mycologia, 2012, 104(1): 1. DOI:10.3852/11-229 |
| [32] |
苏友波, 王贺, 张俊伶, 等. 丛枝菌根对三叶草根际磷酸酶活性的影响[J]. 植物营养与肥料学报, 1998, 4(3): 264. SU Youbo, WANG He, ZHANG Junling, et al. Effect of arbuscular mycorrhiza on phosphatase activity in the rhizosphere of clover[J]. Journal of Plant Nutrition and Fertilizers, 1998, 4(3): 264. |