-
项目名称
- 国家自然科学基金"植被缓冲带土壤水热特性对农业非点源污染物持留影响"(40901132);国家科技支撑计划课题"丹江口库区生态恢复与环境保障关键技术研究与示范"(2012BAC06B03)
-
第一作者简介
- 占海歌 (1990—), 男, 硕士研究生。主要研究方向:水土保持与生态恢复。E-mail:zhanhg826@163.com
-
通信作者简介
- 郭忠录 (1980—), 男, 博士, 副教授, 硕士生导师。主要研究方向:水土保持与生态恢复。E-mail: zlguohzau@163.com
-
文章历史
-
收稿日期:2016-06-21
修回日期:2016-09-09
库滨带 (riparian buffer strips) 是水陆间重要的生态交错带,具有重要的水文、生态、美学和社会经济功能,其作为一种水土保持和控制非点源污染的重要生物措施,能维持河 (湖) 岸稳定和生物多样性,且对氮、磷等污染物具有截留作用[1-2]。土壤氮素矿化是指土壤有机氮在微生物的作用下,转化为无机氮的过程,是氮素循环的关键过程之一,外源有机物 (凋落物和植物残体等) 是生态系统重要氮源,经矿化作用生成大量无机氮,对土壤理化性质产生重要影响,对该生态系统适应性植物的选择有重要作用。大量研究表明:环境因子 (温度和水分)[3]、土壤理化性质 (有机质质量分数、质地、团聚体、水分和土壤温度等)[4]及人为活动[5]等非生物因素,对土壤氮矿化有重要的影响;土壤动物和微生物在其活动和代谢过程中,通过对有机质的破坏、分解及其他生化作用,而对氮素矿化产生影响。
国内外对植被与土壤氮矿化关系的研究主要集中在土壤类型[6]、水热条件[7]和植被种类[8]等因素,植被地上部分[9-11]的研究已有报道,但对地下部分植物根系以及地上地下混合处理的矿化研究鲜有报道。苘麻 (Abutilon theophrasti Medicus) 是丹江口库区库滨带最常见的一年生亚灌木状草本,野外调查发现其伴生的蛇床 (Cnidium monnier L. Cuss) 最为常见;因此,笔者研究不同部位植物添加土壤后的有机氮矿化特征,探究植物化学性质与土壤氮矿化的关系,为该区域植被生态恢复、水土保持与非点源污染治理,提供参考依据。
1 研究区概况习家店镇位于湖北省丹江口市,丹江口水库北岸 (E 110°10′,N 32°43′),属于北亚热带季风气候,年平均气温15.1 ℃,年均降水量在800 mm左右,降雨集中在4—10月份。该区地形的主要特点是高差大、坡度陡和切割深,海拔在500~1 500 m之间,总的地势是西北高、东南低、北陡南缓,汉江沿线形成峡谷和盆地相间的地貌。土壤以山地黄棕壤和黄褐土为主。该区处于亚热带常绿阔叶林和北亚热带常绿落叶阔叶林地带,适生的植物种类繁多,库周群丛生长显著,主要有柑橘 (Citrus reticulate Blanco.)+小飞蓬 (Conyza canadensis L. Cronq.) 群丛,苘麻+蛇床群丛等。
2 材料与方法 2.1 样品采集供试土样和植物 (苘麻,蛇床),于2013年6月采自丹江口习家店镇库周库滨带。土样采自无植物生长的裸地,按“S”型路线随机采集0~10 cm表层土壤 (黄棕壤),间距20 m,多点混合,土壤黏粒、粉粒和砂粒质量分数分别为14.07%、50.50%和35.43%(按美国制为粉壤土);植物样采集完整植株,带回实验室。土壤风干后,剔除杂质,研磨过2 mm筛,取少量过0.149 mm筛,分别做培养和化学分析试验。植物洗净后将地上部分和根分开,105 ℃杀青30 min,65 ℃烘干至恒重,磨碎过2 mm筛备用。
2.2 试验设计 2.2.1 试验处理以上述土壤及植物的叶和根为材料,并设置不添加植物的土壤为对照,采用室内需氧连续培养法,共9个处理,分别为对照 (CK)、苘麻叶 (QL)、苘麻根 (QR)、蛇床叶 (SL)、蛇床根 (SR)、苘麻叶+蛇床叶 (QL+SL)、苘麻叶+蛇床根 (QL+SR)、苘麻根+蛇床叶 (QR+SL)、苘麻根+蛇床根 (QR+SR),每个处理9个培养瓶对应9个取样时间点,3个重复,植物基本性质见表 1。
| 表 1 植物的初始化学性状 Table 1 Initial chemical properties of plant residuals used |
称取植物样 (50.00±0.50) g,根叶混合植物样以质量比1:1各添加0.25 g,混合均匀后平铺于容积为500 mL带盖的特制塑料广口瓶底部,加水使样品含水量为田间持水量的60%,温度设置为25 ℃,分别在培养的1、3、7、14、21、31、41、51和61 d取对应样本,测定土壤铵态氮和硝态氮的质量分数。每次取样将所有处理取下瓶盖,放置于空气中,完全通气4 h。培养期间每隔2 d称量,如果需要浇水保持容器恒重。
2.3 测定方法土壤机械组成采用吸管法,容重采用环刀法,土壤和植物有机碳采用重铬酸钾外加热法,全磷采用氢氧化钠钼蓝比色法,全氮采用半微量凯氏法,铵态氮采用氯化钾浸提-靛酚蓝比色法,硝态氮采用氯化钾浸提-紫外分光光度法,微生物碳采用氯仿薰蒸浸提法,植物木质素和纤维素采用酸性洗涤剂-碘量法,半纤维素采用盐酸水解-DNS法以及多元酚采用Folin-Ciocalteu比色法。
2.4 数据处理采用SPSS 17.0和Excel 2010等软件进行方差分析 (在0.05水平上差异显著,在0.01水平上差异极显著),不同处理之间的多重比较采用LSD法,利用Pearson法,分析不同植物初始化学性质与土壤氮矿化量之间的相关关系,主成分分析 (PCA) 确定植物各化学性质的重要程度。
混合处理有机氮矿化累积量预测值=((苘麻叶或根处理)X+(蛇床叶或根处理)Y)/(X+Y)。
式中:X,Y分别为对应处理所占混合植物样的质量分数之比,X,Y均为50%[12]。
3 结果与分析 3.1 添加植物后各处理矿化量比较添加植物后,不同处理的土壤氮矿化量随时间推移而有所差异 (表 2)。整个试验期,各处理矿化量均小于对照CK,整体趋势表现为:前期减小,中期缓慢增大,最终基本处于平衡。在试验前期1~7 d,各处理的矿化量均表现为减小,其中QL的降幅最大,达到19.46 mg/kg;中期7~41 d,各处理的矿化量均有所增加,其中CK和QL增长幅度较大,达到49.43 mg/kg以上,而SL增长最小,仅为0.32 mg/kg;后期41~61 d,各处理缓慢增长,并最终基本平衡。试验结束时,除混合处理QL+SL和QL+SR仍表现出增长趋势外,其他各处理基本达到平衡。
| 表 2 不同处理土壤氮矿化量 Table 2 Soil nitrogen mineralization rates under different treatments |
对于叶处理,苘麻和蛇床在试验期间,氮矿化量均表现为差异显著,差值最大是后期41~61 d,为64.76 mg/kg;根处理在试验前期1~7 d和中期7~41 d,苘麻和蛇床氮矿化量差异均不显著,后期41~61 d差异显著,差值最大为1.97 mg/kg;混合处理QL+SL和QL+SR以及QR+SL和QR+SR,在试验期氮矿化量差异均不显著。
3.2 添加植物后土壤微生物变化土壤环境的改变会引起微生物的迅速响应,微生物碳的质量分数可作为一种较好的微生物活动数量的指示指标[13]。由图 1可知,仅试验前期1~7 d,处理QR的微生物碳质量分数<CK,其他阶段添加植物处理均大于CK,且均达显著水平。试验结束时,各处理微生物碳质量分数的大小顺序为QL>QR+SL>QL+SR>QR+SR>QL+SL>QR>SL>SR>CK,添加植物处理的微生物碳质量分数为CK的1.25~5.86倍,混合处理微生物碳质量分数>单一处理 (QL除外),总体表现为QL>混合处理>单一处理 (QL除外)。说明添加植物后,土壤微生物质量分数会显著增加,苘麻茎叶的效果最好,混合处理的效果>单一处理。
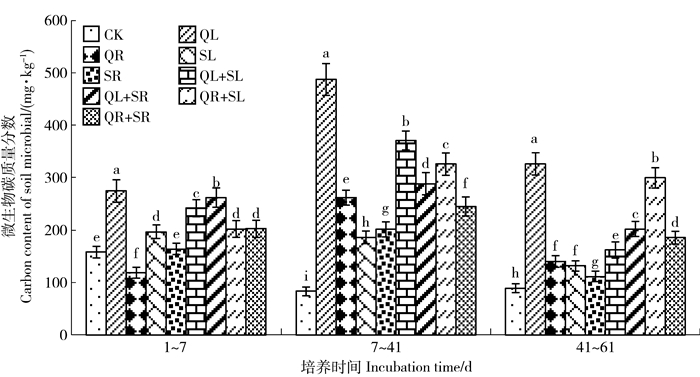
|
不同小写字母表示不同处理有显著差异P < 0.05。 Values with different letters refer to significant difference at 0.05 levels among the treatments. The same below. 图 1 不同处理土壤微生物碳质量分数变化 Figure 1 Carbon content of soil microbial with time under different treatments |
不同时期土壤氮矿化量与植物性质相关分析见表 3。结果表明,在整个试验期间,土壤氮矿化量与植物全磷、木质素、纤维素、半纤维素和多元酚质量分数相关性不显著,与全碳质量分数显著正相关,与全氮质量分数极显著正相关;在试验前期1~7 d和后期41~61 d,与植物C:N和L:N显著负相关。
| 表 3 植物化学性质与氮累积矿化量的相关关系 Table 3 Pearson linear correlation coefficients between plant chemical properties and accumulative soil nitrogen mineralization rates |
对植物化学性质进行主成分分析 (PCA),参考叶回春等[14]方法,计算指标得分系数和权重。由表 4可知:所有变量中,前3个主成分特征值>1,累积方差达到85.26%;第1主成分中,植物全氮、C:N和L:N占有较高载荷,多元酚和纤维素分别在第2和第3主成分中占有最高载荷。因而,选择植物全氮、C:N、L:N、多元酚和纤维素作为最后决定植物化学性质的代表性指标,将各主成分对应的数据除以对应特征值的平方根,得到相应的每个指标的对应系数。由此可得到以下方程:
| $\begin{array}{l} {F_1} =-0.454{\rm{N + 0}}{\rm{.049CE-0}}{\rm{.166PP + }}\\ \;\;\;\;\;\;\;\;\;0.434{\rm{C:N + 0}}{\rm{.421L:N, }} \end{array}$ | (1) |
| $\begin{array}{l} {F_2} =-0.019{\rm{N + 0}}{\rm{.131CE + 0}}{\rm{.559PP + }}\\ \;\;\;\;\;\;\;\;\;0.094{\rm{C:N-0}}{\rm{.286L:N, }} \end{array}$ | (2) |
| $\begin{array}{l} {F_3} = 0.032{\rm{N + 0}}{\rm{.620CE-0}}{\rm{.314PP-}}\\ \;\;\;\;\;\;\;\;0.246{\rm{C:N-0}}{\rm{.158L:N}}{\rm{。}} \end{array}$ | (3) |
| 表 4 植物化学性质主成分分析表 Table 4 Principal component analysis of different plant chemical properties |
综合植物化学性质指标F1、F2、F3各指标乘以相应贡献率,除以总贡献率之和,即
| $\begin{array}{l} F = \left( {0.50788{F_1} + 0.20135{F_2} + 0.14341{F_3}} \right)/\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;0.85264。 \end{array}$ | (4) |
由表 3和表 4可知,各植物化学性质得分系数和权重,由大到小顺序为N>C:N>CE>L:N>PP,说明植物全氮质量分数是土壤有机氮矿化最重要的决定因素,对土壤有机氮矿化有促进作用,植物C:N、L:N、多元酚和纤维素也有重要作用,其为矿化作用的抑制因素。
3.4 植物间的相互效应对混合处理,通过假设检验,比较预测值和实测值之间的差异。氮素矿化量的实测值与预测值对比结果见表 5,所有混合处理实测氮素矿化量均极显著,且小于预测值,说明混合植物处理并不能促进土壤中有机氮矿化,也无激发效应。
| 表 5 混合处理氮矿化量预测值 Table 5 Predicted values of N mineralization under mixed treatments (mean±SE, n=3) |
2种植物叶片处理的土壤氮矿化量,在试验期表现出显著性差异,根处理在试验前期和中期差异不显著,而后期差异显著。这可能与植物自身的化学性质有关[15],化学性质不同,会影响它们的分解速率[3]。B.R.Taylor等[16]研究发现,分解前期由N制约凋落物分解速率,后期由木质素浓度或L:N比制约分解速率;Xu Xiaoniu等[17]也认为,植物质量分解前期主要受养分质量分数的影响,后期则受木质素和纤维素/木质素比支配。笔者研究认为:QL的全氮质量分数是SL的4.05倍,木质素和L:N分别为SL的59.89%和14.75%(表 1);主成分分析表明,植物化学性质重要程度,由大到小顺序为N>C:N>CE>L:N>PP。B.Berg等[18]发现,植物中N、P、K初始浓度高,使得初期分解较快。当N质量分数较低时,制约微生物的生长发育,增加N质量分数,可促进微生物活动,提高土壤氮矿化[3],土壤有机氮矿化与植物C:N比呈负相关,C:N>25时,土壤氮矿化表现为固持作用[4],L:N较高时,会将氮矿化限制在较低的水平,当L:N降至较低后,土壤氮矿化会迅速增加[19]。研究中,各植物处理后,植物纤维素质量分数、C:N、L:N均较高,而全氮质量分数较低,这可能是导致添加植物后,各处理土壤有机氮矿化作用表现为固持的原因。
4.2 添加植物与土壤有机氮矿化的关系研究表明,添加植物后,土壤有机氮矿化分为3个阶段,即前期减小,中期迅速增长,后期基本保持稳定,这与很多学者的研究相同[16-17]。若将研究前期看作预培养,赵满兴等[20]认为培养的前一周时间,由于微生物需要逐步适应环境,并不能准确的反映有机氮矿化情况,笔者研究的中期和后期变化趋势与前人的结果一致。QL虽然是植物质量最好,仍表现为氮固持,这可能与土壤理化性质和植被种类有关。由于植被类型差异,而导致土壤氮矿化的不同,许晓静等[21]发现,针叶树种和豆科树种的凋落物分解N动态模型不同。土壤质地也可能是影响土壤氮矿化的原因,B.A.Roberts等[11]将棉花凋落物加到2种土壤中培养,结果均表现为氮固持,且黏壤土固持量>砂壤土。这是因为黏粒的小孔隙持有更多水分,对土温变化的响应与砂壤土不同,进而影响微生物的种群数量和活动。而笔者研究中,土壤黏粒质量分数为14.07%,介于B.A.Roberts等试验用2种土壤黏粒质量分数之间。
T.B.Gartner等[22]对凋落物混合矿化研究认为,凋落物混合分解过程中,存在无效应、促进效应和抑制效应3种情况,而这3种情况并不是一成不变的,有可能随时间的推移而表现出来[17]。笔者研究中,混合处理无促进作用,也没产生激发效应,这与T.B.Gartner等[22]、A.Hector等[23]研究结论相反,这可能与参与矿化作用的微生物数量和活性有关。Bai Junhong等[24]发现,参与土壤有机氮矿化的微生物主要是真菌、细菌和放线菌,尽管试验期间,叶、根以及混合处理的土壤微生物质量分数显著增加 (图 1),可能参与矿化作用的相关微生物的数量并没有显著增长。M. Zaman等[7]发现,升高温度,有益于土壤氮矿化,当温度由25 ℃升高到40 ℃时,土壤氮矿化量从每天5.5 μg/kg增加到20.9 μg/kg,这是因为温度的升高,使土壤可溶性碳增加,促进了微生物的活动。J.Dessureault-Rompre等[25]发现,大约80%的土壤有机氮矿化作用,发生在微生物活动的水层,且矿化作用的最佳含水量为田间持水量。综上所述,笔者研究的土壤有机氮矿化量较小。
5 结论1) 添加植物后的土壤有机氮矿化呈现3个阶段,即前期减小,中期缓慢增大,最终基本处于平衡;所有处理的有机氮矿化量均<对照,矿化作用是抑制效应。由于植物化学性质的不同,叶处理试验期间,苘麻和蛇床氮矿化量均表现为差异显著;根处理在试验期前期和中期,苘麻和蛇床氮矿化量差异均不显著,后期差异显著;混合处理QL+SL和QL+SR以及QR+SL和QR+SR在试验期,氮矿化量差异均不显著。
2) 根叶混合处理显著增加了土壤微生物数量,但是土壤有机氮矿化并没增加,无激发效应。
3) 主成分分析表明,影响土壤有机氮矿化的主要植物化学性质是全氮、C:N、L:N、多元酚和纤维素,其中全氮的影响效果最为明显,而全磷、木质素和半纤维素作用则较弱,其顺序为全氮>C:N>纤维素>L:N>多元酚。
| [1] |
张广分. 潮白河上游河岸植被缓冲带对氮、磷去除效果研究[J].
中国农学通报, 2013, 29(8): 189.
ZHANG Guangfen. The effects of riparian vegetation buffer zones on nitrogen and phosphorus reduction in Caobai River upstream[J]. Chinese Agricultural Science Bulletin, 2013, 29(8): 189. DOI: 10.11924/j.issn.1000-6850.2012-3443. |
| [2] |
饶良懿, 崔建国. 河岸植被缓冲带生态水文功能研究进展[J].
中国水土保持科学, 2008, 06(4): 121.
RAO Liangyi, CUI Jianguo. Research advances on the eco-hydrological functions of riparian buffer[J]. Science of Soil and Water Conservation, 2008, 06(4): 121. |
| [3] |
王相娥, 薛立, 谢腾芳. 凋落物分解研究综述[J].
土壤通报, 2009, 40(6): 1473.
WANG Xiange, XUE Li, XIE Tengfang. A review on litter decomposition[J]. Chinese Journal of Soil Science, 2009, 40(6): 1473. |
| [4] |
李贵才, 韩兴国, 黄建辉, 等. 森林生态系统土壤氮矿化影响因素研究进展[J].
生态学报, 2001, 21(7): 1187.
LI Guicai, HAN Xingguo, HUANG Jianhui, et al. A review of affecting factors of soil nitrogen mineralization in forest ecosystems[J]. Acta Ecologica Sinica, 2001, 21(7): 1187. |
| [5] | MYLLIEMNGAP W, NASH D, BARIK S K. Changes in vegetation and nitrogen mineralization during recovery of a montane subtropical broadleaved forest in North-eastern India following anthropogenic disturbance[J]. Ecological Research, 2016, 31(1): 21. DOI: 10.1007/s11284-015-1309-8. |
| [6] | BONITO G M, COLEMAN D C, HAINES B L, et al. Can nitrogen budgets explain differences in soil nitrogen mineralization rates of forest stands along an elevation gradient?[J]. Forest Ecology &. Managemen, 2002, 176(1/2/3): 563. |
| [7] | ZAMAN M, CHANG S X. Substrate type, temperature, and moisture content affect gross and net N mineralization and nitrification rates in agroforestry system[J]. Biology & Fertility of Soils, 2004, 39(4): 269. |
| [8] | VAN DERKRIFT T A J, BERENDSE F. The effects of plant species on soil nitrogen mineralization[J]. Journal of Ecology, 2001, 89(4): 555. DOI: 10.1046/j.0022-0477.2001.00580.x. |
| [9] |
胡亚林, 汪思龙, 黄宇, 等. 凋落物化学组成对土壤微生物学性状及土壤酶活性的影响[J].
生态学报, 2005, 25(10): 2662.
HU Yalin, WANG Silong, HUANG Yu, et al. Effects of litter chemistry on soil biological property and enzymatic activity[J]. Acta Ecologica Sinica, 2005, 25(10): 2662. DOI: 10.3321/j.issn:1000-0933.2005.10.030. |
| [10] |
林开敏, 章志琴, 曹光球, 等. 杉木与楠木叶凋落物混合分解及其养分动态[J].
生态学报, 2006, 26(8): 2732.
LIN Kaimin, ZHANG Zhiqi, CAO Guangqiu, et al. Decomposition characteristics and its nutrient dynamics of leaf litter mixtures of both Chinese fir and Phoeba bournei[J]. Acta Ecologica Sinica, 2006, 26(8): 2732. |
| [11] | ROBERTS B A, FRITSCHI F B, HORWATH W R, et al. Nitrogen mineralization potential as influenced by microbial biomass, cotton residues and temperature[J]. Journal of Plant Nutrition, 2015, 38(3): 311. DOI: 10.1080/01904167.2013.868486. |
| [12] | ZENG Dehui, MAO Rong, CHANG S X, et al. Carbon mineralization of tree leaf litter and crop residues from poplar-based agroforestry systems in Northeast China: a laboratory study[J]. Applied soil ecology, 2010, 44(2): 133. DOI: 10.1016/j.apsoil.2009.11.002. |
| [13] | ROSTAMI A, GHOLAMALIZADEH A. Influence of conventional and conservation tillage on C and N mineralization in soil. A Rexiew[J]. International Journal of Plant, Animal and Environmental Sciences, 2014, 4(3): 276. |
| [14] |
叶回春, 张世文, 黄元仿, 等. 北京延庆盆地农田表层土壤肥力评价及其空间变异[J].
中国农业科学, 2013, 46(15): 3151.
YE Huichun, ZHANG Shiwen, HUANG Yuanfang, et al. Assessment of surface soil fertility and its spatial variability in Yanqing Basin, Beijing, China[J]. Scientia Agricultura Sinica, 2013, 46(15): 3151. DOI: 10.3864/j.issn.0578-1752.2013.15.009. |
| [15] | O'CONNELL S, SHI W, GROSSMAN J M, et al. Short-term nitrogen mineralization from warm-season cover crops in organic farming systems[J]. Plant Soil, 2015, 396(1): 353. |
| [16] | TAYLOR B R, PARKINSON D, PARSONS W F J. Nitrogen and lignin content as predictor of litter decay rates: a microcosm test[J]. Ecology, 1989, 70(1): 97. DOI: 10.2307/1938416. |
| [17] | XU Xiaoniu, HIRATA E. Decomposition patterns of leaf litter of seven common canopy species in a subtropical forest: N and P dynamics[J]. Plant and Soil, 2005, 273(1): 279. |
| [18] | BERG B, MARZNER E. Effect of N deposition on decomposition of plant litter and soil organic matter in forest systems[J]. Environmental Reviews, 2000, 5(1): 1. |
| [19] | FINZI A C, CANHAM C D. Non-additive effects of litter mixture on net N mineralization in a southern New England forest[J]. Forest Ecology &.Management, 1998, 105(1/2/3): 129. |
| [20] |
赵满兴, KARSTENK, 周建斌. 黄土区几种土壤培养过程中可溶性有机氮的变化及其与土壤矿化氮的关系[J].
水土保持学报, 2008, 22(4): 122.
ZHAO Manxing, KARSTEN K, ZHOU Jianbin. Dynamics of soluble organic nitrogen and its relation to mineralization of soil organic nitrogen during incubation of several soils in the Loess Region[J]. Journal of Soil and Water Conservation, 2008, 22(4): 122. |
| [21] |
许晓静, 张凯, 刘波, 等. 森林凋落物分解研究进展[J].
中国水土保持科学, 2007, 5(4): 108.
XU Xiaojing, ZHANG Kai, LIU Bo, et al. Review on litter decomposition in forest ecosystems[J]. Science of Soil and Water Conservation, 2007, 5(4): 108. |
| [22] | GARTNER T B, CARDON Z G. Decomposition dynamics in mixed-species leaf litter[J]. Oikos, 2004, 104(2): 230. DOI: 10.1111/oik.2004.104.issue-2. |
| [23] | HECTOR A, BEALE A, MINNS, et al. Consequences of the reduction of plant diversity for litter decomposition: effects through litter quality and microenvironment[J]. Oikos, 2000, 90(2): 357. DOI: 10.1034/j.1600-0706.2000.900217.x. |
| [24] | BAI Junhong, GAO Haifeng, XIAO Rong, et al. A review of soil nitrogen mineralization as affected by water and salt in coastal wetlands: issues and methods[J]. Clean-Soil, Air, Water, 2012, 40(10): 1099. DOI: 10.1002/clen.201200055. |
| [25] | DESSUREAULT-ROMPRE J, ZEBARTH B J, GEORGALLAS A, et al. A biophysical water function to predict the response of soil nitrogen mineralization to soil water content[J]. Geoderma, 2011, 167/168(8): 214. |
 2017, Vol. 15
2017, Vol. 15 
