文章信息
- 田地, 陈义堂, 史月冬, 连书钗, 边黎明, 唐罗忠
- TIAN Di, CHEN Yitang, SHI Yuedong, LIAN Shuchai, BIAN Liming, TANG Luozhong
- 间伐和施肥对杉木近熟林土壤微生物特征的影响
- Effects of thinning and fertilization on soil microbial characteristics in a near-mature Chinese fir plantation
- 森林与环境学报,2023, 43(6): 569-578.
- Journal of Forest and Environment,2023, 43(6): 569-578.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2023.06.002
-
文章历史
- 收稿日期: 2023-02-21
- 修回日期: 2023-04-25
2. 南京林业大学林学院, 江苏 南京 210037;
3. 福建省洋口国有林场, 福建 顺昌 353211
2. College of Forestry, Nanjing Forestry University, Nanjing, Jiangsu 210037, China;
3. Yangkou State Forest Farm, Shunchang, Fujian 353211, China
杉木(Cunninghamia lanceolate)是我国特有的速生用材树种,主要栽培在我国亚热带地区。大规模人工纯林和多代连栽仍然是目前杉木人工林的主要经营方式,面临着生产力下降、地力衰退等问题,制约着杉木人工林的可持续发展[1]。抚育间伐能合理调整林分密度,改善林内光照、温度、湿度等条件,促进保留木生长和林下植被再生,加快森林生态系统功能恢复[1-2]。间伐后林内自然环境和林下植被的改变会导致土壤微生物群落结构和功能发生变化,进而改变土壤养分状况。
土壤微生物个体小,数量多,对环境变化的敏感度高[3]。多数研究认为,微生物多样性越高,土壤的生态功能和生产功能越强[4]。所以,研究土壤微生物生物量碳氮性状和微生物群落特征对解析人工林地力退化机制,维护森林生态系统健康稳定具有重要意义。
关于杉木人工林土壤微生物群落特征研究,目前主要集中在环境胁迫[5-6]、化感作用[7]等所产生的影响方面,对间伐和施肥措施下的土壤微生物群落特征及其与微生物生物量碳氮关系缺乏深入的了解。本研究以杉木栽培中心地福建省洋口国有林场的杉木近熟林为研究对象,利用高通量测序技术分析间伐与施肥处理对土壤微生物群落结构的影响,为探讨土壤微生物群落特征及其与微生物生物量碳氮性状的关系,实现杉木人工林可持续经营提供理论参考。
1 研究区概况与研究方法 1.1 研究区概况试验林位于福建省南平市洋口国有林场打铁坑杉木人工林良种示范区(117°91′E,26°83′N),海拔200~350 m。该区属中亚热带海洋性季风气候,光热资源充足,雨水充沛,年平均气温18.5 ℃,极端最高气温42 ℃,极端最低气温-5.5 ℃,年均日照时间1 740.7 h,无霜期约305 d,年平均降水量1 756 mm,降水多集中于5—7月。土壤为红壤,呈酸性。
1.2 样地设置试验林为1991年采用1年生杉木实生苗营造的人工林,面积为5.34 hm2,林地坡度29°~34°,坡向东南,造林密度为2 500株·hm-2,至2021年,林分的株数保存率为69.9%,林木分布比较均匀。幼林期进行了砍杂除草等抚育措施,但未进行间伐和施肥。2021年2月,选择坡向相同、坡位和坡度相似的地块设置间伐(T)、间伐+施肥(TF)和对照(CK,不间伐不施肥)3种处理,每种处理均随机设置3块大小为40 m×40 m样地(样地间设置6 m宽的隔离带),共计9块样地。对林分进行每木检尺,杉木试验林基本特征见表 1。2021年3月,采用“下层伐”(伐除个体小、长势弱、无培养前途的林木)方式,兼顾均匀分布原则,对3块T处理样地和3块TF处理样地进行间伐,间伐强度分别为62.7%和62.1%。间伐剩余物(枝、叶和嫩梢)保留在林内,原木移出林地。2021年5月,对TF处理样地施用复合肥(N、P2O5、K2O的质量比为15∶15∶15),采用沟施法,沿等高线在每株保留木上方约1.5 m处开设长约1 m,宽约18 cm,深约10 cm的施肥沟,均匀施入1 kg复合肥,与部分土壤搅拌均匀后再覆土,填满施肥沟。
| 处理 Treatment |
间伐前Before thinning | 间伐强度 Thinning intensity/% |
间伐1 a后One year after thinning | ||||
| 林分密度 Stand density /(tree·hm-2) |
平均胸径 Mean DBH/cm |
林分密度 Stand density /(tree·hm-2) |
平均胸径 Mean DBH /cm |
林下植被种类 Types of understory vegetation |
林下植被生物量 Biomass of understory vegetation/(t·hm-2) |
||
| 对照CK | 1 764±35 | 17.8±0.6 | 1 764±35 | 18.1±1.3 | 12 | 3.30±0.37 | |
| 间伐T | 1 768±50 | 18.9±1.1 | 62.7 | 659±26 | 21.0±1.6 | 15 | 4.31±0.23 |
| 间伐+施肥TF | 1 716±37 | 20.0±1.3 | 62.1 | 651±18 | 21.8±1.8 | 16 | 4.86±0.42 |
| 注:除间伐强度和林下植被种类外,其余指标数值为平均值±标准差。Note: the values of all indicators are presented as mean±standard deviation except for thinning intensity and understory vegetation type. | |||||||
2022年2月中旬,即间伐1 a后,在每块样地中随机选择3个位点,分别挖50 cm深的土壤剖面,在0~10、10~20、20~50 cm三个层次分别采集土样,先剔除土样中的砂石、细根等杂质,后过2 mm孔径的土壤筛。分别取3种处理9块样地的表层(0~10 cm)土样各5 g左右,装入无菌指形管中,液氮速冻后迅速转移至干冰保温盒中运输,用于DNA提取和微生物多样性分析。其余土样用无菌自封袋包装后置于干冰保温盒中运输至实验室,用于土壤微生物生物量碳(soil microbial biomass carbon,SMBC)、土壤微生物生物量氮(soil microbial biomass nitrogen,SMBN)含量和土壤pH值、全氮(total nitrogen,TN)和土壤有机碳(soil organic carbon,SOC)含量测定。间伐1 a后杉木林土壤基本性质见表 2。
| 处理 Treatment |
土层 Soil layer/cm |
pH值 pH value |
有机碳含量 SOC content/(g·kg-1) |
全氮含量 TN content/(g·kg-1) |
| 对照CK | 0~10 | 4.66±0.17a | 25.54±1.32ab | 1.31±0.01a |
| 10~20 | 4.49±0.04a | 20.94±1.57ab | 1.08±0.06a | |
| 20~50 | 4.44±0.02a | 9.94±0.78a | 0.66±0.01a | |
| 间伐T | 0~10 | 4.46±0.05ab | 26.40±1.05a | 1.31±0.04a |
| 10~20 | 4.44±0.02ab | 23.70±1.75a | 1.10±0.08a | |
| 20~50 | 4.30±0.04b | 10.15±1.68a | 0.66±0.09a | |
| 间伐+施肥TF | 0~10 | 4.38±0.05b | 23.83±0.54b | 1.29±0.02a |
| 10~20 | 4.31±0.03b | 18.30±1.78b | 1.03±0.05a | |
| 20~50 | 4.37±0.03ab | 10.53±1.42a | 0.62±0.08a | |
| 注:指标数值为平均值±标准差。不同小写字母表示相同土层不同处理间差异显著(P<0.05)。Note: the indicator value is presented as the mean±standard deviation. Different lowercase letters indicate significant differences among different treatments within the same soil layer (P<0.05). | ||||
土壤pH值和全氮、有机碳、SMBC以及SMBN含量均采用常规方法测定。
土壤微生物DNA提取和测序:使用土壤DNA抽提样品试剂盒[生工生物工程(上海)股份有限公司]提取土壤微生物总DNA,提供给上海美吉生物医药科技有限公司进行扩增和测序。细菌(16S)和真菌(ITS)分别采用引物338F-806R和ITS1F-ITS2R经过聚合酶链式反应(polymerase chain reaction,PCR)扩增,对PCR产物进行质量检测、纯化后,建立文库并使用Illumina平台开展高通量测序;利用Fastp对测序数据进行拼接和质控,得到优化序列;采用Uparse软件按照对优化序列进行分类操作单元(operational taxonomic units,OTU)聚类(97%相似性),获得OTU集。细菌与真菌分别对比Silva数据库(release 138 http://www.arb-silva.de)和Unite数据库(release 8.0 http://unite.ut.ee/index.php)进行生物数据对比,确定细菌、真菌群落,并得到每条OTU序列在不同生物分类层次上的分组数据。
1.5 数据分析运用R语言(version 3.3.1)工具制作土壤微生物群落组成柱状图;应用Mothur软件分别统计微生物丰富度指数(Ace和Chao 1)和多样性指数(Shannon和Simpson);基于非加权组平均算法(unweighted pair-group method with arithmetic means,UPGMA)进行层级聚类分析;使用R语言Vegan包完成基于距离的冗余分析(distance-based redundancy analysis,db-RDA)并制图。
使用Excel 2017软件完成了基本数据分析并作图,并使用SPSS 20.0对数据完成了单因素方差分析(one-way ANOVA)和Pearson相关性分析。
2 结果与分析 2.1 间伐和施肥对土壤微生物生物量碳氮含量及其化学计量特征的影响如图 1(a)所示,3种处理的SMBC含量随着土层的加深而均呈降低趋势。在TF处理中,各土层间的SMBC含量均存在显著差异(P<0.05)。在CK和T处理中,SMBC含量仅在0~10 cm与20~50 cm土层间差异显著(P<0.05)。3种处理在各个土层中的SMBC含量均为TF>T>CK,但不同处理之间的差异均不显著(P>0.05)。
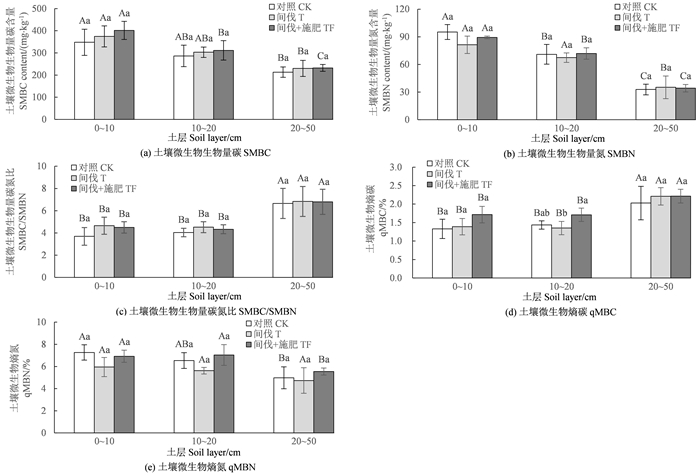
|
注:柱条上不同小写字母表示相同土层不同处理间差异显著(P<0.05),不同大写字母表示相同处理不同土层间差异显著(P<0.05)。 Note: different lowercase letters on the bars indicate significant differences among different treatments in the same soil layer (P<0.05), and different uppercase letters indicate significant differences among different soil layers in the same treatment (P<0.05). 图 1 不同处理不同土层的土壤微生物生物量碳氮性状 Fig. 1 Microbial biomass carbon and nitrogen traits of soil under different treatments and soil layers |
如图 1(b)所示,随着土层加深,3种处理的SMBN含量均呈降低趋势。CK和TF处理的不同土层之间SMBN含量均存在显著差异(P<0.05);T处理的0~10、10~20 cm土层的SMBN含量显著高于20~50 cm土层(P<0.05),但0~10、10~20 cm土层之间的SMBN含量差异不显著(P>0.05)。相同土层不同处理之间的SMBN含量有所不同,但差异均不显著(P>0.05)。
如图 1(c)所示,3种处理的20~50 cm土层SMBC/SMBN均显著高于0~10、10~20 cm土层(P<0.05),而0~10、10~20 cm土层之间SMBC/SMBN差异不显著(P>0.05)。同一土层不同处理间的SMBC/SMBN均无显著差异(P>0.05),但CK处理的SMBC/SMBN在3个土层土壤中均最低,表明在CK林分中,SMBC含量相对较低,SMBN含量相对较高;T和TF处理会提高SMBC比例,降低SMBN比例,导致它们的SMBC/SMBN高于CK。
如图 1(d)所示,3种处理20~50 cm土层的qMBC均显著大于0~10、10~20 cm土层(P<0.05),而0~10 cm与10~20 cm土层的qMBC无显著差异(P>0.05)。除了10~20 cm土层TF处理的qMBC显著大于T处理(P<0.05)外,其他土层中,不同处理之间的qMBC差异均不显著(P>0.05),但TF处理的qMBC总体上较大。
图 1(e)显示,总体上,qMBN随着土层深度的增加而降低。相同土层不同处理之间的qMBN无显著差异(P>0.05),但在3个土层中,T处理的qMBN均低于CK和TF处理。
2.2 间伐和施肥对土壤微生物群落组成的影响从3种处理的土壤标本中检出的细菌有32门79纲189目282科413属746种。在门水平上[图 2(a)],土壤中主要优势细菌门为酸杆菌门(Acidobacteriota)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和放线菌门(Actinobacteriota)。与CK相比,T和TF处理均提高了绿弯菌门的相对丰度,T处理还提高了变形菌门、放线菌门和芽单胞菌门(Gemmatimonadota)的相对丰度,但降低了酸杆菌门和疣微菌门(Verrucomicrobiota)的相对丰度;TF处理提高了酸杆菌门和WPS-2的相对丰度,但降低了变形菌门、放线菌门和厚壁菌门(Firmicutes)的相对丰度。
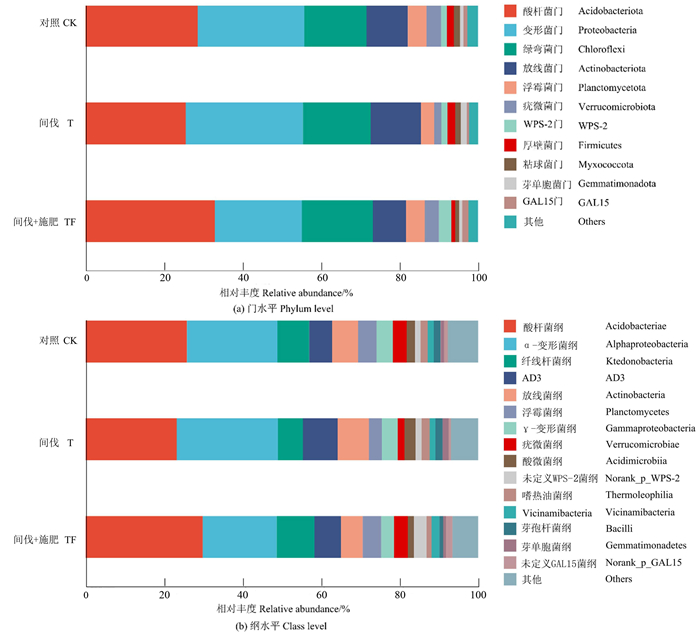
|
图 2 不同处理土壤细菌在门和纲水平上的相对丰度 Fig. 2 Relative abundance of soil bacteria in different treatments at the phylum and class levels |
在纲水平上[图 2(b)],酸杆菌纲(Acidobacteriae)、α-变形菌纲(Alphaproteobacteria)、纤线杆菌纲(Ktedonobacteria)、AD3和放线菌纲(Actinobacteria)为优势菌纲。与CK相比,T处理提高了α-变形菌纲、AD3和放线菌纲的相对丰度,降低了酸杆菌纲和纤线杆菌纲的相对丰度;TF处理提高了酸杆菌纲和纤线杆菌纲的相对丰度,降低了α-变形菌纲和放线菌纲的相对丰度。
从3种处理的土壤标本中检出的真菌有12门48纲111目229科426属615种。不同处理的土壤真菌群落结构存在较大差异。在门水平上[图 3(a)],土壤真菌主要由子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)及尚未被鉴定菌门(Unclassified_K_Fungi)组成。与CK相比,T和TF处理的土壤担子菌门相对丰度明显降低;T和TF处理的土壤子囊菌门相对丰度提高,且T处理提高幅度较大;T和TF处理的土壤被孢霉门的相对丰度明显上升,且TF处理的上升幅度高于T处理。
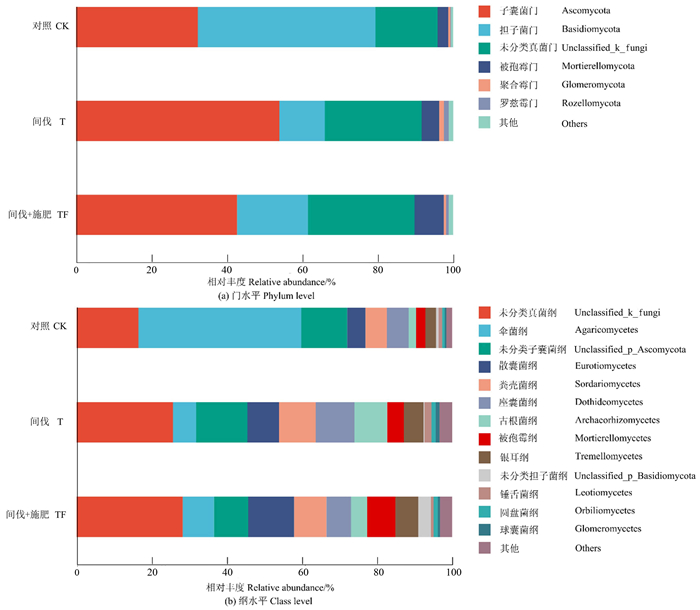
|
图 3 不同处理土壤真菌在门和纲水平上的相对丰度 Fig. 3 Relative abundance of soil fungi in different treatments at the phylum and class levels |
在纲水平上[图 3(b)],T和TF处理均使土壤伞菌纲(Agaricomycetes)的相对丰度明显降低,银耳纲(Tremellomycetes)的相对丰度上升。T和TF两种处理均使土壤散囊菌纲(Eurotiomycetes)、粪壳菌纲(Sordariomycetes)和古根菌纲(Archacorhizomycetes)的相对丰度上升。
2.3 间伐和施肥对土壤微生物群落Alpha多样性的影响表 3显示,T和TF处理下土壤细菌的Ace、Chao 1和Shannon指数均低于CK,T和TF处理下土壤细菌的Simpson指数均高于CK,但3种处理之间的细菌多样性指数差异均不显著(P>0.05);表 3还显示,T和TF处理下的土壤真菌Ace和Chao 1指数均大于CK,但各处理间的差异均不显著(P>0.05)。土壤真菌Shannon指数呈T处理>TF处理>CK趋势,且三者之间差异显著(P<0.05)。T和TF处理下的土壤真菌Simpson指数均显著低于CK(P<0.05),T与TF处理之间Simpson指数差异不显著(P>0.05)。
| 微生物群落 Microbial community |
处理 Treatment |
Ace指数 Ace index |
Chao 1指数 Chao 1 index |
Shannon指数 Shannon index |
Simpson指数 Simpson index |
| 细菌Bacteria | CK | 2 045.08±78.75a | 2 045.72±59.78a | 5.63±0.01a | 0.010 4±0.000 3a |
| T | 1 949.76±126.81a | 1 931.07±98.20a | 5.43±0.16a | 0.013 2±0.001 9a | |
| TF | 1 939.66±28.18a | 1 918.90±18.10a | 5.52±0.07a | 0.012 5±0.001 8a | |
| 真菌Fungi | CK | 815.41±3.88a | 828.40±21.12a | 3.95±0.09c | 0.073 4±0.015 9a |
| T | 869.91±52.54a | 883.89±49.33a | 4.80±0.13a | 0.022 2±0.003 9b | |
| TF | 819.23±6.57a | 841.43±1.81a | 4.58±0.05b | 0.025 1±0.000 5b | |
| 注:同列数值后不同小写字母表示相同类型微生物不同处理之间的差异显著(P<0.05)。Note: different lowercase letters in the same column of values indicate that the same type of microorganisms have significant differences among different treatments (P<0.05). | |||||
从[图 4(a)]可以看出,3种处理的土壤细菌可分为2类:(1)T处理和CK;(2)TF处理。表明T与CK处理的土壤细菌组成相似,TF与其他两种处理之间的土壤细菌组成差异较大。
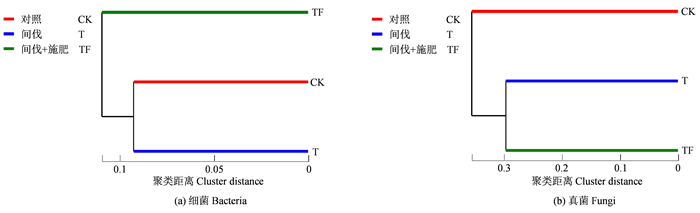
|
图 4 不同处理下土壤微生物群落结构层级聚类分析 Fig. 4 Cluster analysis of soil microorganisms with different treatments |
从[图 4(b)]可以看出,3种处理的土壤真菌也可分为2类:(1)TF和T处理;(2)CK。表明T和TF处理的土壤真菌组成相似,CK与其他两种处理之间的土壤真菌组成差异较大。
2.5 土壤微生物群落特征与微生物生物量碳氮性状的相关性对3种处理下的土壤微生物生物量碳氮性状(SMBC、SMBN、SMBC/SMBN、qMBC和qMBN)与对应的细菌和真菌群落结构进行冗余分析,结果如图 5所示。土壤微生物生物量碳氮性状可分别解释细菌和真菌的30.00%和43.03%的样本信息。根据各微生物生物量碳氮性状在第一和第二排序轴的解释量,可以看出SMBC/SMBN、qMBC和qMBN与细菌群落结构的相关性比较密切,SMBC/SMBN、qMBN和SMBN与真菌群落结构的相关性比较密切。
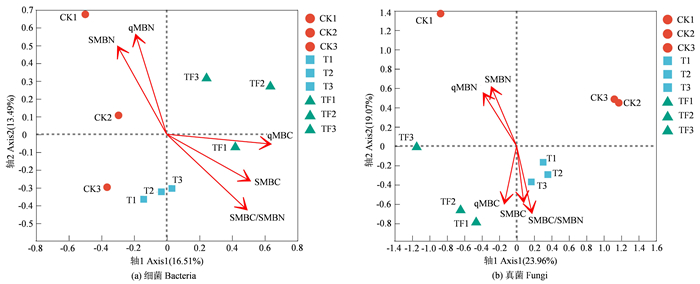
|
注:CK1、CK2和CK3为对照处理;T1、T2和T3为间伐处理;TF1、TF2和TF3为间伐+施肥处理。SMBC为土壤微生物生物量碳;SMBN为土壤微生物生物量氮;SMBC/SMBN为土壤微生物生物量碳氮比;qMBC为土壤微生物熵碳;qMBN为土壤微生物熵氮。 Note: CK1, CK2, and CK3 are control treatments; T1, T2, and T3 are thinning treatments; TF1, TF2, and TF3 are thinning plus fertilization treatments. SMBC represents soil microbial biomass carbon; SMBN represents soil microbial biomass nitrogen; SMBC/SMBN represents the ratio of soil microbial biomass carbon to nitrogen; qMBC represents soil microbial entropy carbon; qMBN represents soil microbial entropy nitrogen. 图 5 林分土壤微生物群落与土壤微生物生物量碳氮性状的冗余分析 Fig. 5 Redundancy analysis of soil microbial communities and soil microbial biomass carbon and nitrogen traits in forest stands |
如表 4所示,土壤细菌多样性指数与微生物生物量碳氮性状(SMBC、SMBN、SMBC/SMBN、qMBC和qMBN)之间均无显著相关性。土壤真菌Simpson多样性指数与微生物生物量碳氮性状之间也无显著相关性(P>0.05);土壤真菌Shannon多样性指数与SMBN之间呈显著负相关(P<0.05);土壤真菌Chao 1丰度指数与SMBN和qMBN之间均呈显著负相关(P<0.05);土壤真菌Ace丰度指数与SMBN和qMBN之间均呈极显著负相关(P<0.01)。
| 微生物多样性指数 Microbial diversity index |
土壤微生物生物量碳 SMBC |
土壤微生物生物量氮 SMBN |
土壤微生物生物量碳氮比 SMBC/SMBN |
土壤微生物熵碳 qMBC |
土壤微生物熵氮 qMBN |
|
| 细菌多样性指数 Bacterial diversity index |
Shannon | -0.16 | 0.13 | -0.16 | -0.12 | 0.16 |
| Simpson | 0.05 | -0.11 | 0.07 | -0.06 | -0.14 | |
| Chao 1 | -0.31 | -0.09 | -0.16 | -0.33 | -0.11 | |
| Ace | -0.24 | -0.27 | -0.01 | -0.26 | -0.27 | |
| 真菌多样性指数 Fungal diversity index |
Shannon | 0.30 | -0.69* | 0.60 | 0.22 | -0.66 |
| Simpson | -0.18 | 0.51 | -0.42 | -0.21 | 0.46 | |
| Chao 1 | -0.15 | -0.73* | 0.35 | -0.31 | -0.79* | |
| Ace | -0.02 | -0.81** | 0.48 | -0.24 | -0.86** | |
| 注:*和**分别代表在P<0.05和P<0.01水平上显著相关。Note: *and ** represent significant correlation at the P<0.05 and P<0.01 levels, respectively. | ||||||
本研究发现,3种处理间土壤微生物生物量碳氮性状均未呈现显著性差异,可能是由于间伐年限较短所致。但与CK相比,T和TF处理后SMBC含量呈上升趋势,且TF处理的上升幅度更大,与李玲等[8]研究间伐对云杉(Picea asperata)林SMBC含量的影响以及郭传阳等[1]研究间伐对杉木人工林SMBC含量的影响结果一致。SMBC含量的增加与间伐后林内环境发生变化密切相关,一方面,间伐后林分密度降低,林内光照增强,土壤温度升高,改变了土壤微生物生存环境,有利于微生物的增殖[9-10];另一方面,间伐后林分密度降低,有利于增加林下植被数量、种类和生物量;特别是TF处理后林下植被生长茂盛,根系密度和根系分泌物增多,有利于SMBC的积累[11]。土壤中的SMBC含量上升,意味着土壤中微生物的数量增加,有利于提高土壤肥力。
但本研究发现T处理会导致SMBN含量下降,TF处理能够缓解SMBN含量的下降。究其原因,一方面可能是间伐后林分密度降低,林下光照增强,促进了林下植被生长,对林地土壤氮素的竞争加大,土壤微生物所能吸收和固持的有效氮减少,从而导致SMBN含量下降;另一方面可能是土壤微生物群落结构因间伐而发生了改变,本试验间伐后的SMBC/SMBN提高,与曹芹等[9]关于间伐对华北落叶松(Larix principis-rupprechtii)人工林土壤微生物生物量影响的研究结果一致。SMBC/SMBN的改变通常能反映林地土壤微生物群落结构发生变化,已有研究[12]认为,SMBC/SMBN越大真菌占比往往越大。真菌对林地枯落物的分解能力较强,能促进土壤肥力提高。本研究结果表明,与CK相比,间伐处理后SMBC/SMBN提高,特别是0~10 cm土层的提高幅度较大,说明真菌占比可能提高,细菌占比可能降低。在TF处理中,人为补充含氮的复合肥可在一定程度上缓解林下植被对氮的竞争,同时也在一定程度上满足了土壤微生物的氮需求,使SMBN含量(0~10、10~20 cm土层)高于T处理。
微生物熵(qMB)能够反映土壤微生物对土壤碳、氮的利用效率,常用来反映微生物的活性[1]。已有研究[13]认为,微生物熵碳(qMBC)越高,土壤碳活性越大。本研究发现,T和TF处理后的qMBC升高,且TF处理较T处理具有更高的提升幅度,说明间伐后,土壤碳库的稳定性降低,土壤碳活性得到提高。
3.2 间伐和施肥对土壤微生物群落组成和多样性的影响本研究发现T和TF处理对土壤细菌和真菌的丰富度指数(Ace、Chao 1)虽无显著影响,但细菌丰富度指数存在降低趋势,真菌丰富度指数存在上升趋势。与CK相比,T和TF两种处理均能显著提高土壤真菌的Shannon指数,并显著降低真菌的Simpson指数,表明T和TF两种处理均能显著提高土壤真菌多样性,这与丁波等[14]研究结果相似。有研究表明真菌多样性与环境相对湿度呈极显著负相关[15],本研究的间伐林分密度显著降低,林下光照增强,土壤的水分蒸发加快,相对湿度降低,可能有利于提高土壤真菌的多样性[1]。在两种间伐处理中,TF处理的真菌多样性低于T处理,这可能与施用化肥有关,有研究[16]认为,化肥的使用易造成土壤酸化,抑制真菌繁殖。
细菌群落组成中,变形菌门和酸杆菌门是土壤细菌群落中的重要组成部分,其中变形菌门(富营养菌群)和酸杆菌门(贫营养菌群)相对丰度的变化可以预示土壤细菌群落营养策略的改变[17]。本研究中,T处理后的土壤酸杆菌门相对丰度降低,变形菌门相对丰度升高,该结果可能与间伐后地表凋落物(杉木枝、叶和嫩梢等采伐剩余物)数量明显增多,土壤微生物可利用碳源增加有关。郝亚群等[18]调查发现,当土壤中的可利用碳源增多,变形菌门的相对丰度会增加,酸杆菌门的相对丰度会降低。而TF处理后,酸杆菌门相对丰度上升,变形菌门相对丰度下降,其原因可能与施肥导致pH值下降有关。
T和TF处理能明显提高土壤真菌中的被孢霉门和子囊菌门的相对丰度,显著降低担子菌门的相对丰度,改变了土壤真菌优势菌门的相对丰度。已有研究[19]表明,被孢霉(Morierella sp.)可以通过在土壤中释放多种有机酸来溶解土壤磷。子囊菌门和担子菌门同属于腐生真菌,子囊菌门主要作用于林地凋落物分解前期(纤维素、半纤维素分解阶段),而担子菌门主要作用于林地凋落物的分解后期(木质素分解阶段)[20],间伐后林地新鲜凋落物会在短期内明显增加,有利于子囊菌门增殖,提高其竞争性,在一定程度上抑制了担子菌门增殖,这一结果符合腐生真菌的一般消长规律[21]。
3.3 土壤微生物生物量碳氮性状与微生物群落结构的关系分析本研究发现真菌群落丰富度和多样性指数与SMBN含量和qMBN之间存在极显著负相关,这可能是因为土壤缺氮导致土壤微生物生态和生理功能发生变化而引起。土壤微生物的生态和生理功能(r-K策略菌群)与土壤营养相关[22],r-策略物种(富营养或机会物种)生长速度快,底物亲和力低,对有效碳和养分输入反应敏感,通常在富含不稳定碳的环境中生存。相反,K-策略物种(寡营养或平衡物种)生长速度慢,底物亲和力高,能有效地利用难分解的碳。通常认为细菌为r-策略菌,真菌为K-策略菌[23]。本研究中T和TF处理导致林分密度降低,林下植被多样性和生物量增加,使土壤中更多的氮素被林下植被吸收利用。同时,林地凋落物增加会降低SMBN含量[24],且研究发现凋落物的C/N明显大于微生物的C/N时,凋落物中的氮含量不足以满足微生物生长需求,微生物必须从土壤中额外吸收和固持一定量的氮,导致土壤氮的有效性降低,而杉木凋落物C/N(77.13)远高于微生物的氮固持与释放的C/N临界值(25)[25-26]。在该土壤条件下,氮素成为微生物群落发育的主要影响因子,对氮营养依赖性比较低的真菌作为K-策略菌在微生物的种群竞争中可能占据了优势。已有研究认为,在森林土壤中,真菌群落对氮素变化的敏感性高于细菌群落,作为K-策略微生物的真菌在可利用氮含量较低的条件下更具有竞争优势[27]。有些K策略菌群(如Eurotiales目)倾向于分解高碳底物,促进SMBC含量和SMBC/SMBN升高[28],这也说明了在本研究中,T和TF处理下的SMBC含量和SMBC/SMBN均高于CK。
本研究仅对杉木近熟林间伐1 a后的土壤微生物生物量碳氮性状和群落特征进行了研究,结果具有局限性,今后有必要开展长期、动态的对比研究,以获得更加全面、精确的结果。
4 结论间伐和间伐+施肥2种处理均可提高杉木近熟林的林下植物种类和生物量,并改变土壤微生物生境,提高SMBC含量、SMBC/SMBN以及qMBC;间伐会加剧林下植物对土壤氮素的竞争,导致SMBN含量和qMBN下降,而在间伐后进行人工施肥可以有效缓解SMBN含量和qMBN的下降幅度;间伐后真菌群落丰富度和多样性以及真菌所占比例有所提高,而细菌群落丰富度和多样性以及细菌所占比例有所降低。综合认为,间伐以及间伐+施肥能够促进杉木近熟林土壤真菌繁殖,真菌种类和数量的增加可以加快土壤有机质分解,提高土壤肥力,为培育杉木大径材提供良好的土壤条件。
| [1] |
郭传阳, 林开敏, 郑鸣鸣, 等. 间伐对杉木人工林土壤微生物生物量碳氮的短期影响[J]. 南京林业大学学报(自然科学版), 2020, 44(5): 125-131. |
| [2] |
王有良, 宋重升, 彭丽鸿, 等. 间伐对杉木人工林土壤碳氮及其组分特征的影响[J]. 水土保持学报, 2021, 35(5): 204-212. |
| [3] |
PAUL E A. Dynamics of organic matter in soils[J]. Plant and Soil, 1984, 76(1): 275-285. |
| [4] |
CHEN Q L, CUI H L, SU J Q, et al. Antibiotic resistomes in plant microbiomes[J]. Trends in Plant Science, 2019, 24(6): 530-541. DOI:10.1016/j.tplants.2019.02.010 |
| [5] |
贺纪正, 李晶, 郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考[J]. 生物多样性, 2013, 21(4): 412-421. |
| [6] |
朱义族, 李雅颖, 韩继刚, 等. 水分条件变化对土壤微生物的影响及其响应机制研究进展[J]. 应用生态学报, 2019, 30(12): 4 323-4 332. DOI:10.13287/j.1001-9332.201912.031 |
| [7] |
袁仁文, 刘琳, 张蕊, 等. 植物根际分泌物与土壤微生物互作关系的机制研究进展[J]. 中国农学通报, 2020, 36(2): 26-35. |
| [8] |
李玲, 苟小林, 樊华, 等. 疏伐措施对大熊猫廊道云杉林土壤养分特征及微生物碳氮的短期影响[J]. 云南大学学报(自然科学版), 2021, 43(5): 1051-1058. |
| [9] |
曹芹, 邱新彩, 刘欣, 等. 不同间伐强度对华北落叶松人工林土壤养分-微生物生物量-胞外酶化学计量的影响[J]. 中南林业科技大学学报, 2022, 42(4): 83-92. |
| [10] |
CHEN X L, CHEN H Y H, CHEN X, et al. Soil labile organic carbon and carbon-cycle enzyme activities under different thinning intensities in Chinese fir plantations[J]. Applied Soil Ecology, 2016, 107: 162-169. |
| [11] |
张成富, 赵庆霞, 蔡银美, 等. 凋落物输入对根系分泌物碳输入及土壤氮的影响[J]. 森林与环境学报, 2021, 41(3): 263-271. |
| [12] |
HEUCK C, WEIG A, SPOHN M. Soil microbial biomass C∶N∶P stoichiometry and microbial use of organic phosphorus[J]. Soil Biology & Biochemistry, 2015, 85: 119-129. |
| [13] |
雷丕锋, 项文化, 田大伦, 等. 樟树人工林生态系统碳素贮量与分布研究[J]. 生态学杂志, 2004, 23(4): 25-30. |
| [14] |
丁波, 丁贵杰, 赵熙州, 等. 间伐对杉木人工林土壤酶活性及微生物的影响[J]. 林业科学研究, 2017, 30(6): 1059-1065. |
| [15] |
肖文娅, 费菲, 刁娇娇, 等. 杉木人工林凋落物中微生物数量对间伐的响应[J]. 东北林业大学学报, 2016, 44(1): 31-36. |
| [16] |
WANG C, LIU D W, BAI E. Decreasing soil microbial diversity is associated with decreasing microbial biomass under nitrogen addition[J]. Soil Biology & Biochemistry, 2018, 120: 126-133. |
| [17] |
ZELENEV V V, VAN BRUGGEN A H C, SEMENOV A M. Modeling wave-like dynamics of oligotrophic and copiotrophic bacteria along wheat roots in response to nutrient input from a growing root tip[J]. Ecological Modelling, 2005, 188(2/3/4): 405-417. |
| [18] |
郝亚群, 谢麟, 陈岳民, 等. 中亚热带地区氮沉降对杉木幼林土壤细菌群落多样性及组成的影响[J]. 应用生态学报, 2018, 29(1): 53-58. |
| [19] |
OSORIO N W, HABTE M. Soil phosphate desorption induced by a phosphate-solubilizing fungus[J]. Communications in Soil Science and Plant Analysis, 2014, 45(4): 451-460. |
| [20] |
JIANG P K, XU Q F, XU Z H, et al. Seasonal changes in soil labile organic carbon pools within a Phyllostachys praecox stand under high rate fertilization and winter mulch in subtropical China[J]. Forest Ecology & Management, 2006, 236(1): 30-36. |
| [21] |
李德会, 韩周林, 吴庆贵, 等. 影响森林细根分解的腐生真菌功能特性研究综述[J]. 世界林业研究, 2021, 34(3): 25-31. |
| [22] |
LYNCH J M, BENEDETTI A, INSAM H, et al. Microbial diversity in soil: ecological theories, the contribution of molecular techniques and the impact of transgenic plants and transgenic microorganisms[J]. Biology and Fertility of Soils, 2004, 40(6): 363-385. |
| [23] |
YANG Y, DOU Y, WANG B, et al. Deciphering factors driving soil microbial life-history strategies in restored grasslands[J]. iMeta, 2023, 2(1): 1-21. |
| [24] |
卢胜旭, 许恩兰, 吴东梅, 等. 米槠人工林土壤微生物群落组成对凋落物输入的响应[J]. 森林与环境学报, 2020, 40(1): 16-23. |
| [25] |
林开敏, 章志琴, 叶发茂, 等. 杉木人工林下杉木、楠木和木荷叶凋落物分解特征及营养元素含量变化的动态分析[J]. 植物资源与环境学报, 2010, 19(2): 34-39. |
| [26] |
葛晓敏, 唐罗忠, 王瑞华, 等. 杨树人工林生态系统凋落物生物量及其分解特征[J]. 生态环境学报, 2017, 26(9): 1 457-1 464. |
| [27] |
程淑兰, 方华军, 徐梦, 等. 氮沉降增加情景下植物-土壤-微生物交互对自然生态系统土壤有机碳的调控研究进展[J]. 生态学报, 2018, 38(23): 8 285-8 295. |
| [28] |
STRICKLAND M S, ROUSK J. Considering fungal: bacterial dominance in soils-methods, controls, and ecosystem implications[J]. Soil Biology & Biochemistry, 2010, 42(9): 1 385-1 395. |
 2023, Vol. 43
2023, Vol. 43


