文章信息
- 赵娜, 刘诗莹, 李少宁, 徐晓天, 温佳美, 鲁绍伟
- ZHAO Na, LIU Shiying, LI Shaoning, XU Xiaotian, WEN Jiamei, LU Shaowei
- 北京典型绿化树种幼苗对干旱-复水的光合生理响应
- Photosynthetic physiological responses of seedlings of two typical tree species in Beijing to drought stress and rehydration
- 森林与环境学报,2022, 42(4): 374-383.
- Journal of Forest and Environment,2022, 42(4): 374-383.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2022.04.005
-
文章历史
- 收稿日期: 2021-12-07
- 修回日期: 2022-01-25
2. 北京燕山森林生态系统定位观测研究站, 北京 100093;
3. 沈阳农业大学林学院, 辽宁 沈阳 110866
2. Beijing Yanshan Forest Ecosystem Positioning Observation and Research Station, Beijing 100093, China;
3. College of Forestry, Shenyang Agricultural University, Shenyang, Liaoning 110866, China
干旱是环境中常见的非生物胁迫之一,会引起植物的许多生理生化反应[1]。近年来,全球气候变暖导致干旱出现频率、持续时间和波及范围等不断增加[2],干旱、半干旱地区水资源短缺现象日益严重。干旱胁迫导致植物体内净光合速率、气孔导度、蒸腾速率和胞间CO2浓度显著降低,水分利用效率下降,严重的干旱胁迫甚至会致使植物叶绿体光合组织受损,使植物水力传导不平衡面临死亡威胁。植物对干旱的胁迫响应随胁迫程度和胁迫时间的不同表现出明显的特征[3]。胁迫初期,多数植物通过关闭气孔以减少水分散失的同时,其光合同化碳量减小,水分利用效率显著提升,气孔限制是光合下调的主要因素,但不会产生可逆损伤[4],有利于复水后恢复。胁迫中期,植物光合系统会产生一定损伤,复水后短时间内光合作用不会恢复。胁迫后期,叶肉细胞的光合机制及其关键酶发生不可逆性氧化损伤[5],随干旱胁迫程度加剧水分利用效率逐渐下降,其复水后无法恢复至正常生长状态,此时非气孔因素是造成光合作用降低的主要原因。与此同时,植物对干旱胁迫的适应性还取决于胁迫解除后的恢复能力,不同胁迫程度下植物恢复机制不同,即在轻-中度干旱胁迫下,由于植物通过调节气孔开闭,减少蒸腾失水,光合器官未受到不可逆损伤,复水后植物的光合和生长完全恢复,许多植物能表现出显著的补偿效应[6-7]。重度干旱下,植物体的代谢活动、细胞结构及酶促反应遭到破坏,光合作用停止、代谢紊乱[8]。因此,在重度干旱复水后,受到不可逆损伤的植物无法恢复至正常生长状态。近年来,干旱胁迫下植物生理生化调节、形态结构变化及其机理等方面已经成为国内外学者的研究热点[9-10]。
北京地区为典型季风气候,降雨主要集中于7—8月,春季干旱较为严重。刺槐(Robinia pseudoacacia) 和油松(Pinus tabuliformis) 作为该地区主要绿化树种(分别占北京市行政规划总面积的14. 0%和19. 1%) 常遭受严重的干旱胁迫。刺槐在干旱胁迫下易表现出落叶、枝条干枯等症状,在土层浅薄、土壤持水能力低下的区域衰败症状更为明显[11]。油松受到持续干旱胁迫,会出现大面积“小老树”现象,林下形成极严重土壤干层[12]。目前,已有研究者对干旱胁迫下刺槐和油松的生理生化特性和光合特性[13-15]进行研究。例如,杨斌等[16]对刺槐的研究表明,中度和极度干旱处理下刺槐幼苗的叶片生物量和光合速率均呈持续下降趋势;王宗琰等[17]设置不同干旱胁迫处理研究表明,不同胁迫程度与时间对油松幼苗当年生新叶,1年生叶、茎、粗根和细根光合产物含量均具有显著交互作用。目前,更多学者关注幼苗在不同程度胁迫下的生理响应及适应规律,由于植物各生理生化指标随胁迫时间延长而不断变化,且不同水分亏缺下植物旱后恢复力存在种间特异性,使该领域的研究存在很大困难。因此,研究不同胁迫程度和胁迫时间下,植物应对干旱胁迫的阶段性光合生理响应特征及其旱后恢复力具有重要意义。目前,针对北京地区春季干旱胁迫下刺槐和油松的响应特征仍待进一步探讨。综上所述,以刺槐和油松幼苗为试验材料,模拟生长季初期干旱及旱后复水事件,观测干旱-复水条件下刺槐和油松幼苗光合生理响应特征,以明确两树种应对干旱胁迫的光合策略,解析干旱持续时间对复水后补偿效应的影响,揭示北京地区典型绿化树种幼苗对干旱-复水的适应性机制,为耐旱林木资源的选培提供理论参考。
1 试验地概况与试验方法 1.1 试验地概况研究区设于北京市农林科学院林业果树研究所资源圃内,西邻北京市西山国家森林公园,地理坐标为北纬39°59′35″,东经116°13′13″,海拔约88m,总面积13.33 hm2,北半球温带大陆性季风气候,大气温度为-8~31℃,全年无霜期180~200d,西部山区较短,年均降水量600mm。
1.2 供试材料试验中使用的土壤为北京西山土壤,用环刀法测定各盆栽平均土壤容重,确保每个盆栽土壤容重一致,土壤容重为1.44g·cm-3、孔隙度为45. 72%、田间持水量为28%,土壤全氮、全磷、全钾含量分别为1.137、1.059、18.21g·kg-1。选取基径、株高、冠幅相对一致,生长状况良好的刺槐(平均地径14.92mm、平均株高113.90cm) 和油松(平均地径20.88mm、平均株高124.60cm) 3年生幼苗为研究对象,移栽至底部带透水孔的花盆中。将移栽好的苗木随机放置于防雨旱棚内,充分灌溉,以确保苗木尽快成活。在整个试验过程中定期将盆栽位置进行替换,以减少小气候对苗木的影响。
1.3 试验方法 1.3.1 试验组设置在2018年6—7月进行刺槐和油松盆栽幼苗萎蔫点确定的预试验,刺槐幼苗顶端新叶和油松幼苗顶端新梢发生萎蔫时,同时测量叶水势及土壤体积含水量,以确定刺槐和油松幼苗的萎蔫点。缓苗后各树种选取10株幼苗,灌足水分至田间持水量后开始自然干旱。幼苗顶端新叶和新梢初现萎蔫时,测量并获得刺槐、油松幼苗各自萎蔫点处土壤体积含水量以及叶水势,随后立即进行复水。旱后复水阶段:经历干旱阶段直至萎蔫现象出现的刺槐、油松幼苗,需立即给盆栽复水,实时测定20~30cm土壤体积含水量,及时补充盆栽水分,使盆栽土壤保持其田间持水量,至植物叶片恢复延展性时旱后复水过程结束。根据前期预试验,确定刺槐幼苗干旱及复水全过程共31d,干旱阶段13d,复水阶段18d;确定油松幼苗干旱及复水全过程共43d,干旱阶段18d,复水阶段25d。
于2019年6—7月利用试验苗圃防雨旱棚拦截自然降雨,在试验处理前全部灌水保持盆栽土壤田间持水量。保证环境因素(土壤水分、光照条件、环境温度、环境湿度等)基本一致,在此基础上分别设置试验处理组(干旱-复水组,T)和对照组(CK)处理。
T组:共包括两个阶段,即干旱与复水两阶段。干旱阶段结束时,立即对试验幼苗进行复水,因此干旱最后一天同时为复水第1天。(1)干旱阶段:每个树种选取72株盆栽幼苗进行干旱胁迫,直至幼苗顶端新叶初现萎蔫时完成逐步干旱过程。在干旱阶段,将刺槐幼苗干旱持续时间(Dn)分为6个测定节点(Dn=0、2、6、8、10、13d),油松幼苗Dn分为6个测定节点(Dn= 0、2、6、10、15、18d)。(2) 在旱后复水阶段,将刺槐幼苗旱后复水持续时间(Wn)分为6个测定节点(Wn= 3、6、9、11、16、19d),油松幼苗Wn分为6个测定节点(Wn= 4、6、11、14、18、26d)。在各树种干旱、旱后复水阶段每节点观测、采集盆栽幼苗,并对6株盆栽幼苗光合生理参数及相关环境因子进行同步观测。
CK组:T组处理前,每个树种选取6株生长状况基本一致的盆栽幼苗作为对照组。所有CK组盆栽幼苗土壤需一直保持土壤田间持水量,因此需实时监测土壤田间持水量。测完后,把土壤表面上留下的针孔覆土,并及时补水至田间持水量,与T组的逐步干旱、旱后复水处理同步结束。CK组分别于干旱前期(CK1)、干旱末期(CK2) 和复水末期(CK3) 3个测定节点进行盆栽幼苗光合生理参数及相关环境因子同步观测。
1.3.2 环境因子监测在干旱、旱后复水测定节点,利用MP-508便携式土壤水分速测仪实时监测盆栽土壤20~30 cm处土壤体积含水量。在遮雨棚附近设置HOBO全自动气象站,同步观测空气温度、相对湿度、气压和总辐射等气象要素参数。本试验全程气象数据如表 1所示。
| 观测日期 Measuring time |
空气温度 Temperature/℃ |
相对湿度 Relative humidity/% |
气压 Atmospheric pressure/hPa |
太阳辐射量 Solar radiation/(W·m-2) |
| 2019-06-03 | 28.57 | 40.64 | 973.18 | 367.97 |
| 2019-06-05 | 25.09 | 48.55 | 934.69 | 337.63 |
| 2019-06-09 | 26.40 | 59.06 | 920.47 | 280.44 |
| 2019-06-11 | 24.92 | 65.54 | 980.85 | 261.53 |
| 2019-06-13 | 27.15 | 59.43 | 927.27 | 201.03 |
| 2019-06-16 | 27.74 | 49.38 | 888.78 | 333.66 |
| 2019-06-18 | 23.53 | 73.30 | 914.21 | 281.66 |
| 2019-06-21 | 29.49 | 60.60 | 938.83 | 294.42 |
| 2019-06-24 | 23.60 | 78.20 | 947.69 | 259.48 |
| 2019-06-26 | 22.24 | 86.71 | 930.91 | 288.10 |
| 2019-07-01 | 27.96 | 64.26 | 934.89 | 403.97 |
| 2019-07-04 | 23.68 | 83.07 | 931.78 | 279.13 |
| 2019-07-08 | 26.71 | 69.19 | 923.58 | 415.40 |
| 2019-08-03 | 27.44 | 78.41 | 927.15 | 398.26 |
(1) 叶光合参数。于2019年6—7月晴好天气,在干旱、旱后复水阶段12个时间节点日的9:00—11:00,选择长势良好的幼苗植株,应用CI-340超轻型便携式光合测定仪测量T、CK两组的供试盆栽幼苗的净光合速率,将光合测定仪的流量设定为0.3L·min-1,叶室温度控制为25~30 ℃,每盆供试苗随机选取1/3上层树冠的3枚向阳处叶片,重复3次,测定其净光合速率(Pn,μmol·m-2·s-1)、蒸腾速率(Tr,mmol·m-2·s-1)、胞间CO2浓度(Ci,μmol·mol-1) 和气孔导度(Gs,mol·m-2·s-1),本试验测定的Gs为气孔对水汽的导度。(2) 瞬时水分利用效率。瞬时水分利用效率(Ewu) 的大小可以反映干旱胁迫下植物适应能力的强弱,表示消耗单位体积的水,植物所固定的CO2量。本研究利用光合测定仪获得的Pn和Tr,求算植物瞬时Ewu,计算公式如下:
| $ {E_{{\rm{wu}}}} = {P_{\rm{n}}}/{T_{\rm{r}}} $ | (1) |
采用Excel 2010软件进行数据处理和绘图,SPSS 25软件对各干旱-复水时间节点处刺槐和油松幼苗Pn、Tr、Gs、Ci和Ewu进行单因素方差分析(One-way ANOVA)、最小显著差异检验(LSD) 和Duncan多重比较,Dn和Wn与各生理指标进行Pearson相关性分析。
2 结果与分析 2.1 干旱-复水对植物幼苗叶片光合参数的影响 2.1.1 净光合速率刺槐幼苗Pn随土壤水分胁迫加剧而减小[图 1(a)],在干旱末期(D13)达到最小值(0.56 μmol·m-2·s-1),比干旱末期对照组(CK2)降低了92.8%(P<0.05)。而油松幼苗Pn在干旱处理第2天达到峰值(8.81μmol·m-2·s-1),比干旱前期对照组(CK1)增大6.87倍(P<0.05)[图 1(b)]。
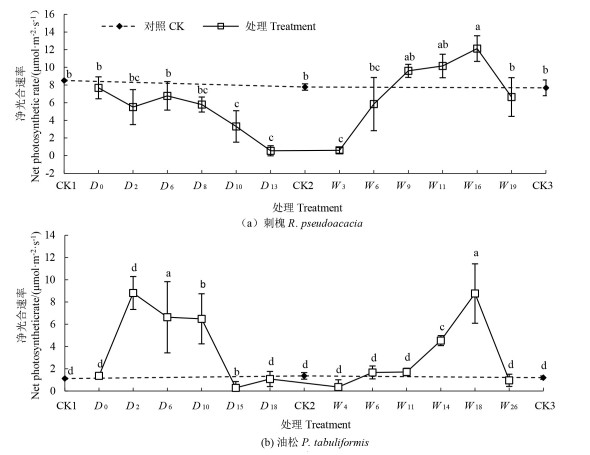
|
注:不同小写字母表示不同处理间差异显著(P<0.05)。 Note: different lowercase letters indicate significant differences among different treatments (P<0.05) 图 1 干旱-复水过程中刺槐和油松净光合速率变化特征 Fig. 1 Variations in net photosynthetic rate of R. pseudoacacia and P. tabuliformis species during the drought-rewatering treatment |
刺槐和油松幼苗Pn随旱后Wn增加而增大,刺槐幼苗Pn在复水第9天恢复至CK水平,油松幼苗Pn复水恢复速度快于刺槐,提前3d(复水第6天)恢复至CK水平。两树种恢复至CK水平后,继续进行复水处理会出现超补偿现象,刺槐幼苗Pn在复水第16天比对照组(CK3)显著提升57.8%(P<0.05,12.12μmol·m-2·s-1),油松幼苗Pn于复水第18天达到最大值(P<0.05,8.76 μmol·m-2·s-1)。
2.1.2 蒸腾速率逐步干旱阶段,刺槐幼苗Tr逐渐减小[图 2(a)],在干旱末期(D13) 达到最小值(0.01mmol·m-2·s-1),比干旱末期对照组(CK2)降低了96.6% (P<0.05)。而油松幼苗Tr先于干旱处理第6天增至最大值(P<0.05,0.30mmol·m-2·s-1) 后,于干旱末期(D18)前一直保持CK水平(P>0.05)[图 2(b)]。
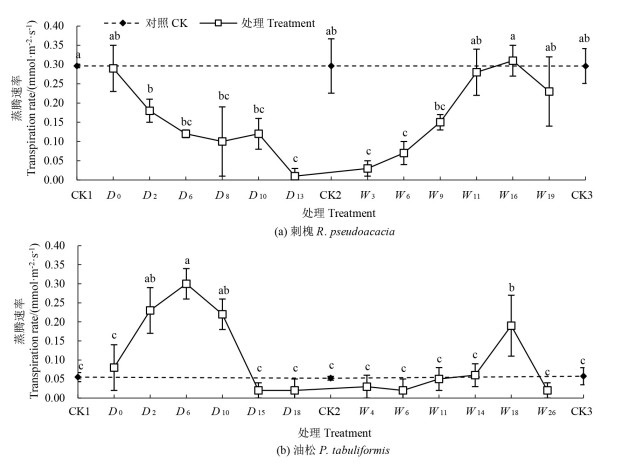
|
注:不同小写字母表示不同处理间差异显著(P<0.05)。 Note: different lowercase letters indicate significant differences among different treatments (P<0.05) 图 2 干旱-复水过程中刺槐和油松蒸腾速率变化特征 Fig. 2 Variations in transpiration rate of R. pseudoacacia and P. tabuliformis species during the drought-rewatering treatment |
旱后复水过程中,刺槐幼苗Tr在W11恢复到CK水平,在W16超出对照(CK3)水平6.9% (P<0.05,0.31mmol·m-2·s-1)。油松幼苗Tr在干旱末期和复水期一直保持CK水平,复水恢复程度高于刺槐幼苗,在W18达到复水最大值(P<0.05,0.19mmol·m-2·s-1),比对照组(CK3)显著提升2.3倍。
2.1.3 气孔导度干旱过程中,刺槐幼苗Gs与其Pn、Tr变化趋势一致,均在干旱末期(D13)达到最小值[P<0.05,5.13mol·m-2·s-1,图 3(a)],比对照组降低了92.7%。油松幼苗Gs与其Pn变化趋势一致,均在干旱处理第2天达到峰值(P<0.05,65.34mol·m-2·s-1,图 3(b)],随后其Gs在干旱末期(D15) 下降至CK水平。逐步干旱过程中,油松幼苗Gs均维持在CK水平。复水过程中,刺槐幼苗Gs在W9恢复至CK水平,在W16上升至最大值(P<0.05,118.54 mol·m-2·s-1),比对照组显著提升69.1%。油松幼苗Gs复水恢复速度快于刺槐,提前5d(W4) 恢复至CK水平,且在干旱末期和复水期均保持CK水平。
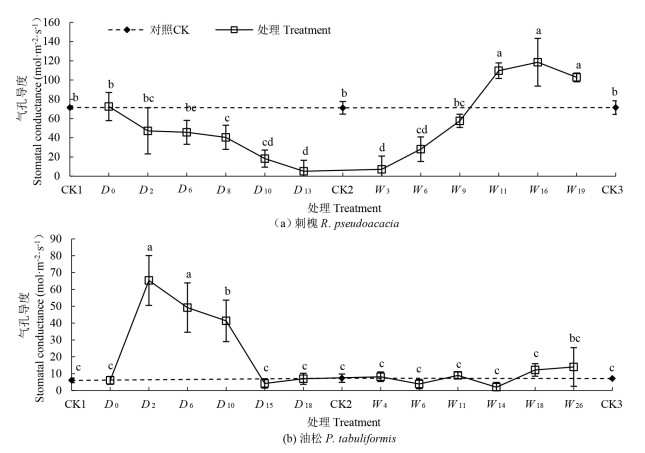
|
注:不同小写字母表示不同处理间差异显著(P<0.05)。 Note: different lowercase letters indicate significant differences among different treatments (P<0.05) 图 3 干旱-复水过程中刺槐和油松气孔导度变化特征 Fig. 3 Variations in stomatal conductance of R. pseudoacacia and P. tabuliformis species during the drought-rewatering treatment |
干旱过程中,刺槐和油松幼苗Ci均在干旱处理第6天达到峰值(P<0.05)(图 4),与对照组(CK1) 相比分别显著提升66.7%、86.1%,之后明显下降,在干旱末期(D13和D18) 分别达到最小值206.34、311.21μmol·mol-1,分别比对照组(CK2)降低了18.2%(P<0.05) 和7.9%(P>0.05)。
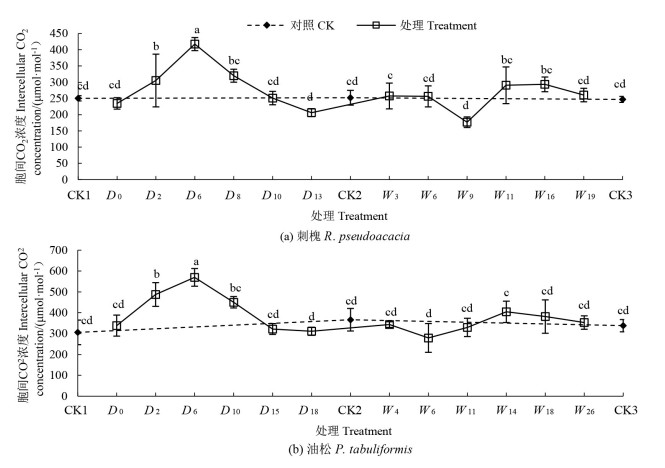
|
注:不同小写字母表示不同处理间差异显著(P<0.05)。 Note: different lowercase letters indicate significant differences among different treatments (P<0.05) 图 4 干旱-复水过程中刺槐和油松胞间CO2浓度变化 Fig. 4 Changes in intercellular CO2 concentration of R. pseudoacacia and P. tabuliformis species during the drought-rewatering treatment |
旱后复水过程中,刺槐与油松幼苗Ci始终保持CK水平。刺槐幼苗Ci先于油松幼苗达到复水最大值,刺槐在复水第11天、油松在复水第14天分别达到最大值(290.60、404.27μmol· mol-1),且比对照组分别提升17.6%和19.6%。
2.2 干旱-复水对植物幼苗瞬时水分利用效率的影响随土壤体积含水量减小,刺槐和油松幼苗瞬时Ewu先增大后减小(图 5)。刺槐和油松Ewu分别在干旱处理第8天(59.56mmol·mol-1)和第10天(75.17 mmol·mol-1) 达到最大值,分别比对照组(CK1) 显著提升1. 06和2.36倍(P<0.05),此时刺槐和油松幼苗最大Ewu出现时的土壤体积含水量分别为8.9%和15.6%。干旱前期和中期油松幼苗Ewu升幅(70.2%) 高于刺槐幼苗(51.5%)。随干旱胁迫的持续加剧,刺槐、油松幼苗Ewu显著下降,分别在各自干旱处理末期(D13和D18) 下降至CK水平。复水过程中,刺槐、油松幼苗Ewu整体均保持在各自CK水平以上。刺槐和油松幼苗Ewu达到超补偿效应的时间存在种间差异,即刺槐幼苗先于油松幼苗出现超补偿效应。在复水第6—9天,刺槐幼苗Ewu显著超过CK水平(P<0.05)。油松幼苗Ewu在复水第14天达到最大值(P<0.05,68.99mmol·mol-1),比对照组显著提升了1.45倍。
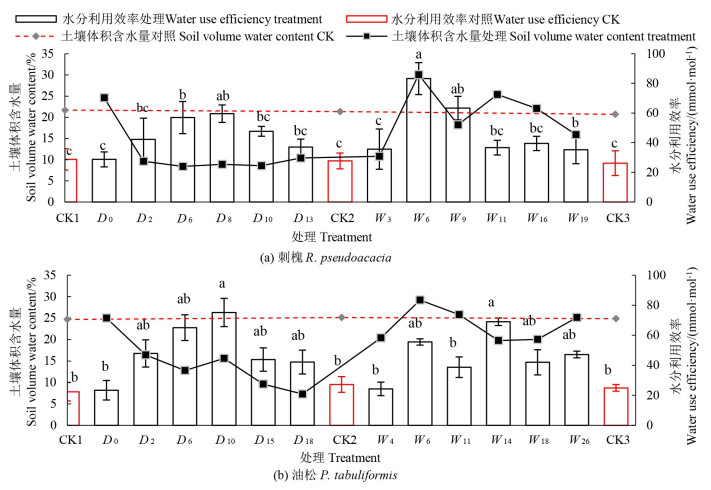
|
注:不同小写字母表示不同处理间差异显著(P<0.05)。 Note: different lowercase letters indicate significant differences among different treatments(P<0.05) 图 5 干旱-复水过程中刺槐和油松瞬时水分利用效率及土壤体积含水量变化特征 Fig. 5 Variations in instantaneous water use efficiency of R. pseudoacacia and P. tabuliformis species and potted soil volumetric water content during the drought-rewatering treatment |
刺槐Dn与其Pn、Gs和Tr呈显著负相关(P<0.05),但与其Ci无显著相关(表 2)。刺槐干旱期间Ci和Ewu分别于干旱第6天和第8天达到峰值后下降。由此,对干旱第6天和第8天为干旱节点的处理时长与各参数间的关系进行分析发现,刺槐D0~6与Ci呈显著正相关(P<0.05),D6~13与Ci呈显著负相关(P<0.05);而刺槐D0~8与Ewu呈显著正相关(P<0.05),D8~13与Ci呈显著负相关(P<0.05)。刺槐Wn与其Gs和Tr (P<0.05) 呈显著正相关,但与其Pn无显著相关。复水第16天刺槐Pn上升到峰值后开始下降,因此分析W3~16的Wn与Pn相关性,得出W3~16与Pn呈显著正相关(P<0.05)。
| 皮尔逊相关性 Pearson |
刺槐R. pseudoacacia | 皮尔逊相关性 Pearson |
油松P. tabuliformis | ||||||||
| Pn | Gs | Tr | Ci | Ewu | Pn | Gs | Tr | Ci | Ewu | ||
| Dn | -0.853* | -0.947** | -0.932** | -0.219 | 0.319 | Dn | -0.491 | -0.468 | -0.529 | -0.462 | 0.192 |
| Wn | 0.612 | 0.886* | 0.833* | 0.288 | -0.418 | Wn | 0.307 | 0.627 | 0.265 | 0.484 | 0.261 |
| W3~16 | 0.932* | 0.949* | 0.952* | 0.343 | -0.274 | D2~18 | -0.939* | -0.969** | -0.872 | -0.873 | -0.375 |
| D0~6 | -0.236 | -0.789 | -0.936 | 0.998* | 0.986 | D0~6 | 0.538 | 0.558 | 0.922* | 0.937* | 0.958 |
| D6~13 | -0.991** | -0.975* | 0.815 | -0.965* | -0.928 | D6~18 | -0.902 | -0.945 | -0.969* | -0.977* | -0.824 |
| D0~8 | -0.462 | -0.837 | -0.941 | 0.686 | 0.975* | D1~10 | 0.416 | 0.333 | 0.591 | 0.462 | 0.949* |
| D8~13 | -0.996 | -0.996 | -0.836 | -0.972 | -0.989* | D10~18 | -0.879 | -0.902 | -0.929 | -0.953 | -0.944* |
| W4~18 | 0.921* | 0.307 | 0.849* | 0.704 | 0.371 | ||||||
| 注:*在0.05级别(双尾)相关性显著,**在0.01级别(双尾)相关性显著。 Note: * significant correlation at level 0.05 (two tailed),** the correlation was significant at the level of 0.01 (two tailed). | |||||||||||
油松Dn和Wn与各生理指标间无显著相关性(表 2)。干旱过程中油松幼苗Pn和Gs于D2达到峰值;Tr和Ci变化幅度较为滞后,于D6达到峰值;Ewu于D10达到峰值。进一步分析可知,干旱阶段各参数峰值之前的Dn与各参数均呈显著负相关(P<0.05),峰值之后的Dn与各参数均呈显著正相关(P<0.05)。复水过程中,油松Pn和Tr于W18达到峰值后下降。分析Wn与参数间相关关系可知,W4~18与Pn和Tr呈显著正相关(P<0.05)。
综上所述,干旱和复水的持续时间会影响植物光合参数对干旱、复水处理的生理响应。其中,刺槐受Dn和Wn的影响作用更为明显,而油松随干旱-旱后复水处理时长的增加无显著变异。根据各树种到达光合参数峰值的时间划分为两部分特异时间段,由此分析可知,以峰值为节点的前后特定时段持续时间与刺槐、油松各参数均表现出显著相关性。
3 讨论 3.1 干旱-复水条件下植物幼苗叶片光合参数的响应变化干旱是抑制植物光合作用最主要的环境因子[18]。试验结果表明,干旱过程中,刺槐和油松幼苗各光合参数均逐渐减小。干旱末期,刺槐幼苗Pn、Gs、Ci与对照相比均显著降低了90%以上(P<0.05),而油松幼苗光合参数降低不显著,说明干旱胁迫下油松幼苗的光合能力和抗旱能力强于刺槐幼苗。研究表明,植物在复水过程中出现快速生长,以弥补前期胁迫造成的损失[19]。本试验中两树种幼苗复水后光合参数均有不同程度恢复,且Tr、Ci和Gs恢复至CK水平的速度慢于Pn,说明复水前期气孔限制和代谢损伤依然存在[20]。刺槐和油松幼苗Pn分别于复水第9天和第6天恢复至CK水平,继续进行复水处理会出现超补偿现象,刺槐幼苗Pn于复水第16天超出CK水平60.3%;油松幼苗Pn于复水第18天恢复至超出CK水平的6.06倍,表明干旱未对刺槐和油松幼苗造成不可逆的氧化损伤,两树种经过一段时间复水后均能得到有效恢复。Dn和Wn同样影响植物光合生理响应,刺槐Dn与Pn、Gs和Tr呈显著负相关(P<0.05),Wn与Gs和Tr (P<0.05)呈显著正相关。这是因为刺槐在胁迫初期通过降低Gs,减少光合及蒸腾作用,仅依赖植物体储存的碳水化合物满足其呼吸、渗透调节或防御方面的碳需求[21],因此其光合参数随Dn的增加而降低。旱后复水阶段刺槐的Gs迅速上调,光合生理机能得到有效恢复,其光合参数随Wn的增加而上升。而干旱胁迫下油松幼苗各光合参数无显著下降,且Dn和Wn与光合参数之间无显著相关性,原因可能是油松幼苗气孔对叶片ABA浓度的敏感性更低,胁迫下气孔关闭较晚,干旱时能维持一定的Gs以调节光合及Tr,表现为气孔的非等水调节行为[22]。不同树种根据气孔对水分亏缺敏感性及气孔调控的程度不同[23],使得刺槐和油松幼苗光合生理参数对Dn和Wn响应存在差异。综上所述,刺槐幼苗受Dn和Wn影响更显著,干旱胁迫下,光合参数的降幅明显大于油松幼苗。而油松受时间影响不明显,且复水后光合作用恢复程度快于刺槐幼苗,即干旱胁迫下油松幼苗的适应性强于刺槐。
干旱胁迫下气孔限制因素和非气孔限制因素导致了植物光合速率的降低[24]。水分不足时Gs下降,导致CO2进入叶片受到阻碍,光合速率下降源于气孔限制。此外,叶肉细胞光合活性的影响,也就是非气孔因素限制也会造成植物光合速率下降[25]。本试验结果表明,随着干旱程度增加,刺槐幼苗叶片Gs、Pn、Tr呈降低趋势,而Ci呈先升高后降低的趋势。干旱初期,Ci较高,此时内部导度很大,刺槐幼苗未受到严重损伤,植物通过调节气孔开闭来减少水分散失,此时Pn下降主要受气孔限制;干旱后期,Ci下降,内部导度减小,说明叶肉细胞光合机制受到损伤,导致Pn下降受非气孔因素限制。刺槐幼苗光合速率的降低在干旱初期受气孔因素影响,干旱后期受非气孔因素影响。谭晓红等[26]的研究表明刺槐叶片Pn降低受到气孔限制与非气孔限制两种方式影响造成。虽然油松幼苗叶片的Gs在逐步干旱进程一直维持CK水平,但其Pn与Gs、Tr和Ci均呈相同变化规律,当Pn降低时, Ci降低, 表明引起Pn下降主要由气孔限制引起。油松幼苗受气孔限制作用以减轻干旱胁迫对光合器官的伤害,这与王巧等[27]对幼龄油松研究结果一致。干旱初期油松幼苗各参数都有不同程度的升高,这与陈龙涛等[28]对油松的研究结果相似。这可能是由于干旱初期土壤含水量过多,不适宜油松幼苗生长,随土壤水分降低,油松逐渐达到适宜自身生长的土壤水分条件,因而出现各参数随干旱胁迫加剧而上升的现象。
3.2 干旱-复水条件下植物幼苗瞬时水分利用效率的变化干旱胁迫下,植物通过提高自身Ewu来增强对干旱胁迫的抵抗力,进而提高其在干旱胁迫期间的生产力和生存率[29]。本试验中两树种幼苗Ewu随胁迫程度的增加,整体呈先增大后减小趋势。Pn、Ewu对土壤体积含水量表现出各自参数的特定阈值响应,且存在种间特异性,即刺槐幼苗Ewu峰值对应土壤体积含水量(8.9%) 远低于Pn峰值对应土壤体积含水量(22.1%);而油松幼苗Ewu和Pn达到最大值时对应土壤体积含水量(15.6%和16.4%) 基本一致。当土壤体积含水量在一定范围内下降时,两树种幼苗Ewu均会增加。这是因为Pn由CO2传递导度决定,包括内部导度、边界层导度和气孔对CO2导度。植物内部导度远大于其它两个导度之和,因此Pn由内部导度主导,而Tr主要由气孔对水汽的导度决定。在适度干旱条件下,水汽导度的快速下调致使Tr降幅略大于Pn[30],造成Ewu出现暂时提升现象。干旱前期和中期油松幼苗Ewu升幅高于刺槐幼苗,说明干旱前中期油松水分竞争能力和抵御干旱的能力强于刺槐。干旱阶段刺槐和油松幼苗Ewu存在种间差异,这是因为植物Ewu具有遗传性,且对水分变化的响应敏感性不一。刺槐和油松幼苗Ewu均在复水第6天提升,分别在复水第6天和第14天出现超补偿效应,幼苗在经历一定的水分亏缺条件改善后所再出现的生产量显著提高,与复水前期相比差异性显著(P<0.05)。复水后刺槐幼苗先于油松幼苗出现超补偿效应,这是由于前期干旱胁迫使刺槐经受抗旱锻炼,而直至胁迫末期油松幼苗光合能力未受到干旱的显著影响,油松未经历抗旱训练。因此,前期干旱经历使刺槐在旱后复水阶段迅速恢复自身光合生理机能,并较早出现补偿效应。刺槐和油松幼苗Ewu复水恢复程度及达到超补偿效应的时间差异性,可能与植物的种间特异性和生物学特性有关,如植物的形态结构、同化方式、气孔调控方式、物质同化积累与分配模式等。因此,在气候变化背景下,需要结合不同造林树种的水分利用策略,进行精量控制灌溉,提高灌溉水利用效率,促进水资源的良性循环和高效利用。
4 结论(1) 逐渐干旱过程中,刺槐幼苗光合作用受气孔与非气孔限制共同影响,其光合生理参数(如Pn、Tr和Gs) 随干旱胁迫历时的增加而逐渐降低。适度干旱胁迫增加了油松光合能力;受到气孔限制作用,胁迫末期又回落至油松CK水平。旱后复水阶段,两树种幼苗各光合参数均能得以恢复并出现超补偿效应。(2) 刺槐受Dn和Wn影响更为显著,而油松受Dn和Wn影响不明显。干旱阶段刺槐光合生理参数先于油松表现出下降趋势,复水阶段刺槐各参数恢复速度慢于油松,但其出现超补偿效应的时间快于油松。以峰值为节点的前后特定时段持续时间与刺槐、油松各参数均表现出显著相关性。(3) 刺槐和油松幼苗应对干旱胁迫的水分调节策略存在差异。干旱胁迫下,刺槐通过调节气孔开闭来影响植物光合生理响应,表现为等水调节行为;油松气孔对大气蒸发需求及土壤水分变化不敏感,表现为非等水行为。(4) 刺槐和油松幼苗采用不同的Ewu策略应对水分胁迫。刺槐幼苗Ewu于D8达到最优,在W3恢复至CK水平,在W6出现复水超补偿效应;油松幼苗Ewu于D10达到最优,在W4恢复至CK水平,在W14出现超补偿效应。干旱前、中期刺槐幼苗Ewu升幅小于油松,而刺槐幼苗Ewu复水后出现超补偿效应的速度快于油松。综上所述,解析北京地区典型绿化树种应对生长季初期干旱胁迫及旱后复水事件中水分利用生理机制,可为在水资源短缺背景下,北京地区森林水资源的高效利用及森林旱后恢复潜力评价提供理论依据。
| [1] |
ZHANG S C, QI Y L, LIU M, et al. SUMO E3 ligase AtMMS21 regulates drought tolerance in Arabidopsis thaliana[J]. Plant Biology, 2013, 55(1): 83-95. |
| [2] |
MANTGEM P J V, STEPHENSON N L, BYRNE J C, et al. Widespread increase of tree mortality rates in the western United States[J]. Science, 2009, 323(5913): 521-524. DOI:10.1126/science.1165000 |
| [3] |
代英超, 徐奎源, 马凯, 等. 珍稀濒危植物堇叶紫金牛对持续干旱的生理响应[J]. 生态学报, 2015, 35(9): 2954-2959. |
| [4] |
FARQUHAR G D, LEARY M H, BERRY J A. On the relationship between carbon isotope discrimination and the intercellular carbon dioxide concentration in leaves[J]. Functional Plant Biology, 1982, 9(2): 121-137. DOI:10.1071/PP9820121 |
| [5] |
YU S W. Plant physiology and molecular biology[M]. Beijing: Science Press, 1992.
|
| [6] |
ABID M, ALI S, QI L K, et al. Physiological and biochemical changes during drought and recovery periods at tillering and jointing stages in wheat (Triticum aestivum L.)[J]. Scientific Reports, 2018, 8(1): 4615. DOI:10.1038/s41598-018-21441-7 |
| [7] |
冯树林, 李博渊, 吕国利, 等. 紫穗槐幼苗不同生长阶段叶水势对干旱胁迫与复水的响应特征[J]. 草地学报, 2020, 28(5): 1363-1371. |
| [8] |
安玉艳, 梁宗锁. 植物应对干旱胁迫的阶段性策略[J]. 应用生态学报, 2012, 23(10): 2907-2915. |
| [9] |
吴芹, 张光灿, 裴斌, 等. 3个树种对不同程度土壤干旱的生理生化响应[J]. 生态学报, 2013, 33(12): 3648-3656. |
| [10] |
CASSOL J C, SPONCHIADO D, DORNELLES S H B, et al. Silicon as an attenuator of drought stress in plants of Oryza sativa L. treated with dietholate[J]. Brazilian Journal of Biology, 2021, 81(4): 1061-1072. DOI:10.1590/1519-6984.235052 |
| [11] |
王林, 代永欣, 郭晋平, 等. 刺槐苗木干旱胁迫过程中水力学失败和碳饥饿的交互作用[J]. 林业科学, 2016, 52(6): 1-9. |
| [12] |
王琰, 陈建文, 狄晓艳. 不同油松种源光合和荧光参数对水分胁迫的响应特征[J]. 生态学报, 2011, 31(23): 46-53. |
| [13] |
肖姣娣. 不同强度干旱胁迫对刺槐幼苗生理生化特性的影响[J]. 中南林业科技大学学报, 2015, 35(8): 23-26. |
| [14] |
刘娟娟, 李吉跃, 张建国. 高CO2浓度和干旱胁迫对4种树苗光合特性的影响[J]. 林业科学研究, 2015, 28(3): 339-345. DOI:10.3969/j.issn.1001-1498.2015.03.006 |
| [15] |
LIU X, WANG N, CUI R, et al. Quantifying key points of hydraulic vulnerability curves from drought-rewatering experiment using differential method[J]. Frontiers in Plant Science, 2021, 12(2): 49-62. |
| [16] |
杨斌, 彭长辉, 张贤, 等. 干旱胁迫对刺槐幼苗叶片氮含量、光合速率及非结构性碳水化合物的影响[J]. 应用与环境生物学报, 2019, 25(6): 1261-1269. |
| [17] |
王宗琰, 王凯, 姜涛, 等. 油松幼苗非结构性碳水化合物对干旱胁迫的阶段性响应[J]. 植物研究, 2018, 38(3): 460-466. |
| [18] |
齐曼·尤努斯, 木合塔尔·扎热, 塔衣尔·艾合买提. 干旱胁迫下尖果沙枣幼苗的根系活力和光合特性[J]. 应用生态学报, 2011, 22(7): 1789-1795. |
| [19] |
厉广辉, 万勇善, 刘风珍, 等. 苗期干旱及复水条件下不同花生品种的光合特性[J]. 植物生态学报, 2014, 38(7): 729-739. |
| [20] |
张玉玉, 王进鑫, 马戌, 等. 土壤干旱及复水对侧柏叶绿素荧光参数的影响[J]. 水土保持研究, 2021, 28(2): 242-247, 255. |
| [21] |
MCDOWELL N, POCKMAN W, ALLEN C, et al. Mechanisms of plant survival and mortality during drought: why do some plants survive while others succumb to drought?[J]. New Phytologist, 2008, 178(4): 719-739. DOI:10.1111/j.1469-8137.2008.02436.x |
| [22] |
范嘉智, 王丹, 胡亚林, 等. 最优气孔行为理论和气孔导度模拟[J]. 植物生态学报, 2016, 40(6): 631-642. |
| [23] |
罗丹丹, 王传宽, 金鹰. 植物水分调节对策: 等水与非等水行为[J]. 植物生态学报, 2017, 41(9): 1020-1032. |
| [24] |
吴俊文, 刘珊, 李吉跃, 等. 干旱胁迫下广东石漠化地区造林树种光合和耗水特性[J]. 生态学报, 2016, 36(11): 3429-3440. |
| [25] |
刘旻霞, 夏素娟, 穆若兰, 等. 黄土高原中部三种典型绿化植物光合特性的季节变化[J]. 生态学杂志, 2020, 39(12): 4098-4109. |
| [26] |
谭晓红, 王爽, 马履一, 等. 豫西刺槐能源林培育的光合生理生态理论基础[J]. 生态学报, 2010, 30(11): 2940-2948. |
| [27] |
王巧, 刘秀梅, 王华田, 等. 干旱和水涝胁迫对幼龄油松生长及光合作用的影响[J]. 中国水土保持科学, 2015, 13(6): 40-47. DOI:10.3969/j.issn.1672-3007.2015.06.006 |
| [28] |
陈龙涛. 华北落叶松和油松幼苗对干旱胁迫的响应及其抗旱性评价[D]. 太原: 山西农业大学, 2017.
|
| [29] |
ALESSANDRA R, PAOLA P, SIMONE L, et al. Improving plant water use efficiency through molecular genetics[J]. Horticulturae, 2017, 3(2): 31. DOI:10.3390/horticulturae3020031 |
| [30] |
XU J Z, PENG S Z, YANG S H, et al. Coupled model of stomatal conductance-photosynthesis-transpiration for paddy rice under water-saving irrigation[J]. Archives of Agronomy and Soil Science, 2014, 60(2): 163-181. DOI:10.1080/03650340.2013.780650 |
 2022, Vol. 42
2022, Vol. 42


