文章信息
- 吴荣菊, 文晓鹏, 李正春, 梅利那, 申洛男, 吴泽英
- WU Rongju, WEN Xiaopeng, LI Zhengchun, MEI Lina, SHEN Luonan, WU Zeying
- 马尾松蔗糖磷酸合酶基因的克隆和表达分析
- Cloning and expression analysis of Pinus massoniana sucrose phosphate synthase gene
- 森林与环境学报,2022, 42(2): 199-207.
- Journal of Forest and Environment,2022, 42(2): 199-207.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2022.02.011
-
文章历史
- 收稿日期: 2021-10-08
- 修回日期: 2021-11-15
2. 贵州大学农业生物工程研究院, 贵州 贵阳 550025;
3. 贵州大学林学院, 贵州 贵阳 550025
2. Institute of Agricultural Bioengineering, Guizhou University, Guiyang, Guizhou 550025, China;
3. College of Forestry, Guizhou University, Guiyang, Guizhou 550025, China
蔗糖作为植物光合作用的主要产物,在植物生长发育中起着重要作用[1]。一方面,它为植物提供能量和组成成分;另一方面,蔗糖及其水解产物可能作为信号分子发挥作用,调节植物的重要生理过程[2]。在蔗糖生物合成过程中蔗糖磷酸合酶(sucrose-phosphate synthase,SPS) 作为关键酶之一,在植物叶片的碳分配中起着重要作用[3]。SPS首先通过催化6-磷酸果糖和UDP-葡萄糖形成蔗糖-6-磷酸,随后蔗糖磷酸酶(sucrose phosphate phosphatase,SPP) 将蔗糖-6-磷酸水解为蔗糖[4]。系统发育分析指出植物SPS都是从共同的祖先“SPS-like”基因进化而来[5]。通过对不同物种SPS基因进行系统发育分析,发现SPS基因可分为A、B和C 3个亚族[6]。研究表明,SPS活性与植物叶片中的蔗糖和淀粉含量、叶片的碳输出速率和植物生长速率相关[7],SPS还参与细胞分化、纤维细胞壁合成和生物产量的形成[8],此外,SPS还与植物的光合作用有关[1]。因此克隆和分析马尾松SPS基因,对研究其在马尾松生长发育过程中的作用具有重要意义。
关于马尾松(Pinus massoniana Lamb.) 的研究中,光合作用对产脂具有重要作用[9],高产脂马尾松的光合能力强于低产脂[10],而蔗糖作为光合作用的产物,合成量高,松脂相应地也会增多[11]。因此,马尾松通过光合作用合成蔗糖的能力可能是影响马尾松次生代谢产物合成的重要因素。有研究表明,马尾松的可溶性糖(包括蔗糖、果糖和葡萄糖) 含量与产脂力具有极显著的相关性[12],马尾松在干旱胁迫下可溶性糖含量也会随着胁迫过程上升[13]。马尾松糖代谢相关基因的研究表明,PmFBP基因在抗虫品种中的表达量明显高于对照,说明该基因在抗虫防御过程中起着关键作用[14]。目前马尾松中蔗糖代谢方面的研究较少,鲜见有关马尾松SPS基因的报道。
本研究从高低产脂马尾松转录组数据中检索克隆得到4个马尾松SPS基因,并进行了系统的基因序列分析、系统进化分析及表达特性分析。此结果将有助于深入了解马尾松中SPS的功能及蔗糖合成的分子机制。1材料与方法
1 材料与方法 1.1 试验材料不同组织试验材料选取贵州都匀12年生马尾松的针叶、树皮、木质部3部分。不同发育时期的材料为贵州都匀两年生马尾松的嫩叶、成熟叶、嫩茎和木质化茎。不同种质材料采自广西南宁市林业科学研究所国家马尾松良种基地的12年生高、低产脂马尾松无性系。低磷胁迫的材料选用出芽30 d幼苗,以霍格兰和阿农微量元素营养液为基础[15],调整KH2PO4的用量来调节低磷胁迫的磷浓度,处理分为对照组(磷浓度为10 mg · L-1) 和实验组(磷浓度为2. 0 mg · L-1),每3 d浇一次营养液(100 mL),48 d时进行取样。每个试验条件的材料分别采集3棵长势一致、生长健壮的马尾松作为3个生物学重复,立即用液氮速冻,于-80 ℃保存。
1.2 SPS基因鉴定课题组前期通过测序获得高低产脂马尾松全长转录组数据,从中筛选出功能注释为SPS的基因序列,在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI) 的ORFfinder在线软件(https://www.ncbi.nlm.nih.gov/orffinder) 中对其开放阅读框(open reading frame,ORF) 进行分析,并与拟南芥(Arabidopsis thaliana)、烟草(Nicotiana tabacum L.)、橡胶树(Hevea brasiliensis) 等植物进行同源比对。利用NCBI的CDD在线分析软件(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) 对候选基因进行保守结构域判读,确保每个得到的基因分别具有SPS基因的保守结构域,最终获得马尾松蔗糖磷酸合酶(PmSPS) 基因的cDNA序列。
1.3 总RNA提取与cDNA的合成取-80 ℃保存的植物样品0. 1~0. 2 g,液氮中研磨为细粉,根据艾德莱生物公司的EASYspin Plus植物RNA快速提取试剂盒的说明书操作步骤进行马尾松总RNA的提取,用全波长扫描型酶标仪(Thermo Fisher) 和1%琼脂糖凝胶电泳检测总RNA的浓度和质量;用TaKaRa公司反转录试剂盒(PrimeScriptTM RT reagent Kit with gDNA Eraser) 进行反转录,合成cDNA第一链。
1.4 PmSPS基因的克隆根据转录组测序获得的PmSPS基因ORF序列设计特异引物(表 1),由生工生物工程(上海) 股份有限公司合成。PCR反应体系如下:cDNA模板1 μL、酶5 μL、ddH2O 3 μL、正向引物(10 μmol · L-1) 0. 5 μL、反向引物(10 μmol · L-1) 0. 5 μL。PCR反应条件为95 ℃变性10 s、60 ℃退火10 s、72 ℃延伸30 s,共循环35次。PCR产物用1%琼脂糖凝胶电泳检测,目的条带切胶回收后与Blunt克隆载体连接,并转化至大肠杆菌感受态中,送生工生物工程(上海) 股份有限公司测序。
| 用途Purpose | 基因Gene | 引物Primer | 序列Sequence |
| 基因克隆Gene cloning | PmSPS1 | F | 5′ ATGGCGGGGAATGAGTG 3′ |
| R | 5′ CTAGGATGCAGATCCCTCA 3′ | ||
| PmSPS2 | F | 5′ ATGGCTGGGAATGATTGG 3′ | |
| R | 5′ CTATATATGTCTAAATTTCTGAATCTCA 3′ | ||
| PmSPS3 | F | 5′ ATGGCGGCAAACGACTG 3′ | |
| R | 5′ TTACACAGCAGCCAGTTCTAGTTT 3′ | ||
| PmSPS4 | F | 5′ ATGGGAAACAGAGATGATATAGATGAAAT 3′ | |
| R | 5′ CTATATATGTCTAAATTTCTGAATCTCATT 3′ | ||
| 荧光定量Fluorescence quantification | PmSPS1 | F | 5′ GTGGATGAACGGGTACTTAGAGG 3′ |
| R | 5′ TCTTCCTGCGGCTGATGTG 3′ | ||
| PmSPS2 | F | 5′ GAAGCAAGGCAGGCAGTCA 3′ | |
| R | 5′ GGGTGGCAAGGCTTTAGGAG 3′ | ||
| PmSPS3 | F | 5′ CCCCCGAAAGCCTATGATT 3′ | |
| R | 5′ TGATGTTTGGGATACGCTACCT 3′ | ||
| PmSPS4 | F | 5′ GGGACCACCATCTTCTATCACTG 3′ | |
| R | 5′ ATAGCACAAGACCCGCAAATC 3′ | ||
| UBI3 | F | 5′ TCCAGACCTGCTGACTTACGAA 3′ | |
| R | 5′ GCATAACCCACGACCCAAAC 3′ |
使用生物信息学软件对马尾松SPS基因进行分析,利用在线软件ExPASy (http: // web.expasy.org/protparam/) 进行蛋白相对分子量和等电点等理化性质进行分析;采用在线软件SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 对蛋白的二级结构进行预测。采用SignalP 4. 0 Server (http://www.cbs.dtu.dk/services/SignalP-4.0/) 进行蛋白的信号肽预测;在线网站softberry (http://www.softberry.com/berry.phtml) 中的ProtComp程序被用于蛋白定位预测。不同植物的氨基酸序列比对利用DNAMAN软件和ClustalW软件完成,用MEGA7. 0软件,算法为Neighbor-Joining,自检举1 000次,构建系统发育树。
1.6 基因表达分析利用Primer Premier 5软件设计实时荧光定量PCR (qRT-PCR) 特异性引物(表 1),扩增片段长度为240~420 bp, 退火温度均为60 ℃。实时荧光PCR检测用百迈客生物科技公司的Biomarker 2×SYBR Green Fast qPCR Mix。qRT-PCR反应体系为10 μL,其中Biomarker 2×SYBR Green Fast qPCR Mix 5 μL、上游引物0. 5 μL、下游引物0. 5 μL (引物浓度为10 μmol · L-1)、cDNA模板1 μL、ddH2O 3 μL。qPCR反应程序采用三步法,反应参数:94 ℃预扩增10 min;94 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;在每个循环结束后进行荧光信号采集,所有循环结束后进行溶解曲线分析(65~95 ℃)。以本课题组前期试验筛选出的UBI3作为内参基因,使用qTOWER3G扩增仪(analytikjena) 检测基因的表达,每个样品做3次技术重复。数据处理采用SPSS 2. 0软件,使用Duncan检验和LSD检验完成单因素方差分析:P<0. 01表示组间差异极显著,P<0. 05表示组间差异显著,参照SCHMITTGEN et al[16]的方法计算基因相对表达量。
2 结果与分析 2.1 PmSPS基因的克隆根据植物RNA快速提取试剂盒操作步骤提取了马尾松总RNA (图 1),利用PmSPS基因的特异性克隆引物,以反转录得到的高产脂马尾松针叶cDNA作为模板进行PCR扩增,再通过1%琼脂糖凝胶电泳检验分别获得了4条PCR产物(图 2)。得到的目的条带先进行胶回收纯化,再经载体连接,转化大肠杆菌感受态,筛选阳性克隆进行测序得到正确序列。结果得到4个ORF长度分别为3 213、3 243、3 231和1 701 bp的PmSPS基因,分别命名为PmSPS1、PmSPS2、PmSPS3、PmSPS4。
|
图 1 马尾松RNA提取电泳检测 Fig. 1 Electrophoretic assay of RNA extraction from P. massoniana |
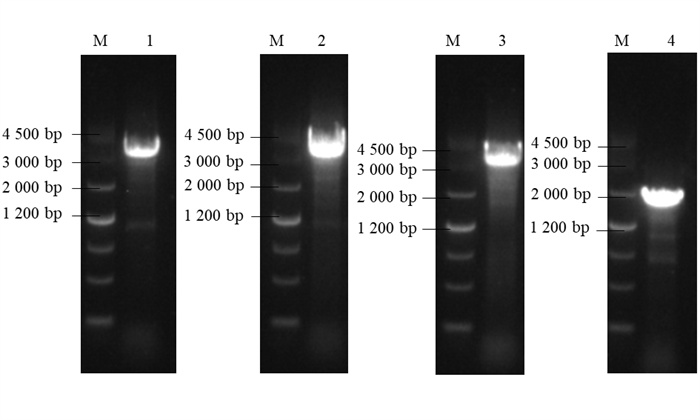
|
泳道M为D4 500 DNA marker;泳道1,2,3,4分别为PmSPS1、PmSPS2、PmSPS3、PmSPS4基因克隆片段。Note: lane M is D4 500 DNA marker; lanes 1, 2, 3 and 4 are PmSPS1, PmSPS2, PmSPS3 and PmSPS4 gene clone fragments, respectively. 图 2 PmSPS克隆片段的PCR电泳图 Fig. 2 PCR electrophoresis of PmSPS cloning fragment |
通过对蛋白理化性质分析发现(表 2),PmSPS编码566~1 080个氨基酸,相对分子质量范围为63. 37~120. 91,等电点为5. 34~6. 05,不稳定性均大于40,亲水性平均系数在-0. 331~-0. 469之间,推测PmSPS属于一类亲水性不稳定酸性蛋白。蛋白二级结构分析发现PmSPS1~PmSPS3的α-螺旋占比为40%左右,无规则卷曲约39%,延伸链约13%,β-转角比例最低(表 3)。而PmSPS4的蛋白质二级结构则以无规则卷曲为主,其余占比大小为α-螺旋>延伸链>β-转角。信号肽预测结果表明,马尾松的4个PmSPS都不属于分泌蛋白。亚细胞定位预测显示,PmSPS可能定位到细胞核。为了解马尾松SPS家族序列特征,将PmSPS氨基酸进行多序列比对,结果如图 3所示,4个PmSPS成员均含有SPS蛋白的特征序列和功能结构域,即蔗糖合酶结构域(sucrose-synth)、糖基转移酶结构域(glycos-transf-1) 和蔗糖-6-磷酸磷酸水解酶结构域(S6PP)。
| 基因名称 Gene name |
编码长度 Encoding length/bp |
氨基酸数 Number of amino acids |
相对分子质量 Relative molecular mass |
等电点 Isoelectric point |
不稳定系数 Instability index |
亲水性系数 Grand average of hydropathicity |
| PmSPS1 | 3 213 | 1 070 | 120.26 | 5.69 | 53.56 | -0.469 |
| PmSPS2 | 3 243 | 1 080 | 120.91 | 5.87 | 43.84 | -0.428 |
| PmSPS3 | 3 231 | 1 076 | 120.39 | 5.34 | 40.62 | -0.331 |
| PmSPS4 | 1 701 | 566 | 63.37 | 6.05 | 43.90 | -0.432 |
| 蛋白名称 Protein name |
蛋白质二级结构各组分占比/% | 信号肽D值 Signal peptide D value |
亚细胞定位 Subcellular localization |
|||
| α-螺旋 Alpha helix |
β-转角 Beta turn |
延伸链 Extended stran |
无规则卷曲 Random coil |
|||
| PmSPS1 | 41.03 | 6.64 | 13.83 | 38.50 | 0.179 | 细胞核Nuclear |
| PmSPS2 | 41.20 | 6.30 | 13.06 | 39.44 | 0.245 | 细胞核Nuclear |
| PmSPS3 | 40.15 | 6.23 | 13.75 | 39.87 | 0.367 | 细胞核Nuclear |
| PmSPS4 | 35.16 | 5.30 | 15.55 | 43.99 | 0.286 | 细胞核Nuclear |

|
注:绿色线表示蔗糖合酶结构域(sucrose-synth),蓝色线表示糖基转移酶结构域(glycos-transf-1),红色线表示蔗糖-6-磷酸磷酸水解酶结构域(S6PP);氨基酸序列中深蓝色表示序列同源性为100%,粉色表示序列同源性为80%~90%,淡蓝色表示序列同源性为60%~70%,白色区域表示序列同源性<50%。 Note: green line indicates sucrose synthase structural domain (sucrose-synth), blue line indicates glycosyltransferase structural domain (glycos-transf-1), and red line indicates sucrose-6-phosphate phosphate hydrolase structural domain (S6PP); dark blue in amino acid sequence indicates 100% sequence homology, pink indicates 80%-90% sequence homology, light blue indicates 60%-70% sequence homology, and white area indicates <50% sequence homology. 图 3 PmSPS成员间多序列比对 Fig. 3 Multiple sequence alignments of PmSPS members |
为了解PmSPS家族成员在进化上的位置与亲缘关系,将4个PmSPS氨基酸序列与模式植物拟南芥、烟草和水稻(Oryza sativa L.) 的共10个SPS氨基酸序列构建系统进化树。由图 4可知SPS可以被分成3个亚家族,其中,PmSPS1和PmSPS3属于A亚家族,PmSPS2和PmSPS4同属B亚家族,C亚族包括烟草NtSPSC、水稻OsSPS11、拟南芥AtSPS4F 3个蛋白。
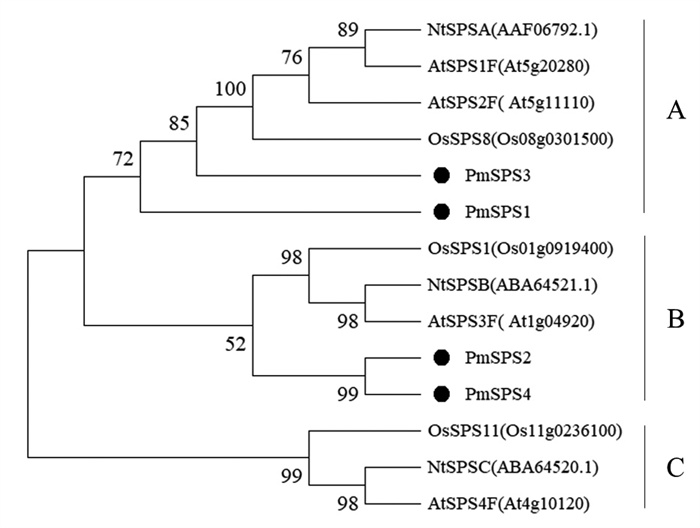
|
注:At,Os,Nt,Pm分别代表拟南芥、水稻、烟草和马尾松。 Note: At, Os, Nt, and Pm represent A. thaliana, O. sativa, N. tabacum, and P. massoniana, respectively. 图 4 马尾松与其他物种SPS蛋白序列进化分析 Fig. 4 Evolutionary analysis of P. massoniana and other species SPS protein sequence |
通过qRT-PCR分析PmSPS在不同组织中的表达,结果如图5(a)所示,4个基因在所检测的马尾松各组织中均有表达,但表达特性不同。其中PmSPS1和PmSPS3的表达量体现为树皮最高,针叶和木质部中较低。PmSPS2、PmSPS4表达量最高的组织是针叶,树皮次之,在木质部中呈现出最低的表达。
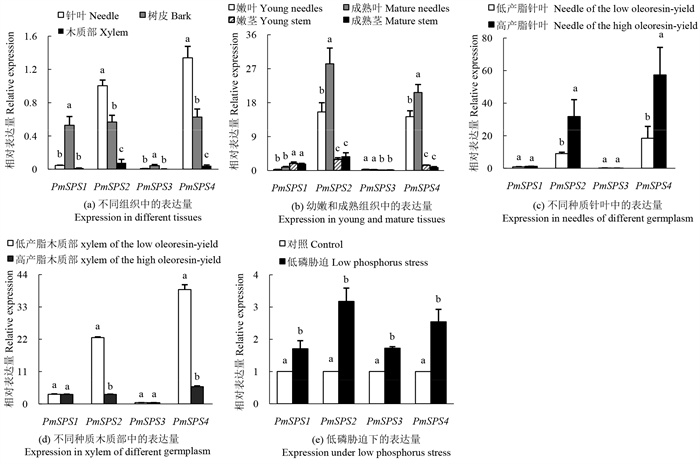
|
注: 不同小写字母表示同一基因在不同条件下的相对表达量差异显著(P < 0.05)。 Note: different lowercase letters indicate significant differences in the relative expression of the same gene under different conditions (P < 0. 05). 图 5 不同条件下马尾松PmSPS基因的表达分析 Fig. 5 Expression analysis of PmSPS genes in P. massoniana under different conditions |
PmSPS在马尾松在幼嫩和成熟组织的表达情况如图 5(b)所示。PmSPS2、PmSPS4在成熟叶中的表达量比嫩叶中的表达量高,但在幼嫩茎和成熟茎间无明显变化。其余两个基因PmSPS1和PmSPS3在针叶和茎的幼嫩、成熟期之间均无显著差异。结果说明,PmSPS1和PmSPS3基因在组织的幼嫩和成熟期表达相对稳定,PmSPS2、PmSPS4在茎中表达稳定,在针叶中主要在成熟期发挥作用。
2.6 马尾松PmSPS基因在高低产脂种质中的表达通过分析PmSPS基因在高低产脂种质针叶中的表达水平,结果如图5(c)所示, PmSPS1和PmSPS3在高低产脂针叶的表达量无显著差异,而PmSPS2和PmSPS4高产脂针叶中的表达量显著高于低产脂。由图5(d)可知,PmSPS1和PmSPS3在高产脂和低产脂木质部中的表达均无差异,PmSPS2和PmSPS4则是高产脂表达量低于低产脂。结果表明,PmSPS2和PmSPS4在高产脂针叶中高表达可能与高产脂种质产脂特性相关,而PmSPS1和PmSPS3相关性不强。
2.7 马尾松PmSPS基因在低磷胁迫处理针叶中的表达对PmSPS基因进行低磷胁迫处理的表达分析,得到PmSPS基因分别在低磷胁迫下不同程度的响应情况。表达结果如图5(e)所示,马尾松受低磷胁迫后,4个PmSPS基因在针叶中均呈现为上调表达。其中,PmSPS2在低磷条件的表达量达到了对照组的3. 18倍。PmSPS1、PmSPS3和PmSPS4基因在低磷处理下表达量分别是对照的1. 71、1. 73、2. 54倍。
3 讨论马尾松松脂作为我国重要的工业原料,具有广泛用途,涵盖了胶黏剂、合成橡胶、涂料、造纸及食品医药等各方面[17]。松树通过针叶进行光合作用首先产生糖类,再经由复杂的一系列反应在薄壁细胞中形成了一类代谢产物,即松脂[18]。蔗糖作为植物体内贮藏与运输碳水化合物的重要载体,在其合成途径中的SPS起到了关键的限速作用[19],而关于该类基因的研究报道未在马尾松中发现。
本研究通过对马尾松转录组数据的检索,鉴定并克隆了4个SPS基因,命名为PmSPS1~PmSPS4。与大多数植物相似,SPS通常包含3~5个成员[20]。一些物种由于其进化过程中所经历的基因组加倍事件造成SPS基因家族成员数量变多[21]。通过生物信息学分析发现4个基因均包含了SPS家族的特征功能结构域,编码蛋白质的性质相似,亚细胞定位相同,PmSPS的基因序列和保守结构域与其他植物SPS基因非常相似,表明所鉴定到的4个PmSPS基因均是SPS家族成员。由系统进化分析得到PmSPS在进化上与其他植物SPS共同分为A、B、C 3个亚族,其中PmSPS1、PmSPS3聚为A亚家族,PmSPS2、PmSPS4同为B亚家族。这些结果暗示PmSPS1和PmSPS3的功能可能与PmSPS2和PmSPS4之间存在差异。在拟南芥[22]、小麦[23]、玉米[24]、烟草[25]和水稻[26]SPS基因表达的研究中,不同亚族SPS基因体现出了不同的表达模式。但没有在不同物种间观察到SPS基因一致的表达模式,因而很难将特定的功能分配给任何一个家族[27]。例如,水稻的5个SPS基因中,属于B亚族的OsSPS1在源组织(叶片) 中的表达最高,并且在蔗糖合成中起主导作用[28]。然而,在烟草[25]和拟南芥[29]中,SPS B家族基因对源叶中蔗糖合成的贡献甚微。
植物SPS主要负责光合组织中蔗糖的合成,同时在非光合组织中也能检测到其基因的表达[30]。在组织表达分析结果中,PmSPS基因在针叶、树皮和木质部中均有表达。其中,PmSPS1和PmSPS3在树皮中的表达丰度最高,表明其可能参与库组织蔗糖水平的调控,与PARK et al[31]对拟南芥A亚族SPS基因的研究结果相似。在棉花中B亚族GhSPS基因在叶片中高表达, 表明其可能主要参与源器官中蔗糖的合成[21]。而PmSPS2和PmSPS4在针叶中表达显著高于树皮和木质部,说明PmSPS2和PmSPS4主要在源器官中的蔗糖水平调控中发挥作用,与棉花的研究结果相似。有关不同成熟度叶片的研究表明,成熟叶的光合作用强度较嫩叶强[32],光合作用和蔗糖的积累主要发生在成熟叶片。同样,本研究发现PmSPS2和PmSPS4在成熟针叶中的表达量显著高于幼嫩时期。进一步说明,PmSPS2和PmSPS4可能在针叶的蔗糖合成和积累中具有重要作用。
有研究表明,高糖品种甘蔗叶片中SofSPSB基因的表达量、糖含量和蔗糖代谢相关酶活性都比中糖品种高,得出高糖甘蔗叶片中的蔗糖代谢能力比中糖品种更高[33]。本研究中,PmSPS2和PmSPS4在高产脂种质针叶中的表达量比低产脂高,推测高产脂马尾松针叶的蔗糖合成能力可能高于低产脂,与郑元英等[12]的“产脂力与可溶性糖含量呈正相关”研究结果相似。PmSPS2和PmSPS4可能在高产脂马尾松针叶的蔗糖合成中起重要作用,同时可能和松脂产量存在一定联系。
在植物体内,磷参与了多种化合物的组成,能调节糖类和淀粉的生成和转运,参与生物固氮,影响根系发育,低磷胁迫对植物的生长及结构、光合特性、叶片营养元素等方面造成影响[34]。研究表明低磷胁迫下马尾松可溶性糖含量显著提高[35]。在本研究中,马尾松PmSPS基因在低磷胁迫下均表现为不同程度的上调表达,推测PmSPS基因可能参与马尾松对低磷胁迫的响应。
本研究通过对马尾松PmSPS基因的克隆和表达分析,分析4个PmSPS基因序列信息及其在马尾松不同组织、不同种质、低磷胁迫中的表达特性,为深入研究SPS基因在马尾松中的功能奠定理论基础。
致谢: 感谢广西壮族自治区林业科学研究院冯源恒高级工程师在马尾松高低产脂材料收集及采样过程中给予的帮助!| [1] |
WIND J, SMEEKENS S, HANSON J. Sucrose: metabolite and signaling molecule[J]. Phytochemistry, 2010, 71(14/15): 1 610-1 614. |
| [2] |
DUAN Y, YANG L, ZHU H J, et al. Structure and expression analysis of sucrose phosphate synthase, sucrose synthase and invertase gene families in Solanum lycopersicum[J]. International Journal of Molecular Sciences, 2021, 22(9): 4 698. DOI:10.3390/ijms22094698 |
| [3] |
HASHIDA Y, HIROSE T, OKAMURA M, et al. A reduction of sucrose phosphate synthase(SPS)activity affects sucrose/starch ratio in leaves but does not inhibit normal plant growth in rice[J]. Plant Science, 2016, 253: 40-49. DOI:10.1016/j.plantsci.2016.08.017 |
| [4] |
STEIN O, GRANOT D. An overview of sucrose synthases in plants[J]. Frontiers in Plant Science, 2019, 10: 95. DOI:10.3389/fpls.2019.00095 |
| [5] |
苏纪勇, 姚圆, 刘玉含, 等. 蔗糖磷酸合酶功能、结构与催化机制的研究进展[J]. 生物工程学报, 2021, 37(6): 1 858-1 868. |
| [6] |
LANGENKÄMPER G, FUNG R W M, NEWCOMB R D, et al. Sucrose phosphate synthase genes in plants belong to three different families[J]. Journal of Molecular Evolution, 2002, 54(3): 322-332. DOI:10.1007/s00239-001-0047-4 |
| [7] |
HUBER S C. Role of sucrose-phosphate synthase in partitioning of carbon in leaves[J]. Plant Physiology, 1983, 71(4): 818-821. DOI:10.1104/pp.71.4.818 |
| [8] |
WANG L, CUI N, ZHANG K Y, et al. Research advance of sucrose phosphate synthase(SPS)in higher plant[J]. International Journal of Agriculture & Biology, 2013, 15(6): 1 221-1 226. |
| [9] |
杨章旗. 马尾松材性与产脂性状遗传改良研究[D]. 北京: 北京林业大学, 2012.
|
| [10] |
魏永成, 刘青华, 周志春, 等. 马尾松不同产脂力无性系光合特性差异分析[J]. 东北林业大学学报, 2015, 43(2): 36-41. DOI:10.3969/j.issn.1000-5382.2015.02.009 |
| [11] |
郭宇渭, 赵文书, 汪福斌, 等. 思茅松林分生物环境因子与产脂量关系的研究[J]. 云南林业科技, 1993(4): 11-16. |
| [12] |
郑元英, 洪蓉. 马尾松产脂力、生长量和针叶中糖、淀粉含量的节律性变化[J]. 福建林业科技, 1995, 22(S1): 12-16. |
| [13] |
陈虎, 谭健晖, 颜培栋, 等. 马尾松果糖-1, 6-二磷酸酶基因克隆及表达模式分析[J]. 广西林业科学, 2016, 45(1): 12-18. DOI:10.3969/j.issn.1006-1126.2016.01.003 |
| [14] |
王好运, 吴峰, 吴昌明, 等. 马尾松不同叶型幼苗对干旱及复水的生长及生理响应[J]. 东北林业大学学报, 2018, 46(1): 1-6. DOI:10.3969/j.issn.1000-5382.2018.01.001 |
| [15] |
秦晓佳, 丁贵杰. 低磷胁迫对不同种源马尾松幼苗的影响[J]. 林业科技, 2012, 37(3): 1-5. |
| [16] |
SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative CT method[J]. Nature Protocols, 2008, 3(6): 1 101-1 108. DOI:10.1038/nprot.2008.73 |
| [17] |
冯源恒, 杨章旗, 吴东山, 等. 广西脂用松类高产脂选择技术[J]. 广西林业科学, 2017, 46(4): 343-349. DOI:10.3969/j.issn.1006-1126.2017.04.001 |
| [18] |
安宁, 丁贵杰, 谌红辉, 等. 马尾松产脂量与树体因子关系研究[J]. 西北林学院学报, 2018, 33(3): 106-110. DOI:10.3969/j.issn.1001-7461.2018.03.16 |
| [19] |
HUANG T, LUO X, WEI M, et al. Molecular cloning and expression analysis of sucrose phosphate synthase genes in cassava (Manihot esculenta Crantz)[J]. Scientific Reports, 2020, 10(1): 1-12. DOI:10.1038/s41598-019-56847-4 |
| [20] |
JIANG S Y, CHI Y H, WANG J Z, et al. Sucrose metabolism gene families and their biological functions[J]. Scientific Reports, 2015, 5(1): 1-24. DOI:10.9734/JSRR/2015/14076 |
| [21] |
晁毛妮, 胡海燕, 付丽娜, 等. 陆地棉蔗糖磷酸合成酶基因家族的鉴定及表达分析[J]. 棉花学报, 2020, 32(1): 30-41. |
| [22] |
SUN J, ZHANG J, LARUE C T, et al. Decrease in leaf sucrose synthesis leads to increased leaf starch turnover and decreased RuBP regeneration-limited photosynthesis but not rubisco-limited photosynthesis in Arabidopsis null mutants of SPSA1[J]. Plant, Cell & Environment, 2011, 34(4): 592-604. |
| [23] |
CASTLEDEN C K, AOKI N, GILLESPIE V J, et al. Evolution and function of the sucrose-phosphate synthase gene families in wheat and other grasses[J]. Plant Physiology, 2004, 135(3): : 1 753-1 764. DOI:10.1104/pp.104.042457 |
| [24] |
LUTFIYYA L L, XU N, ROBERT L D, et al. Phylogenetic and expression analysis of sucrose phosphate synthase isozymes in plants[J]. Journal of Plant Physiology, 2007, 164(7): 923-933. DOI:10.1016/j.jplph.2006.04.014 |
| [25] |
CHEN S, HAJIREZAEI M, BÖRNKE F. Differential expression of sucrose-phosphate synthase isoenzymes in tobacco reflects their functional specialization during dark-governed starch mobilization in source leaves[J]. Plant Physiology, 2005, 139(3): 1 163-1 174. DOI:10.1104/pp.105.069468 |
| [26] |
OKAMURA M, AOKI N, HIROSE T, et al. Tissue specificity and diurnal change in gene expression of the sucrose phosphate synthase gene family in rice[J]. Plant Science, 2011, 181(2): 159-166. DOI:10.1016/j.plantsci.2011.04.019 |
| [27] |
VOLKERT K, DEBAST S, VOLL L M, et al. Loss of the two major leaf isoforms of sucrose-phosphate synthase in Arabidopsis thaliana limits sucrose synthesis and nocturnal starch degradation but does not alter carbon partitioning during photosynthesis[J]. Journal of Experimental Botany, 2014, 65(18): 5 217-5 229. DOI:10.1093/jxb/eru282 |
| [28] |
HIROSE T, HASHIDA Y, AOKI N, et al. Analysis of gene-disruption mutants of a sucrose phosphate synthase gene in rice, OsSPS1, shows the importance of sucrose synthesis in pollen germination[J]. Plant Science, 2014, 225: 102-106. DOI:10.1016/j.plantsci.2014.05.018 |
| [29] |
BAHAJI A, BAROJA-FERNÁNDEZE, RICARTE-BERMEJO A, et al. Characterization of multiple SPS knockout mutants reveals redundant functions of the four Arabidopsis sucrose phosphate synthase isoforms in plant viability, and strongly indicates that enhanced respiration and accelerated starch turnover can alleviate the blockage of sucrose biosynthesis[J]. Plant Science, 2015, 238: 135-147. DOI:10.1016/j.plantsci.2015.06.009 |
| [30] |
IM K H. Expression of sucrose-phosphate synthase(SPS)in non-photosynthetic tissues of maize[J]. Molecules & Cells, 2004, 17(3): 404-409. |
| [31] |
PARK J Y, CANAM T, KANG K Y, et al. Over-expression of an Arabidopsis family A sucrose phosphate synthase(SPS)gene alters plant growth and fibre development[J]. Transgenic Research, 2008, 17(2): 181-192. DOI:10.1007/s11248-007-9090-2 |
| [32] |
刘顺枝. 不同成熟度龙眼叶片组织显微结构的观察[J]. 嘉应大学学报, 2000, 18(6): 85-86. |
| [33] |
陈忠良, 秦翠鲜, 桂意云, 等. 生长前期甘蔗叶片糖分含量及蔗糖磷酸合成酶基因表达分析[J]. 分子植物育种, 2020, 18(13): 4 229-4 235. |
| [34] |
陈雯彬, 欧阳泽怡, 欧阳硕龙, 等. 低磷胁迫对植物生长及生理特性影响的研究进展[J]. 湖南林业科技, 2020, 47(3): 132-136. |
| [35] |
乔光, 崔博文, 文晓鹏, 等. 不同种源马尾松幼苗对低磷胁迫的生理响应[J]. 种子, 2017, 36(8): 32-41. |

 2022, Vol. 42
2022, Vol. 42


