文章信息
- 张苏炯, 叶碧欢, 陈友吾, 沈建军, 朱杰丽, 李海波
- ZHANG Sujiong, YE Bihuan, CHEN Youwu, SHEN Jianjun, ZHU Jieli, LI Haibo
- 4种黄精属植物的基因组大小比较分析
- Comparative analysis on genome sizes of four Polygonatum species
- 森林与环境学报,2022, 42(2): 193-198.
- Journal of Forest and Environment,2022, 42(2): 193-198.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2022.02.010
-
文章历史
- 收稿日期: 2021-09-17
- 修回日期: 2021-10-08
2. 浙江省林业科学研究院, 浙江 杭州 310023
2. Zhejiang Academy of Forestry, Hangzhou, Zhejiang 310023, China
黄精为多年生草本植物,隶属百合科(Liliaceae)黄精属(Polygonatum Mill.),在全球范围内主要分布于北温带和北亚热带,约有60种。我国的黄精属植物广泛分布于除南方热带以外的广大地区,约有31种[1]。黄精属植物多可药食两用,在民间的使用历史悠久,作为传统药食同源性中药材的原生药,一同收录于《中国药典》(2020年版) 的有滇黄精(P. kingianum Coll. et Hemsl.)、黄精(P. sibiricum Red.)、多花黄精(P. cyrtonema Hua.) 和玉竹[P. odoratum (Mill.) Druce] 4个物种。黄精具有潜在的药用价值,包括抗衰老、调节免疫、降血糖血脂、改善记忆力、抗肿瘤、抗菌等。近年来,随着我国大健康产业的蓬勃发展,药食兼用的黄精成为研究的热点之一[2-3]。
基因组大小即C值是指一个物种单倍体或配子所含的DNA总量[4],单位为pg或Mb (1 pg相当于978 Mb) [5]。一个物种的基因组大小不仅是种群进化、物种分类和生态学研究的有用证据[6],且对于基因组学研究、全基因组测序和进化生物学研究等工作具有参考价值[7]。
植物倍性已知是确定其单倍体DNA含量的前提。因此在进行基因组大小估测前,须先明确该物种供试材料的倍性。黄精属是染色体数目进化非常复杂的一个类群,黄精属植物的染色体在数目和结构两个方面都是多变的[8]。滇黄精主要分布于我国西南以及越南和缅甸,其染色体数目的差异很大,在该物种进化中的多倍化事件中,伴随有非整倍化现象;黄精广泛分布于亚洲北部温带地区,主要报道为二倍体,但不同居群的染色体基数不同;多花黄精在我国大范围分布,种内变异复杂,其染色体数目多变;玉竹广泛分布于北半球,是黄精族里面染色体报道最多的种类,迄今报道的倍性均为二倍体[9]。
传统的倍性鉴定主要是染色体计数法和形态观察法,染色体计数法结果虽然可靠,但制备标本复杂,步骤繁琐,技术难度大,鉴定速度慢,因而不适用于大规模的样品鉴定;对于多倍体,由于植株高大,形态观察法的准确性不高,特别是在高倍性下的形态特征与倍性并不呈正相关[10-11]。植物基因组大小的估测方法主要有孚尔根光密度测量法(Feulgen densitometry) 和基因组测序法。前者实验操作复杂,难度较大,结果不稳定[12],后者工作量大,成本昂贵、速度慢。流式细胞术(flow cytometry, FCM) 具有样品制备简易、快速、灵敏、结果稳定可靠等优势,且可同时进行倍性鉴定和基因组大小的估测,因而广泛应用于多种植物,包括茅苍术[Atractylodes lancea (Thunb.) DC.]、枣树(Ziziphus jujuba Mill.)、美洲黑杨(Populus deltoides Marsh.) 和刺槐(Robinia pseudoacacia L.) 等多种植物的多倍体鉴定[13-16],以及槭属(Acer Linn.)、人参属(Panax) 和鼠尾草属(Salvia) 等植物的基因组大小检测[17-20]。
迄今为止,关于黄精属植物基因组大小的报道仅有7种,包括轮叶黄精[P. verticillatum (L.) All.] [21]、宽叶黄精[P. latifolium(Jacq.) Desf.] [21]、玉竹[22]、多毛黄精[P. pubescens (Willd.) Pursh.] [23]、首乌黄精[P. multiflorum(L.) All.] [24]、蓝果黄精[P. biflorum(Walter.) Elliott.] [23]和距药黄精(P. franchetii Hua.) [21]。本研究拟利用流式细胞仪,分别以已知基因组大小的玉米(Zea mays L.) [25]和毛竹(Phyllostachys pubescens Mazel.) [26]为内标,对源自不同产地的4种收录于药典的黄精属植物进行倍性检测和基因组大小估测,以期丰富该属植物的基因组大小数据,并为后续的基因组学、物种分类以及种群进化研究提供基础参考数据。
1 材料与方法 1.1 材料4种黄精属植物用于本研究,分别为滇黄精、黄精、多花黄精和玉竹,每个物种各取3个植株,其详细信息见表 1。用于基因组大小分析的内标玉米品种浙甜11号和毛竹植株分别由浙江省农业科学院和浙江省林业科学研究院竹种园提供。
| 物种Species | 植株编号Plant number | 产地Origin | 倍性Ploidy |
| 滇黄精 P. kingianum |
pk1 | 浙江农林大学磐安黄精种植基地Pan’an Polygonatum Plant Cultivation Base of Zhejiang Agriculture and Forestry University | 二倍体Diploid |
| pk2 | 安徽,亳州Bozhou, Anhui Province | 四倍体Tetraploid | |
| pk3 | 安徽,亳州Bozhou, Anhui Province | 四倍体Tetraploid | |
| 黄精 P. sibiricum |
ps1 | 浙江农林大学磐安黄精种植基地Pan’an Polygonatum Plant Cultivation Base of Zhejiang Agriculture and Forestry University | 二倍体Diploid |
| ps2 | 云南,曲靖Qujing, Yunnan Province | 二倍体Diploid | |
| ps3 | 云南,曲靖Qujing, Yunnan Province | 二倍体Diploid | |
| 多花黄精 P. cyrtonema |
pc1 | 浙江农林大学磐安黄精种植基地Pan’an Polygonatum Plant Cultivation Base of Zhejiang Agriculture and Forestry University | 二倍体Diploid |
| pc2 | 浙江,衢州龙游Longyou, Quzhou, Zhejiang Province | 三倍体Triploid | |
| pc3 | 浙江,衢州龙游Longyou, Quzhou, Zhejiang Province | 三倍体Triploid | |
| 玉竹 P. odoratum |
po1 | 浙江省磐安县盘峰高山玉竹基地Panfeng Gaoshan Yuzhu Base, Pan’an, Zhejiang | 二倍体Diploid |
| po2 | 浙江,磐安大盘山 Pan’an Dapan Mountain, Zhejiang | 二倍体Diploid | |
| po3 | 浙江,磐安大盘山 Pan’an Dapan Mountain, Zhejiang | 二倍体Diploid |
分别取4种黄精属植物的12个植株的健康新鲜叶片进行倍性分析。以浙江农林大学磐安黄精种植基地的pk1、ps1、pc1植株和磐安县盘峰高山玉竹基地的po1植株作为二倍体对照样品。倍性分析所用的试剂盒为CyStainTM UV Ox Protect (Sysmex-Partec, Germany),具体步骤为:取0. 5 m2的叶片放入培养皿中,垂直切碎样品,加入400 μL染色液,染色持续30~60 s。用30 μm的滤膜过滤样品,加入1 600 μL DAPI (4, 6-diamidino-2-phenylindole-2HCl) 染色溶液,充分混匀,室温下孵育30~60 s,上机检测。每个植株重复检测3次。倍性分析所用的仪器为Sysmex CyFlow®Ploidy Analyser流式细胞仪(Sysmex-Partec, Germany)。
1.3 基因组大小估测分别取4种黄精属植物的12个植株的健康新鲜叶片进行基因组大小估测。基因组大小估测所用的试剂盒为CyStain®PI Absolute P (Sysmex-Partec, Germany)。具体步骤为:取0. 5 m2的叶片放入培养皿中,加入400 μL染色液,垂直切碎样品,持续30~60 s;室温下孵育30~90 s;加入1 600 μL碘化丙啶(PI) 染色溶液(染色缓冲液+PI+RNase储存液),避光室温,孵育30~60 min,上机检测。每个植株重复检测3次。基因组大小估测所用的仪器为Sysmex CyFlow®Cube6流式细胞仪(Sysmex-Partec, Germany)。待测基因组大小的计算公式为:待测基因组大小(pg或Mb) =待测荧光强度(峰值) /内标荧光强度(峰值) ×内标倍性/待测倍性×内标基因组大小。
2 结果与分析 2.1 倍性检测结果植物细胞分裂间期G1期的DNA含量反应一个细胞的倍性,因此可用DNA相对含量来估计细胞的倍性。利用流式细胞仪对12个黄精属植株进行倍性检测,结果显示,滇黄精pk2和pk3植株的DNA相对含量均约为二倍体对照植株pk1的4倍;黄精ps2和ps3植株与二倍体对照植株ps1相近;多花黄精pc2和pc3植株均约为二倍体对照植株pc1的2. 35倍;玉竹po2和po3植株与二倍体对照植株po1接近(图 1),表明滇黄精pk2和pk3植株为四倍体,黄精ps2和ps3植株为二倍体,多花黄精pc2和pc3植株为三倍体,玉竹po2和po3植株为二倍体(表 1)。这一结果再次表明黄精属植物的染色体在倍性上的多变性,暗示了该属是染色体数目进化非常复杂的一个类群。
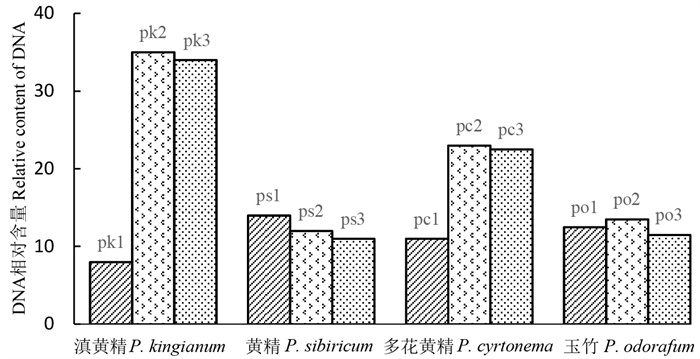
|
图 1 4种黄精属植物的倍性检测 Fig. 1 Ploidy level detection for four Polygonatum species |
分别以基因组大小已知的玉米和毛竹为内标,估测12个黄精属植株的基因组大小。在以玉米为内标测定时,出现了双峰现象,第二峰M2横坐标值接近第一峰M1的2倍,分别代表DNA合成G0/G1期2C的DNA含量和G2/M期4C的DNA含量,这表明选取的玉米内标材料可能恰好在细胞分裂旺盛期(图 2A)。以玉米内标与黄精属植株进行的混测结果显示,多花黄精的pc1植株和黄精的ps2、ps3植株与玉米的G2/M期出现重叠峰(图 2B~D)。因此我们选取的玉米材料并不是分析黄精属基因组大小的合适内标。
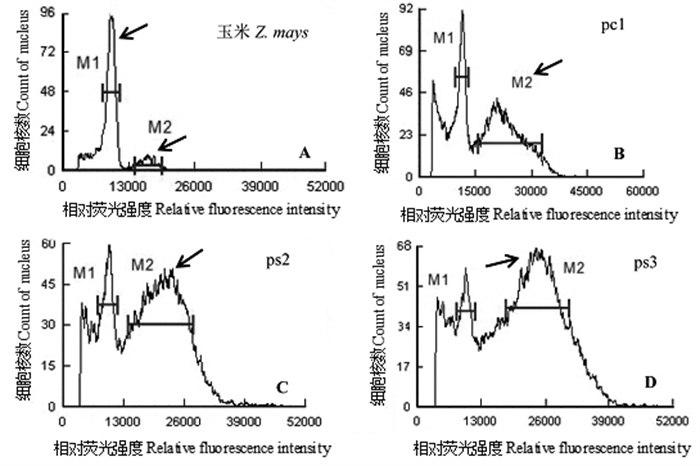
|
图 2 玉米与黄精属植物的流式细胞仪峰值 Fig. 2 Peak value of Zea mays and Polygonatum species by flow cytometry |
四倍体毛竹基因组大小为2. 08 pg (2 034 Mb) [26]。在以毛竹为内标混测时,没有出现重叠峰,保证了用毛竹作为内标的可靠性(图 3)。以毛竹为内标估测出的基因组大小显示,在4种黄精属植物中,同为二倍体植株,玉竹与滇黄精的基因组大小较为接近,玉竹为14. 14~14. 40 pg (13 829~14 083 Mb),滇黄精为14. 09 pg (13 780 Mb);黄精的基因组略小,为13. 08~13. 82 pg (12 792~13 516 Mb);多花黄精的基因组最小,为9. 52pg (9 311 Mb)。多花黄精三倍体植株的基因组大小为11. 28~11. 52 pg (11 032~11 267 Mb),是二倍体植株的1. 2倍。滇黄精四倍体植株的基因组大小范围为12. 36~12. 69 pg (12 088~12 411 Mb),是二倍体植株的89% (表 2)。
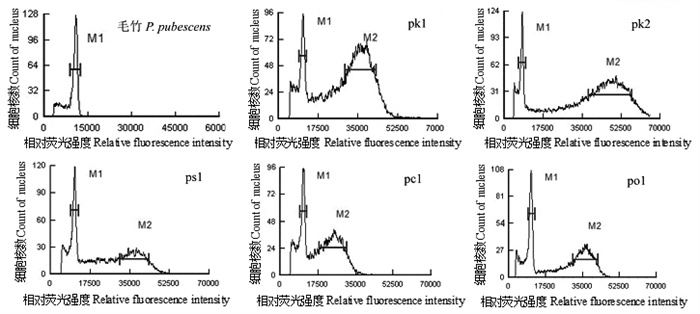
|
图 3 毛竹与黄精属植物的流式细胞仪峰值 Fig. 3 Peak value of Phyllostachys pubescens and Polygonatum species using flow cytometry |
| 物种Species | 植株编号及倍性 Plant number and ploidy |
样品平均峰值/内标平均峰值 Mean peak value of sample/reference standard |
C值 C value/pg |
| 毛竹Phyllostachys pubescens | 4X | 10 547.59 | 2.08 |
| 滇黄精P. kingianum | pk1,2X | 35 972.8/10 621.8 | 14.09 |
| pk2,4X | 47 509.5/7 783.6 | 12.69 | |
| pk3,4X | 42 772.8/7 198.5 | 12.36 | |
| 黄精P. sibiricum | ps1,2X | 35 972.8/10 831.2 | 13.82 |
| ps2,2X | 34 553.2/10 442.6 | 13.76 | |
| ps3,2X | 33 007.9/10 495.6 | 13.08 | |
| 多花黄精P. cyrtonema | pc1,2X | 24 345.1/10 645.8 | 9.52 |
| pc2,3X | 43 363.0/10 440.5 | 11.52 | |
| pc3,3X | 42 087.0/10 346.1 | 11.28 | |
| 玉竹P. odoratum | po1,2X | 36 092.0/10 434.7 | 14.38 |
| po2,2X | 36 145.9/10 434.9 | 14.40 | |
| po3,2X | 35 440.7/10 422.9 | 14.14 |
在流式细胞术用于基因组大小估测中,选择合适的内标事关数据的准确性。鸡血红细胞和人淋巴细胞是早期研究中广为采用的内标,但在操作过程中,由于两种细胞的细胞核水解速率不同,混样时可能会导致DNA特异染色不均等问题[27]。在进行植物基因组大小分析时,应选用PI作为荧光染料,以植物材料作为内标,且内标核DNA含量的2C或4C峰与待测样品的2C或4C峰接近但不重叠[28]。本研究以PI作为荧光染料,选用基因组大小已知的毛竹作为内标植物,可明确区分内标与样品的出峰位置,无杂质峰影响,保证了黄精属植物基因组大小估测结果的可靠性。
黄精属植物种类繁多,经过长期的自然选择,其染色体数目和结构的变异类型非常多样,且主要为二倍体水平染色体在长度上的变异和比较突出的非整倍化现象,多倍化不占主导地位[8-9, 29]。多倍化与地域分布也存在一定的关联,分布于中国西南地区及喜马拉雅东部地区的黄精属种类多倍体出现频率均高于其他地区[29]。在本研究来自不同产地的黄精属植物中,3个滇黄精植株中的2个为四倍体,3个多花黄精植株中的2个为三倍体,预示了黄精属植物染色体的多倍化现象也可能在某些地域普遍存在。
在本研究中,4种黄精属植物种间的基因组大小为9. 52~14. 40 pg,彼此差异明显,特别是二倍体多花黄精(9.52 pg) 与二倍体滇黄精(14.09 pg) 和二倍体玉竹(14.14~14.40 pg) 的差异很大,与业已报道的该属植物基因组大小[包括轮叶黄精(8.44 pg)、宽叶黄精(9.10 pg)、玉竹(9.83 pg)、多毛黄精(10.90 pg)、首乌黄精(15.35 pg)、蓝果黄精(20.80 pg) 和距药黄精(31.08 pg)] 相比,也存在较大差异。植物种间基因组大小的差异在槭属、人参属、鼠尾草属等植物中也存在[17-19]。同时,本研究结果还显示,黄精属同一个物种的不同植株间,其基因组大小也不尽相同。多花黄精三倍体植株的基因组是二倍体植株的1. 2倍,滇黄精四倍体植株的基因组大小是二倍体植株的89%。玉竹二倍体植株与业已报道的基因组大小也存在较大差异。不同物种间的基因组大小差异很大,且物种的复杂性与基因组大小不相关[30]。存在于基因组中大量的非编码DNA重复序列(转座因子、卫星DNA与核糖体基因) 是造成这种差异的主要原因,特别是以转座机制为代表的突变方式对于基因组大小的影响尤其显著。种内不同种群间的基因组大小变异、以及种间基因组大小的差异都主要是由这些重复序列引起造成[31-32]。研究表明,黄精属植物居群的变异丰富,遗传多样性高,种间杂交频繁,过渡种繁多,种的界限相对模糊[33]。因此,导致黄精属植物种间或种内基因组大小差异的主要根源可能是该属内丰富的变异或种间杂交而导致种间或种内重复序列的变化。
基因组扩张(或DNA含量增加) 和删减丢失是两种反方向进化动力,基因组大小的进化与这二种进化动力的共同作用相关[34-36]。绝大多数植物的基因组在完成二倍体化过程中,都先经历过基因组加倍、加倍后的染色体重排或删除,并在大量复制基因的丢失后,才将基因组的扩大稳定下来。基因组多倍体化总体上是导致基因组迅速扩张的重要机制,尽管加倍后存在部分DNA的删减丢失[7]。因此,黄精属植物进化过程中比较突出的染色体非整倍化以及多倍化现象也可能是导致其同物种不同倍性的植株在基因组大小上差异的原因之一。
本研究建立了流式细胞术测定黄精属植物基因组大小的方法,首次完成了4种药典收录黄精属植物的基因组大小,增补了黄精属植物的基因组大小数据,研究结果为黄精属植物后续的基因组学、物种分类以及种群进化研究提供基础参考数据。
| [1] |
俞德浚, 吴征镒, 崔鸿宾. 百合科Liliaceae[M]//中国科学院中国植物志编辑委员会. 中国植物志: 15卷, 北京: 科学出版社, 1978: 52.
|
| [2] |
陈哗, 孙晓生. 黄精的药理研究进展[J]. 中药新药与临床药理, 2010, 21(3): 328-330. |
| [3] |
张洁, 马百平, 杨云, 等. 黄精属植物甾体皂苷类成分及药理活性研究进展[J]. 中国药学杂志, 2006, 41(5): 330-332. DOI:10.3321/j.issn:1001-2494.2006.05.004 |
| [4] |
BENNETT M D, BHANDOL P, LEITCH L J. Nuclear DNA amountsin angiosperms and their modern uses-807 new estimates[J]. Annals of Botany, 2000, 86(4): 859-909. DOI:10.1006/anbo.2000.1253 |
| [5] |
DOLEZEL J, BARTOS J, VOGLMAYR H, et al. Nuclear DNA content and genome size of trout and human[J]. Cytometry, 2003, 51(2): 127-128. |
| [6] |
JOAO L, PAVEL T, JANA R, et al. The use of flow cytometry in the biosystematics, ecology and population biology of homoploid plants[J]. Preslia, 2010, 82(1): 3-21. |
| [7] |
陈建军, 王瑛. 植物基因组大小进化的研究进展[J]. 遗传, 2009, 31(5): 464-470. |
| [8] |
陈少风. 黄精属八种植物的染色体研究[J]. 植物分类学报, 1989, 27(1): 39-48. |
| [9] |
王家坚. 基于分子系统发育的黄精族染色体进化研究[D]. 吉首: 吉首大学, 2016.
|
| [10] |
石庆华, 刘平, 刘孟军, 等. 果树倍性育种研究进展[J]. 园艺学报, 2012, 39(9): 1 639-1 654. |
| [11] |
王利虎, 吕晔, 罗智, 等. 流式细胞术估测枣染色体倍性和基因组大小方法的建立及应用[J]. 农业生物技术学报, 2018, 26(3): 511-520. |
| [12] |
MOSCONE E A, BARANYI M, EBERT I, et al. Analysis of nuclear DNA content in Capsicum (Solanaceae) by flow cytometry and feulgen densitometry[J]. Annals of Botany, 2003, 92(1): 21-29. DOI:10.1093/aob/mcg105 |
| [13] |
贾会霞, 姬慧娟, 胡建军, 等. 杨树新品种的SSR指纹图谱构建和倍性检测[J]. 林业科学, 2015, 51(2): 69-79. |
| [14] |
刘琰玮, 李美育, 朱景乐, 等. 枣树多倍体种质资源的发掘及其SSR鉴定[J]. 分子植物育种, 2018, 16(10): 3 395-3 400. |
| [15] |
李伟强, 戴晓港, 李小平, 等. 美洲黑杨种质材料倍性鉴定[J]. 南京林业大学学报(自然科学版), 2019, 43(5): 51-58. |
| [16] |
冯玥, 任云辉, 李秀宇, 等. 人工诱导多倍体刺槐及其倍性鉴定[J]. 分子植物育种, 2018, 16(21): 254-261. |
| [17] |
马秋月, 李淑顺, 马骧, 等. 基于流式细胞技术的两种槭属植物基因组大小测定[J]. 南京林业大学学报(自然科学版), 2018, 42(5): 201-205. |
| [18] |
潘跃芝, 张亦弛, 龚洵, 等. 4种人参属植物基因组大小的测定[J]. 植物分类与资源学报, 2014, 36(2): 233-236. |
| [19] |
林峰, 周翔宇, 徐莉, 等. 几种鼠尾草属植物基因组C值测定[J]. 农业生物技术学报, 2017, 25(10): 1 622-1 628. |
| [20] |
倪金菁, 贺彬, 汪文杰, 等. 流式细胞法测定茅苍术基因组大小[J]. 中药材, 2015, 38(6): 1 153-1 156. |
| [21] |
VESELý P, BUREŠ P, ŠMARDA P, et al. Genome size and DNA base composition of geophytes: the mirror of phenology and ecology?[J]. Annals of Botany, 2012, 109: 65-75. DOI:10.1093/aob/mcr267 |
| [22] |
SILJAK-YAKOVLEV S, PUSTAHIJA F, ŠOLIC E M, et al. Towards a genome size and chromosome number database of Balkan flora: C-values in 343 taxa with novel values for 242[J]. Advanced Science Letters, 2010, 3(2): 190-213. DOI:10.1166/asl.2010.1115 |
| [23] |
BAI C, ALVERSON W S, FOLLANSBEE A, et al. New reports of nuclear DNA content for 407 vascular plant taxa from the United States[J]. Annals of Botany, 2012, 110(8): 1 623-1 629. DOI:10.1093/aob/mcs222 |
| [24] |
ZONNEVELD B J M, LEITCH I J, BENNETT M D. First nuclear DNA amounts in more than 300 angiosperms[J]. Annals of Botany, 2005, 96(2): 229-244. DOI:10.1093/aob/mci170 |
| [25] |
BENNETT M D, SMITH J B. Nuclear DNA amounts in angiosperms[J]. Philosophical Transactions of the Royal Society of London Series B: Biological Sciences, 1991, 334(1 271): 309-345. |
| [26] |
桂毅杰, 王晟, 全丽艳, 等. 毛竹基因组大小和序列构成的比较分析[J]. 中国科学C辑: 生命科学, 2007, 37(4): 488-492. |
| [27] |
LOUREIRO J, RODRIGUEZ E, DOLEZEL J, et al. Two new nuclear isolation buffers for plant DNA flow cytometry: a test with 37 species[J]. Annals of Botany, 2007, 100(4): 875-888. DOI:10.1093/aob/mcm152 |
| [28] |
JOHNSON J S, BENNETT M D, RAYVURN A L, et al. Reference standards for determination of DNA content of plant nuclei[J]. American Journal of Botany, 1999, 86(5): 609-613. DOI:10.2307/2656569 |
| [29] |
王家坚, 聂泽龙, 孟盈. 天门冬科黄精族细胞学研究进展[J]. 西北植物学报, 2016, 36(4): 834-845. |
| [30] |
陈建军, 王瑛. 植物基因组大小进化的研究进展[J]. 遗传, 2009, 31(5): 464-470. |
| [31] |
石米娟, 程莹寅, 张婉婷, 等. 浅析基因组大小的进化机制[J]. 科学通报, 2016, 61(30): 3 188-3 195. |
| [32] |
BIEMONT C. Genome size evolution: within-species variation in genome size[J]. Heredity (Edinb), 2008, 101(4): 297-298. DOI:10.1038/hdy.2008.80 |
| [33] |
朱巧, 邓欣, 张树冰. 黄精属6种植物的SSR遗传差异分析[J]. 中国中药杂志, 2018, 43(14): 2 935-2 943. |
| [34] |
PETROV D A. Mutational equilibrium model of genome size evolution[J]. Theoretical Population Biology, 2002, 61(4): 531-544. DOI:10.1006/tpbi.2002.1605 |
| [35] |
GREGORY T R. Insertion-deletion biases and the evolution of genome size[J]. Gene, 2004, 324(1): 15-34. |
| [36] |
HAWKINS J S, GROVER C E, WENDEL J F. Repeated big bangs and the expanding universe: directionality in plant genome size evolution[J]. Plant Science, 2008, 174(6): 557-562. DOI:10.1016/j.plantsci.2008.03.015 |

 2022, Vol. 42
2022, Vol. 42


