文章信息
- 卯吉华, 李荣波, 景跃波, 宁德鲁, 李勇鹏, 陈海云
- MAO Jihua, LI Rongbo, JING Yuebo, NING Delu, LI Yongpeng, CHEN Haiyun
- 核桃园土壤丛枝菌根真菌多样性及接种效应
- Arbuscular mycorrhizal fungi associated with walnut trees and their effect on seedling growth
- 森林与环境学报,2022, 42(1): 71-80.
- Journal of Forest and Environment,2022, 42(1): 71-80.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2022.01.009
-
文章历史
- 收稿日期: 2021-08-31
- 修回日期: 2021-11-03
丛枝菌根是高等植物根系与菌根真菌形成的互惠共生体,丛枝菌根真菌是土壤生态系统中分布最为广泛、最丰富的一类重要功能微生物,对植物生长以及土壤生态系统具有重要的生理和生态学功能[1]。丛枝菌根真菌通过与宿主植物的根系形成共生关系,在促进宿主植物对水分和营养物质吸收利用的同时,宿主植物体所固定的20%的碳也会被转移到根际土壤的真菌中,从而实现了宿主植物与丛枝菌根真菌之间的互惠共生[2]。大量研究表明,接种丛枝菌根真菌能促进宿主植物生长发育,提高植物生长量和生物量的积累等。如接种丛枝菌根真菌提高了酸枣(Ziziphus acidojujuba Mill.) [3]、桑树(Morus alba) [4-5]、大青杨(Populus ussuriensis Kom.) [6]、柑橘(Citrus aurantium L.) [7]等植株根系、株高、地径等形态生长,促进植物地上和地下部分以及总生物量积累,植物体叶绿素和C、N、P的含量显著增加, 进而提高其光合速率。
核桃(Juglans spp.) 又名胡桃,是我国重要的木本食用油料树种[8]。云南省核桃种植面积和产量均位居全国之首[9],核桃已成为云南省产业发展中的第一经济林果,云南核桃的主要栽培种为深纹核桃(Juglans sigillata),又名铁核桃、泡核桃、茶核桃和漾濞泡核桃[10]。然而在核桃产业发展过程中,为追求产量过度施用各种化学肥料和农药,造成核桃林地土壤污染严重、质量衰退,导致核桃品质差、效益和产值低下。在作物栽培越来越来重视绿色、有机、生态种植的背景下,植物与土壤有益微生物互作的研究也越来越倍受关注。核桃是一种典型的菌根营养型树种,国外胡桃属(Juglans) 菌根有少量的研究报道,BROOKSHIRE et al[11]和DOLCET-SANJUAN et al[12]分别对黑核桃(Juglans nigra)和普通核桃(Juglans regia)两个种开展过苗期的丛枝菌根真菌接种试验研究。国内吴强盛等[13]于2003年在开展果树菌根研究时,发现核桃属于菌根营养型树种;王进[14]通过对核桃接种丛枝菌根真菌发现,接种显著促进了核桃幼苗株高、地径生长,并提高了苗木地上及地下部分生物量的积累;高娅等[15]在盐胁迫下对核桃幼苗接种印度梨形孢菌得出,在盐胁迫条件下接种,提高了幼苗生长量和生物量,增强幼苗的光合效率,并能显著提高核桃的耐盐性。以上有关核桃接种菌根方面的研究所涉及的接种剂是商品化和分离提纯的菌,而有关核桃根际土著丛枝菌根真菌接种于核桃的相关研究鲜有报道。基于此,本研究在探明了核桃种植园根际土壤中丛枝菌根真菌群落组成及多样性的基础上,通过盆栽接种试验,研究土著丛枝菌根真菌对核桃幼苗的接种效应,一方面探索土著丛枝菌根真菌在核桃生长中能否发挥显著的促进作用,另一方面为菌根技术在云南核桃栽培和管理上的应用积累一些优良的丛枝菌根真菌资源,以及菌根这一高效生物技术在核桃种植管理中的进一步应用提供理论依据和技术支撑。
1 材料与方法 1.1 研究区概况与样品采集采样点位于云南省临沧市临翔区凤翔街道南本村委会小南本组(100°11′61″ E,23°79′10″N),海拔2 056 m。该区属亚热带季风气候,四季温差不大,干湿分明,年平均气温为17.2 ℃,有效积温为6 352.9 ℃,土壤类型为黄棕壤,年平均降雨量为1 300~1 500 mm,全年无霜期约290 d[16]。该区特殊的生境及气候条件较适宜发展种植以核桃为主的经济林果产业。2020年1月,在10年生荒芜(不套种其它作物) 核桃种植园随机选取6株胸径相近的10年生核桃,在距离树干1 m处选取东南西北4个方位,除去地表层杂物及上层土层,挖取5~20 cm土层的根系,同时轻轻抖落附着于根系表面的土壤,即根际土壤,然后将4个方位的根际土壤混合为1个土壤样品(约2 kg),装入密封塑料袋带回实验室备用。
1.2 核桃根系中丛枝菌根真菌共生结构研究对核桃根系中丛枝菌根真菌的染色处理参考杨亚宁等[17]试验方法并稍作调整,采用碱解离、纯蓝墨水染色法制片,然后将制好的片置于光学显微镜下,运用十字交叉法检测丛枝菌根真菌在各根系中的侵染情况。记录根系中丛枝、泡囊、菌丝、菌丝圈等各结构的侵染情况并计算其侵染率。丛枝菌根真菌侵染率/%=侵染根段数/观察根段总数×100。
1.3 核桃根际土壤中丛枝菌根真菌孢子的分离与鉴定核桃根际土壤中丛枝菌根真菌孢子采用湿筛倾析法[18]进行筛取,将湿筛得到的健康孢子或孢子果按形状、颜色以及大小等特征在体视镜下进行初步分类与计数。将湿筛得到的孢子或同类型的孢子或孢子果分别置于载玻片上含聚乙烯乳酸甘油或聚乙烯乳酸甘油+梅尔泽试剂的浮载剂中,加盖玻片制成标本片后置于光学显微镜下测定孢子和孢子果的大小,观察其颜色、形状、孢壁厚度和分层、连孢菌丝特征等形态学特征。根据SCHENCK et al[19]、国际丛枝菌根真菌菌种保藏中心(http://invam.caf.wvu.edu) 提供的种的描述及图片,同时参阅相关文献和近年来发表新种的文献资料进行丛枝菌根真菌种的鉴定[20]。对有代表性或特征明显的孢子和孢子果用光学显微镜(Olympus BX 53) 进行拍照。本研究中孢子密度指每克自然风干土样中含有的孢子和孢子果数目,相对多度(relative abundance,RA) /%=该采样点丛枝菌根真菌某属或种孢子数/该采样点丛枝菌根真菌总孢子数×100, 表征一个生境中丛枝菌根真菌种的产孢能力,指某种丛枝菌根真菌的孢子数占总孢子数的百分比。
1.4 核桃幼苗丛枝菌根真菌接种试验在对核桃园中丛枝菌根真菌多样性及组成进行研究的基础上,开展了土著丛枝菌根真菌(native arbuscular mycorrhizal fungi,NAMF) 接种试验,同时采用了美国商品化丛枝菌根真菌(commoditization arbuscular mycorrhizal fungi,CAMF) 参与接种比较。NAMF是采自研究区核桃种植园内的10年生核桃根际混合土,土壤中含有16种丛枝菌根真菌,平均孢子密度为21个·g-1。CAMF里面含有9种丛枝菌根真菌,分别为摩西斗管囊霉(Funneliformis moseae)、聚丛根孢囊霉(Rhizophagus aggregatum)、幼套近明球囊霉(Claroideoglomus etunicatum)、异形根孢囊霉(Rhizophagus intraradices)、沙荒隔球囊霉(Septoglomus deserticola)、单孢球囊霉(Glomus monosporum)、明根孢囊霉(Rhizophagus clarus)、巴西类球囊霉(Paraglomus brasilianum)、珠状巨孢囊霉(Gigaspora margarita),前面4个种平均孢子密度为13个·g-1,后面5个种平均孢子密度为2.5个·g-1。
试验设3个处理,分别接种NAMF、CAMF和对照(CK,加入等量经两次灭菌处理的根际土壤),接种剂量均为20 g·株-1,每处理20株重复。接种基质为草炭和蛭石(V草炭∶V蛭石=1∶2),充分混匀,经高温(121 ℃) 高压灭菌2 h,隔1~2 d灭菌第2次。所用容器为塑料杯,高25 cm,直径15 cm,可装培养基质500 g,2020年4月进行接种。接种幼苗为普通核桃种子,于2019年10月采自云南省漾濞县,去青皮晾干后用1%的高锰酸钾浸泡30 min,再用流水浸泡3 d,然后进行沙藏催芽60 d后,选择长势基本一致的核桃幼苗进行接种。接种后对苗木进行常规管理(每周浇水2次,温室平均温度为28 ℃,相对湿度70%,光照条件好)。
1.5 核桃幼苗丛枝菌根真菌接种后各指标参数的测定接种处理5个月后,每处理随机抽取6株苗木,取根系,检测其丛枝菌根真菌各结构的侵染率和侵染情况,方法与1.2相同。对参试核桃幼苗测定记录苗高、地径、生物量、光合参数。用直尺测量株高和根长,用数显游标卡尺测量地径。采用LI-6400XT便携式光合仪,在晴朗的上午9:00—11:00,选取顶芽下第5片健康叶片,测定净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs) 和胞间CO2浓度(intercellular CO2 concentration,Ci) 等参数,并计算水分利用效率(water use efficiency,WUE),WUE=Pn/Tr[21]。将幼苗整棵取出,清洗干净,分为地上部分和地下部分,称量得到鲜质量,于105 ℃烘箱中先杀青30 min,再置于80 ℃环境下烘干至恒质量,最后用分析天平测其干质量。计算根冠比,根冠比=根系干质量/地上部分干质量。将烘干后的苗木地上和地下部分样品粉碎后,分别称取0.3 g于消煮管中,消煮至澄清,待冷却至室温后定容,再吸取清液测定植株的全N、P、K含量。先用浓硫酸-过氧化氢消煮法消解,采用凯氏定氮蒸馏法测定全N含量,采用钼锑抗吸光光度法测定全P含量,采用火焰光度计法测定全K含量[22]。
1.6 数据处理采用DPS 7.05统计软件对数据进行方差分析,对差异达到显著的变量采用新复极差法进行均值的多重比较。
2 结果与分析 2.1 核桃种植园根系土壤中丛枝菌根真菌侵染状况在所采集的核桃根系中均检测到丛枝菌根真菌, 其典型结构见图 1。菌丝、菌丝圈、丛枝和泡囊的侵染率分别为65.68%、23.07%、43.53%和25.31%,总侵染率为75.67%~84.37%之间,平均总侵染率为80.67% (表 1)。表明核桃种植园中的核桃与丛枝菌根真菌之间形成了良好的菌根共生关系,且丛枝菌根真菌侵染普遍存在、侵染率较高。

|
注:A. 100×; B. 1 000×; C. 1 000×; H. 菌丝;V. 泡囊;Ar. 丛枝;HC. 菌丝圈。 Note: A. 100×; B. 1 000×; C. 1 000×; H. hypha; Ar. arbuscule; V. vesicles; HC. hyphal coil. 图 1 10年生核桃根系中丛枝菌根真菌的侵染 Fig. 1 Structures of arbuscular mycorrhizal fungi colonizing the roots of 10-years-old walnut trees. |
| 样本 Sample |
侵染率Colonization/% | 总侵染率 Total colonization/% |
孢子密度 Spore density/(individual·g-1) |
|||
| 菌丝 Hypha |
菌丝圈 Hypha coil |
丛枝 Arbuscule |
泡囊 Vesicle |
|||
| 1 | 54.63 | 32.90 | 51.43 | 20.12 | 81.38 | 26 |
| 2 | 78.40 | 13.47 | 31.34 | 33.85 | 82.17 | 22 |
| 3 | 56.69 | 26.11 | 39.49 | 16.88 | 75.67 | 16 |
| 4 | 70.31 | 15.94 | 43.12 | 45.00 | 84.37 | 24 |
| 5 | 54.60 | 33.23 | 57.27 | 7.41 | 79.65 | 20 |
| 6 | 79.44 | 16.77 | 38.51 | 28.57 | 80.79 | 18 |
| 平均值Average value | 65.68 | 23.07 | 43.53 | 25.31 | 80.67 | 21 |
| 变异系数CV/% | 17.99 | 38.36 | 21.57 | 52.71 | 3.62 | 17.81 |
从10年生核桃根际土壤中共分离到7属16种丛枝菌根真菌孢子,分别为长孢球囊霉(Glomus dolichosporum)、微丛球囊霉(Glomus microaggregatum)、小果球囊霉(Glomus microcarpum)、台湾硬囊霉(Sclerocystis taiwanense)、悬钩子硬囊霉(Sclerocystis rubiformis)、弯丝硬囊霉(Sclerocystis sinuosa)、缩隔球囊霉(Septoglomus constrictum)、褐色斗管囊霉(Funneliformis badium)、异形根孢囊霉(Rhizophagus intraradices)、象牙白多样孢囊霉(Diversispora eburnea) 和4个未鉴定到种的球囊霉属丛枝菌根真菌(Glomus sp.1、Glomus sp.2、Glomus sp.3、Glomus sp.4)、1个未鉴定到种的无梗霉属(Acaulospora sp.1) 以及1个未鉴定到种的盾巨孢囊霉属1种(Scutellospora sp.1), 其相对多度见表 2。6个重复样本平均孢子密度为21个· g-1。其中悬钩子硬囊霉为该核桃种植园的优势种,相对多度达25.39%,其次是微丛球囊霉,为17.65%,第三是球囊霉1种(Glomus sp.3),为16.18%。部分丛枝菌根真菌孢子的显微观察见图 2。
| 丛枝菌根真菌 Arbuscular mycorrhizal fungi |
孢子密度Spore density/(individual·g-1) | 变异系数 CV/% |
相对多度 RA/% |
||||||
| 样本1 Sample 1 |
样本2 Sample 2 |
样本3 Sample 3 |
样本4 Sample 4 |
样本5 Sample 5 |
样本6 Sample 6 |
平均值 Average value |
|||
| 长孢球囊霉Glomus dolichosporum | 1.75 | 2.00 | 1.25 | 1.85 | 0.10 | 0.95 | 1.32 | 54.34 | 6.27 |
| 微丛球囊霉Glomus microaggregatum | 7.60 | 6.80 | 0.45 | 6.90 | 0.20 | 0.30 | 3.71 | 98.07 | 17.65 |
| 小果球囊霉Glomus microcarpum | 3.45 | 1.90 | 0.85 | 2.90 | 4.20 | 0.30 | 2.27 | 67.06 | 10.79 |
| 球囊霉属1种Glomus sp.1 | 3.20 | 2.65 | 2.15 | 3.05 | 1.15 | 3.85 | 2.68 | 35.07 | 12.75 |
| 球囊霉属1种Glomus sp.2 | 0.45 | 0.25 | 0.35 | 0.35 | 0.10 | 0.40 | 0.32 | 39.49 | 1.19 |
| 球囊霉属1种Glomus sp.3 | 1.20 | 1.00 | 5.35 | 1.25 | 6.25 | 5.35 | 3.40 | 73.17 | 16.18 |
| 球囊霉属1种Glomus sp.4 | 0.30 | 0.25 | 0.00 | 0.25 | 0.00 | 0.10 | 0.15 | 89.33 | 0.71 |
| 褐色斗管囊霉Funneliformis badium | 0.00 | 0.00 | 0.15 | 0.05 | 0.00 | 0.05 | 0.04 | 139.75 | 0.20 |
| 缩隔球囊霉Septoglomus constrictum | 0.30 | 0.20 | 0.90 | 0.20 | 0.30 | 0.90 | 0.47 | 72.56 | 2.22 |
| 根内根孢囊霉Rhizophagus intraradices | 0.15 | 0.05 | 0.70 | 0.10 | 0.10 | 2.25 | 0.56 | 154.52 | 2.66 |
| 象牙白多样孢囊霉Diversispora eburnea | 0.40 | 0.35 | 0.00 | 0.30 | 0.65 | 0.30 | 0.33 | 62.51 | 1.59 |
| 悬钩子硬囊霉Sclerocystis rubiformis | 6.65 | 6.40 | 2.60 | 6.45 | 6.55 | 3.35 | 5.33 | 34.57 | 25.39 |
| 弯丝硬囊霉Sclerocystis sinuosa | 0.00 | 0.10 | 0.15 | 0.05 | 0.20 | 0.95 | 0.24 | 161.49 | 1.15 |
| 台湾硬囊霉Sclerocystis taiwanensis | 0.00 | 0.00 | 0.00 | 0.00 | 0.10 | 0.40 | 0.08 | 191.61 | 0.40 |
| 无梗囊霉属1种Acaulospora sp.1 | 0.45 | 0.40 | 0.95 | 0.35 | 0.00 | 0.25 | 0.40 | 78.25 | 1.91 |
| 盾巨孢囊霉属1种Scuteiiospora sp.1 | 0.00 | 0.05 | 0.05 | 0.00 | 0.05 | 0.00 | 0.03 | 108.00 | 0.12 |

|
注:A. 褐色斗管囊霉;B. 微丛球囊霉;C. 小果球囊霉;D. 根内根孢囊霉;E. 悬钩子硬囊霉;F. 弯丝硬囊霉;G. 台湾硬囊霉;H. 缩隔球囊霉。 Note: A. Funneliformis badium; B. Glomus microaggregatum; C. Glomus microcarpum; D. Rhizophagus intraradices; E. Sclerocystis rubiformis; F. Sclerocystis sinuosa; G. Sclerocystis taiwanensis; H. Septoglomus constrictum. 图 2 核桃根际土壤中分离到的部分丛枝菌根真菌 Fig. 2 Arbuscular mycorrhizal fungi spores isolated from the rhizosphere soils of walnut trees and their morphological identification |
由图 3可知,核桃幼苗接种丛枝菌根真菌5个月后,对照处理的核桃幼苗根系中没有检测到丛枝菌根真菌,而接种NAMF和CAMF的处理均不同程度地侵染了核桃幼苗根系,且接种NAMF处理的核桃幼苗根系中丛枝菌根真菌侵染较好,可见典型的丛枝、泡囊、菌丝等结构。
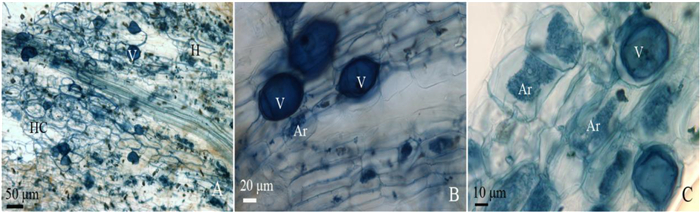
|
注:A. 200×; B. 400×; C. 1 000×; H. 菌丝;Ar. 丛枝;V. 泡囊;HC. 菌丝圈。 Note: A. 200×; B. 400×; C. 1 000×; H. hypha; Ar. arbuscule; V. vesicles; HC. hyphal coil. 图 3 核桃幼苗接种丛枝菌根真菌培养5个月根系中的侵染状况 Fig. 3 Structures of the arbuscular mycorrhizal fungi colonizing the roots of inoculated walnut seedlings |
由表 3可知,接种丛枝菌根真菌显著提高了核桃幼苗丛枝菌根真菌侵染率,不同接种剂处理下丛枝菌根真菌各结构的侵染率不相同。接种NAMF, 核桃幼苗的根系中丛枝菌根真菌的总侵染率最高,为42.03%,菌根侵染后产生大量的菌丝和丛枝,其侵染率分别为38.75%、30.48%,而菌丝圈和泡囊结构相对较少;接种CAMF, 核桃幼苗的根系中丛枝、菌丝、菌丝圈和泡囊4种结构相对较少,总侵染率也较低,仅为2.43%;而对照处理的核桃幼苗根系中丛枝菌根真菌的侵染率为零。方差分析结果表明,接种NAMF核桃幼苗的根系中菌丝、丛枝、泡囊、菌丝圈和总侵染率均极显著高于接种CAMF的,而接种CAMF核桃幼苗中除了总侵染率与对照之间有显著差异外,其它4种结构的侵染率差异不显著,但接种CAMF核桃幼苗根系中4种结构侵染率均高于对照的。由此说明,接种丛枝菌根真菌对核桃根系与丛枝菌根真菌共生关系具有显著的积极作用,而接种NAMF的促进作用极为显著。
| 接种剂 Inoculate |
侵染率Colonization/% | 总侵染率 Total colonization/% |
|||
| 菌丝Hypha | 菌丝圈Hypha coil | 丛枝Arbuscule | 泡囊Vesicle | ||
| 土著丛枝菌根真菌NAMF | 38.75±3.47Aa | 13.64±2.74Aa | 30.48±4.51Aa | 11.99±1.32Aa | 42.03±3.86Aa |
| 商品化丛枝菌根真菌CAMF | 2.49±0.58Bb | 1.44±0.82Bb | 2.75±0.76Bb | 1.04±0.43Bb | 3.02±0.68bb |
| 对照CK | 0Bb | 0Bb | 0Bb | 0Bb | 0Bc |
| 注:同列数据后不同的大写字母表示不同接种剂处理该平均值的多重比较在0. 01的水平上有极显著差异(P<0.01);不同的小写字母表示不同接种剂处理该平均值的多重比较在0. 05的水平上有显著差异(P<0.05)。Note: the different capital letters represent significant differences (P<0.01) among treatments; different lowercase letters represent significant differences (P<0.05) among treatments. | |||||
由表 4可知,核桃幼苗接种丛枝菌根真菌后其生长量均有所提高。接种NAMF, 核桃幼苗的平均地径和株高较对照分别增加了66.59%、26.39%;接种CAMF, 核桃幼苗平均地径和株高较对照分别增加了17.16%、2.16%。多重比较结果表明:接种NAMF,核桃幼苗的地径极显著高于接种CAMF和对照的,苗高显著高于接种CAMF和对照的;接种CAMF,核桃幼苗的苗高和地径值均高于对照的,但两者之间差异不显著。由此可见,丛枝菌根真菌接种处理对核桃幼苗株高和地径生长促进明显,而对地径生长促进极为显著,核桃幼苗根际土壤中NAMF接种效果比CAMF的好。接种丛枝菌根真菌后核桃幼苗的主根长、侧根数、根冠比都有所提高,接种NAMF,苗木侧根数、主根长、根冠比分别较对照的增加了45.45%、24.59%、42.65%;接种CAMF,较对照的分别增加了27.27%、14.05%、10.29%。多重比较结果表明:接种NAMF,核桃幼苗的根冠比显著高于接种CAMF和对照的,而接种CAMF和对照之间差异不显著;接种NAMF,核桃幼苗的主根长和侧根数均极显著高于对照的,而在接种NAMF与CAMF和接种CAMF与对照两两处理之间的主根长和侧根数差异显著。说明接种丛枝菌根真菌对核桃根系生长具有显著的促进作用,而核桃幼苗根际土壤中NAMF接种对根系的促进作用更加明显。
| 接种剂 Inoculate |
苗高 Seedling height/cm |
地径 Basal diameter/mm |
主根长 Length of the main root/cm |
侧根数 Numbers of lateral roots/strip |
根冠比 Root shoot ratio |
| 土著丛枝菌根真菌NAMF | 41.48±6.87Aa | 7.28±1.23Aa | 32.27±4.02Aa | 32±6.2Aa | 0.97±0.17Aa |
| 商品化丛枝菌根真菌CAMF | 33.53±7.15Ab | 5.12±1.01Bb | 29.54±4.49ABab | 28±6.42ABab | 0.75±0.15Ab |
| 对照CK | 32.82±8.34Ab | 4.37±1.05Bb | 25.90±6.67Bb | 22±8.89Bb | 0.68±0.16Ab |
| 注:同列数据后不同的大写字母表示不同接种剂处理该平均值的多重比较在0. 01的水平上有极显著差异(P<0.01);不同的小写字母表示不同接种剂处理该平均值的多重比较在0. 05的水平上有显著差异(P<0.05)。Note: the different capital letters represent significant differences (P<0.01) among treatments; different lowercase letters represent significant differences (P<0.05) among treatments. | |||||
由表 5可知,接种丛枝菌根真菌有效地提高了核桃幼苗生物量的积累。接种NAMF,核桃幼苗地下部分鲜质量和干质量、地上部分鲜质量和干质量、总鲜质量、总干质量分别比对照的提高65.36%、130.88%、104.88%、66.33%、75.33%、104.79%;接种CAMF,核桃幼苗的地下部分鲜质量和干质量、地上部分鲜质量和干质量、总鲜质量、总干质量分别比对照的提高29.90%、18.38%、52.53%、3.57%、36.88%、32.53%。多重比较结果表明:核桃幼苗的总鲜质量在不同接种剂两两处理之间差异达显著水平;接种NAMF,核桃幼苗地上部分和地下部分的干质量、总干质量、根冠比均显著高于接种CAMF和对照的,而接种CAMF和对照之间差异未达到显著水平,但接种CAMF的各指标均高于对照的;核桃幼苗地上和地下部分鲜质量在接种NAMF和对照之间的差异达极显著水平,而两种不同接种剂处理之间以及接种CAMF和对照之间差异不显著。接种丛枝菌根真菌对核桃幼苗生物量的积累有显著的促进作用,且核桃幼苗根际土壤中NAMF的促进作用更加显著。
| 接种剂 Inoculate |
总鲜质量 Total freshweight |
总干质量 Total dry weight |
地上部分Shoot | 地下部分Root | |||
| 鲜质量 Fresh weight |
干质量 Dry weight |
鲜质量 Fresh weight |
干质量 Dry weight |
||||
| 土著丛枝菌根真菌NAMF | 21.11±2.19Aa | 5.98±2.14Aa | 10.92±5.67Aa | 3.26±1.10Aa | 10.12±4.25Aa | 3.14±1.86Aa | |
| 商品化丛枝菌根真菌CAMF | 16.48±1.83Ab | 3.87±1.88ABb | 8.13±3.49ABab | 2.03±1.93Ab | 7.95±2.43ABab | 1.61±0.85Ab | |
| 对照CK | 12.04±2.17Bc | 2.92±1.31Bb | 5.33±2.26Bb | 1.96±0.87Ab | 6.12±2.28Bb | 1.36±0.97Ab | |
| 注:同列数据后不同的大写字母表示不同接种剂处理该平均值的多重比较在0. 01的水平上有极显著差异(P<0.01);不同的小写字母表示不同接种剂处理该平均值的多重比较在0. 05的水平上有显著差异(P<0.05)。Note: the different capital letters represent significant differences (P<0.01) among treatments; different lowercase letters represent significant differences (P<0.05) among treatments. | |||||||
由表 6可知,接种丛枝菌根真菌后,核桃幼苗叶片中净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci) 及水分利用效率(WUE) 各项指标均高于对照的,接种NAMF,核桃幼苗的各项光合参数指标和水分利用效率均高于接种CAMF的。多重比较结果表明:接种NAMF,核桃幼苗的净光合速率和胞间CO2浓度极显著高于接种CAMF和对照的,蒸腾速率、气孔导度和水分利用效率显著高于接种CAMF和对照的,而接种CAMF和对照两处理间的净光合速率、胞间CO2浓度、蒸腾速率、气孔导度和水分利用效率差异不显著,但接种CAMF核桃幼苗的各项光合参数值均高于对照的。表明接种丛枝菌根真菌对核桃幼苗光合作用有明显的促进作用,而核桃幼苗根际土壤中NAMF接种效果较CAMF的好。
| 接种剂 Inoculate |
净光合速率Pn/(μmol·m -2·s -1) | 蒸腾速率Tr/(μmol·m-2·s -1) | 气孔导度Gs/(mol·m-2 ·s -1) | 胞间CO2浓度Ci/(μmol·mol-1) | 水分利用效率WUE/(μmol·mmol-1) |
| 土著丛枝菌根真菌NAMF | 3.997 7±0.476 9Aa | 2.133 2±0.278 4Aa | 0.132 4±0.045 0Aa | 342.023 4±10.126 4Aa | 1.876 3±0.862 1Aa |
| 商品化丛枝菌根真菌CAMF | 3.129 2±0.527 8Bb | 1.891 6±0.182 7Ab | 0.091 6±0.027 6Ab | 315.925 6±13.342 3Bb | 1.687 5±0.633 8Ab |
| 对照CK | 3.062 9±0.312 2Bb | 1.818 8±0.133 2Ab | 0.085 2±0.014 7Ab | 313.360 7±9.206 9Bb | 1.670 0±0.398 6Ab |
| 注:同列数据后不同的大写字母表示不同接种剂处理该平均值的多重比较在0. 01的水平上有极显著差异(P<0.01);不同的小写字母表示不同接种剂处理该平均值的多重比较在0. 05的水平上有显著差异(P<0.05)。Note: the different capital letters represent significant differences (P<0.01) among treatments; different lowercase letters represent significant differences (P<0.05) among treatments. | |||||
由表 7可知,接种丛枝菌根真菌有效地促进了核桃幼苗地上和地下部分营养元素的吸收,但不同的接菌处理,核桃幼苗对养分吸收各不相同。接种NAMF,核桃幼苗地上部分全N、P、K含量分别较对照的增加了12.61%、33.83%、7.31%,地下部分全N、P、K含量分别较对照的增加了14.35%、28.57%、24.36%;接种CAMF,核桃幼苗地上部分全N、P、K含量分别较对照的增加了2.29%、83.46%、4.39%,地下部分全N、P、K含量分别较对照的增加了10.14%、88.33%、22.84%。从总体上看,P含量增加的幅度大于N和K含量的,对地下部分养分吸收提高的幅度大于地上部分的。多重比较结果表明,接种CAMF,核桃幼苗地上和地下部分全P含量均极显著多于接种NAMF的,接种NAMF,核桃幼苗地上和地下部分全P含量极显著多于对照的,说明接菌处理显著地促进了核桃幼苗对P元素的吸收,而接种CAMF对P元素吸收的促进效果更好。接种NAMF和CAMF,核桃幼苗地下部分全N和全K含量均极显著多于对照的,而接种NAMF和CAMF两处理间差异不显著,说明接菌显著地促进了核桃幼苗地下部分N、K元素的吸收,NAMF和CAMF对地下部分N、K元素的吸收促进效果差不多。接种NAMF,核桃幼苗地上部分全N含量显著多于接种CAMF和对照的,而接种CAMF和对照两处理间差异不显著, 说明接种NAMF显著增加了核桃幼苗地上部分N含量,且效果优于接种CAMF的。地上部分全K含量在各处理之间差异不显著,说明接菌处理对核桃幼苗地上部分K含量的促进作用不明显。由此可见,在核桃幼苗期接种丛枝菌根真菌对P和N元素的吸收促进效果远大于K元素的,尤其是对P元素的吸收促进效果最显著。
| 接种剂 Inoculate |
地上部分Shoot | 地下部分Root | |||||
| 全氮含量 Total N content |
全磷含量 Total P content |
全钾含量 Total K content |
全氮含量 Total N content |
全磷含量 Total P content |
全钾含量 Total K content |
||
| 土著丛枝菌根真菌NAMF | 7.86±0.27Aa | 1.78±0.15Bb | 9.54±4.0.67Aa | 13.31±0.38Aa | 1.68±0.74Bb | 16.44±0.84Aa | |
| 商品化丛枝菌根真菌CAMF | 7.14±0.40Ab | 2.44±0.17Aa | 9.28±0.78Aa | 12.82±0.98Aa | 2.26±0.15Aa | 16.24±0.43Aa | |
| 对照CK | 6.98±0.43Ab | 1.33±0.23Cc | 8.89±0.57Aa | 11.64±0.23Bb | 1.20±0.25Cc | 13.22±0.42Bb | |
| 注:同列数据后不同的大写字母表示不同接种剂处理该平均值的多重比较在0. 01的水平上有极显著差异(P<0.01);不同的小写字母表示不同接种剂处理该平均值的多重比较在0. 05的水平上有显著差异(P<0.05)。Note: the different capital letters represent significant differences (P<0.01) among treatments; different lowercase letters represent significant differences (P<0.05) among treatments. | |||||||
本研究选择云南核桃主要种植区(云南省临沧市临翔区核桃种植园) 10年生核桃为研究对象,对核桃根系与丛枝菌根真菌共生状况以及核桃幼苗根际土壤中丛枝菌根真菌群落组成和多样性进行研究。结果发现,10年生核桃根系中丛枝菌根真菌侵染率较高,平均总侵染率达80.67%,根际土壤中丛枝菌根真菌资源丰富,从核桃根际土壤中共分离到7属16种丛枝菌根真菌,其中悬钩子硬囊霉为优势种类,相对多度为25.39%,土壤中丛枝菌根真菌孢子密度大,平均每克风干土中含有21个孢子。这与迪丽努尔等[23]的研究结果不太一致,其研究得出,新疆伊犁地区野核桃根系中丛枝菌根真菌平均侵染率为97.8%,高于本研究的结果,其从野核桃根际土壤中分离到2属6种丛枝菌根真菌孢子,孢子种类和丰富低于本研究。已有研究表明,丛枝菌根真菌侵染和群落组成受土壤条件、环境因子、管理措施、树龄等多种因素影响[24],因此,不同气候、土壤、海拔、树龄、人为干扰等因素对宿主植物根际土壤中丛枝菌根真菌侵染、群落组成和分布均会产生不同程度的影响。故从不同地区采集的核桃根系中丛枝菌根真菌侵染率和根际土壤中丛枝菌根真菌群落组成及多样性存在一定的差异。
丛枝菌根真菌对植物的直接影响是促进植物生长[4]。事实上,丛枝菌根真菌在苗木培育中的接种效应已在很多树种上得到证实,张中峰等[25]研究证明,接种丛枝菌根真菌能够促进茶条木(Delavaya toxocarpa)、降香黄檀(Dalbergia odorifera)、香椿(Toona sinensis)、喜树(Camptothecaa cuminata)和任豆(Zenia insignis) 苗高、地径生长以及养分的吸收,并能显著地提高苗木野外造林成活率及保存率。RAJAN et al[26]研究发现,接种丛枝菌根真菌能提高柚木(Tectona frandis Linn. f.) 苗高和地径生长,增加苗木生物量,促进苗木地上部分的N、P等养分元素的吸收。本试验研究发现,在苗期接种土著丛枝菌根真菌(NAMF)和商品化丛枝菌根真菌(CAMF) 均不同程度地促进了核桃幼苗生长量的分配和生物量的积累,提高了其光合效率,并促进苗木对养分的吸收。与其它研究不同的是,以往研究中所用的接种剂大多是外来菌种而非当地土壤中的土著菌种,本研究采用了从当地核桃园(10 a种植园) 土壤中采集的土著丛枝菌根真菌作为接种菌剂,结果发现土著丛枝菌根真菌对核桃幼苗接种效果优于外来商品丛枝菌根真菌。这与邹慧等[27]、吴伟等[28]在西南桦(Betula alnoides Buch.)、柑橘(Citrus aurantium L.) 等的研究结果一致,他们的研究发现, 与外来商品丛枝菌根真菌相比,接种当地土壤中土著丛枝菌根真菌,促进了幼苗生长量、生物量以及N、P、K养分含量的积累,且接种效果优于外来商品丛枝菌根真菌。究其原因,一方面可能是由于土著丛枝菌根真菌中菌群组成多样性和丰度较高,丰富的丛枝菌根真菌菌群为核桃幼苗与丛枝菌根真菌形成良好的菌根共生关系提供了有利条件,从而促使根系表面发育更多的菌丝体,吸收更大范围的营养和水分供宿主植物吸收利用,而本研究中土著丛枝菌根真菌对核桃幼苗根系生长的促进作用也相应较大,也正说明了这一点。另一方面可能是由于土著丛枝菌根真菌由于长期与核桃生长在生态条件相似的环境中,与核桃形成了较强的亲和力,能更好地适应土壤环境,从而有效地发挥其功能与作用。因此,将其接种于核桃幼苗很快便能与核桃根系形成良好的菌根共生关系,进而促进核桃生长。同时KLIRONOMOS[29]和MIDDLETON et al[30]的研究也表明,接种土著丛枝菌根真菌对宿主植物生长和抗逆性的效果显著优于外来商品丛枝菌根真菌,且土著丛枝菌根真菌较外来商品丛枝菌根真菌对宿主植物的亲和力更强,更能适应本地的宿主植物和环境条件,从而能更有效地发挥其功能和作用。DIAGNE et al[31]的研究也得出,使用外来商品丛枝菌根真菌易引起土壤中其它微生物群落的剧烈变化,不利于土壤生态系统中微生物群落多样性的维持。以上研究都证实了土著丛枝菌根真菌对宿主植物的接种效应优于外来商品丛枝菌根真菌,然而在此之前的研究中,未见将土著丛枝菌根真菌接种于核桃幼苗的相关文献报道,核桃作为我国林产业中十分重要的经济树种,研究土著丛枝菌根真菌在核桃苗木高效培育中的接种效应,对于提高该树种绿色、生态、科学种植技术水平,具有非常重要的意义和价值。
本研究在探明核桃园根际土壤中丛枝菌根真菌群落组成及多样性的基础上,首次将土著丛枝菌根真菌接种于核桃幼苗,并证实了核桃根际土壤中土著丛枝菌根真菌在核桃苗木培育中具有显著的功能与作用。为今后菌根生物技术在核桃的高效培育和科学管理方面提供了重要的理论依据和技术支撑。土著丛枝菌根真菌资源在核桃高效栽培中具有很好的应用前景,因此,在今后核桃苗木培育过程中,在选择丛枝菌根真菌时,尽量考虑使用土著丛枝菌根真菌,筛选出高效的土著丛枝菌根真菌菌株,通过苗期接种使幼苗或幼树尽早形成菌根化,为植物充分发挥菌根生态功能和作用创造有利条件,促进植物从土壤中吸收更多的养分和水分,从而可以有效缩减化肥、农药等化学药品的施用量, 是一项应用效果显著、绿色、生态、友好的生物技术措施。然而本研究仅考虑接种土著丛枝菌根真菌对核桃幼苗生长的促进效果,在后续研究中还需进一步将深入研究土著丛枝菌根真菌对核桃的促生机理以及丛枝菌根真菌在逆境条件下(干旱、严寒) 和重金属污染严重的核桃栽培区具有的潜在作用与功能。
| [1] |
TRESEDER K K, CROSS A. Global distributions of arbuscular mycorrhizal fungi[J]. Ecosystems, 2006, 9(2): 305-316. DOI:10.1007/s10021-005-0110-x |
| [2] |
SMITH S E, READ D J. Mycorrhizal symbiosis[M]. 3rd ed. London: Academic Press, 2008.
|
| [3] |
毛永民, 鹿金颖, 申连英, 等. VA菌根真菌对酸枣实生苗生长和蒸腾作用的影响[J]. 河北农业大学学报, 2000, 23(2): 44-47. DOI:10.3969/j.issn.1000-1573.2000.02.012 |
| [4] |
任强, 杨晓红, 何炜, 等. 丛枝菌根真菌对桑扦插苗生长的影响研究[J]. 西南大学学报(自然科学版), 2008, 30(4): 115-118. |
| [5] |
晏梅静, 补春兰, 黄盖群, 等. 丛枝菌根真菌对桑树(Morus alba) 地上部分的促进作用[J]. 植物生理学报, 2020, 56(12): 2 647-2 654. |
| [6] |
宋福强, 杨国亭, 孟繁荣, 等. 丛枝菌根对大青杨苗木生长的影响[J]. 林业科学研究, 2004, 17(6): 770-776. DOI:10.3321/j.issn:1001-1498.2004.06.014 |
| [7] |
吴强盛, 邹英宁. 柑橘丛枝菌根的研究新进展[J]. 江西农业大学学报, 2014, 36(2): 279-284. |
| [8] |
耿树香, 宁德鲁, 韩明珠, 等. 云南核桃主要栽培品种蛋白质及脂肪酸综合评价分析[J]. 中国油脂, 2019, 44(10): 116-120, 141. |
| [9] |
吴涛, 陈少瑜, 肖良俊, 等. 基于SSR标记的云南省核桃种质资源遗传多样性及核心种质构建[J]. 植物遗传资源学报, 2020, 21(3): 767-774. |
| [10] |
贺娜, 耿树香, 宁德鲁, 等. 云南核桃主栽品种表型特征及主成分分析[J]. 西部林业科学, 2019, 48(5): 101-106. |
| [11] |
BROOKSHIRE B L, GARRETT H E, ROBISON T L. Effects of vesicular-arbuscular mycorrhizae and seed source on nursery-grown black walnut seedlings[C] //Proceedings of the 13th Central Hardwood Forest Conference. Sao Paulo, Minnesota: Department of Agriculture, Forest Service, North Central Research Station, 2003: 468-475.
|
| [12] |
DOLCET-SANJUAN R, CLAVERIA E, CAMPRUBÍ A, et al. Micropropagation of walnut trees (Juglans regia L) and response to arbuscular mycorrhizal inoculation[J]. Agronomie, 1996, 16(10): 639-645. DOI:10.1051/agro:19961008 |
| [13] |
吴强盛, 夏仁学. 果树VA菌根的研究与应用[J]. 植物生理学通讯, 2003, 39(5): 536-540. |
| [14] |
王进. 丛枝菌根真菌对核桃幼苗接种效应研究[D]. 荆州: 长江大学, 2015.
|
| [15] |
高娅, 梁玉, 董智, 等. 盐胁迫下印度梨形孢对核桃幼苗生长的影响[J]. 干旱区资源与环境, 2019, 33(8): 194-198. |
| [16] |
王鹏, 赵军, 李梓勋. 昌宁县核桃产业转型升级发展措施分析[J]. 林业调查规划, 2018, 43(4): 150-153. DOI:10.3969/j.issn.1671-3168.2018.04.033 |
| [17] |
杨亚宁, 巴雷, 白晓楠, 等. 一种改进的丛枝菌根染色方法[J]. 生态学报, 2010, 30(3): 774-779. |
| [18] |
TAN K H. Soil sampling, preparation, and analysis[M]. New York: Marcel Dekker, 1996.
|
| [19] |
SCHENCK N C, PEREZ Y. Manual for the identification of VA mycorrhizal fungi[M]. 2nd ed. Gainesville: INVAM, University of Florida, 1988: 91-97.
|
| [20] |
王幼珊, 刘润进. 球囊菌门丛枝菌根真菌最新分类系统菌种名录[J]. 菌物学报, 2017, 36(7): 820-850. |
| [21] |
邹慧, 王春胜, 曾杰. 土著菌根真菌对西南桦无性系幼苗光合生理的影响[J]. 中南林业科技大学学报, 2019, 39(1): 1-7. |
| [22] |
陈运雷, 罗静, 蔡开朗, 等. 接种丛枝菌根真菌对土沉香和降香黄檀营养元素吸收的影响[J]. 热带作物学报, 2018, 39(12): 2 355-2 362. |
| [23] |
迪丽努尔, 唐明, 王亚军. 新疆伊犁野生植物VA菌根真菌及其生态分布[J]. 西北农林科技大学学报(自然科学版), 2006, 34(6): 96-100. DOI:10.3321/j.issn:1671-9387.2006.06.020 |
| [24] |
XIANG D, VERESOGLOU S D, RILLIG M C, et al. Relative importance of individual climatic drivers shaping arbuscular mycorrhizal fungal communities[J]. Microbial Ecology, 2016, 72(2): 418-427. DOI:10.1007/s00248-016-0773-1 |
| [25] |
张中峰, 张金池, 周龙武, 等. 丛枝菌根真菌对石漠化地区造林苗木生长的影响[J]. 生态学杂志, 2018, 37(10): 2 927-2 934. |
| [26] |
RAJAN S K, REDDY B J D, BAGYARAJ D J. Screening of arbuscular mycorrhizal fungi for their symbiotic efficiency with Tectona grandis[J]. Forest Ecology and Management, 2000, 126(2): 91-95. DOI:10.1016/S0378-1127(99)00089-4 |
| [27] |
邹慧, 曾杰. 土著菌根真菌侵染对西南桦无性系幼苗生长和叶片养分的影响[J]. 分子植物育种, 2018, 16(19): 6 494-6 503. |
| [28] |
吴伟, 周杨, 陈杰忠, 等. 柑橘园土壤中丛枝菌根真菌土著菌株的促生效应研究[J]. 亚热带植物科学, 2018, 47(4): 327-332. DOI:10.3969/j.issn.1009-7791.2018.04.005 |
| [29] |
KLIRONOMOS J N. Variation in plant response to native and exotic arbuscular mycorrhizal fungi[J]. Ecology, 2003, 84(9): 2 292-2 301. DOI:10.1890/02-0413 |
| [30] |
MIDDLETON E L, RICHARDSON S, KOZIOL L, et al. Locally adapted arbuscular mycorrhizal fungi improve vigor and resistance to herbivory of native prairie plant species[J]. Ecosphere, 2015, 6(12): 1-16. |
| [31] |
DIAGNE N, BAUDOIN E, SVISTOONOFF S, et al. Effect of native and allochthonous arbuscular mycorrhizal fungi on Casuarina equisetifolia growth and its root bacterial community[J]. Arid Land Research and Management, 2018, 32(2): 212-228. DOI:10.1080/15324982.2017.1406413 |

 2022, Vol. 42
2022, Vol. 42


