文章信息
- 韩森汇, 丁奕, 陈全助, 邹华南, 陈清根, 宋漳
- HAN Senhui, DING Yi, CHEN Quanzhu, ZOU Huanan, CHEN Qinggen, SONG Zhang
- 鄂西红豆枝干枯萎病病原菌分离与鉴定
- Isolation and identification of the pathogen causing Ormosia hosiei branch blight
- 森林与环境学报,2021, 41(5): 554-560.
- Journal of Forest and Environment,2021, 41(5): 554-560.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.05.014
-
文章历史
- 收稿日期: 2021-06-09
- 修回日期: 2021-07-11
2. 福建农林大学金山学院, 福建 福州 350002;
3. 华安县林业局, 福建 华安 363800;
4. 福建省华安金山国有林场, 福建 华安 363800
2. Jinshan College, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China;
3. Forestry Bureau of Hua'an, Hua'an, Fujian 363800, China;
4. Hua'an Jinshan State Forest Farm of Fujian, Hua'an, Fujian 363800, China
鄂西红豆树(Ormosia hosiei Hemsl.et Wils.)别名红豆树、何氏红豆等,为我国南方特有原生品种,国家Ⅱ级重点保护植物。鄂西红豆属蝶形花科红豆属、常绿落叶阔叶乔木,树冠葱郁、高大挺拔,胸径可达1 m[1]。红豆树树形美观,木材坚硬厚重,既可制作高档家具及用于雕刻,又可作行道树和庭园荫树等。鄂西红豆种子鲜红、圆润有光泽,常用于做手链等装饰品。其种子中含有丰富的蛋白质、多糖、苷类、类黄酮和有机酸等物质,种子和根均可入药[2-3]。福建南平市、三明市、漳州市、宁德市等地均有种植,一般散生在海拔500 m以下的山坡、山谷林内[4-6]。近年来,福建省华安县境内多处苗圃地上培育的鄂西红豆苗木发生枝干枯萎,严重时引起苗木大量枯死,对当地林业造成了严重的经济损失,因此,迫切需要探清鄂西红豆枝干枯萎病发病原因。本研究从福建省华安县鄂西红豆枝干枯萎病重病区采集获得的枯萎病样本,通过分离、纯化和致病性试验,结合病原菌形态学特征和分子学鉴定,确定鄂西红豆枝干枯萎病的病原,为该病害的防治提供理论基础。
1 材料与方法 1.1 试验材料2019年4—6月,从福建省华安县沙建镇(117°34′19.55″E,24°45′16.79″N,海拔164.9 m)鄂西红豆苗木种植区采集发病样品。种植区内主要为3~4年生鄂西红豆苗木,共收集80份样品。
1.2 病原菌分离与纯化采用常见的病组织分离法[7]。取病健交接处的枝干表皮,用剪刀将其剪成5 mm×5 mm的小块,先用体积分数75%酒精浸泡30 s,然后再用质量分数0.1%次氯酸钠浸泡1 min,无菌水漂洗3遍,放置在滤纸上吸干水分,将组织块呈梅花状置于之前准备好的PDA平板上。25 ℃恒温环境下黑暗培养。待小块周围长出菌丝后,挑取菌丝至新的PDA平板中纯化培养,观察菌落的颜色、形态特征,逐一进行编号。将分离到的菌株先用无菌水洗脱成孢子悬浮液,再用无菌水稀释到在显微镜下每视野只观察到1~2个孢子为止,吸取50 μL孢子悬浮液用涂布棒均匀涂抹于PDA平板上,25 ℃恒温培养2 d后,挑取单菌落至PDA斜面上,25 ℃恒温培养至菌丝覆盖斜面,4 ℃冰箱中保存。
1.3 致病性测定致病性测定采用活体刀割有伤接种法。将已分离的纯净的菌株转移至PDA平板上,置于25 ℃暗培养10 d后,用无菌水稀释配置成1×106个·mL-1的孢子悬浮液。挑选苗圃内培育的健壮2年生实生盆栽苗进行回接,用酒精棉擦净枝干表面,做针刺有伤处理,将脱脂棉吸取孢子悬浮液贴于伤口处,医用胶带呈漏斗式缠绕固定,套袋保湿48 h。每个菌株接种5棵健康苗木,每棵苗木准备3个接种位置。以无菌水接种为对照,置于25 ℃温室中保湿培养30 d,逐日观察记录。等出现症状后从病斑处再次取样再分离。
1.4 病原菌形态学鉴定将病原菌在PDA培养基上纯化培养,25 ℃恒温培养,每天观察记录菌株逐渐变化的菌落直径,计算菌落生长速度。观察培养皿内菌丝形态,菌落颜色、质地、有无分泌物及气味等[8]。待菌落产生孢子后,将已经培养好的病原菌用灭菌的挑针挑取少许菌丝,置于滴有水滴的载玻片上,观察显微镜中菌丝体的形态结构,孢子的着生方式及形态,有无小孢子和厚垣孢子(测量记录孢子的大小、隔数),观察产孢细胞和产孢结构的形态。综合菌落形态特征及显微观察,参考BOOTH[9]的分类系统及《常见镰刀菌鉴定指南》[10]对分离后得到的病原菌进行形态学鉴定。
1.5 病原菌分子鉴定采用CTAB法[11],提取病原菌DNA。接着用RPB1和RPB2通用引物[12]对病原菌代表菌株HA-1进行PCR扩增,引物合成及测序由擎科生物科技有限公司完成。将测序所得序列上传至NCBI数据库(http://www.ncbi.nlm.gov)。联合RPB1与RPB2序列在Fusarium-MLST(https://fusarium.mycobank.org/)数据库中进行比对,根据比对结果选取所属Species-Complex的RPB1与RPB2基因序列联合构建系统发育树,以F. buharicum NRRL 25488为外群,MEGA 7.0软件MUSCLE比对后通过Sequence Matrix软件[13]对RPB1和RPB2序列进行串联。将RPB1与RPB2序列接着用MEGA 7.0软件构建系统进化树,建树方法为Maximum-likelihood法,bootstrap值为1 000。
2 结果与分析 2.1 病害症状对福建省华安县培育鄂西红豆苗木的几个苗圃地调查发现,鄂西红豆枝干枯萎病主要发生在苗木上,成年树上偶有轻微发生。病害从4月初开始发生,最初在枝干上(尤其在枝丫处)出现缢缩性病斑,棕褐色,有水渍溢出,病斑部位稍肿胀。病斑处初有少许粉白色至粉红色菌丝生成,植株无明显萎蔫现象。4月中下旬持续下雨天气病情发生严重,受害枝干布满橘黄色至橘红色菌丝,有潮湿感,环绕整个枝干部位,后期发黑干枯稍凹陷,连年受害枝干发黑腐烂枯死,严重时整株枯萎(图 1)。5月底6月初,当雨水少、湿度低、温度高时,病情停止发展。

|
注:A~B.茎部症状;C.枝干基部症状;D.田间枯死苗。 Note: A and B. Stem symptoms; C. Branch base symptoms; D. Dead seedling in the field. 图 1 鄂西红豆枝干枯萎病症状 Fig. 1 Symptoms of branch blight in O. hosiei |
从表 1可知,在种植区共随机调查80株鄂西红豆树,其中有18株健康,62株发病;病株中3株病斑面积占总枝干面积的1/4;2株病斑几乎包满枝干;57株病斑占枝干面积1/4~3/4。鄂西红豆枝干枯萎病病株率达77.50%,病情指数48.44。
| 调查株数Investigation number | 分级级数Graded series | 病株数Number of sick plants | 病株率Incidence/% | 病情指数Disease index |
| 0 | 18 | |||
| 1 | 3 | |||
| 80 | 2 | 27 | 77.50 | 48.44 |
| 3 | 30 | |||
| 4 | 2 |
通过组织分离法共分离和纯化出23株菌株,依据各菌株菌落生长特征、外表形态及显微镜下分生结构形态等进行对比和分类,最终归为6类菌株(图 2):HA-1、HA-3、HA-5、HA-7、HA-16和HA-18,分离率分别为100%、45%、54%、60%、62%和70%。
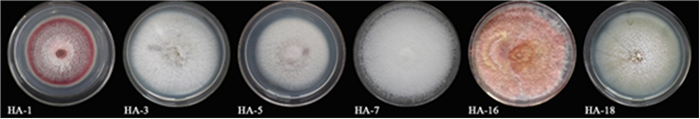
|
图 2 分离株菌落特征 Fig. 2 Colony morphology of isolates obtained and purified from branch blight samples |
采取在活的植株上接种的方式来检测分离到的6类菌株致病性。结果表明,只有接种HA-1能引起枝干枯萎病症状,且与田间发病时的症状相似。HA-1菌株引起的枝干枯萎病症状如图 3所示,接种7 d后伤口处有白色菌丝长出,病斑最初褐色,后期干枯凹陷,接种30 d后整株枯死。将以无菌水接种为对照的对照组与处理组进行横切和纵切处理,发现处理组枝干枯死,呈褐色,枝干中空。接种后的症状与自然发病一致。用组织分离法对发病枝干进行再分离,再分离菌株的菌落形态,分生孢子形态与接种的原始分离物一致,表明HA-1菌株为致病菌。

|
注:A.接种30 d后健康苗(左)和枯死苗(右);B.健康枝条与发病枝条对比图;C.发病部位细节图;D.对照枝干横切面;E.发病枝干横切面;F.对照枝干纵切面;G.发病枝干纵切面。 Note: A. Healthy seeding and dead seedling after 30 days after inoculation; B. Photo highlighting the contrast of healthy branch and diseased branches; C. Magnified image of a site of disease; D. Cross section of a control branch; E. Cross section of a diseased branch; F. Longitudinal section of a control branch; G. Longitudinal section of a diseased branch. 图 3 致病力测定 Fig. 3 Pathogenicity test results |
病原菌HA-1菌株在PDA培养基上25 ℃黑暗培养4 d后菌落平均直径3.03 cm,培养14 d菌落铺满培养皿,病原菌生长速度为0.65 cm·d-1。气生菌丝丛卷毛状,白至玫瑰粉,也可呈红棕色,菌落产生玫瑰红色色素(图 4A),无气味产生。菌落后期产生桔黄色分生孢子座(图 4B),大型分生孢子聚集在分生孢子座上(图 4C)。菌丝无色,壁薄,未观察到厚垣孢子。产孢细胞为单瓶梗(图 4D)。分生孢子形成丰富,培养过程中仅仅发现大型分生孢子,未见小型分生孢子。大型分生孢子细胞壁薄且形态多样,有形状比较宽、两端比较钝的马特型(图 4E);有形状比较细、向两端慢慢缩小、孢子比较匀称的美丽型(图 4F~I);有中部直宽、两端渐尖的纺锤形(图 4J)。顶部细胞大部分较钝,少部分鸟嘴形。基部脚胞有的有足跟,有的无足跟。分生孢子大多3~6隔,鲜少观察到7~8隔,有的分隔不清楚。孢子长宽如下:3个分隔的分生孢大小为(23.90~35.51) μm×(2.92~5.62) μm,4个分隔的分生孢子大小为(29.54~ 47.37) μm×(4.51~ 5.92) μm,5个分隔的分生孢子大小为(35.8~51.29) μm×(4.12~6.19) μm,6个分隔的分生孢子大小为(41.20~53.85) μm×(4.07~6.48) μm,7个分隔的分生孢子大小为(4.88~61.12) μm×(4.20~7.03) μm,8个分隔的分生孢子大小为7.98 μm×5.24 μm。根据形态学特性,HA-1初步鉴定为镰刀菌。
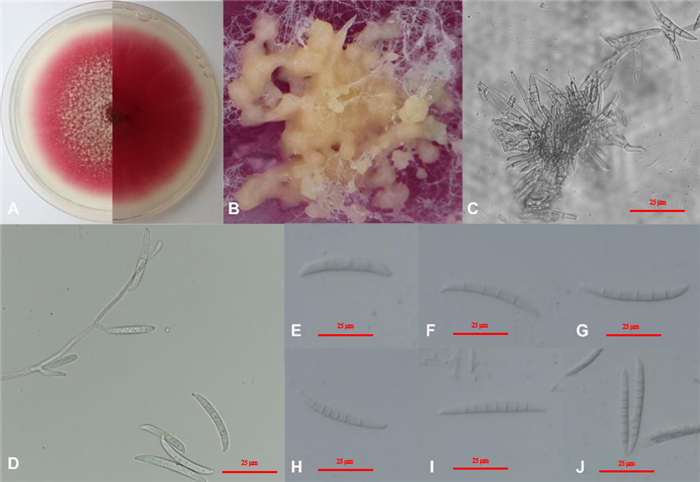
|
注:A为病原菌菌落正反面;B为桔黄色分生孢子座;C为分生孢子座;D为分生孢子梗及分生孢子;E~J为3~8隔分生孢子。 Note: A. Views from above and below a colony; B. Orange sporodochia; C. Sporodochia; D. Conidiophore and macroconidia; E-J. 3-8 septa macroconidia. 图 4 HA-1菌株形态学特征 Fig. 4 Pathogen morphology |
通过NCBI在线BLAST对HA-1的ITS序列进行比对,结果显示,HA-1的ITS序列与F. lateritium isolate T59(FJ459977.1)的一致性(identities)为98.39%。为验证其准确性,从NCBI上下载不同种镰刀菌的ITS序列并构建进化树,结果如图 5所示。HA-1与所有6种砖红镰刀菌(F. lateritium)聚集在同一分支上。因此,将HA-1初步鉴定为砖红镰刀菌。但通过与相关文献[9]比较发现,HA-1的形态学特性与砖红镰刀菌并不完全一致。
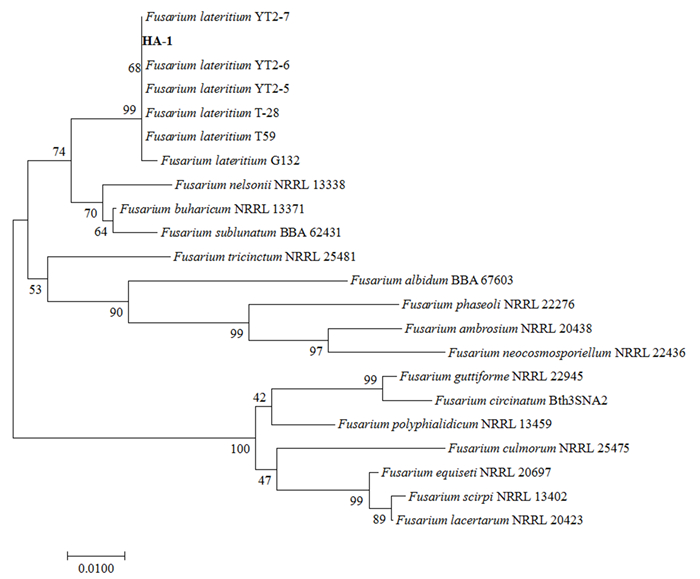
|
图 5 基于ITS序列和邻接法构建系统进化树 Fig. 5 Phylogenetic tree constructed using neighbor-joining analysis of ITS gene sequences obtained from HA-1 isolates |
为准确地鉴定HA-1,选取RNA聚合酶最大亚基RPB1基因和RNA聚合酶第二大亚基RPB2基因对其进行更为准确的鉴定。使用RPB1基因和RPB2基因通用引物进行PCR扩增,纯化测序后得到的序列长度分别为1 809和1 970 bp。将上述序列提交到GenBank获得登录号分别为MT526787、MT526788。将RPB1与RPB2提交至Fusarium-MLST联合比对,结果显示,HA-1属于F. lateritium-Complex。为更为准确地鉴定HA-1,进一步对F. lateritium-Complex的RPB1和RPB2序列进行联合建树(图 6),结果显示,HA-1菌株与束梗镰刀菌(F. stilboides NRRL20429)聚在同一分支上,说明其遗传距离更为接近,最终结合形态学特征确定HA-1菌株为束梗镰刀菌(Fusarium stilboides Wollenw.)。
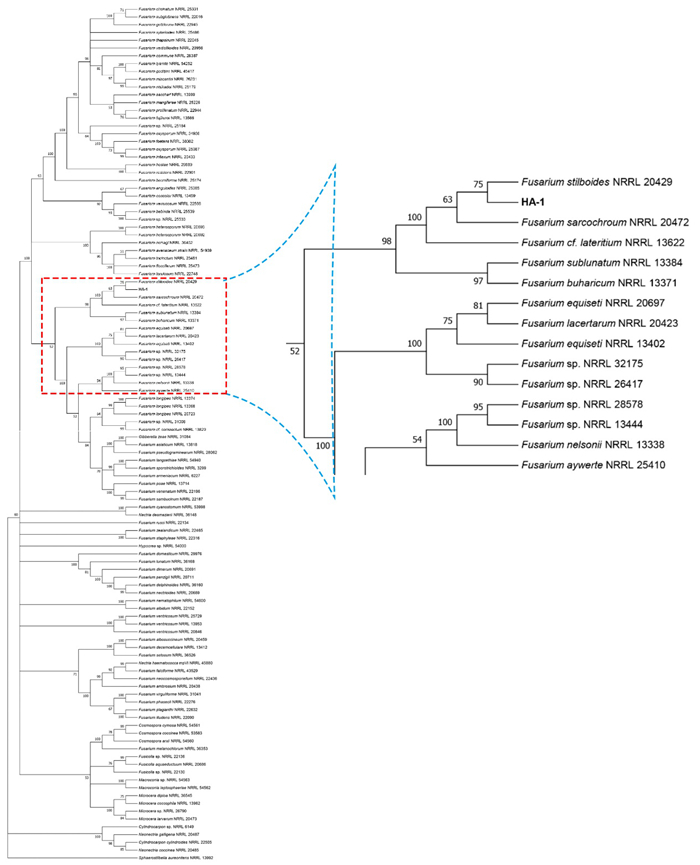
|
图 6 RPB1、RPB2系统进化树 Fig. 6 Phylogenetic tree based on combined RPB1 and RPB2 sequences of selected HA-1 strain |
对鄂西红豆枝干枯萎病病害样品进行采集、分离和纯化,共分离出HA-1、HA-3、HA-5、HA-7、HA-16和HA-18等6类菌株。经柯赫氏法则验证,HA-1具有致病性,确定为鄂西红豆枝干枯萎病病原菌。HA-1接种7 d后伤口处有白色菌丝长出,病斑最初褐色,后期干枯凹陷,30 d时观察到整株枯死,病死枝干有中空现象,与镰状镰刀菌(F. fusarioides)等引起的枝干枯萎病的症状相符合[14]。束梗镰刀菌侵染小麦果实引起它的腐烂病[15],束梗镰刀菌侵染竹基布引起刚竹紫斑病也均有报道[16]。在东南亚热带地区,束梗镰刀菌引起了咖啡树和柑橘果实病害,本研究结果扩大了这一菌种的地理分布和寄主植物的范围。林木枝干枯萎病大多发生在坚果[17]、沙棘[18]、油橄榄[14]、核桃[19]等树种上。引起枝干枯萎病的病原及寄主多种多样,如由韦斯梅拟盘多毛孢菌(Pestalotiopsis vismiae)引起的蓝莓枝干枯萎病[20]、由间座壳属真菌(Diaporthe nobilis)引起的梨树枝干枯萎病[21]、由细交链孢霉(Alternaria tenuis Nees)引起的丁香枝干枯萎病[22]、由核桃黑盘孢引起的核桃枝干枯萎病[23]、由镰状镰刀菌引起的油橄榄枝干枯萎病[14]等。镰刀菌广泛分布于世界各地,空气、土壤、植物、动物等生物体中均发现镰刀菌的存在,能够侵染超过百余种寄主植物,在灯笼椒[24]、咖啡[25]和向日葵[26]上也可引起病害,镰刀菌在侵染不同的植物过程中,会导致叶片萎缩、植株枯死、根腐、茎基腐、穗腐或果腐等危害,导致作物和林木产量和质量降低,直接造成巨大的经济和生态损失。
鄂西红豆枝干枯萎病病原菌HA-1菌株在PDA平板上25 ℃黑暗培养4 d后菌落平均直径3.03 cm,培养14 d菌落铺满培养皿;气生菌丝丛卷毛状,白色渐变至粉色,也可能呈红棕色,菌丝代谢产生深红色色素;大型分生孢子3~8隔,大多3~6隔,鲜少观察到7~8隔;大型分生孢子形态多样,有马特型、圆筒形、美丽型和纺锤形等;未观察到小型分生孢子和厚垣孢子。相比较与砖红镰刀菌的气丝菌丝稀疏,起初无色又变为砖红色,菌落中央产生橙色红色黏孢子团,分生孢子以5个隔膜最多。在PDA培养基上,气生菌丝为绒状,白色或粉色。许多分生孢子为镰刀形,稍弯曲,小型分生孢子为卵圆形。从形态学上来讲本研究的致病菌与其并不相同,本研究中形态学特征与王拱辰等[10]的《常见镰刀菌鉴定指南》、BOOTH[9]的《镰刀菌属》中对束梗镰刀菌的描述相似。进一步对病原菌进行鉴定,用镰刀菌RPB1、RPB2特异性引物对HA-1进行分子生物学鉴定,经序列串联比对及构建系统进化树后发现,HA-1与束梗镰刀菌聚集在同一分支上。综合形态学及分子鉴定结果表明,鄂西红豆枝干枯萎病病原菌为束梗镰刀菌。此外,由束梗镰刀菌引起的鄂西红豆枝干枯萎病尚属首次发现,本研究的开展可为后续鄂西红豆枝干枯萎病的综合防治奠定基础。
| [1] |
何官榕, 张文春, 何碧珠, 等. 鄂西红豆树种子的无菌萌发[J]. 福建农林大学学报(自然科学版), 2017, 46(6): 623-629. |
| [2] |
郑天汉, 汤文彪, 陈清根, 等. 红豆树开花结实规律及种子发芽试验[J]. 林业工程学报, 2006, 20(6): 38-41. |
| [3] |
POUNY I, BATUT M, VENDIER L, et al. Cytisine-like alkaloids from Ormosia hosiei Hemsl. & E.H. Wilson[J]. Phytochemistry, 2014, 107: 97-101. DOI:10.1016/j.phytochem.2014.07.022 |
| [4] |
汤良智. 鄂西红豆树育苗技术及苗高生长规律研究[J]. 福建林业科技, 2013, 40(3): 128-130. DOI:10.3969/j.issn.1002-7351.2013.03.29 |
| [5] |
曾喜荣. 华安县鄂西红豆病虫害调查及其综合治理技术[J]. 林业勘察设计, 2018, 38(3): 14-17. |
| [6] |
杨汉唐. 福建清流鄂西红豆人工林群落调查与物种多样性初步研究[J]. 绿色科技, 2014(9): 75-77. DOI:10.3969/j.issn.1674-9944.2014.09.035 |
| [7] |
方中达. 植病研究方法[M]. 北京: 农业出版社, 1998: 94-98.
|
| [8] |
马迪. 园林植物国槐溃疡病致病真菌的生物学特性和致病酶活性的研究[D]. 聊城: 聊城大学, 2018: 23.
|
| [9] |
BOOTH C. 镰刀菌属[M]. 陈其英, 译. 北京: 农业出版社, 1998: 83-93.
|
| [10] |
王拱辰, 郑重. 常见镰刀菌鉴定指南[M]. 北京: 中国农业出版社, 1996.
|
| [11] |
易润华, 朱西儒, 周而勋. 简化CTAB法快速微量提取丝状真菌DNA[J]. 广东海洋大学学报, 2003, 23(6): 72-73. DOI:10.3969/j.issn.1673-9159.2003.06.015 |
| [12] |
O'DONNELL K, ROONEY A P, PROCTOR R H, et al. Phylogenetic analyses of RPB1 and RPB2 support a middle Cretaceous origin for a clade comprising all agriculturally and medically important fusaria[J]. Fungal Genetics and Biology, 2013, 52: 20-31. DOI:10.1016/j.fgb.2012.12.004 |
| [13] |
VAIDYA G, LOHMAN D J, MEIER R. Sequence matrix: concatenation software for the fast assembly of multi-gene datasets with character set and codon information[J]. Cladistics, 2011, 27(2): 171-180. DOI:10.1111/j.1096-0031.2010.00329.x |
| [14] |
张知晓, 季梅, 刘凌, 等. 云南永仁油橄榄病害种类调查及其病原鉴定[J]. 西部林业科学, 2018, 47(5): 75-79. |
| [15] |
胡亚娟, 贺运春, 郭明霞. 山西晋中地区植物病原镰刀菌(Fusarium)种类鉴定[J]. 山西农业大学学报(自然科学版), 2007, 27(3): 276-280. DOI:10.3969/j.issn.1671-8151.2007.03.014 |
| [16] |
陈鸿逵, 王拱辰, 陈继团, 等. 竹类镰刀菌及束梗镰孢与刚竹紫斑病的关系[J]. 竹子研究汇刊, 1989, 8(4): 58-64. |
| [17] |
周芳. 广西澳洲坚果主要虫害及病害防治措施[J]. 农业与技术, 2019, 39(1): 135-136. |
| [18] |
马远超. 不同化学药剂防治沙棘枝枯病效果研究[J]. 防护林科技, 2018, 181(10): 55-57. |
| [19] |
李敏霞. 丹凤县核桃主要病害的发生和防治[J]. 现代园艺, 2018(17): 159. |
| [20] |
曾尔玲, 任春光, 桑维钧, 等. 蓝莓枝枯病病原菌生物学特性及室内药剂筛选[J]. 江苏农业科学, 2018, 46(12): 79-82. |
| [21] |
徐成楠, 迟福梅, 冀志蕊, 等. 辽宁梨树间座壳菌枝枯病的病原鉴定[J]. 植物病理学报, 2018, 48(5): 577-581. |
| [22] |
杨小萌. 丁香枝枯病病原菌的分离和测定[J]. 山西林业科技, 2018, 47(2): 28-30. DOI:10.3969/j.issn.1007-726X.2018.02.011 |
| [23] |
庞跃刚, 李柳青. 核桃根腐病和枝枯病的发生与防治[J]. 现代农村科技, 2018(2): 36. DOI:10.3969/j.issn.1674-5329.2018.02.034 |
| [24] |
SANDOVAL-CHAVEZ R A, MARTINEZ-PENICHE R L, HERNANDEZ-ITURRIAGA M, et al. Postharvest biological and chemical control of Fusarium stilboides on bell pepper (Capsicum annuum L.)[J]. Revista Chapingo Serie Horticultura, 2011, 17(2): 161-172. |
| [25] |
SERANI S, TALIGOOLA H K, HAKIZA G J. An investigation into Fusarium spp. associated with coffee and banana plants as potential pathogens of robusta coffee[J]. African Journal of Ecology, 2007, 45: 91-95. DOI:10.1111/j.1365-2028.2007.00744.x |
| [26] |
高婧. 向日葵枯萎病菌的分离鉴定, 致病力分化以及侵染过程的研究[D]. 呼和浩特: 内蒙古农业大学, 2016: 42.
|

 2021, Vol. 41
2021, Vol. 41


