文章信息
- 马淑敏, 法蕾, 王海霞, 裴顺祥, 吴迪, 辛学兵
- MA Shumin, FA Lei, WANG Haixia, PEI Shunxiang, WU Di, XIN Xuebing
- 北京九龙山林下真菌对凋落叶分解及养分释放的影响
- Effect of understory fungi on decomposition and nutrient release from litter in Beijing Jiulong Mountain
- 森林与环境学报,2021, 41(5): 510-518.
- Journal of Forest and Environment,2021, 41(5): 510-518.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.05.009
-
文章历史
- 收稿日期: 2021-06-08
- 修回日期: 2021-08-19
森林凋落物是森林生态系统的重要组成部分,林下凋落物分解是森林生态系统养分循环的重要生态过程,分解释放的养分可提供给植物根系吸收利用[1-3]。凋落物分解速率受内在因素即凋落物质量影响较大,研究表明,凋落物氮含量、木质素含量、C/N等直接影响凋落物分解速率[4-5],凋落物分解前期,主要受N制约其分解速率,初始N含量越高,分解越快,凋落物分解后期则主要受木质素含量限制[6]。环境和生物也是凋落物分解的重要影响因素,生物作用尤其微生物作用对凋落物是否能够彻底分解起决定性作用[7],目前真菌(主要是丝状真菌)被认为是森林凋落物的主要分解者,在森林生态系统物质循环及养分循环过程中具有至关重要的作用[8-9]。真菌的菌丝能够进入凋落物组织内部并分泌多种降解酶,能够将难分解的有机物转化为易分解的无机物,如真菌分泌的漆酶能够降解凋落物中难分解的木质素,从而改变凋落物化学结构并软化凋落物组织,使凋落物更容易分解转化。凋落物的快速分解也可以减少森林地表可燃物积累,对预防森林火灾有重要作用[10]。
森林凋落物的分解与养分释放是森林生态研究中的热点[11-13],微生物在凋落物分解过程中的作用已引起国内外学者的关注[14-17],但是目前国内对凋落物类型和微生物如何共同作用影响凋落物分解的研究相对较少。华北石质山区气候干燥少雨,土层瘠薄,林下凋落物分解缓慢,凋落物的堆积易引发森林火灾,造成严重损失。为选择适宜华北石质山区林下环境的分解真菌,在北京九龙山选取针叶、阔叶、针阔混合3种不同林型试验地,调查采集凋落物层真菌,在实验室分离培养后优选长势良好的菌株反接至不同类型凋落物进行分解模拟试验,研究所选真菌对不同类型凋落物的分解促进作用,同时研究凋落物分解过程中的养分及性质变化情况,分析不同分解阶段凋落物的残留率,为华北石质山区的土壤养分归还及森林火灾的预防提供一定的理论基础。
1 材料与方法 1.1 试验地概况试验地位于北京市京西西郊的九龙山森林保护区(115°59′~116°06′E,39°54′~39°57′N),此地夏季炎热多雨,秋冬季寒冷干燥,每年的6—9月为降水季节,每年干旱时长5~6个月,属暖温带大陆东岸半湿润季风气候。九龙山森林保护区植被主要包括油松针叶林、栎属阔叶林、针阔混交林等人工林,及天然次生灌丛林等。
1.2 试验设计和样品处理2018年5月,在九龙山油松林下、栓皮栎林下及两者混交林下分别设置样地,并在各样地内随机设置5个1 m×1 m的样方,收集自然凋落叶带回实验室,除杂后70 ℃下烘干至恒重,分别称取针叶8 g、阔叶8 g、针阔混合8 g(针叶和阔叶各4 g)装入玻璃广口瓶,灭菌后备用。
在林下枯枝落叶层采集真菌,室内分离培养后,选取3个菌种作为供试菌株,杯伞(Clitocybe)、光柄菇(Pluteus)和环炳菇(Lepiota)(分别用F1、F2、F3表示),取约1 cm×1 cm的菌丝接入100 mL无菌液体培养基中培养,获得真菌悬液,同时设对照组CK,为未接入菌剂的无菌液体培养基。3种凋落叶样品中分别接入约40 mL的3种菌液和CK,透气膜包扎封口,置于培养室(保持室内温度25 ℃、湿度50%~60%、自然光), 整个试验持续21个月,每3个月取样一次,并补充1次无菌液体培养基(30 mL),整个试验共取样7次,不同处理间设3个重复,制备样品252瓶。
将烘干后的凋落叶样品进行粉碎,过0.15 mm筛,测定凋落叶初始及每次取样后凋落叶的C、N、P、K等养分含量。全C含量用浓硫酸-重铬酸钾法测定;全N含量用凯氏定氮法测定;全P含量用钼锑抗比色法测定;全K含量用火焰光度计法测定。
1.3 数据分析采用Olson指数衰减模型拟合凋落叶分解速率,数据采用SPSS 16.0、Excel进行统计与分析,用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)比较3种类型凋落叶在4种处理下的失重率[18]。
| $凋落叶分解指数模型为:y = a{{\rm{e}}^{ - Kt}} $ | (1) |
| $完全分解时间(95\% 分解)计算式为:{t_{0.95}} = \frac{{\ln 0.05}}{{ - K}} $ | (2) |
式中:y为凋落叶的月残留率(%);a为拟合参数;e为自然对数底;t为分解时间(月);K为凋落叶的分解系数(g·g-1)。
| $凋落叶质量损失率: {L_t}/\% = ({M_0} - {M_t})/{M_0} \times 100 $ | (3) |
| $凋落叶质量剩余率:{M_{\rm{R}}}/\% = {M_t}/{M_0} \times 100 $ | (4) |
| $凋落叶养分元素剩余率:{N_{\rm{R}}}/\% = {N_t}{M_t}/({N_0}{M_0}) \times 100 $ | (5) |
式中:M0与Mt分别为初始与时间t的凋落物叶质量(g),N0与Nt分别为初始与时间t的凋落叶养分元素含量(mg·g-1)。
2 结果与分析 2.1 凋落物分解状态不同类型凋落物在不同菌种处理下,置于培养室内进行分解试验,凋落物分解前、分解中及分解后状态如图 1所示。

|
图 1 凋落物分解状态 Fig. 1 Litter decomposition state |
3种凋落叶初始化学组成如表 1所示。针叶与阔叶的各个组分均有显著差异,阔叶中的N、K含量显著高于针叶,其他组分均显著低于针叶,针阔混合凋落叶的组分介于针叶和阔叶之间。
| 凋落叶类型 Litter type |
C含量 C content/(mg·g-1) |
N含量 N content/(mg·g-1) |
P含量 P content/(mg·g-1) |
K含量 K content/(mg·g-1) |
C/N |
| 针叶Coniferous leaf | 604.51±6.58c | 8.81±0.23a | 0.51±0.01c | 1.88±0.29a | 68.79±1.06c |
| 阔叶Broad leaf | 513.22±6.07a | 12.50±0.35c | 0.32±0.02a | 2.54±0.57b | 40.70±0.67a |
| 混合叶Mixed leaf | 558.70±2.54b | 10.71±0.16b | 0.41±0.02b | 2.21±0.25a | 52.31±0.52b |
| 注:同列不同小写字母表示凋落物初始养分含量在不同类型凋落物间差异显著(P<0.05)。Note:different lowercase letters in the same column indicate significant differences in litter initial nutrient content between different types of litter(P<0.05). | |||||
对不同处理的3种类型凋落叶失重率进行分析,结果显示,不同菌种处理、不同类型凋落叶的失重率有所差异。由图 2(a)可知,针叶凋落物分解到6个月后,3种真菌处理的凋落叶失重率均显著高于对照组(P<0.05),经过21个月的分解,对照组的失重率不到15%,而真菌处理的失重率则达到26%~37%,显著高于CK(P<0.05),针叶凋落物在F2处理下失重率最高,达37.2%。由图 2(b)可知,阔叶凋落物分解到12个月后,F1处理的分解效果最好,分解到21个月时,F1、F2、F3处理的失重率均达到40%以上,其中F1处理的失重率最大,高达49.8%。由图 2(c)可知,针阔混合凋落叶分解到9个月时,真菌处理的失重率均达到30%以上,分解到21个月时,F3处理的失重率最高,达45.6%。
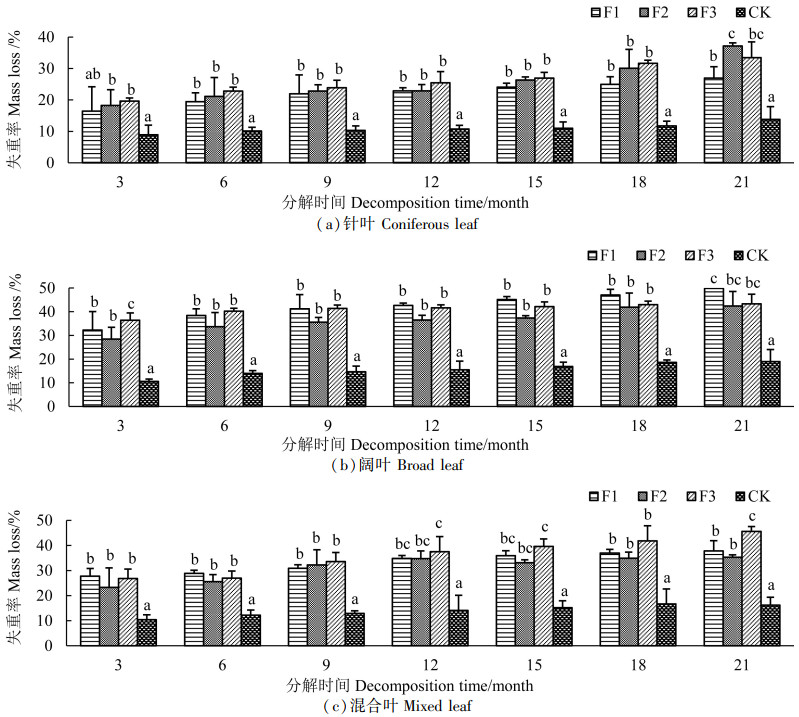
|
注:不同字母表示处理间差异显著(P<0.05)。 Note: different letters indicate significant differences between treatment(P < 0.05). 图 2 不同处理对针、阔、混合凋落叶失重率的影响 Fig. 2 Effects of different treatments on weight loss rate of coniferous, broadleaf and mixed litters |
采用Olson指数衰减模型对凋落物分解速率进行拟合,得到3种类型凋落叶在不同处理下的分解系数、相关系数、半分解和95%分解时间(表 2)。针叶凋落叶在F2处理下年分解系数最大,95%分解时间最短,为15.13 a,比对照组CK减少近17 a;阔叶凋落叶在F1处理下年分解系数最大,95%分解时间为9.92 a,F3处理年分解系数仅次于F1,95%分解时间为10.40 a;针阔混合凋落叶在F3处理下年分解系数最大,95%分解时间最短,为10.59 a。针、阔、混合3种类型凋落叶分别在F2、F1、F3处理下,95%分解时间最短。
| 凋落叶类型 Litter type |
真菌处理 Fungus treatment |
回归方程 Regression equation |
分解系数K Decomposition coefficient K |
相关系数R2 Correlation coefficient R2 |
半分解时间 Time of half decomposition/a |
95%分解时间 Time of 95% decomposition/a |
| 针叶Coniferous leaf | CK | y=93.638e-0.092t | 0.092 | 0.893 | 7.53 | 32.56 |
| F1 | y=90.432e-0.153t | 0.153 | 0.913 | 4.53 | 19.58 | |
| F2 | y=95.837e-0.198t | 0.198 | 0.943 | 3.77 | 15.13 | |
| F3 | y=92.938e-0.182t | 0.182 | 0.918 | 3.81 | 16.46 | |
| 阔叶Broad leaf | CK | y=93.751e-0.122t | 0.122 | 0.913 | 5.68 | 24.56 |
| F1 | y=90.619e-0.302t | 0.302 | 0.910 | 2.30 | 9.92 | |
| F2 | y=90.105e-0.229t | 0.229 | 0.913 | 3.03 | 13.08 | |
| F3 | y=91.237e-0.288t | 0.288 | 0.928 | 2.41 | 10.40 | |
| 混合叶Mixed leaf | CK | y=90.963e-0.115t | 0.115 | 0.926 | 6.03 | 26.05 |
| F1 | y=89.862e-0.230t | 0.230 | 0.893 | 3.01 | 13.02 | |
| F2 | y=89.987e-0.183t | 0.183 | 0.883 | 3.79 | 16.37 | |
| F3 | y=91.635e-0.272t | 0.272 | 0.910 | 2.55 | 10.59 |
通过分析3种类型凋落叶N元素动态规律发现(图 3),N元素初始含量,阔叶>混合叶>针叶,真菌处理的凋落叶N含量均高于对照组CK。3种凋落叶在分解的前3个月,N含量均呈现富集,随着分解时间延长至21个月,总体呈现出富集-释放-富集的规律,但是不同处理下,N元素富集和释放的时间节点有所不同。针叶中N元素含量变化不大,分解到12个月时,F2处理N含量高于其他各处理;阔叶凋落叶分解过程中N元素含量波动较大,F1处理分解到3个月后N元素出现明显的释放状态,分解6个月后开始富集,且分解12个月后,F1处理N含量高于其他各处理;混合凋落叶在F2、F3处理下分解到3个月后呈释放状态,到9个月后出现富集,且从12个月开始,F3处理的N含量高于其他各处理,15个月时比对照高出83.3%。
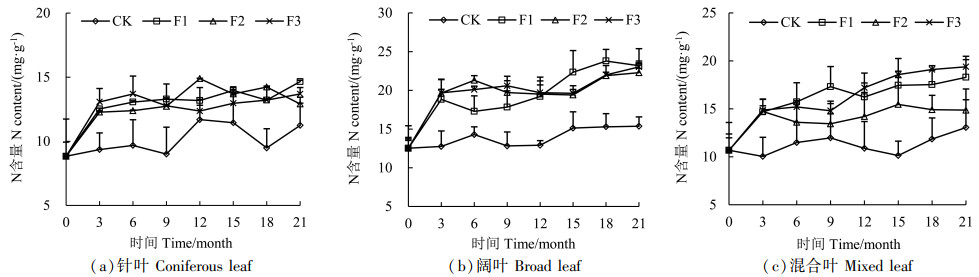
|
图 3 凋落叶分解过程中N含量变化 Fig. 3 Changes of N content during litter decomposition |
由图 4可以看出,真菌处理的凋落叶P含量均高于对照组,分解的前3个月,凋落叶P元素均呈富集状态,这与N元素变化规律一致。随着分解的进行,P元素呈现出不同的释放规律。针叶在F1处理下,整个分解过程P元素没有出现明显释放现象,F2处理下分解到15个月后开始释放,即富集-释放的规律,对照组CK及F3处理整体呈富集-释放-富集规律;阔叶凋落叶P含量总体处于缓慢上升趋势,分解9个月后F1处理明显高于其它处理;混合叶在F1处理下分解到12个月后由富集到释放,15个月后又出现富集,即富集-释放-富集,F2处理3个月后处于释放模式,且P含量高于CK,低于其它菌种处理,F3处理下分解到12个月后P含量高于其它处理。
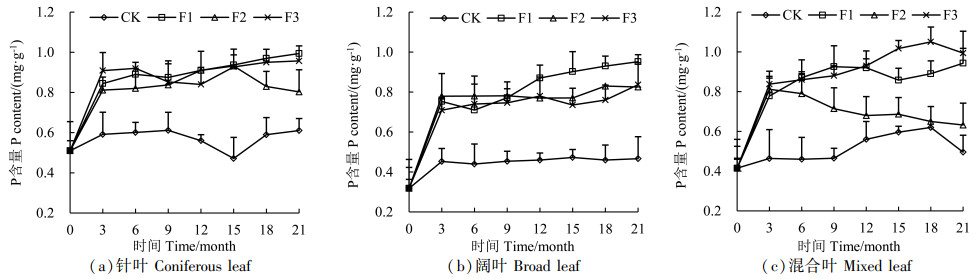
|
图 4 凋落叶分解过程中P含量变化 Fig. 4 Changes of P content during litter decomposition |
由图 5可知,3种凋落叶K元素初始含量,阔叶>混合叶>针叶,针叶和阔叶在整个分解过程中,K元素总体呈释放模式。针叶在F2处理下K元素释放最快,阔叶在F1处理下释放最快,K元素释放与凋落叶失重快慢表现出一致的规律。混合叶分解3个月之前K元素均处于释放状态,之后不同处理呈现不同的富集-释放模式,且混合叶各处理没有明显差异,F1、F3处理分解到6~12个月时,K元素出现明显的富集。
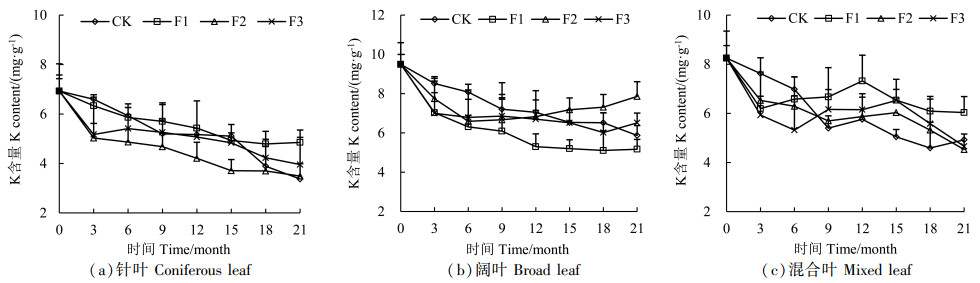
|
图 5 凋落叶分解过程中K含量变化 Fig. 5 Changes of K content during litter decomposition |
由图 6可知,3种凋落叶全C初始含量,针叶>混合叶>阔叶,全C作为衡量凋落物分解速率的一个指标,C含量越高凋落物分解越慢,这与凋落物分解速率针叶<混合叶<阔叶符合。通过分析C释放规律发现,分解的前3个月,C元素呈释放状态,整个分解总体呈释放-富集-释放-富集的规律。3种凋落叶在F2处理下分解到15个月后,C元素开始出现明显富集,其中针叶在F2处理下分解到18~21个月时,C含量明显高于其他处理,阔叶在F1处理下分解到18个月时,C含量明显低于其他处理,混合叶在F2处理下分解到18~21个月时,C含量高于其他处理。
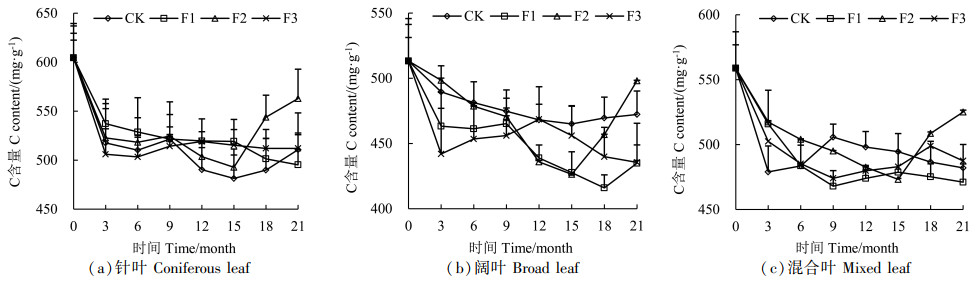
|
图 6 凋落叶分解过程中C含量变化 Fig. 6 Changes of C content during litter decomposition |
C/N也是反映凋落物分解速率的一个重要指标。本研究结果显示,真菌处理下凋落叶分解速率均高于CK,而真菌处理下凋落叶的C/N均低于对照组CK(图 7),这与C/N越低凋落物分解速率越快相一致。3种凋落叶在分解的前3个月C/N呈明显下降趋势,针叶在F2和F3处理下,整个分解过程中C/N呈下降趋势;阔叶凋落叶在真菌处理下总体呈下降-上升-下降的规律;混合凋落叶在F3处理下C/N始终呈下降趋势,分解到12个月后F3处理的C/N最低。
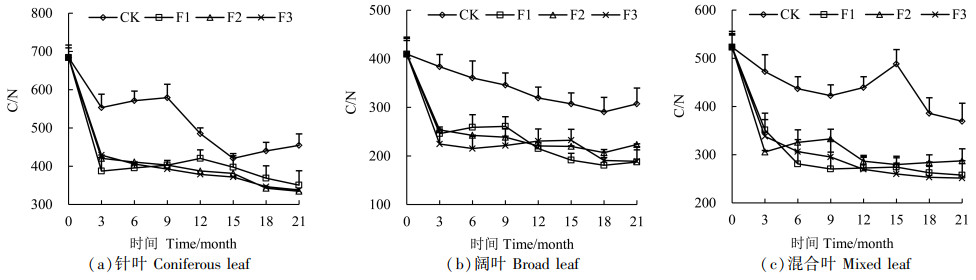
|
图 7 凋落叶分解过程中C/N变化 Fig. 7 Changes of C/N during litter decomposition |
由表 3可知,凋落叶分解21个月后,质量剩余率与初始C含量及C/N具有显著的正相关关系(P<0.05),而与初始N、P、K含量具有显著负相关关系(P<0.05), 与C/P、N/P无显著相关关系(P>0.05);凋落叶各养分元素剩余率与初始养分含量之间不存在显著的相关关系(P>0.05)。
| 养分剩余率 Nutrient remaining ration |
初始C含量 Initial C content |
初始N含量 Initial N content |
初始P含量 Initial P content |
初始K含量 Initial K content |
初始C/N Initial C/N |
初始C/P Initial C/P |
初始N/P Initial N/P |
| 质量剩余率Mass remaining ratio | 0.685* | -0.685* | -0.682* | -0.687* | 0.692* | 0.665 | 0.666 |
| N剩余率N remaining ratio | 0.133 | -0.173 | 0.165 | -0.178 | 0.198 | -0.135 | -0.137 |
| P剩余率P remaining ratio | -0.585 | 0.573 | -0.594 | 0.579 | -0.551 | 0.623 | 0.622 |
| K剩余率K remaining ratio | 0.046 | -0.052 | 0.048 | -0.054 | 0.066 | -0.032 | -0.032 |
| C剩余率C remaining ratio | 0.445 | -0.435 | 0.443 | -0.446 | 0.448 | -0.433 | -0.434 |
| 注:*表示差异显著(P<0.05)。Note:* indicates a significant difference(P<0.05). | |||||||
本研究中3种真菌处理均加快了凋落叶的分解。结果显示,不同真菌处理下,不同类型凋落物分解特征不同,凋落叶分解速率:栓皮栎阔叶﹥油松栓皮栎针阔混合﹥油松针叶,真菌处理的凋落叶分解速率大于对照。相同环境条件下,凋落物分解速率的差异主要是因为凋落物初始养分含量不同,较高的N含量和较低C/N比会提高凋落物的分解速率[19-20]。本研究中N元素初始含量阔叶>混合>针叶,分解过程中真菌处理的凋落叶N含量均高于对照组CK;且由表 3可知,凋落叶分解21个月后的剩余率与初始N含量显著负相关(r=-0.685),与初始C/N显著正相关(r=0.692),这两点说明了影响凋落物分解速率的重要指标是凋落物初始N含量和C/N,与前人研究结论一致[11]。此外,本研究中栓皮栎凋落叶比油松凋落叶分解速率大,也是因为两种凋落叶物理结构不同。有研究表明,凋落物的表面积大利于微生物繁殖[1],所以栓皮栎凋落叶比油松凋落叶更利于微生物的生存繁殖,从而更易分解。针阔混合凋落叶分解速率大于针叶凋落叶,可能有以下两个原因:一是因为混合凋落叶的初始养分含量比针叶高[10],二是可能混合凋落叶的多样性提高了真菌的数量和活性,混合凋落叶为真菌分解者提供了更有利的微环境,进而加快了凋落叶的分解[21-23]。
凋落叶分解过程中,微生物及其分解酶是很重要的分解者和驱动力,尤其真菌在凋落物分解过程中具有重要作用[24-25],有研究表明,真菌种类的多样化可以加快不同类型凋落叶的分解速率[26-28],施入真菌可以提高凋落叶中的真菌数量、种类丰富度及真菌的活性,真菌种类的多样化促进了分解酶的多样化,不同种类的真菌之间相互作用,提高了降解酶的丰富度和活性,从而加快了凋落叶的分解[29]。本研究中,不同真菌对不同类型凋落物的分解优势有差异,研究结果为F1对阔叶凋落叶、F2对针叶凋落叶、F3对混合凋落叶的分解优势最明显,可能是因为在分解过程中不同类型的凋落叶为真菌提供的微环境条件存在差异,不同的真菌选择利于自身繁殖的微环境,以提高自身及降解酶的数量和活性,导致不同的真菌对不同类型的凋落物分解优势不同。后续将进行多菌种混合对凋落物的分解试验,以及野外自然环境下分解菌对凋落物分解的深入研究,进一步分析分解菌在自然环境因素下、微生物群落相互作用下对凋落物的分解效果。
通过凋落物Olson分解指数模型分析发现,在不同真菌处理下,凋落叶分解95%所需时间均为分解50%所需时间的4~6倍,凋落物分解前期速率较快,到了分解后期较缓慢,一方面因为前期主要是易分解的简单无机物或水溶性物质[10],另一方面在分解前期,真菌利用凋落叶充足的碳快递提高生物量和活性,易分解的碳源及易消化的物质优先被微生物利用,这也是前期分解较快的主要原因[24]。
3.2 真菌类型对凋落叶养分释放的影响凋落物分解是养分在凋落物-土壤-植物这个生态系统循环中的重要过程,凋落物分解过程中的养分释放主要包括淋溶-富集-释放、富集-释放、直接释放等模式[21]。本研究发现在真菌处理下,3种类型凋落物分解过程中的N、P元素含量均显著高于CK。N元素在凋落叶分解过程中表现出先富集后释放的特征,有研究表明,凋落物初始N含量较低(<25 mg·g-1)或C/N较高(>20),N元素会先富集,反之则直接释放[11, 30];如果凋落物的C/N显著高于真菌自身的C/N,真菌也会对凋落物释放的N元素固持[21],另外,凋落物在分解过程中可能自生固氮菌有时也会侵入[31],这些均是凋落物在分解过程中出现N富集的原因。本研究发现P元素在分解初期也呈现出富集现象,与N元素表现一致,可能该试验的凋落叶样品初始C/P比大于1 000,是导致P元素呈现先富集后释放的直接原因,因为有研究表明如果凋落物初始C/P过高,P元素释放会受到抑制,凋落物需要在分解过程中先富集P元素达到一定程度才开始释放[32]。阔叶在F1处理下、针叶在F2处理下的K元素含量显著低于CK,其他各处理无明显差异。K元素在针叶、阔叶凋落叶的分解过程中总体呈释放模式,因为K元素在植物中主要以离子形式存在,容易移动且易释放[33],而在混合凋落叶分解中,F1和F3处理下分解到6~12个月时,K元素出现了明显的富集,可能是针叶、阔叶混合影响了K元素的存在形式,也可能是真菌对混合凋落叶的影响导致K元素的存在形式与单一凋落叶相比发生改变,进而影响了K元素释放,具体原因还有待进一步研究。凋落叶的C/N真菌处理组均低于对照组CK,真菌处理降低了凋落叶的C/N比,加速了凋落叶的分解,这与C/N越低凋落物分解速率越快的结论相一致。C元素作为构成凋落叶的主要元素,其含量在不同处理间无明显差异。在凋落叶分解前期及中期C元素主要表现为净释放,因为凋落叶在前期主要分解易分解物质,极易分解的碳水化合物含有大量碳元素,因此C元素表现出了直接释放的特征。
| [1] |
杨晨, 刘勇, 陈晓, 等. 油松人工林下真菌群落对凋落物分解的影响[J]. 中南林业科技大学学报, 2016, 36(7): 41-47. |
| [2] |
葛晓改, 曾立雄, 黄志霖, 等. 土壤温度和水分含量对三峡库区马尾松林凋落物叶分解的影响[J]. 林业科学研究, 2013, 47(9): 153-157. |
| [3] |
李姗姗, 王正文, 杨俊杰. 凋落物分解过程中土壤微生物群落的变化[J]. 生物多样性, 2016, 24(2): 195-204. |
| [4] |
徐波, 朱忠福, 李金洋, 等. 九寨沟国家自然保护区4个典型树种叶片凋落物在林下及高山湖泊中的分解及养分释放特征[J]. 植物生态学报, 2016, 40(9): 883-892. |
| [5] |
林成芳, 彭建勤, 洪慧滨, 等. 氮、磷养分有效性对森林凋落物分解的影响研究进展[J]. 生态学报, 2017, 37(1): 54-62. |
| [6] |
郭伟, 张健, 黄玉梅, 等. 森林凋落物影响因子研究进展[J]. 安徽农业科学, 2009, 37(4): 1544-1546. DOI:10.3969/j.issn.0517-6611.2009.04.068 |
| [7] |
WARING B G. Exploring relationships between enzyme activities and leaf litter decomposition in a wet tropical forest[J]. Soil Biology and Biochemistry, 2013, 64: 89-95. DOI:10.1016/j.soilbio.2013.04.010 |
| [8] |
PRESCOTL C E, BLEVINS L. Litter decomposition in British Columbia forests: influences of forestry activities[J]. Journal of Eco-systems and Management, 2004, 5(2): 30-43. |
| [9] |
严海元, 辜夕容, 申鸿. 森林凋落物的微生物分解[J]. 生态学杂志, 2010, 29(9): 1827-1835. |
| [10] |
马淑敏, 王海霞, 辛学兵, 等. 分解促进剂对九龙山林下凋落叶分解的影响[J]. 福建农林大学学报(自然科学版), 2019, 48(3): 330-336. |
| [11] |
施妍, 陈芳清. 大老岭自然保护区日本落叶松林凋落物分解及养分释放研究[J]. 林业科学研究, 2016, 29(3): 430-435. DOI:10.3969/j.issn.1001-1498.2016.03.019 |
| [12] |
HOBBIE S E. Plant speciese effects on nutrient cyclin: revisiting litter feedbacks[J]. Trends in Ecology and Evolution, 2015, 30(6): 357-363. DOI:10.1016/j.tree.2015.03.015 |
| [13] |
WITOON P, DANUTA K, PECYNA M J, et al. Influence of different forest system management practices on leaf litter decomposition rates, nutrient dynamics and the activity of ligninolytic enzymes: a case study from central European forests[J]. Plos One, 2014, 9(4): e93700. DOI:10.1371/journal.pone.0093700 |
| [14] |
AUBERT M, MARGERIE P, TRAP J, et al. Aboveground-belowgroundrelationships in temperate forests: plant litter composes and microbiota orchestrates[J]. Forest Ecology and Management, 2010, 259(3): 563-572. DOI:10.1016/j.foreco.2009.11.014 |
| [15] |
陈法霖, 郑华, 欧阳志云, 等. 土壤微生物群落结构对凋落物组成变化的响应[J]. 土壤学报, 2011, 48(3): 603-611. |
| [16] |
季晓燕, 江洪, 洪江华, 等. 模拟酸雨对亚热带三个树种凋落叶分解速率及分解酶活性的影响[J]. 环境科学学报, 2013, 33(7): 2027-2035. |
| [17] |
宋影, 辜夕容, 严海元, 等. 中亚热带马尾松林凋落物分解过程中的微生物与酶活性动态[J]. 环境科学, 2014, 35(3): 1151-1158. |
| [18] |
武启骞. 高山森林雪被斑块对凋落物分解的影响[D]. 雅安: 四川农业大学, 2013.
|
| [19] |
MANZONI S, PIEIRO G, JACKSON R B, et al. Analytical models of soil and litter decomposition: solutions for mass loss and time dependent decay rates[J]. Soil Biology and Biochemistry, 2012, 50(5): 66-76. |
| [20] |
VEEN G F, FRESCHET G T, ORDONEZ A, et al. Litter quality and environmental controls of home field advantage effects on litter decomposition[J]. Oikos, 2014, 65(2): 187-195. |
| [21] |
葛晓敏, 唐罗忠, 王瑞华, 等. 杨树人工林生态系统凋落物生物量及其分解特征[J]. 生态环境学报, 2017, 26(9): 1457-1464. |
| [22] |
HANDA I T, AERTS R, BERENDSE F, et al. Consequences of biodiversity loss for litter decomposition across biomes[J]. Nature, 2014, 509(7499): 218-221. DOI:10.1038/nature13247 |
| [23] |
HOSSAIN M Z, SUGIYAMA S I. Influences of plant litter diversity on decomposition, nutrient mineralization and soil microbial community structure[J]. Grassland Science, 2011, 57(2): 72-80. DOI:10.1111/j.1744-697X.2011.00211.x |
| [24] |
陈明蓉, 林永慧, 何兴兵, 等. 杉木叶片内生真菌定殖对凋落物分解及其微生物活性的影响[J]. 微生物学通报, 2020, 47(5): 89-102. |
| [25] |
MATULICH K L, MARTINY J B H. Microbial composition alters the response of litter decomposition to environmental change[J]. Ecology, 2015, 96(1): 154-163. DOI:10.1890/14-0357.1 |
| [26] |
VORÍŠKOVÁ J, BALDRIAN P. Fungal community on decomposing leaf litter undergoes rapid successional changes[J]. The ISME Journal, 2013, 7(3): 477-486. DOI:10.1038/ismej.2012.116 |
| [27] |
陈翔, 周梅, 魏江生, 等. 模拟氮沉降对兴安落叶松林凋落物分解的影响[J]. 生态环境学报, 2013, 22(9): 1496-1503. DOI:10.3969/j.issn.1674-5906.2013.09.007 |
| [28] |
黄婷, 包和林, 吴承祯, 等. 模拟氮硫沉降对邓恩桉人工龄林凋落物C﹑N含量的影响[J]. 山东农业大学学报(自然科学版), 2014, 45(2): 187-189. |
| [29] |
贾丙瑞. 凋落物分解及其影响机制[J]. 植物生态学报, 2020, 43(8): 648-657. |
| [30] |
陈金玲, 金光泽, 赵凤霞. 小兴安岭典型阔叶红松林不同演替阶段凋落物分解及养分变化[J]. 应用生态学报, 2010, 21(9): 2209-2216. |
| [31] |
杨艳鲜, 冯光恒, 潘志贤, 等. 干热河谷罗望子人工林凋落物分解及养分释放[J]. 干旱区资源与环境, 2013, 27(1): 102-107. |
| [32] |
FRESCHET G T, CORNWELL W K, WARDLE D A, et al. Linking litter decomposition of above and below ground organs top plant soil feedbacks worldwide[J]. Journal of Ecology, 2013, 101(4): 943-952. DOI:10.1111/1365-2745.12092 |
| [33] |
BRUDER A, SCHINDLER M H, MORETTI M S, et al. Litter decomposition in a temperate and a tropical stream: the effects of species mixing, litter quality and shredders[J]. Freshwater Biology, 2014, 59(3): 438-449. DOI:10.1111/fwb.12276 |

 2021, Vol. 41
2021, Vol. 41


