文章信息
- 薄伟, 王松, 康红梅, 王晋, 薛新平
- BO Wei, WANG Song, KANG Hongmei, WANG Jin, XUE Xinping
- 铅胁迫对玉蝉花生长及生理生化的影响
- Effects of lead stress on the growth and physio-biochemistry of Iris ensata
- 森林与环境学报,2021, 41(4): 373-381.
- Journal of Forest and Environment,2021, 41(4): 373-381.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.04.006
-
文章历史
- 收稿日期: 2021-04-02
- 修回日期: 2021-05-11
由于我国工业废物大量排放、化肥农药广泛应用和大规模采矿作业,致使土壤、水体环境重金属污染严重。近年来,环境保护部会同国土资源部发布了《全国土壤污染状况调查公报》,发现全国土壤环境状况整体较为严峻,部分工矿业废弃地土壤重金属污染问题突出,土壤质量严重恶化[1]。其中,土壤、水体铅(Pb)污染因其对人类健康造成严重危害而备受关注,已成为今后重金属污染的防治重点[2]。为了防治环境Pb污染,传统的物理、化学等方法虽取得了一定的效果,但还存在实施复杂、花费昂贵和易降低土壤肥力等弊端,难以规模化应用。植物修复法是一种治理Pb污染土壤和水体的重要手段,该技术的顺利实施与植物自身对Pb胁迫的生理适应性密切相关。诸多研究发现,抗氧化酶系统和渗透调节物质在植物抵御Pb污染胁迫中发挥着重要作用[3]。凤仙花(Impatiens balsamina L.)在低浓度Pb处理下,可通过调节体内超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)等酶活性,提高植物清除活性氧能力,适应土壤Pb污染[4]。黑麦草(Lolium perenne L.)则通过分解相应蛋白质,快速增加脯氨酸(proline,Pro)含量,增强体内渗透调节作用,减少Pb毒害[5]。
多年生玉蝉花(Iris ensata Thunb.)又名东北鸢尾,为鸢尾属水陆两生植物种类,具有花大色浓、抗寒耐湿、栽培管理粗放等特点,被广泛应用于湿地水岸美化、寒地花坛花境等方面[6]。目前有关玉蝉花的研究主要集中在繁育[7]、病虫害[8]、园林应用[9]等方面,而关于玉蝉花在不同Pb浓度下的富集效果及响应Pb胁迫环境的机理,尤其是抗氧化酶系统和渗透调节物质发挥的保护性作用鲜有报道。由于我国含Pb绿地分布广泛,玉蝉花的实际运用存在一定Pb毒害风险,研究玉蝉花对Pb胁迫的生长生理响应有助于进一步了解玉蝉花对Pb的耐受机理,对玉蝉花的养护管理具有重要意义。为此,本研究采用营养液培养法,以玉蝉花为研究对象,测定不同浓度Pb胁迫下玉蝉花Pb吸收量以及形态、生物量、抗氧化酶活性、渗透调节物质等指标,分析Pb胁迫对玉蝉花叶片和根系的影响,探讨Pb环境下玉蝉花抗氧化酶系统和渗透调节系统的生理生化变化,旨在为利用玉蝉花进行Pb污染植物修复及玉蝉花在Pb污染地区的栽培应用提供参考依据。
1 材料与方法 1.1 试验材料试验材料玉蝉花引自江苏,栽培于山西省园艺科技示范基地,供试种苗均为无性繁殖群体当年从根状茎萌发的幼苗,选取长势一致的新生幼苗待用。
1.2 试验方法试验采用营养液培养法,参考施旭丽等[10]的方法,2020年5月, 将待用幼苗洗净根部基质,用去离子水缓苗培养,在有白色新根长出后转入装有1/2霍格兰营养液的塑料箱(容积4 L)中预培养,试验用苗均用具孔泡沫板固定,每个塑料箱栽植12株幼苗。预培养20 d后,随机选取7个塑料箱,分别设置Pb浓度为0、200、400、600、800、1 200和1 600 mg·L-1的7个处理,Pb以Pb(NO3)2的形式加入,对照(CK,Pb浓度为0 mg·L-1)则使用1/2霍格兰营养液继续培养。利用气泵为水体加氧,每4 d更换1次营养液,培养温度25 ℃。各处理测定指标重复3次。
1.3 指标测定方法形态指标和生物量的测定:胁迫处理20 d后,随机选取7个处理的玉蝉花各6株,3株使用直尺测量叶长(最长叶)、叶宽(最长叶最宽处)和根长(最长根);3株将地上部分(茎叶)和地下部分(根)分开,洗净后分别称取茎叶和根的鲜质量,然后置于烘箱10 5 ℃杀青1 h,80 ℃烘干至恒质量,记录茎叶和根的干质量[10]。
Pb含量和生理生化指标的测定:参考田松青等[11]的方法,各处理分别选取3株烘干至恒质量的叶、茎和根,测定Pb浓度;各处理收获3株叶和根,测定POD(愈创木酚氧化比色法)、SOD(NBT光还原法)、过氧化氢酶(catalase,CAT)(紫外线吸收法)活性及丙二醛(malondialdehyde,MDA)(硫代巴比妥酸比色法)、Pro(茚三酮比色法)、可溶性蛋白(soluble protein,SP)(考马斯亮蓝法)、可溶性糖(soluble sugar,SS)(蒽酮比色法)、超氧阴离子自由基(superoxide radical,O2·-)(磺胺比色法)、过氧化氢(hydrogen peroxide,H2O2)(可见分光光度法)含量。
1.4 迁移率与隶属函数值的计算| $ 根至茎转移率/\%=茎 \mathrm{Pb} 含量/根 \mathrm{Pb} 含量\times 100 $ | (1) |
| $ 茎至叶转移率/\%= 叶 \mathrm{Pb} 含量/茎 \mathrm{Pb} 含量 \times 100^{[11]} $ | (2) |
| $ f\left(X_{j}\right)=f\left(X_{j}-X_{\min }\right) / f\left(X_{\max }-X_{\min }\right), j=1, 2, \cdots, n $ | (3) |
式中:Xj为第j个指标;f(Xj)为第j个指标的隶属函数值;Xmax和Xmin分别为第j个指标的最大和最小值;若抗旱性指标和植物抗旱能力呈正相关,以正隶属函数公式计算;反之,则以负隶属函数公式计算[12]。
1.5 数据处理采用Excel 2010软件计算数据并作图,使用SPSS 19.0软件对数据进行单因素方差分析。
2 结果与分析 2.1 Pb在玉蝉花不同器官的富集与分布从不同Pb浓度处理下玉蝉花叶、茎和根Pb含量的变化(图 1)可以看出,玉蝉花叶、茎和根的Pb含量均随Pb浓度的升高而增加,植物吸入的Pb主要富集在根组织,积累量依次为根>茎>叶。当Pb浓度为200 mg·L-1时,玉蝉花根富集量(771.4 mg·kg-1)与CK的差异显著,从Pb浓度为600 mg·L-1开始,Pb富集量快速增加,当Pb浓度达到1 600 mg·L-1时,富集量高达39 345.6 mg·kg-1,是Pb浓度为200 mg·L-1时的51.01倍。在Pb浓度为400 mg·L-1时,茎的Pb含量相比CK的差异显著,但整体随Pb浓度的升高而缓慢增加,在Pb浓度为1 600 mg·L-1时,达到最大值(5 207.5 mg·kg-1)。叶和茎的类似,对Pb积累较小,在Pb浓度为400 mg·L-1时,叶的Pb含量仅为220.7 mg·kg-1,在高浓度(1 600 mg·L-1)Pb处理下, 与CK的差异显著,但Pb含量也仅为1 091.3 mg·kg-1。
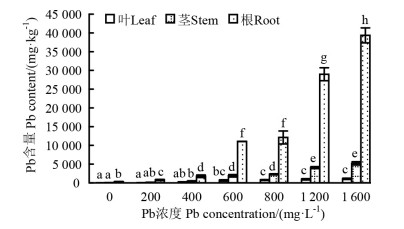
|
注:不同小写字母表示差异显著(P < 0.05)。Note:different letters indicate significant differences at the level of P < 0.05. 图 1 不同Pb浓度处理下玉蝉花不同组织的Pb含量 Fig. 1 Effects of different Pb concentration treatments on the Pb content of Iris ensata |
由图 2可知,在不同Pb浓度处理下,玉蝉花对Pb的分配存在一定差异。根至茎转移率总体表现为先升高后降低的变化趋势,当Pb浓度为600 mg·L-1时达到最大转移率(22.7%)。茎至叶转移率与根至茎转移率趋势相同,在Pb浓度为400 mg·L-1时达到最大值(55.9%),转移率明显高于根至茎的。
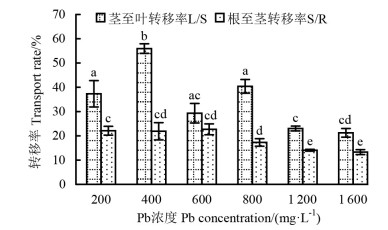
|
注:不同小写字母表示差异显著(P < 0.05)。Note:different letters indicate significant differences at the level of P < 0.05. 图 2 不同Pb浓度处理下玉蝉花Pb转移率的变化 Fig. 2 Values of stem-to-leaf transfer rate and root-stem transfer rate for Iris ensata with different Pb treatments |
由表 1可知,200 mg·L-1 Pb处理下,玉蝉花的叶长、叶宽和根长略高于CK的,但两者无明显差异(P>0.05)。随着Pb浓度的升高,玉蝉花的叶长、叶宽和根长与CK相比,呈逐渐减小的趋势,其中,在低浓度(400 mg·L-1)和高浓度(1 600 mg·L-1)Pb处理下,玉蝉花叶长分别减小了13.0%和40.8%;叶宽分别减小了4.6%和23.1%,对叶长的抑制作用显著(P < 0.05);根长在1 600 mg·L-1 Pb处理下减小了15.3%。600~1 600 mg·L-1 Pb处理对玉蝉花生物量影响显著(P < 0.05),随着Pb浓度的升高,玉蝉花的各生物量呈先增加后减少的变化趋势(表 1)。200 mg·L-1 Pb处理下,玉蝉花各生物量均高于CK的,根鲜质量、根干质量、茎叶鲜质量、茎叶干质量分别增加了15.3%、61.8%、3.0%、22.6%,其中根干质量较CK的差异显著(P < 0.05),说明低浓度Pb处理可在一定程度上促使玉蝉花生物量增加。而当Pb浓度大于200 mg·L-1,玉蝉花各生物量逐渐减少,且Pb浓度越高,对生物量的抑制效果越强,1 600 mg·L-1 Pb处理下各生物量指标均最小,根鲜质量、根干质量、茎叶鲜质量、茎叶干质量仅为CK的15.3%、19.6%、42.1%、45.8%。
| Pb浓度 Pb concentration /(mg·L-1) |
叶长 Leaf length /cm |
叶宽 Leaf width /cm |
根长 Root length /cm |
根鲜质量 Fresh weight of root/g |
根干质量 Dry weight of root/g |
茎叶鲜质量 Fresh weight of stem and leaf/g |
茎叶干质量 Dry weight of stem and leaf/g |
| 0(CK) | 37.17±2.30a | 1.08±0.07a | 10.47±3.59a | 2.49±0.05a | 1.02±0.03a | 5.39±1.11ac | 1.55±0.16a |
| 200 | 37.83±4.80a | 1.13±0.35a | 11.63±1.74a | 2.87±0.09a | 1.65±0.03b | 5.55±0.22ab | 1.90±0.18a |
| 400 | 32.33±1.26ab | 1.03±0.06a | 11.07±2.72a | 2.45±0.65ab | 1.22±0.06c | 3.58±1.19cd | 1.01±0.23b |
| 600 | 24.57±2.30bc | 0.97±0.25a | 10.40±3.42a | 1.38±0.06cde | 0.23±0.02c | 2.73±0.06d | 0.67±0.02b |
| 800 | 24.40±3.83bc | 0.98±0.23a | 9.73±2.41a | 1.64±0.29bd | 0.29±0.04c | 2.48±0.51d | 0.73±0.04b |
| 1 200 | 24.47±3.02bc | 0.93±0.12a | 9.23±0.86a | 0.77±0.26e | 0.22±0.08c | 2.28±0.35d | 0.76±0.09b |
| 1 600 | 22.00±4.58c | 0.83±0.12a | 8.87±1.03a | 0.38±0.14e | 0.20±0.08bc | 2.27±0.15d | 0.71±0.02b |
| 注:同列数据后不同小写字母表示差异显著(P < 0.05)。Note:different letters indicate significant differences at the level of P < 0.05 under different Pb concentrations. | |||||||
由图 3(a)可知,随着Pb浓度的升高,玉蝉花叶和根的POD活性均呈先升高后降低的变化趋势,高浓度Pb对叶的POD活性存在一定抑制作用。在600 mg·L-1 Pb处理下,玉蝉花叶和根的POD活性达最大值(45.1、130.8 U·mg-1),分别高出CK(21.4、64.2 U·mg-1)110.7%和103.7%,且在不同Pb浓度处理下叶的POD活性均低于根的。
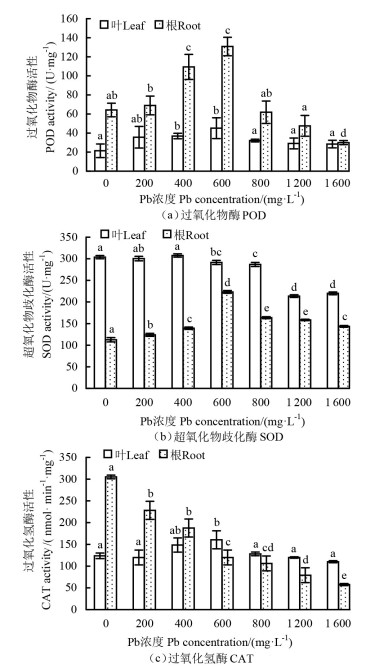
|
注:不同字母表示同一部位不同Pb浓度处理下差异显著(P < 0.05)。Note:different letters indicate significant differences at the level of P < 0.05 under different Pb concentrations in the same part. 图 3 不同Pb浓度处理下玉蝉花的抗氧化酶活性 Fig. 3 Antioxidant enzyme activities of Iris ensata under different Pb concentration treatments |
由图 3(b)可知,低浓度Pb处理对玉蝉花叶的SOD活性影响不大,但在1 200、1 600 mg·L-1高浓度Pb处理下,叶的SOD活性分别为213.7、220.0 U·mg-1,与CK(303.8 U·mg-1) 的相比差异显著(P < 0.05),分别比CK下降了29.7%和27.6%。不同Pb浓度处理下玉蝉花根的SOD活性均高于CK;叶的均高于根的。
由图 3(c)可知,随着Pb浓度的升高,玉蝉花叶的CAT活性表现为先升高后降低的趋势,在600 mg·L-1 Pb处理下达到最大值,较CK的差异显著(P < 0.05)。Pb胁迫对玉蝉花根的CAT活性具有明显抑制作用(P < 0.05),在1 600 mg·L-1 Pb处理下降到最小值(57.6 nmol·min-1 ·mg-1),仅为CK(305.1 nmol·min-1·mg-1)的18.9%。此外,在600~1 600 mg·L-1 Pb处理下,玉蝉花叶的CAT活性高于根的,而CK和在200~400 mg·L-1 Pb处理下的则相反。
2.4 Pb胁迫对玉蝉花渗透调节物质的影响由图 4(a)可知,200~1 200 mg·L-1 Pb处理下玉蝉花叶的可溶性糖含量均大于CK的,在600 mg·L-1 Pb处理下达到最大值(5.6mg·g-1),较CK(3.9 mg·g-1)的增加了43.6%,且与CK的差异显著(P < 0.05)。不同Pb浓度处理下玉蝉花根的可溶性糖含量呈先增加后减少的变化趋势,且均多于CK的,但在高浓度(1 200、1 600 mg·L-1)Pb处理下,与CK的差异不显著(P>0.05)。
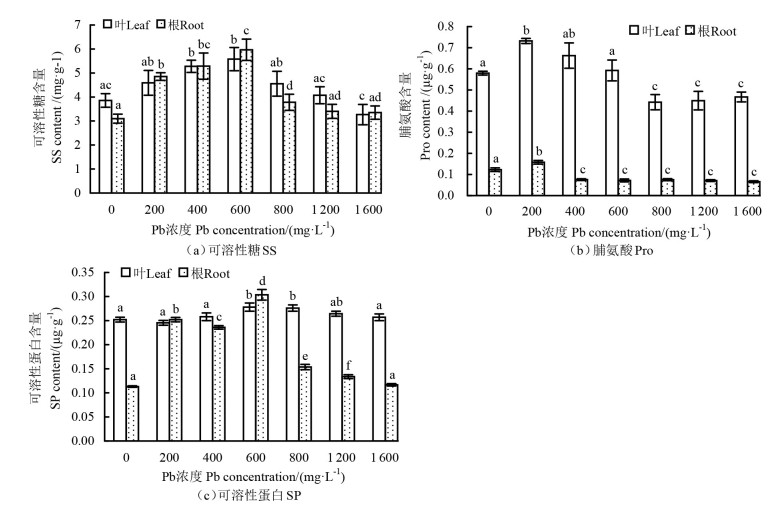
|
注:不同字母表示同一部位不同Pb浓度处理下差异显著(P < 0.05)。Note:different letters indicate significant differences at the level of P < 0.05 under different Pb concentrations in the same part. 图 4 不同Pb浓度处理下玉蝉花的渗透调节物质 Fig. 4 Osmotic adjustment substances of Iris ensata under different Pb concentration treatments |
由图 4(b)可知,不同Pb浓度处理下玉蝉花叶和根的脯氨酸含量均表现为先增加后减少的趋势,在200 mg·L-1 Pb处理下达最大值(0.73、0.16 μg·g-1),分别较CK(0.58、0.12 μg·g-1)的增加了25.9%和33.3%,与CK的差异显著(P < 0.05)。随着Pb浓度的升高,叶和根的脯氨酸含量显著减少(P < 0.05),但在800~1 600 mg·L-1高浓度Pb处理下差异不大(P>0.05)。此外,叶的脯氨酸含量总体多于根的。
由图 4(c)可知,玉蝉花叶和根的可溶性蛋白含量在不同Pb浓度处理下呈先增加后减少的变化趋势,在600 mg·L-1 Pb处理下达到最大值(0.28、0.30 μg·g-1),显著大于CK(0.25、0.11 μg·g-1) (P < 0.05),分别较CK的增加了12.0%和172.7%,且在800~1 600 mg·L-1高浓度Pb处理下未受明显抑制。
2.5 Pb胁迫对玉蝉花超氧阴离子自由基含量、过氧化氢和丙二醛含量的影响随着Pb处理浓度的升高,玉蝉花叶和根的O2·-、H2O2含量呈增加趋势(图 5)。除根的H2O2含量外,在200 mg·L-1 Pb浓度处理下,叶和根的O2·-、H2O2含量(0.48、0.50 nmol·g-1和1.80、0.69 μmol·g-1)与CK(0.46、0.47 nmol·g-1和1.64、0.22 μmol·g-1)的相比,增量较小,分别高出CK的4.3%、6.4%和9.8%、213.6%,且与CK的差异不显著(P>0.05),而在800~1 600 mg·L-1高浓度Pb处理下,叶和根的这两项指标显著增加(P < 0.05)。在不同浓度Pb处理下,玉蝉花叶和根的MDA含量总体呈先减少后增加的趋势。在600 mg·L-1 Pb处理下,叶和根的MDA含量最少(11.2、12.7 nmol·g-1),分别为CK(14.0、21.6 nmol·g-1)的80.0%、58.8%,与CK的差异显著(P < 0.05);当Pb处理浓度高于800 mg·L-1时,叶和根的MDA含量显著增加,在1 600 mg·L-1 Pb处理下MDA含量最多(28.5、45.5 nmol·g-1),分别高出CK(14.0、21.6 nmol·g-1)的103.6%、111.1%,与其余浓度的Pb处理差异显著(P < 0.05)。说明高浓度Pb处理使植物细胞膜受到严重伤害。
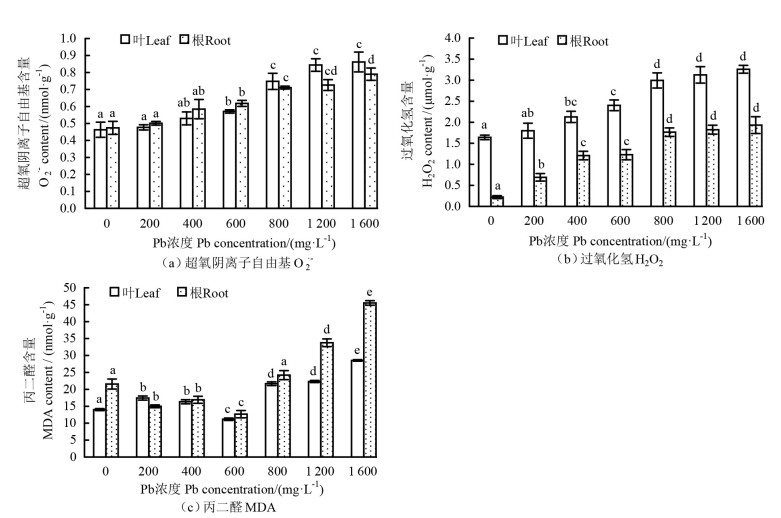
|
注:不同字母表示同一部位不同Pb浓度处理下差异显著(P < 0.05)。Note:different letters indicate significant differences at the level of P < 0.05 under different Pb concentrations in the same part. 图 5 不同Pb浓度处理下玉蝉花的超氧阴离子自由基、过氧化氢和丙二醛含量 Fig. 5 Effect of Pb stress on O2·-, H2O2, and MDA contents of Iris ensata |
Pb胁迫下,植物会做出一系列生理生化反应来缓解Pb的毒害作用,以维持自身正常生命活动。由表 2可知,玉蝉花生长和生理指标之间存在一定的相关关系。玉蝉花多数生长指标和O2·-、H2O2含量之间均呈极显著负相关,叶宽、根长和根鲜质量与SOD活性呈显著正相关,与SP、SS含量相关性不显著。说明不同指标反映Pb胁迫对玉蝉花生长影响的差异程度不同。
| 指标 Indexes |
SS | SOD | CAT | MDA | O2·- | POD | H2O2 | SP | LL | LW | RL | RFW | RDW | SFW | SDW | Pro |
| SS | 1.00 | |||||||||||||||
| SOD | 0.62 | 1.00 | ||||||||||||||
| CAT | 0.92** | 0.55 | 1.00 | |||||||||||||
| MDA | -0.73 | -0.78* | -0.75 | 1.00 | ||||||||||||
| O2·- | -0.50 | -0.90** | -0.44 | 0.84* | 1.00 | |||||||||||
| POD | 0.85* | 0.30 | 0.77* | -0.42 | -0.20 | 1.00 | ||||||||||
| H2O2 | -0.34 | -0.82* | -0.28 | 0.77* | 0.98** | -0.03 | 1.00 | |||||||||
| SP | 0.43 | -0.09 | 0.54 | -0.10 | 0.38 | 0.46 | 0.52 | 1.00 | ||||||||
| LL | 0.11 | 0.69 | -0.03 | -0.53 | -0.86* | -0.19 | -0.93** | -0.73 | 1.00 | |||||||
| LW | 0.39 | 0.81* | 0.18 | -0.68 | -0.89** | 0.05 | -0.90** | -0.44 | 0.92** | 1.00 | ||||||
| RL | 0.60 | 0.85* | 0.41 | -0.71 | -0.92** | 0.38 | -0.88** | -0.41 | 0.83* | 0.90** | 1.00 | |||||
| RFW | 0.41 | 0.89** | 0.23 | -0.64 | -0.91** | 0.06 | -0.91** | -0.47 | 0.92** | 0.97** | 0.93** | 1.0 | ||||
| RDW | 0.20 | 0.66 | -0.01 | -0.39 | -0.79* | -0.01 | -0.84* | -0.76* | 0.94** | 0.86* | 0.88** | 0.90** | 1.00 | |||
| SFW | 0.03 | 0.65 | -0.10 | -0.50 | -0.85* | -0.22 | -0.92** | -0.74 | 0.98** | 0.88** | 0.78* | 0.87* | 0.89** | 1.00 | ||
| SDW | -0.07 | 0.52 | -0.27 | -0.34 | -0.73 | -0.24 | -0.82* | -0.81* | 0.94** | 0.85* | 0.74 | 0.81* | 0.90** | 0.97** | 1.00 | |
| Pro | 0.50 | 0.71 | 0.34 | -0.62 | -0.86* | 0.38 | -0.84* | -0.53 | 0.79* | 0.77* | 0.94* | 0.81* | 0.88** | 0.76* | 0.73 | 1.00 |
| 注:*表示指标间差异显著(P < 0.05);**表示指标间差异极显著(P < 0.01);SS.可溶性糖含量;SOD.超氧化物歧化酶活性;CAT.过氧化氢酶活性;MDA.丙二醛含量;O2·-.超氧阴离子自由基含量;POD.过氧化物酶活性;H2O2.过氧化氢含量;SP.可溶性蛋白含量;LL.叶长;LW.叶宽;RL.根长;RFW.根鲜质量;RDW.根干质量;SFW.茎叶鲜质量;SDW.茎叶干质量;Pro.脯氨酸含量。Note:* indicates significant differences between indexes at the level of P < 0.05; ** indicates significant differences between indexes at the level of P < 0.01; SS.soluble sugar content; SOD.superoxide dismutase activity; CAT.catalase activity; MDA.malondialdehyde content; O2·-.superoxide anion radical content; POD.peroxidase activity; H2O2.hydrogen peroxide content; SP.soluble protein content; LL.leaf length; LW.leaf width; RL.root length; RFW.root fresh weight; RDW.root dry weight; SFW.stem and leaf fresh weight; SDW.stem and leaf dry weight; Pro.proline content. | ||||||||||||||||
隶属函数分析是以测定多种指标为基础,综合评价植物抗逆性的一种途径。为避免单个指标评价植物的片面性,对玉蝉花生长和生理指标进行隶属函数分析,以综合评价其耐Pb性。隶属函数均值越大,说明植物耐Pb性越强。由表 3可知,不同Pb浓度处理下隶属均值依次为:200>400>0>600>800>1 000>1 200>1 600 mg·L-1,在200 mg·L-1 Pb处理下的隶属值最大,在1 600 mg·L-1Pb处理下的玉蝉花长势最差,由于在200 mg·L-1 Pb处理下的玉蝉花生长指标最大,而生理指标在Pb浓度为200~600 mg·L-1处理时表现较好,表明较低浓度的Pb处理对玉蝉花有一定的促进作用,在200 mg·L-1Pb处理下玉蝉花整体生长状况最好。
| 指标Index | Pb浓度Pb concentration/(mg·L-1) | ||||||
| 0 | 200 | 400 | 600 | 800 | 1 200 | 1 600 | |
| 可溶性糖含量SS content | 0.26 | 0.57 | 0.87 | 1.00 | 0.56 | 0.35 | 0.00 |
| 超氧化物歧化酶活性SOD activity | 0.96 | 0.92 | 1.00 | 0.83 | 0.78 | 0.00 | 0.07 |
| 过氧化氢酶活性CAT activity | 0.27 | 0.19 | 0.76 | 1.00 | 0.36 | 0.19 | 0.00 |
| 丙二醛含量MDA content | 0.84 | 0.64 | 0.70 | 1.00 | 0.40 | 0.36 | 0.00 |
| 超氧阴离子自由基含量O2·- content | 1.00 | 0.96 | 0.83 | 0.73 | 0.29 | 0.05 | 0.00 |
| 过氧化物酶活性POD activity | 0.00 | 0.60 | 0.65 | 1.00 | 0.45 | 0.33 | 0.30 |
| 过氧化氢含量H2O2 content | 1.00 | 0.90 | 0.70 | 0.53 | 0.16 | 0.08 | 0.00 |
| 可溶性蛋白含量SP content | 0.20 | 0.00 | 0.39 | 1.00 | 0.94 | 0.58 | 0.36 |
| 叶长Leaf length | 0.96 | 1.00 | 0.65 | 0.16 | 0.15 | 0.16 | 0.00 |
| 叶宽Leaf width | 0.83 | 1.00 | 0.67 | 0.47 | 0.50 | 0.33 | 0.00 |
| 根长Root length | 0.58 | 1.00 | 0.80 | 0.55 | 0.31 | 0.13 | 0.00 |
| 根鲜质量Fresh weight of root | 0.85 | 1.00 | 0.83 | 0.40 | 0.51 | 0.16 | 0.00 |
| 根干质量Dry weight of root | 0.57 | 1.00 | 0.70 | 0.02 | 0.06 | 0.01 | 0.00 |
| 茎叶鲜质量Fresh weight of stem and leaf | 0.95 | 1.00 | 0.40 | 0.14 | 0.06 | 0.00 | 0.00 |
| 茎叶干质量Dry weight of stem and leaf | 0.72 | 1.00 | 0.28 | 0.00 | 0.05 | 0.07 | 0.03 |
| 脯氨酸含量Pro content | 0.47 | 1.00 | 0.76 | 0.52 | 0.00 | 0.03 | 0.09 |
| 均值Average value | 0.65 | 0.80 | 0.69 | 0.58 | 0.35 | 0.18 | 0.05 |
| 排名Ranking | 3 | 1 | 2 | 4 | 5 | 6 | 7 |
高浓度Pb胁迫会使植物生长受到抑制,而部分植物对Pb胁迫具有一定适应性,可在Pb污染环境下生长[13]。韩航等[14]发现,低浓度Pb胁迫会使金丝草[Pogonatherum crinitum (Thunb.) Kunth]的生物量增加。粟春青等[12]也发现,低浓度Pb胁迫会促进金花茶[Camellia nitidissima C. W. Chi]地上和根系生物量增加。本研究中,在200 mg·L-1 Pb处理下,玉蝉花的各生长指标增长,表现出一定耐Pb性,当Pb浓度>200 mg·L-1时,玉蝉花的叶长、叶宽、根长、生物量下降,在Pb浓度为1 600 mg·L-1时,这些指标值最小,显著低于CK的。这种“低促高抑”现象与前人研究结果一致[14],可能是低浓度Pb胁迫触发植物保护效应,植物快速生长降低了Pb在体内的相对浓度,而高浓度Pb胁迫则会影响植物营养物质的吸收和转运,导致植物长势不良,生物量降低[15]。同时,Pb主要富集在玉蝉花根部,但在低浓度Pb胁迫下根系积累量有限,根至茎Pb转移率较高,在一定范围内,根系与茎叶鲜质量的比值随着Pb浓度升高而增大,表明根积累少量Pb可提高玉蝉花根系生物量占比,通过增强根系从环境中吸取营养、水分的能力来适应Pb胁迫[14]。
Pb胁迫会使植物产生H2O2、O2·-等多种活性氧,膜脂过氧化又会引起MDA含量增多。为避免或减少Pb的毒害作用,SOD、POD、CAT作为清除过剩活性氧的一道重要屏障会增加活性来抵御Pb环境。其中SOD是植物体内特异将O2·-歧化成H2O2的酶类,POD、CAT又能进一步清除对植物细胞产生毒害作用的H2O2,其中POD对H2O2更具有亲和性,可作用于植物体内低浓度H2O2[16]。已有研究表明,Pb浓度越高,香根草[Vetiveria zizanioides (L.) Nash]SOD活性越大,POD、CAT活性则在Pb浓度大于4 mmol.L-1时受到抑制[17]。藜(Chenopodium album L.)幼苗的SOD活性在200 mg·kg-1 Pb处理下达到最大值,POD、CAT活性则在100 mg·kg-1 Pb处理时达到最高[18]。本试验中,除玉蝉花根的CAT活性受Pb胁迫明显降低外,叶和根的其他酶活性均表现出先升高后降低的变化趋势。这可能是在一定浓度范围内,Pb胁迫对玉蝉花抗氧化酶活性有激活作用,提高酶活性使植物的MDA含量减少,H2O2、O2·-等活性氧无明显增加,但随着Pb浓度的升高,玉蝉花酶系统受损,机体防御机制下降,MDA、H2O2、O2·-含量显著增加,致使细胞膜遭到破坏,这与韩航等[19]的研究结果相似。且在相同Pb浓度下,玉蝉花叶与根的酶活性和MDA含量变化程度不同,在600~1 600 mg·L-1 Pb处理下,玉蝉花根的SOD、CAT活性均小于叶的,MDA含量则多于叶的,推测是玉蝉花根系直接浸入较高浓度Pb溶液后,富集了大量Pb,引起根系生长受限,根系损伤对酶系统的伤害更大所致,而叶的H2O2、O2·-含量较多,表明过量的Pb(800~1 600 mg·L-1) 虽然激活了叶片抗氧化酶活性,但仍未能有效地缓解其产生的大量活性氧,使得玉蝉花叶片细胞膜受损。
Pro、SS和SP作为有机抗氧化物,能以渗透调节的方式维持植物细胞结构稳定,增强自身抗逆性[20]。王芳等[21]在研究Pb胁迫对玉米(Zea mays Linn.)的生理影响时发现,低浓度(100 mg·L-1)Pb胁迫可使玉米的Pro、SS、SP含量明显减少。而张家洋[22]关于蓬莱蕉(Monstera deliciosa Liebm.)的耐Pb性研究认为,随着Pb含量的增加,Pro、SS和SP含量逐渐增加,有助于蓬莱蕉耐Pb能力的提高。本研究中,200~1 600 mg·L-1 Pb胁迫可能诱导了玉蝉花相关基因表达,使其叶和根的SS和SP含量始终保持在较多水平,避免因环境水势减少而引起的植物失水,使玉蝉花生理代谢正常运转,这可能是玉蝉花重要的耐Pb机制之一。而在800~1 600 mg·L-1 Pb胁迫下,玉蝉花的Pro含量明显少于CK的,这与毛雪飞等[23]得出高浓度Pb处理使金银花(Lonicera japonica Thunb.)Pro含量减少的结果一致。推测是高浓度Pb处理造成玉蝉花机体生理机能损坏,Pro合成受限,分解加快所致。且在高浓度Pb处理下,玉蝉花叶的Pro、SP含量明显多于根的,原因可能是叶片光合产物转运受限,抑制根的Pro、SP合成所致,也可能是玉蝉花对高浓度Pb环境的生理反应。
此外,大量研究表明,不同植物对Pb的最佳耐受能力不同,如刨花润楠(Machilus pauhoi Kanehira)在300 mg·L-1Pb处理时长势最好[24],旱柳(Salix matsudana Koidz.)在Pb浓度为600 mg·kg-1时耐Pb性最强[25]。本研究中,在200 mg·L-1 Pb处理下,玉蝉花的隶属函数均值最大,表现出较好的耐Pb能力,此时根系的Pb累积量达771.3 mg·kg-1,且根至茎和茎至叶Pb转移率较高,而600~1 600 mg·L-1 Pb处理会使玉蝉花受到不同程度的毒害。综上所述,低浓度Pb处理虽使玉蝉花叶和根受到过氧化伤害,但机体也通过调节生物量、抗氧化系统活性和渗透调节物质含量来提高自身耐Pb能力。因此,玉蝉花可作为Pb污染土壤修复植物栽植应用于轻度Pb污染地区。
| [1] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[J]. 中国环保产业, 2014(5): 10-11. |
| [2] |
NEMATI K, BAKAR N K A, ABAS M R, et al. Speciation of heavy metals by modified BCR sequential extraction procedure in different depths of sediments from Sungai Buloh, Selangor, Malaysia[J]. Journal of Hazardous Materials, 2011, 192(1): 402-410. |
| [3] |
MAHAR A, WANG P, ALI A, et al. Challenges and opportunities in the phytoremediation of heavy metals contaminated soils: a review[J]. Ecotoxicology and Environmental Safety, 2016, 126: 111-121. DOI:10.1016/j.ecoenv.2015.12.023 |
| [4] |
杨小琴, 赵运林, 孙玉珍. 凤仙花生物量及抗氧化酶系统对重金属铅胁迫的生理响应[J]. 安徽农业科学, 2008, 36(9): 3526-3528. DOI:10.3969/j.issn.0517-6611.2008.09.024 |
| [5] |
刘慧芹, 韩巨才, 刘慧平, 等. 铅梯度胁迫对多年生黑麦草幼苗生理生化特性影响[J]. 草业学报, 2012, 21(6): 57-63. |
| [6] |
庞素文, 刘涵. 玉蝉花等三种鸢尾属植物的鉴别与园林应用[J]. 吉林林业科技, 2016, 45(1): 26-27. |
| [7] |
XIAO Y E, JIN D M, JIANG K, et al. Pollinator limitation causes sexual reproductive failure in ex situ populations of self-compatible Iris ensata[J]. Plant Ecology and Diversity, 2019, 12(1): 21-35. DOI:10.1080/17550874.2019.1569170 |
| [8] |
YANG J W, FANG D H, SHEN J G, et al. Molecular characterization of tobacco ringspot virus from Iris ensata[J]. European Journal of Plant Pathology, 2020, 158(3): 805-809. DOI:10.1007/s10658-020-02105-7 |
| [9] |
吴友炉, 李宜斌, 谭广文, 等. 广州下沉式绿地草本植物应用综合评价[J]. 中国园林, 2021, 37(1): 122-126. |
| [10] |
施旭丽, 朱安超, 陈发棣, 等. 17个菊花品种幼苗的耐镉性评价[J]. 植物资源与环境学报, 2015, 24(3): 50-59. DOI:10.3969/j.issn.1674-7895.2015.03.07 |
| [11] |
田松青, 朱旭东, 原海燕, 等. 铅胁迫下路易斯安那鸢尾铅吸收量和非蛋白巯基的变化[J]. 北方园艺, 2015(21): 77-82. |
| [12] |
粟春青, 蒋霞, 亢亚超, 等. 金花茶幼苗对铅胁迫的生长生理响应[J]. 森林与环境学报, 2019, 39(5): 467-474. |
| [13] |
TOMSETT A B, THURMAN D A. Molecular biology of metal tolerances of plants[J]. Plant, Cell & Environment, 1988, 11(5): 383-394. |
| [14] |
韩航, 陈顺钰, 薛凌云, 等. 铅胁迫对金丝草生长及生理生化的影响[J]. 草业学报, 2018, 27(4): 131-138. |
| [15] |
IQBAL M M, MURTAZA G, SAQIB Z A, et al. Growth and physiological responses of two rice varieties to applied lead in normal and salt-affected soils[J]. International Journal of Agriculture & Biology, 2015, 17(5): 901-910. |
| [16] |
张俊霞, 刘晓鹏, 向极钎. 植物抗氧化系统对逆境胁迫的动态响应[J]. 湖北民族学院学报(自然科学版), 2015, 33(4): 435-439. |
| [17] |
韩露, 张小平, 刘必融. 香根草对重金属铅离子的胁迫反应研究[J]. 应用生态学报, 2005, 16(11): 2178-2181. DOI:10.3321/j.issn:1001-9332.2005.11.034 |
| [18] |
刘俊华, 姚志刚. 重金属铅胁迫对2种杂草种子萌发和幼苗生长的影响: 英文[J]. 农业科学与技术, 2016, 17(12): 2726-2731. |
| [19] |
韩航, 陈雪娇, 陈顺钰, 等. 类芦对铅胁迫的生理响应[J]. 森林与环境学报, 2017, 37(4): 398-404. |
| [20] |
徐延浩, 侯泽豪, 张文英, 等. 5-氮杂胞苷和丁酸钠对大麦苗期耐湿性的影响[J]. 广东农业科学, 2015, 42(24): 26-30. DOI:10.3969/j.issn.1004-874X.2015.24.007 |
| [21] |
王芳, 李永生, 王汉宁, 等. 钙对铅胁迫下玉米幼苗生长及生理特性的影响[J]. 水土保持学报, 2016, 30(3): 202-207. |
| [22] |
张家洋. 重金属铅镉短期胁迫对蓬莱蕉生理生化指标的影响[J]. 水土保持学报, 2016, 30(2): 340-345. |
| [23] |
毛雪飞, 何金娇, 韩忠康, 等. 铅胁迫对金银花生长、生理及积累特性的影响[J]. 东北农业科学, 2019, 44(5): 69-75, 87. |
| [24] |
郑绍鑫, 蒋林, 滕维超, 等. 刨花润楠对硝酸铅胁迫的生长和生理响应机制[J]. 林业科技开发, 2015, 29(3): 25-30. |
| [25] |
夹书珊. 旱柳生长过程对铅胁迫的响应机理研究[D]. 长沙: 中南林业科技大学, 2016.
|

 2021, Vol. 41
2021, Vol. 41


