文章信息
- 张成富, 赵庆霞, 蔡银美, 李昕颖, 何腾兵
- ZHANG Chengfu, ZHAO Qingxia, CAI Yinmei, LI Xinying, HE Tengbing
- 凋落物输入对根系分泌物碳输入及土壤氮的影响
- Effect of litter input on root exudative carbon input and rhizosphere nitrogen
- 森林与环境学报,2021, 41(3): 263-271.
- Journal of Forest and Environment,2021, 41(3): 263-271.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.03.006
-
文章历史
- 收稿日期: 2021-01-04
- 修回日期: 2021-01-31
2. 贵州大学新农村发展研究院, 贵州 贵阳 550025
2. Institute of New Rural Development, Guizhou University, Guiyang, Guizhou 550025, China
在全球气候变化背景下,温度升高和大气CO2浓度增加会提高植物碳的同化率,增加植物净初级生产力[1],进而引起凋落物输入量的改变。凋落物输入量的改变首先改变了凋落物层的数量、质量和分解速率,造成土壤表层土壤温湿度的改变;其次通过改变输入土壤中碳、氮、磷等养分的数量和质量,对森林生态系统内部养分循环产生影响[2],从而影响土壤养分状况和树木根系生长。根系作为首先感知周围土壤环境变化的重要器官,除了吸收养分、水分和固定地上部分之外,还可以分泌多种化合物,即根系分泌物,来调控根际养分循环,在维持根际土壤生态养分平衡方面发挥着重要作用。根系分泌物主要包括一些低分子(氨基酸、有机酸、糖类和其他次生代谢产物)和高分子(蛋白质、黏液)有机化合物[3],占植物光合同化产物的5%~20%[4]。有研究表明,植物会通过改变根系分泌物的分泌速率来响应环境变化,调节根际养分循环[5-7]。如在低氮下,火炬松(Pinus taeda L.)和云杉(Picea asperata Mast.)根系分泌物的释放速率会加强[5-7], 持续增温下,云杉会增加根系分泌物的释放速率[7],进而影响有机质的矿化和养分的释放[8]。但是目前森林根系分泌物对环境的响应研究主要集中在分泌速率对CO2浓度和温度升高的响应[5-7]。而凋落物输入量变化能否引起植物根系分泌物输入的改变尚不清楚。在森林生态系统中,凋落物是养分归还土壤最主要的途径,它的去除和添加都会改变对土壤碳、氮的输入。凋落物去除,阻隔了养分向土壤的归还,导致表层土壤有机质的降低[9];凋落物添加,促进土壤有机质的积累或者由于输入更多的可溶性有机质,促使土壤有机碳发生激发效应,降低土壤的有机碳、氮含量[10]。目前凋落物输入量变化对土壤养分循环的影响已经有一定的研究,但是根系分泌物也影响根际养分循环过程,根系分泌物中的有机物是土壤微生物丰富的碳源和氮源,在改变土壤微生物数量和活性的同时,深刻影响有机质的分解和养分代谢过程,促进氮转化[8]。因此,将凋落物、根系分泌物、土壤养分三者结合起来的综合分析,对补充认识地上养分输入变化下根系分泌物介导的地下养分周转过程具有重要意义[11]。
贵州黔中地区水土流失严重,土壤肥力低,森林生态功能逐渐弱化。马尾松(Pinus massoniana Lamb.)是该地区水土保持,稳定森林生态功能的重要树种。短柱茶[Camellia brevistyla (Hayata) Coh. St]属山茶科(Theaceae)山茶属(Camellia)常绿灌木,是该地区马尾松人工林林下优势植被,在维持人工林森林多样性、生态功能稳定性和持续地力生产方面具有重要作用[12]。森林地下生态学相关研究表明,植物根系分泌物在活化土壤养分、调节土壤养分循环与响应外界环境变化方面具有重要作用[5-8]。因此,本研究以贵州黔中地区典型的乔木和灌木树种马尾松和短柱茶为研究对象,通过3个不同的凋落物处理,采用原位收集马尾松和短柱茶根系分泌物的方式,初步探索凋落物输入量变化下植物根系分泌物碳输入速率和根际氮素状况,及其相关关系。弄清凋落物处理是否影响植物根系分泌物地下碳输入?乔木和灌木由于对光照和土壤资源的获取和利用效率不同,其根系分泌物碳输入和根际氮素是否具有差异?根系分泌物的分泌速率和根际氮含量及氮转化相关酶活性是否具有相关关系?该研究对进一步认识凋落物输入量变化下不同植物地下生理调节策略、根际养分循环过程具有重要意义,同时为人工林生态可持续经营管理提供一定的理论基础。
1 材料与方法 1.1 研究区概况研究区设置于贵州省贵阳市花溪区(106°39′8″ E,26°28′15″ N),地处黔中高原山地丘陵区,属亚热带季风气候。研究区海拔1 145 m,年平均气温14.9 ℃,年平均日照时间1 354 h左右,相对湿度75.5%,全年无霜期246 d左右,年平均降雨量1 178.3 mm。试验对象为35年生的马尾松人工林(播种林),无人为经营砍伐,林分郁闭度约为0.8,林分密度为853株·hm-2,平均胸径为32.17 cm,平均树高为28.32 m。林下优势灌木为短柱茶,林龄为10 a,为野生短柱茶,无人为经营砍伐,分布均匀,密度为2 944株·hm-2,平均高度为4.31 m,平均冠幅为2.21 m,覆盖度约为80%。其他林下植物有女贞(Ligustrum lucidum Ait.)、荚蒾(Viburnum dilatatum Thunb.)、棕竹[Rhapisexcelsa (Thunb.) Henry ex Rehd.]、常春藤[Hedera nepalensis K. Koch var. sinensis (Tobl.) Rehd.]。试验地土壤类型为黄壤,成土母质为第四纪红色黏土, pH值为4.44,有机质含量为29.06 g·kg-1,全氮含量为2.77 g·kg-1,全磷含量为0.76 g·kg-1。凋落物为混合凋落物,包括乔木、灌木和草本层凋落物。利用凋落物收集框(0.5 m×0.5 m)调查该马尾松人工林2020年凋落物归还量,为598.20 g·m-2·a-1,地表凋落物层厚度为0.5~1.2 cm,凋落物以针叶为主,占总凋落物量的83%。
1.2 试验设置2018年10月, 在马尾松人工林样地采用随机区组设计分别设置9个10 m×10 m的样方,样方与样方之间设置10 m隔离带。试验设置3个调落物处理,分别为:对照(CK), 保持原状凋落物不变;去除凋落物(litter removal, LR)处理,建立样方时,去除样方内土壤表面全部乔木、灌木和草本层凋落物,之后每月底去除样方内新增的全部凋落物;添加凋落物(litter addition,LA)]处理,将去除凋落物处理样方内的每次去除的凋落物均匀放置到添加凋落物处理的样方内。每种处理3个重复。
1.3 样品采集与测定采用的根系分泌物原位收集装置是基于PHILLIPS et al[13]、刘庆等[14]的加以优化改进。2020年7月12日,每个样方选择胸径相近、长势良好的马尾松和短柱茶各两株,在每株树的3个不同方位挖取完整细根(直径≤2 mm,长20~30 cm),用于根系分泌物收集。用去离子水小心冲洗细根,除去表面的土壤和杂质,再用无机营养液(0.1 mmol·L-1KH2PO4、0.2 mmol·L-1 K2SO4、0.2 mmol·L-1 MgSO4·7H2O、0.3 mmol·L-1 CaCl2·2H2O和0.5 mmol·L-1 NH4NO3)温和地冲洗2~3次。细根转移至底部装有玻璃棉(防止抽滤时玻璃珠堵塞筒口)注射器针筒中,再装入直径为1 mm的玻璃珠(2 mol·L-1 HCl浸泡24 h),最后加橡胶塞密封。通过注射器向注射筒中注射上述营养液15 mL作为细根培养的缓冲液,用铝箔密封后埋入土中培养。24 h后利用电动真空泵抽滤3次至棕色塑料瓶中,收集完后,重新注入营养液继续培养,连续收集3 d。同时在样地附近做6个空白对照,除不放入细根外,其余操作一致。收集后的样品经0.22 μm滤膜过滤后,-20 ℃低温保存。同时将细根剪下,用于定量研究细根形态特征。
在收集根系分泌物的细根周围,采集根际土。在根系分泌物取样的3个方向,沿细根方向寻找根系,将粘着在根系表面约2 mm厚度的土壤取下即为根际土。每株树3个方向土壤均匀混合为1个样品,每个样方每个树种采集根际土混合样两份。将取得的土样带回实验室,用四分法分一部分土样在-4 ℃低温冷藏,用于测定土壤酶活性和铵态氮(NH4+-N)、硝态氮(NO3--N)、微生物生物量碳(microbial biomass carbon,MBC)和微生物量氮(microbial biomass nitrogen,MBN)含量,另一部分自然风干,过0.149 mm筛,用于土壤全氮含量的测定。
根系分泌物中总有机碳(total organic carbon,TOC)和全氮(total nitrogen,TN)含量使用总有机碳/总氮分析仪(Vario,TOC,德国)测定,细根样品扫描后采用WinRhizo软件分析根系形态参数(根长和根表面积),随即65℃烘干至恒重,万分之一天平称量,得出细根生物量。结合根系分泌物的总有机碳含量、细根生物量、根长、根表面积,再根据收集时间,将根系分泌物碳输入速率转化成单位根生物量、单位根长、单位根表面积根系分泌物碳输入速率。
土壤全氮含量采用浓H2SO4和H2O2消煮,全自动间断化学分析仪(CleverChem 380,德国)测定;土壤铵态氮、硝态氮含量采用KCl浸提全自动间断化学分析仪测定;土壤微生物量碳、氮含量采用氯仿熏蒸法测定,氯仿熏蒸和未熏蒸土壤使用0.5 mol·L-1K2SO4(水土比为4∶1)浸提,浸提液立即用总有机碳/总氮分析仪测定,微生物量碳、氮转换系数(KC、KN)分别取值0.45和0.54;土壤脲酶、羟胺还原酶、硝酸还原酶、亚硝酸还原酶活性的测定参照赵悦[15]的方法。
1.4 数据分析采用双因素方差分析,检验凋落物处理、树种、凋落物处理和树种交互作用对马尾松和短柱茶3种根系分泌物碳输入速率的影响。采用单因素方差分析,检验同一树种各指标在不同凋落物处理间的差异,多重比较选用最小显著差异(least-significant difference,LSD)(P < 0.05)。同一凋落物处理下,各指标在两树种间的差异采用配对样本t检验方法。相关性分析采用Person相关性。使用SPSS 22.0软件进行数据的统计分析,图形绘制使用Excel软件。
2 结果与分析 2.1 凋落物处理对根系分泌物碳输入速率的影响3种凋落物处理下,马尾松单位根生物量、单位根长和单位根表面积根系分泌物碳输入速率平均值分别为22.46 μg·g-1·h-1、0.06 μg·cm-1·h-1、0.22 μg·cm-2·h-1;短柱茶的分别为27.30 μg·g-1·h-1、0.06 μg·cm-1·h-1、0.28 μg·cm-2·h-1(图 1)。双因素方差分析结果表明,凋落物处理对马尾松和短柱茶单位根生物量、根长和根表面积的根系分泌物碳输入速率均无显著影响,马尾松和短柱茶根系分泌物碳输入速率差异不显著,凋落物处理和树种的交互效应对根系分泌物碳输入速率的影响不显著(表 1)。虽然凋落物处理对根系分泌物碳输入速率的影响不显著,但去除凋落物处理下马尾松根系分泌物碳输入速率增强,添加凋落物处理下短柱茶单位根生物量和单位根长根系分泌物碳输入速率均增强(图 1)。可能因为本研究凋落物处理时间较短,新添加的凋落物未完全分解,对土壤养分的影响较小,进而对根系分泌物碳输入的影响未达到显著性水平。
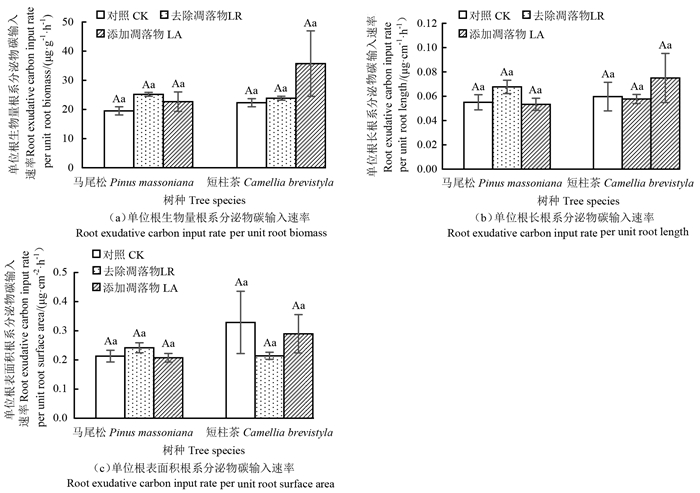
|
| 注:不同大写字母表示同一凋落物处理不同树种间差异显著(P < 0.05);不同小写字母表示同一树种不同凋落物处理间差异显著(P < 0.05);误差线为标准误。 |
Note: different capital letters indicate that the same litter treatment differs significantly between the two tree species at P < 0.05; the different lowercase letters indicate that different litter treatments for the same tree species differ significantly at P < 0.05; the error lines represent the standard errors. |
|
| 变异来源 Source |
单位根生物量根系分泌物碳输入速率 Root exudative carbon input rateper unit root biomass |
单位根长根系分泌物碳输入速率 Root exudative carbon input rateper unit root length |
单位根表面积根系分泌物碳输入速率 Root exudative carbon input rate per root unit surface area |
|
| 凋落物处理 | F | 1.267 | 0.236 | 0.330 |
| Litter treatment | P | 0.317 | 0.793 | 0.725 |
| 树种 | F | 1.291 | 0.407 | 1.728 |
| Trees species | P | 0.278 | 0.536 | 0.213 |
| 凋落物处理×树种 | F | 1.011 | 1.149 | 1.005 |
| Litter treatment×tree species | P | 0.393 | 0.350 | 0.395 |
由表 2可知,凋落物处理对马尾松和短柱茶根际土壤的全氮、硝态氮、铵态氮、微生物量碳、微生物量氮含量及微生物量碳氮比均无显著影响。同一凋落物处理下,马尾松和短柱茶根际土壤全氮、硝态氮、铵态氮、微生物量碳、微生物量氮含量及微生物量碳氮比均无显著差异。
| 树种 Tree species |
凋落物处理 Litter treatment |
全氮含量 TN content/(g·kg-1) |
铵态氮含量 NH4+-N content/(mg·kg-1) |
硝态氮含量 NO3--N content/(mg·kg-1) |
微生物量碳含量 MBC content/(mg·kg-1) |
微生物量氮含量 MBN content/(mg·kg-1) |
微生物量碳氮 比MBC/MBN |
| 马尾松 | 对照CK | 2.65±0.46Aa | 6.61±1.61Aa | 11.40±2.23Aa | 356.84±16.81Aa | 99.26±8.16Aa | 4.48±1.11Aa |
| Pinus massoniana | 去除凋落物LR | 2.48±0.54Aa | 5.77±0.99Aa | 11.90±1.08Aa | 432.95±57.94Aa | 127.15±35.42Aa | 4.71±0.52Aa |
| 添加凋落物LA | 2.96±0.62Aa | 6.55±1.28Aa | 10.97±2.98Aa | 342.97 ±71.59Aa | 64.70±5.86Aa | 5.09±1.05Aa | |
| 短柱茶 | 对照CK | 2.20±0.50Aa | 5.78±1.04Aa | 8.48±1.55Aa | 400.12±57.97Aa | 106.58±6.08Aa | 4.32±0.79Aa |
| Camellia brevistyla | 去除凋落物LR | 2.54±0.54Aa | 5.44±1.02Aa | 10.61±1.17Aa | 416.18±85.79Aa | 95.24±24.38Aa | 5.06±1.15Aa |
| 添加凋落物LA | 2.01±0.28Aa | 8.14±3.01Aa | 11.84±1.95Aa | 342.34±27.94Aa | 74.94±18.68Aa | 5.46±1.75Aa | |
| 注:同列数据后不同大写字母表示同一凋落物处理不同树种间差异显著(P < 0.05);不同小写字母表示同一树种不同凋落物处理间差异显著(P < 0.05)。Note: different capital letters indicate that the same litter treatment differs significantly between the two tree species at P < 0.05; the different lowercase letters indicate that different litter treatments for the same tree species differe significantlyat P < 0.05. | |||||||
由图 2可知,凋落物处理对马尾松根际土壤脲酶、羟胺还原酶、硝酸还原酶和亚硝酸还原酶活性均无显著影响;凋落物处理对短柱茶根际土壤脲酶、羟胺还原酶和亚硝酸还原酶活性无显著影响。同一凋落物处理下,马尾松和短柱茶根际土壤氮素转化相关酶活性无显著差异。短柱差硝酸还原酶活性在不同凋落物处理差异显著,表现为去除凋落物显著大于对照。
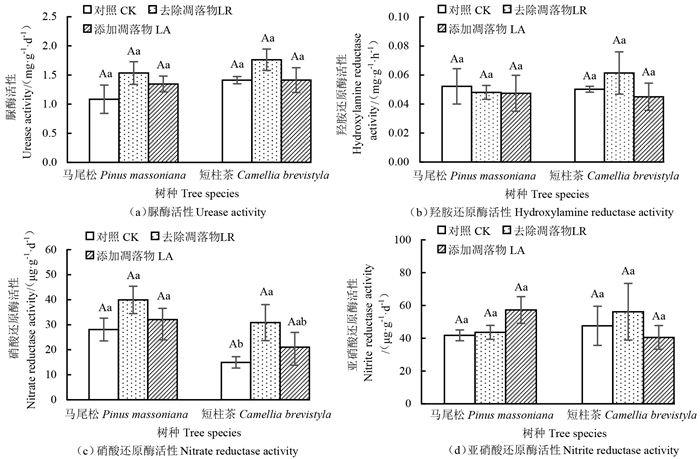
|
注:不同大写字母表示同一凋落物处理不同树种间差异显著(P < 0.05);不同小写字母表示同一树种不同凋落物处理间差异显著(P < 0.05);误差线为标准误。 Note: different capital letters indicate that the same litter treatment differs significantly between the two tree species at P < 0.05; the different lowercase letters indicate that different litter treatments for the same tree species differ significantly at P < 0.05; the error lines represent the standard errors. 图 2 不同凋落物处理下根际土壤氮转化相关酶活性 Fig. 2 Enzyme activities related to nitrogen conversion in the rhizosphere under different litter treatments |
相关性分析(表 3)结果表明,两树种根系分泌物碳输入速率与根际土壤铵态氮、微生物量氮含量及氮素转化相关酶活性无显著关系。单位根长根系分泌物碳输入速率与根际土壤全氮含量呈显著负相关关系,单位根表面积根系分泌物碳输入速率与根际土壤硝态氮含量呈显著负相关关系。
| 根系分泌物碳输入速率 Root exudative carboninput rate |
全氮含量 TN content |
铵态氮含量 NH4+-Ncontent |
硝态氮含量 NO3--Ncontent |
微生物量氮含量 MBN content |
脲酶活性 Urease activity |
羟胺还原酶活性 Hydroxylamine reductase activity |
硝酸还原酶活性 Nitrate reductase activity |
亚硝酸还原酶活性 Nitrite reductaseactivity |
| 单位根生物量根系分泌物碳输入速率Root exudative carbon input rate per unit root biomass | -0.11 | -0.26 | -0.15 | 0.18 | 0.10 | -0.27 | 0.14 | -0.07 |
| 单位根长根系分泌物碳输入速率Root exudative carbon inputrateper unit root length | -0.52* | -0.44 | -0.20 | 0.00 | -0.06 | -0.10 | 0.01 | 0.05 |
| 单位根表面积根系分泌物碳输入速率Root exudative carbon inputrateper unit root surface area | -0.41 | -0.21 | -0.55* | 0.12 | -0.10 | -0.14 | -0.19 | 0.24 |
| 注:*表示在0.05水平上显著相关(双尾)。Note: * indicates that the correlation is significant at P < 0.05 (two-tailed). | ||||||||
植物根系分泌物碳输入受生物和非生物因素的影响,前人研究结果发现不同植物根系分泌物碳输入速率差异较大。乔木根系分泌物碳输入速率通常较高,其中云杉[7, 16-19]、冷杉[Abies fabri(Mast.)Craib][7, 19]、杉木[Cunninghamia lanceolata (Lamb.) Hook.][20]普遍较高;针叶树种根系分泌物碳输入速率普遍高于阔叶树种[7, 16-19, 21];常绿树种普遍高于落叶树种[7, 16-19, 22]。其原因可能是:乔木由于植株更高大,叶片更多,可以竞争到更多的光照,冠层光合利用效率较高,植物根系向地下碳分配的比例更高;针叶树种对环境变化的抵御能力较强,即使是在耐寒的情况下也会以稍低的光合速率维持植物生长,持续维持地下碳分配;常绿树种与落叶树种光合特征不同,落叶树种能在短期内合成大量的光合产物,但寿命短,常绿树种虽然光合速率较小,但维持光合时间长,导致累计同化的碳以及向下输入的碳较多[23]。
本研究中马尾松根系分泌物碳输入速率在针叶常绿树种中处于较低水平,可能是马尾松深根系、须根少、根系密度小的特性,导致碳分泌速率低。而且,本研究中马尾松单位根生物量根系分泌物碳输入速率与外生菌根树种北美红栎(Quercus rubra L.)、美洲水青冈木(Fagus grandifolia Ehrh.)相接近,高于丛枝菌根树种北美鹅掌楸(Liriodendron tulipifera Linn.)、糖枫(Acer saccharum Marshall)[21]。菌根类型也可能是影响分泌速率的一个原因[21]。马尾松是典型的外生菌根树种,该树种根系获取的氮素主要以有机质分解为主,因此树木需要分泌更多的含碳物质来矿化有机质中的氮,而丛枝菌根树种根际无机氮的有效性本来就较高,不需要根系分泌更多的含碳物质来获取[21]。此外,相比丛枝菌根,外生菌根树种可以合成许多不同的水解酶和氧化胞外酶来降解有机质[21],所以外生菌根树种根系分泌物的分泌速率显著高于丛枝菌根树种。另外,植物不同生长阶段根系分泌物碳的分泌情况也不同[18],因此本研究中马尾松根系分泌物碳输入速率还可能与林龄有关。
本研究结果显示,马尾松和短柱茶根系分泌物碳输入速率无显著差异,该结果与前人研究结果不一致[5, 7, 21, 24],并没有呈现明显的树种差异。其原因可能是前人关于乔木与灌木的根系分泌物碳输入研究都具有时间和地点的异质性,缺乏同一条件下的乔木和灌木根系分泌物分泌速率的对比研究。另外,短柱茶的根系分泌物碳输入速率与青藏高原东缘窄叶鲜卑花[Sibiraea angustata (Rehd.) Hand.-Mazz.]灌丛根系分泌物碳输入速率相接近[24],表明灌木对光照的获取和对各种资源的竞争情况相似,因此, 地下碳分配情况比较相近。但当前对灌木根系分泌物碳输入的研究样本较少,难以对灌木整体分泌情况做出比较准确的判断。因此,未来可聚焦到不同植物类型对同一环境变化的响应以及具体的响应机制研究。
3.2 凋落物处理对根系分泌物碳输入速率的影响本研究结果表明, 凋落物输入量变化对马尾松和短柱茶根系分泌物碳输入速率均无显著影响, 其原因可能是以下3点。第一,凋落物处理时间较短,凋落物未完全分解,土壤养分尚未产生明显影响,因此对根系分泌物碳输入的影响也不显著。已有相关研究[6-7, 24]表明,根系分泌物碳输入速率受到土壤养分的影响,即高氮抑制植物根系分泌物的分泌,而低氮促进植物根系分泌物的分泌[6]。例如,高氮处理(100 mg·L-1)导致2年生云杉根系分泌物碳输入速率显著降低[25]。低氮处理导致火炬松和云杉根系分泌物的释放速率加强[5-7]。因为土壤氮充足时,植物对养分的微生物驱动需求低,降低植物根系分泌物分泌速率,采取的是低氮收益-低碳投入的生理策略[24]。当土壤有效氮较低时根系分泌速率加强,目的是为了促使微生物分泌更多的胞外酶以加速土壤有机质分解,释放无机氮来满足植物生长所需的养分[8]。因此,凋落物的去除和添加可能通过影响土壤养分,影响根系分泌物的分泌。然而,本研究中凋落物处理时间较短,新添加的凋落物未完全分解,对土壤养分的影响不显著,对根系分泌物碳输入的影响也不显著。第二,成熟林木根系分泌物分泌速率对凋落物输入量变化的响应可能不敏感。森林土壤中限制植物生长的养分如氮,都结合在土壤有机质中[21]。树木通过分泌根系分泌物来加速有机质的矿化,获取更多的养分,然而随着森林的成熟,养分会被滞留在缓慢的周转库中,通过分泌根系分泌物以从土壤中获取养分的方式会逐渐减弱[26]。这种通过激发效应刺激微生物产生胞外酶来从土壤有机质中获取养分的策略在成熟林中会减缓[21, 26],导致当地上部养分输入变化时,根系分泌物碳输入可能未做出反馈。第三,本研究根系分泌物碳输入速率仅为1次测定结果,不同季节根系分泌物碳输入速率可能存在差异。如窄叶鲜卑花灌丛根系分泌物碳输入速率具有明显的季节动态规律,具体表现为8月>6月>10月[24]。连香树(Cercidiphyllum japonicum Sieb. Et Zucc.)的根系分泌物碳输入速率也表现出类似的季节动态规律,具体表现为7月>4月>9月>12月[27]。因此,根系分泌物碳输入速率对凋落物输入量变化的响应可能具有季节差异。
3.3 凋落物处理对土壤氮含量的影响凋落物主要通过两种途径来影响土壤养分及土壤酶活性:一方面是分解和淋溶作用,通过改变输入土壤中碳、氮、磷等养分的数量和质量,从而改变土壤养分含量,对森林生态系统养分循环产生影响[2];另一方面通过地表温湿度的改变,影响土壤微生物活性,同时影响腐殖化和矿质化进程。本研究中,马尾松林凋落物添加和去除对土壤氮无显著影响,原因可能是凋落物处理的年限较短,凋落物未完全分解。这与之前的有些研究结果一致:杉木人工林4年的凋落物处理后,相对于对照,土壤有机碳、全氮和土壤微生物量碳氮未发生显著变化[28];8年的油松(Pinus tabuliformis Carr.)-辽东栎(Quercus wutaishansea Mary)混交林凋落物处理对土壤硝态氮和铵态氮均未表现出显著性差异[29]。可见,土壤养分的累积和有机质矿化过程较为缓慢,短暂的凋落物处理难以对土壤养分造成显著影响,因此需要后期长时间的定位观察研究。
3.4 根系分泌物碳输入速率与土壤氮转化的关系根系分泌物碳输入与土壤氮转化相互影响。本研究结果表明,单位根长根系分泌物碳输入速率与根际土壤全氮含量呈显著负相关关系,单位根表面积根系分泌物碳输入速率与根际土壤硝态氮含量呈显著负相关关系。根系分泌物碳的分泌速率取决于根际土壤氮供应水平,与根际土壤氮含量呈显著负相关关系。根系分泌物向根际释放速率的改变是是植物一项重要的生理调节过程,外界环境变化对根系分泌速率的刺激作用取决于土壤养分水平,低养分条件下,植物通过增加根系分泌物的释放速率来增强土壤微生物活性和加快氮素转化,高养分条件下,植物采取的是低氮收益-低碳投入的生理策略,会降低根系分泌物碳输入速率[6-7, 24]。根系分泌速率的提高给微生物提供更多的养分来源,促使微生物分泌更多的胞外酶以加速土壤有机质分解,从而满足植物和微生物生长所需养分[8]。而充足的氮使得植物更轻易的从根际获取养分,不需要通过加快根系分泌速率的途径来分解矿化难以利用的土壤有机质以获取氮,而是偏好利用易于分解的有机化合物[30]。此时植物通过自我生理调节降低根系分泌物碳的分泌速率[24]。因此,氮养分有效性是驱动根系分泌物碳输入速率的主要因素之一。反之,根系分泌物碳输入也会深刻影响氮素转化过程。植物通过根系释放一些含碳化合物到根际土壤中,给微生物提供养分,引起土壤激发效应,刺激根际土壤微生物群落活动,调控根际土壤氮转化[8, 31]。而且根系分泌物的一些物质还可以作为生物硝化抑制剂,抑制土壤硝化作用,同时促进反硝化作用参与调控土壤氮转化过程[31]。如MEIER et al[8]研究发现,添加根系分泌物对微生物裂解氨基酸的蛋白水解酶活性有积极影响。LANGARICA-FUENTES et al[32]发现,随着根系分泌物碳输入的增加,土壤硝态氮含量显著下降,且N2O排放速率增加,反硝化速率显著增加。胡凯等[33]发现向土壤中添加人工模拟根系分泌物能明显提高固氮功能基因nifH和反硝化功能基因nosZ的数量。因此,根系分泌物与根际土壤氮素相互影响,在森林生态系统养分循环中发挥重要作用。
通过凋落物人为添加和去除,研究凋落物处理对马尾松和短柱茶根系分泌物碳输入、根际土壤氮素状况及氮转化相关酶活性的影响,并分析其相关关系。凋落物输入量变化对马尾松和短柱茶根系分泌物碳输入速率无显著影响,马尾松和短柱茶根系分泌物碳输入速率无显著差异。凋落物输入量变化不显著影响根际土壤氮含量及马尾松根际土壤氮转化相关酶活性,短柱茶根际土壤硝酸还原酶活性表现为去除凋落物大于对照,其余氮转化相关酶活性未表现出现显著差异。单位根长根系分泌物碳输入速率与根际土壤全氮含量呈显著负相关关系,单位根表面积根系分泌物碳输入速率与根际土壤硝态氮含量呈显著负相关关系。本研究初步探索了凋落物输入量变化对根系分泌物碳输入速率的影响,但可能凋落物处理年限较短或林分年龄较大,植物根系分泌物碳输入还未表现出明显的响应,因此未来可以继续开展长时间、不同林龄、不同植物类型的定位研究。
| [1] |
SAXE H, CANNELL M G R, JOHNSEN Y, et al. Tree and forest functioning in response to global warming[J]. New Phytologist, 2001, 149(3): 369-399. DOI:10.1046/j.1469-8137.2001.00057.x |
| [2] |
林文泉, 高伟, 叶功富, 等. 南亚热带海岸沙地不同林分凋落物量及养分归还[J]. 森林与环境学报, 2019, 39(3): 225-231. |
| [3] |
BADRI D V, VIVANCO J M. Regulation and function of root exudates[J]. Plant, Cell & Environment, 2009, 32(6): 666-681. |
| [4] |
DIJKSTRA F A, CHENG W X. Interactions between soil and tree roots accelerate long-term soil carbon decomposition[J]. Ecology Letters, 2007, 10(11): 1046-1053. DOI:10.1111/j.1461-0248.2007.01095.x |
| [5] |
PHILLIPS R P, BERNHARDT E S, SCHLESINGER W H. Elevated CO2 increases root exudation from loblolly pine (Pinus taeda) seedlings as an N-mediated response[J]. Tree Physiology, 2009, 29(12): 1513-1523. DOI:10.1093/treephys/tpp083 |
| [6] |
PHILLIPS R P, FINZI A C, BERNHARDT E S. Enhanced root exudation induces microbial feedbacks to N cycling in a pine forest under long-term CO2 fumigation[J]. Ecology Letters, 2011, 14(2): 187-194. DOI:10.1111/j.1461-0248.2010.01570.x |
| [7] |
YIN HJ, LI Y F, XIAO J, et al. Enhanced root exudation stimulates soil nitrogen transformations in a subalpine coniferous forest under experimental warming[J]. Global Change Biology, 2013, 19(7): 2158-2167. DOI:10.1111/gcb.12161 |
| [8] |
MEIER I C, FINZI A C, PHILLIPS R P. Root exudates increase N availability by stimulating microbial turnover of fast-cycling N pools[J]. Soil Biology and Biochemistry, 2017, 106: 119-128. DOI:10.1016/j.soilbio.2016.12.004 |
| [9] |
LAJTHA K, BOWDEN R D, NADELHOFFER K. Litter and root manipulations provide insights into soil organic matter dynamics and stability[J]. Soil Science Society of America Journal, 2014, 78(S1): 261-269. DOI:10.2136/sssaj2013.08.0370nafsc |
| [10] |
FANG X, ZHAO L, ZHOU G Y, et al. Increased litter input increases litter decomposition and soil respiration but has minor effects on soil organic carbon in subtropical forests[J]. Plant and Soil, 2015, 392(1/2): 139-153. DOI:10.1007/s11104-015-2450-4 |
| [11] |
倪惠菁, 苏文会, 范少辉, 等. 养分输入方式对森林生态系统土壤养分循环的影响研究进展[J]. 生态学杂志, 2019, 38(3): 863-872. |
| [12] |
何艺玲, 傅懋毅. 人工林林下植被的研究现状[J]. 林业科学研究, 2002, 15(6): 727-733. DOI:10.3321/j.issn:1001-1498.2002.06.015 |
| [13] |
PHILLIPS R P, ERLITZ Y, BIER R, et al. New approach for capturing soluble root exudates in forest soils[J]. Functional Ecology, 2008, 22(6): 990-999. DOI:10.1111/j.1365-2435.2008.01495.x |
| [14] |
刘庆, 肖娟, 李宇飞, 等. 一种根系分泌物原位收集装置及系统: CN202471455U[P]. 2012-10-03.
|
| [15] |
赵悦. 转Bt基因抗虫棉根分泌物对土壤N转化的影响及机制[D]. 武汉: 华中农业大学, 2016.
|
| [16] |
ZHANG Z L, QIAO M F, LI D D, et al. Do warming-induced changes in quantity and stoichiometry of root exudation promote soil N transformations via stimulation of soil nitrifiers, denitrifiers and ammonifiers?[J]. European Journal of Soil Biology, 2016, 74: 60-68. DOI:10.1016/j.ejsobi.2016.03.007 |
| [17] |
YIN H J, XIAO J, LI Y F, et al. Warming effects on root morphological and physiological traits: the potential consequences on soil C dynamics as altered root exudation[J]. Agricultural and Forest Meteorology, 2013, 180: 287-296. DOI:10.1016/j.agrformet.2013.06.016 |
| [18] |
李娇, 蒋先敏, 尹华军, 等. 不同林龄云杉人工林的根系分泌物与土壤微生物[J]. 应用生态学报, 2014, 25(2): 325-332. |
| [19] |
肖娟. 夜间增温和施氮对两种川西亚高山针叶树幼苗根系分泌物的影响研究[D]. 北京: 中国科学院大学, 2013.
|
| [20] |
熊德成, 黄锦学, 陈光水, 等. 中亚热带米槠和杉木细根分泌物研究初报[J]. 亚热带资源与环境学报, 2015, 10(1): 83-86. DOI:10.3969/j.issn.1673-7105.2015.01.013 |
| [21] |
YIN H Y, WHEELER E, PHILLIPS R P. Root-induced changes in nutrient cycling in forests depend on exudation rates[J]. Soil Biology and Biochemistry, 2014, 78: 213-221. DOI:10.1016/j.soilbio.2014.07.022 |
| [22] |
章晴. 杨-桤混交林根系碳分泌及其对根际土壤氮转化的影响[D]. 南京: 南京林业大学, 2016.
|
| [23] |
翁恩生, 周广胜. 用于全球变化研究的中国植物功能型划分[J]. 植物生态学报, 2005, 29(1): 81-97. DOI:10.3321/j.issn:1005-264X.2005.01.012 |
| [24] |
何为, 杨雪英, 肖娟, 等. 氮素富集对青藏高原东缘窄叶鲜卑花灌丛根系分泌物碳输入的影响[J]. 植物生态学报, 2017, 41(6): 610-621. |
| [25] |
AITKENHEAD-PETERSON J A, KALBITZ K. Short-term response on the quantity and quality of rhizo-deposited carbon from Norway spruce exposed to low and high N inputs[J]. Journal of Plant Nutrition and Soil Science, 2005, 168(5): 687-693. DOI:10.1002/jpln.200420468 |
| [26] |
JOHNSON D W. Progressive N limitation in forests: review and implications for long-term responses to elevated CO2[J]. Ecology, 2006, 87(1): 64-75. DOI:10.1890/04-1781 |
| [27] |
王小平, 肖肖, 唐天文, 等. 连香树人工林根系分泌物输入季节性变化及其驱动的根际微生物特性研究[J]. 植物研究, 2018, 38(1): 47-55. |
| [28] |
阮超越, 刘小飞, 吕茂奎, 等. 杉木人工林凋落物添加与去除对土壤碳氮及酶活性的影响[J]. 土壤学报, 2020, 57(4): 954-962. |
| [29] |
郭晓伟, 张雨雪, 张潇, 等. 长期地上凋落物处理和氮添加对油松-辽东栎混交林表层土壤碳氮组分的影响[J]. 环境科学学报, 2020, 40(7): 2589-2598. |
| [30] |
梁儒彪, 梁进, 乔明锋, 等. 模拟根系分泌物C: N化学计量特征对川西亚高山森林土壤碳动态和微生物群落结构的影响[J]. 植物生态学报, 2015, 39(5): 466-476. |
| [31] |
COSKUN D, BRITTO D T, SHI W M, et al. How plant root exudates shape the nitrogen cycle[J]. Trends in Plant Science, 2017, 22(8): 661-673. DOI:10.1016/j.tplants.2017.05.004 |
| [32] |
LANGARICA-FUENTES A, MANRUBIA M, GILES M E, et al. Effect of model root exudate on denitrifier community dynamics and activity at different water-filled pore space levels in a fertilised soil[J]. Soil Biology and Biochemistry, 2018, 120: 70-79. DOI:10.1016/j.soilbio.2018.01.034 |
| [33] |
胡凯, 陶建平, 黄科, 等. 模拟根系分泌物碳输入对凋落叶分解中微生物群落动态的影响[J]. 应用与环境生物学报, 2020, 26(2): 417-424. |

 2021, Vol. 41
2021, Vol. 41


