文章信息
- 张月高, 王曙光, 龙昊, 黄玲, 李璟, 李娟
- ZHANG Yuegao, WANG Shuguang, LONG Hao, HUANG Ling, LI Jing, LI Juan
- 慈竹扦插苗移栽后不同时期的生理适应性
- The physiological adaptation of Neosinocalamus affinis cuttings at different time periods post-transplantation
- 森林与环境学报,2021, 41(3): 248-254.
- Journal of Forest and Environment,2021, 41(3): 248-254.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.03.004
-
文章历史
- 收稿日期: 2020-10-17
- 修回日期: 2021-01-22
2. 西南林业大学生命科学学院, 云南 昆明 650224;
3. 富宁县剥隘镇中心学校, 云南 富宁 663406
2. College of life Sciences, Southwest Forestry University, Kunming, Yunnan 650224, China;
3. Center School of Bao'ai Town, Funing, Yunnan 663406, China
由于竹类植物的种子很难得到,因此,竹类植物通常采用扦插等无性繁殖技术进行育苗。移栽是竹子扦插苗植苗造林成功与否的关键环节之一。在优越的设施环境条件下培育的竹子扦插苗因生长快、抗性差而导致其对野外环境适应能力差,易死亡[1],因而,移栽后的竹子扦插苗需要进行一段时间的合理管护,使其逐渐适应环境,以减少死亡,这对提高扦插苗的植苗造林成活率非常重要。而叶片是植物体中唯一完全暴露在空气中的营养器官,是植物进行光合作用和蒸腾作用的主要场所[2],也是高等植物光合作用产生可溶性糖和淀粉的主要营养器官[3-4],其结构特征和生理生化等指标是植物对环境适应情况的综合体现。此外,苗木栽植过程中植物失水过多会大大降低植株的成活率[5],因此,应尽量减少移植植株的水分散失,以维持植株正常的生命活动。
慈竹(Neosinocalamus affinis)为禾本科(Gramineae)慈竹属(Neosinocalamus)竹种,不仅可以用于园林绿化,还是造纸等工业生产上的优选原料[6]。长期以来,竹类植物扦插苗移栽后需要如何管护及管护多长时间缺乏相关的文献报道,有关扦插苗移栽驯化过程中的解剖与生理的适应性变化也一直缺乏研究。本研究以移栽后不同时期的慈竹扦插苗叶片作为试验材料,通过研究慈竹扦插苗在移栽驯化过程中叶片的形态与组织解剖结构、光合特性及可溶性糖与淀粉和干物质含量等生理生化指标的变化规律,总结慈竹扦插苗移栽驯化过程中如何管护及最佳管护时间,探讨其驯化过程中的生理适应性特征,可为提高慈竹扦插苗苗期的植苗造林成活率提供理论依据。
1 材料与方法 1.1 试验地概况及材料2019年秋季,于西南林业大学生命科学学院试验基地(25°03′N,102°45′E,秋季平均气温18~25 ℃,降温较快,天气干燥)选取移栽1、2、3个月后的慈竹扦插苗和完全适应环境的3年生慈竹扦插苗的健康功能叶片作为试验材料。其中,选取移栽后各时期扦插苗功能叶片各30片放于50%FAA固定液中浸泡固定[7],用作叶片解剖结构观察的备用材料,其余叶片装入保温箱并及时带回实验室,测定叶片含水量,用于测定可溶性糖和淀粉含量的叶片材料放于-80 ℃超低温冰箱保存备用。
1.2 试验方法 1.2.1 叶片下表皮气孔观察使用Nikon-ECLIPSE 400荧光显微镜观察新鲜的慈竹叶片下表皮气孔[7]。叶片表皮的气孔在365 nm紫外波长下自发蓝色的荧光。利用二维测量软件DS-300测量气孔的长和宽[7](每个指标测100个数据,取平均值)。
1.2.2 叶片解剖结构观察采用常规石蜡切片技术[8]对已固定备用的慈竹叶片进行叶横切制片[7]。运用高碘酸-席夫试剂染色法(PAS反应法)染色[9],观察叶片淀粉粒。利用二维测量软件DS-300测量叶片、角质层和表皮细胞的厚度,泡状细胞和梭形细胞的面积[8](每个指标测100个数据,取平均值)。
1.2.3 叶片生理指标测定在同一环境条件下,使用便携式托普3051 D光合作用测定仪测定移栽后不同时期的慈竹扦插苗功能叶片的净光合速率(Pn)和蒸腾速率(Tr)[7]。选取移栽后不同时期慈竹扦插苗健康的功能叶片,并用纸巾擦去叶片表面的污物,称取新鲜叶片各10 g,然后将选取的叶片放于110 ℃烘箱中杀青1 h,再用75 ℃烘箱烘干至恒质量,烘干的材料取出后可以放于干燥器中冷却[7],称量,用于测定叶片的干鲜质量比和含水量,重复3次,取平均值。
用苯酚-硫酸比色法[10]测定移栽后不同时期慈竹扦插苗叶片中的可溶性糖和淀粉的含量,重复3次,取平均值。
1.2.4 数据处理与分析运用SPSS 23.0软件对数据进行统计及LSD法多重比较分析。
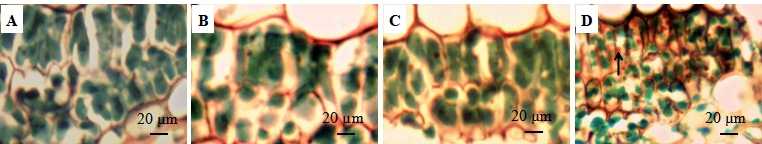
2 结果与分析 2.1 移栽后不同时期扦插苗叶片气孔的特征荧光显微镜下可见慈竹叶片下表皮气孔呈长椭圆形,并纵向成行排列于叶脉两侧(图 1A~D)。移栽1个月后的慈竹扦插苗和移栽2个月后的慈竹扦插苗叶片气孔排列相近,前者多为2层排列,零星出现3层(图 1A),后者为2~3层排列(图 1B);移栽3个月后的慈竹扦插苗叶片气孔多为3层排列,零星出现2层(图 1C);3年生慈竹扦插苗叶片气孔多为3~4层(图 1D),气孔间呈交替排列,且排列紧密。随着移栽时间的延长,慈竹叶片单位面积气孔密度显著增大,气孔长度与宽度逐渐变小,移栽3 a的慈竹扦插苗叶片气孔长、宽最小(表 1)。

|
注:A.移栽1个月后扦插苗;B.移栽2个月后扦插苗;C.移栽3个月后扦插苗;D.3年生扦插苗。 Note: A.cuttings after transplantation at one month; B. cuttings after transplantation at two months; C.cuttings after transplantation at three months; D.cuttings after transplantation at three years. 图 1 移栽后不同时期的叶片气孔分布(气孔显示蓝色荧光) Fig. 1 Leaf stomatal distribution at different time periods post-transplantation (blue fluorescence indicates leaf stomata) |
| 移栽后时间Post-transplantation time | 气孔密度Stomatal density/(ind·mm-2) | 气孔长度Stomatal length/μm | 气孔宽度Stomatal breadth/μm |
| 1个月One month | 394.99±5.76d | 8.79±0.14a | 6.93±0.15a |
| 2个月Two months | 423.20±4.98c | 8.65±0.08a | 5.73±0.15b |
| 3个月Three months | 499.54±1.66b | 8.48±0.29a | 5.21±0.22c |
| 3 a Three years | 554.31±6.64a | 7.93±0.13b | 3.53±0.03d |
| 注:同列数字后不同字母代表存在显著差异(P < 0.05)。Note:different letters following numbers in the same column indicate a significant difference (P < 0.05). | |||
移栽后不同时期的慈竹扦插苗叶片大小和厚度存在显著差异。移栽后,慈竹扦插苗叶片逐渐增大、增厚(表 2)。移栽1个月、2个月后的慈竹扦插苗叶片大小相近,移栽3个月与移栽3 a的慈竹扦插苗叶片大小更为接近。移栽1个月后的慈竹扦插苗叶片的平均长度、宽度、厚度分别比移栽3 a的小6.33 cm、0.98 cm、36.12 μm。
| 移栽后时间 Post-transplantation time |
叶片长 Leaf length/cm |
叶片宽 Leaf breadth/cm |
叶片厚 Leaf thickness/μm |
上角质层厚 Upper cuticle thickness/μm |
下角质层厚 Lower cuticle thickness/μm |
| 1个月One month | 21.53±0.44d | 4.17±0.04d | 90.75±0.49d | 0.79±0.02d | 0.74±0.04d |
| 2个月Two months | 22.91±0.21c | 4.35±0.07c | 96.14±0.94c | 1.06±0.08c | 0.88±0.05c |
| 3个月Three months | 25.58±0.84b | 4.58±0.07b | 99.73±0.74b | 2.11±0.03b | 1.31±0.03b |
| 3 a Three years | 27.86±0.25a | 5.15±0.08a | 126.87±0.53a | 3.48±0.06a | 3.47±0.06a |
| 移栽后时间 Post-transplantation time |
上表皮厚 Upper epidermis thickness/μm |
下表皮厚 Lower epidermis thickness/μm |
泡状细胞面积 Area of bulliform cells/μm2 |
梭形细胞面积 Area of spindle cells/μm2 |
|
| 1个月One month | 10.95±0.42c | 7.37±0.06d | 696.29±14.08d | 2 134.80±46.62a | |
| 2个月Two months | 11.96±0.11b | 7.59±0.09c | 765.81±24.8c | 1 936.08±85.44b | |
| 3个月Three months | 13.35±0.52a | 7.93±0.09b | 806.43±17.55b | 1 716.36±49.30c | |
| 3 a Three years | 13.75±0.33a | 8.51±0.14a | 1 217.77±12.68a | 1 542.72±52.65d | |
| 注:同列数字后不同字母代表存在显著差异(P < 0.05)。Note:different letters following numbers in the same column indicate a significant difference (P < 0.05). | |||||
显微镜下可见慈竹叶片的上、下表皮外壁上均具有连续分布的角质层,经番红染色后呈红色(图 2A~D)。随着移栽时间的延长,慈竹叶片上、下角质层显著增厚,且移栽后各时期的慈竹扦插苗叶片上角质层厚度均大于下角质层,上角质层厚度0.79~3.48 μm,下角质层厚度0.74~3.47 μm(表 2)。慈竹叶片的上表皮和下表皮都只有一层紧凑排列的表皮细胞。随着移栽时间的延长,慈竹扦插苗叶片上、下表皮细胞逐渐变大,且上表皮细胞比下表皮细胞要大,上表皮细胞厚度为下表皮细胞厚度的1.49~1.62倍(表 2,图 2A~D)。移栽1个月、2个月的慈竹扦插苗叶片上表皮厚度明显小于3年生慈竹扦插苗叶片上表皮,移栽3个月与移栽3 a的慈竹扦插苗叶片的上、下表皮厚度更接近。

|
注:A.移栽1个月后扦插苗;B.移栽2个月后扦插苗;C.移栽3个月后扦插苗;D.3年生扦插苗(UC为上角质层;LC为下角质层;UE为上表皮;LE为下表皮;MC为泡状细胞;ME为叶肉细胞;SC为梭形细胞)。 Note: A.cuttings after transplantation at one month; B.cuttings after transplantation at two months; C.cuttings after transplantation at three months; D.cuttings after transplantation at three years (UC means upper cuticle; LC means lower cuticle; UE means upper epidermis; LE means lower epidermis; MC means motor cell; ME means mesophyll cell; SC means spindle cell). 图 2 移栽后不同时期的叶片横切面显微结构 Fig. 2 Micro-structure of cross-sections of leaves at different time periods post-transplantation |
慈竹叶片的每个泡状细胞复合体由2~6个大小不一、形状多样的无色透明状细胞组成。随着慈竹扦插苗移栽时间的延长,组成叶片泡状细胞复合体的细胞数量逐渐减少,泡状细胞面积逐渐增大(表 2,图 2A~D)。移栽1个月、2个月的慈竹扦插苗叶片泡状细胞复合体分别由5~6个(图 2A)、3~4个(图 2B)大小不一的泡状细胞共同组成,且泡状细胞伸入叶肉的深度较接近。移栽3个月、3 a的慈竹扦插苗叶片泡状细胞复合体都由2~3个大型的泡状细胞组成,3年生慈竹扦插苗叶片的泡状细胞下陷程度更深(图 2C、D)。完全适应环境的移栽3 a后的慈竹扦插苗叶片泡状细胞面积约是移栽1个月后的1.75倍。
2.2.4 梭形细胞面积在慈竹叶片的叶脉、细脉两侧分布有近透明状的梭形细胞,且随着移栽时间的延长,慈竹扦插苗叶片的梭形细胞面积明显逐渐减小(表 2,图 2A~D)。移栽1个月的慈竹扦插苗叶片梭形细胞呈不规则长条状,移栽2个月、3个月的慈竹苗和3年生的慈竹苗叶片梭形细胞近梭形,且移栽1个月的慈竹扦插苗叶片梭形细胞面积是移栽3 a的1.38倍(表 2,图 2A)。
2.3 移栽后不同时期扦插苗叶片生理指标动态变化 2.3.1 光合速率和蒸腾速率的日变化随着移栽时间的延长,慈竹扦插苗叶片的净光合速率逐渐增强[图 3(a)]。移栽1个月的慈竹扦插苗叶片净光合速率在10:00最大,“午休”现象不明显。移栽2个月、3个月、3 a的慈竹扦插苗叶片的净光合速率在10:00和14:00达到峰值,而且这两个值相差较小,在12:00时都出现了明显的光合“午休”现象,“午休”现象的出现反映了慈竹扦插苗逐渐适应环境的过程,以减少叶片水分的散失。
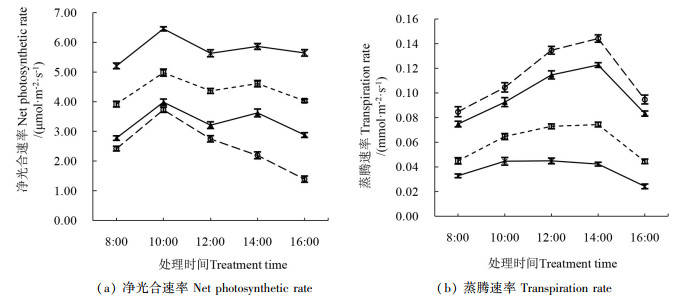
|
图 3 移栽后不同时期的叶片净光合速率(Pn)和蒸腾速率(Tr)日变化 Fig. 3 3 Diurnal changes in leaf net photosynthetic and transpiration rates at different time periods post-transplantation |
慈竹扦插苗叶片的蒸腾速率随着移栽时间的延长而逐渐降低[图 3(b)]。移栽后的前3个月,慈竹扦插苗叶片蒸腾速率均在14:00前呈上升趋势,在14:00出现峰值。而移栽3 a的慈竹扦插苗蒸腾速率在12:00有峰值,变化趋势比较缓和,14:00开始逐渐下降,逐渐接近于甚至低于12:00的,在16:00时,移栽后各时期的慈竹扦插苗叶片蒸腾速率都比10:00至12:00的低,移栽3个月后和移栽3 a后的慈竹扦插苗叶片蒸腾速率在16:00甚至比8:00还低[图 3(b)]。因此,移栽后的前3个月慈竹扦插苗应该在16:00后进行浇水,以防止水分过度散失。在10:00至14:00时间段,若光照太强、环境温度过高则应对其进行适当的遮阴。
2.3.2 叶片干鲜质量、可溶性糖与淀粉含量的变化随着移栽时间的延长,慈竹扦插苗叶片含水量、可溶性总糖含量、淀粉含量及淀粉粒数量均发生显著变化。移栽1个月、2个月、3个月的扦插苗叶片干鲜质量比持续增加,而叶片含水量持续下降(表 3)。
| 移栽后时间Post-transplantation time | 干鲜质量比Dry fresh weight ratio | 含水量Content of water/% | 可溶性糖含量Content of soluble sugar/(μg·g-1) | 淀粉含量Content of starch/(μg·g-1) | 淀粉粒Density of starch granules/(grains·mm-2) |
| 1个月One month | 0.44±0.02b | 56.40±0.30a | 1.72±0.01a | 0.22±0.01d | 4.98±0.42d |
| 2个月Two months | 0.45±0.01b | 55.50±0.30b | 1.56±0.02b | 0.46±0.01c | 13.28±0.74c |
| 3个月Three months | 0.46±0.01b | 54.43±0.22c | 0.68±0.01c | 1.47±0.01b | 21.58±1.73b |
| 3 a Three years | 0.54±0.01a | 46.22±0.43d | 0.35±0.01d | 3.54±0.02a | 51.45±2.24a |
| 注:同列数字后不同字母代表存在显著差异(P < 0.05)。Note:different letters following numbers in the same column indicate a significant difference (P < 0.05). | |||||
移栽后的慈竹扦插苗叶片中可溶性糖含量逐渐减少,而淀粉含量及淀粉粒数量则逐渐增多。此外,移栽1个月、2个月的扦插苗叶片中可溶性糖含量比淀粉含量多,而移栽3个月和移栽3 a后的慈竹扦插苗叶片淀粉含量高于可溶性糖含量。移栽3个月后的慈竹扦插苗叶片中淀粉粒的数量显著多于移栽1个月和2个月后的,且3 a生扦插苗叶片中淀粉粒数量是移栽1个月后的10.33倍(表 3,图 4A~D)。随着移栽时间的延长,慈竹扦插苗叶片中干鲜质量比、淀粉含量及淀粉粒数量显著增加,光合速率逐渐提高,叶片干物质逐渐增加,因而积累更多的光合产物,反映了慈竹扦插苗的适应性逐渐增强。
|
注:A.移栽1个月后扦插苗;B.移栽2个月后扦插苗;C.移栽3个月后扦插苗;D.3年生扦插苗(PAS反应后,淀粉粒呈不同深度红色的颗粒,箭头:淀粉粒)。 Note: A.cuttings after transplantation at one month; B.cuttings after transplantation at two months; C.cuttings after transplantation at three months; D.cuttings after transplantation at three years (starch granules showed varying degrees of red staining after the PAS staining. The arrow indicates a starch granules). 图 4 移栽后不同时期的叶片淀粉粒的分布 Fig. 4 The distribution of leaf starch granules at different time periods post-transplantation |
光照、温度、CO2浓度和水分条件等环境因素都会影响气孔特征,高浓度CO2和高温条件下,气孔密度减小[11-12]。水分过多气孔密度加大[13],水分过少气孔密度也加大,且气孔变小[14]。本研究中,移栽1个月、2个月后的扦插苗叶片气孔较大、排列较稀疏,而移栽3个月、3 a的扦插苗叶片气孔更小、排列更密集。随着移栽时间的延长,慈竹扦插苗叶片气孔逐渐变小、数量逐渐增多,叶片的这些生理指标变化反映了慈竹扦插苗逐渐适应外界的环境。
3.2 移栽后不同时期扦插苗叶片解剖结构的变化叶片会随着环境温度的升高而变薄,随着环境温度降低而变厚,而叶片的大小受温度变化影响不明显[15-16]。随着移栽时间的延长,慈竹扦插苗叶片面积逐渐增大,叶片与角质层及上下表皮细胞逐渐增厚,叶片增厚的过程也是慈竹扦插苗对环境适应能力增强的过程。
随着移栽时间的延长,慈竹扦插苗叶片角质层和表皮逐渐增厚,进而保水能力提高,环境适应能力增强,叶片的蒸腾作用逐渐减小,进而避免叶片由于过度失水造成扦插苗死亡。叶片厚度、上下表皮及角质层厚度增加,叶片干物质含量也增加,进而提高了叶片的干鲜质量比。
叶片缺水时,泡状细胞面积增大、下陷程度更深,且下陷程度越深,泡状细胞复合体对叶片运动能力的控制越强,进而减少水分散失,以适应环境的改变[17]。随着移栽时间的延长,慈竹扦插苗叶片泡状细胞面积逐渐增大,下陷程度加深,对水分散失的控制能力增强,这也反映了慈竹扦插苗对环境的适应能力增强。因此,叶片各组织解剖结构的变化,可以作为判断慈竹幼苗对环境适应能力提高的一个重要标准。
目前梭形细胞的功能尚未明确,有研究者认为梭形细胞是细胞间隙或是空腔[18],也有研究者推测光合作用的强弱与梭形细胞面积的大小有关[19]。慈竹扦插苗移栽后叶片的叶肉逐渐增厚、梭形细胞面积减小,慈竹扦插苗对环境适应能力逐渐增强,推测梭形细胞可能受两侧叶肉细胞的挤压而变小,也可能与叶片水分蒸腾有关,需进一步研究。
3.3 移栽后不同时期扦插苗叶片生理指标变化竹子移植过程中会对竹根造成一定程度的破坏,进而影响植株对水分的吸收能力,若环境中的水分不能维持植株的正常生命活动,植株就会枯萎甚至死亡[20]。光照太强和温度过高时,叶片蒸腾作用增强,植物叶片通过散发水分来降低自身的温度[21-23]。光照强度和环境温度会影响叶片净光合速率,使得气孔闭合或张开,因此叶片蒸腾速率会出现早晚较低,中午较高的现象[24]。本研究中,与3年生的慈竹扦插苗相比,新移栽的慈竹苗可能由于叶片及其角质层较薄,上、下表皮细胞较薄,叶片含水量较高,光合作用能力较弱,蒸腾速率较大,因而植株更容易受到环境变化带来的伤害。随着移栽时间的延长,慈竹扦插苗叶片及其表皮、角质层逐渐增厚,蒸腾速率逐渐减小,叶片的保水能力逐渐增强,叶片的净光合速率逐渐增强,叶片逐渐出现了光合“午休”的现象,干物质含量不断增加。其中,移栽3个月后的慈竹扦插苗叶片的各项解剖结构与生理指标更接近野外条件下已经生长3 a的慈竹扦插苗。反映了慈竹扦插苗叶片较厚的角质层和表皮细胞可以减少植株因中午高温、强光照带来的过度蒸腾而失水,表明植株逐渐适应野外自然环境。此外,根据移栽后慈竹扦插苗的蒸腾速率日变化曲线,认为新出圃移栽的慈竹扦插苗在10:00—14:00时段应适当遮阴,以防止环境光照太强、温度过高而导致植株因过度蒸腾而失水。
植物受到环境胁迫时,容易引起机体内碳水化合物代谢加快、抗逆能力增强,以适应环境的变化[25]。植株体内的淀粉含量会随环境的变化而改变。逆境下,植株体内淀粉发生水解,转化为糖类物质[26]。光合作用降低导致植物叶片中淀粉含量降低[27]。而植物体内的可溶性糖含量会随干旱或低温程度的加深而不断增加,这可能与植物叶片的淀粉水解加快有关[28]。本研究中,移栽1个月、2个月的慈竹扦插苗叶片的可溶性总糖含量较高,淀粉含量相对较低,而移栽3个月、3 a后的慈竹扦插苗叶片的可溶性糖含量均低于淀粉含量,这可能由于移栽后的前2个月慈竹扦插苗为了更好地适应野外环境,新陈代谢比较旺盛,光合产物分解和转运速度相对较快,积累的光合产物较少,而移栽3个月后的慈竹扦插苗相比于移栽1个月、2个月后的慈竹扦插苗积累更多的光合产物,积累的糖分主要以临时贮藏淀粉粒的形式贮藏在叶肉中,这反映了植株光合能力逐渐提高,表明移栽3个月后的植株已经充分适应环境,具有更高的光合碳同化能力,这也是慈竹扦插苗逐渐适应环境的结果。因此,叶片淀粉含量的高低能够直接反映移栽后的慈竹扦插苗对环境的适应情况。
出圃移栽后的前3个月是慈竹扦插苗驯化的关键时间段,也是慈竹扦插苗植苗造林成功与否的关键。出圃移栽后的前3个月,必须对慈竹扦插苗进行适当地管护,以使其各项指标尽快达到完全适应环境的标准,避免由于管护不当造成扦插苗的死亡从而导致慈竹扦插苗造林的失败。该研究可以为提高慈竹扦插苗植苗造林及其经营管理提供相关的理论指导和依据。
| [1] |
刘伟涛. 园林绿化苗木栽植及成活率措施要点分析[J]. 现代园艺, 2019, 394(22): 38-39. |
| [2] |
马炜梁, 王幼芳, 李宏庆. 植物学[M]. 北京: 高等教育出版社, 2009.
|
| [3] |
王晓慧, 徐克章, 李大勇, 等. 大豆品种遗传改良过程中叶片可溶性糖含量和比叶重的变化[J]. 大豆科学, 2007, 26(6): 879-884. DOI:10.3969/j.issn.1000-9841.2007.06.014 |
| [4] |
庄波, 徐克章, 杜双洋, 等. 新、老大豆品种冠层产量和光合作用的比较[J]. 华南农业大学学报, 2010, 31(1): 6-9. DOI:10.3969/j.issn.1001-411X.2010.01.002 |
| [5] |
侯晶东, 曹兵, 宋丽华. 3种落叶树种苗木失水及电特性与栽植成活率间的关系初探[J]. 中国农学通报, 2011, 27(8): 17-22. |
| [6] |
QI J Q, CHI B, XIE J L, et al. Study on variations of fiber morphology and tissue proportion of Neosinocalamus affinis culm[J]. Trans China Pulp Paper, 2013, 28(3): 1-4. |
| [7] |
黄玲, 初彩华, 邓琳, 等. 不同栽培条件下的勃氏甜龙竹苗的叶片结构与光合特性研究[J]. 西部林业科学, 2020, 49(2): 68-74. |
| [8] |
李正理. 植物组织制片[M]. 北京: 北京大学出版社, 1996.
|
| [9] |
胡适宜, 徐丽云. 显示环氧树脂厚切片中多糖、蛋白质和脂类的细胞化学方法[J]. 植物学报, 1990, 32(11): 841-846. |
| [10] |
HANNAH L C, GIROUX M, BOYER C. Biotechnological modification of carbohydrates for sweet corn and maize improvement[J]. Scientia Horticulturae, 1993, 55(1/2): 177-197. |
| [11] |
WOODWARD F I, KELLY C K. The effect of CO2 concentration on stomatal density[J]. New Phytology, 1995, 131(3): 311-327. DOI:10.1111/j.1469-8137.1995.tb03067.x |
| [12] |
BEERLING D J, CHALONER W G. The impact of atmospheric CO2 and temperature changes on stomatal density: observations from Quercus robur Lammas leaves[J]. The Annals of Botany, 1993, 71(3): 231-235. DOI:10.1006/anbo.1993.1029 |
| [13] |
TICHA I, CATSK J. Photosynthetic characteristics during ontogenesis of leaves stomatal density and size[J]. Photosynthetica, 1982, 16(1): 371-375. |
| [14] |
齐红岩, 刘洋, 刘海涛. 水分亏缺对番茄叶片气孔特性及叶绿体超微结构的影响[J]. 西北植物学报, 2009, 29(1): 9-15. DOI:10.3321/j.issn:1000-4025.2009.01.002 |
| [15] |
王勋陵, 王静. 植物形态结构与环境[M]. 兰州: 兰州大学出版社, 1989.
|
| [16] |
罗文文, 高琛稀, 张东, 等. 不同海拔环境因子对富士苹果叶片和果实品质的影响[J]. 应用生态学报, 2014, 25(8): 2243-2250. |
| [17] |
朱宇旌, 张勇, 胡自治, 等. 小花碱茅叶适应盐胁迫的显微结构研究[J]. 中国草地学报, 2001, 23(2): 19-22. |
| [18] |
METCALFE C R. Anatomy of the monocotyledons: I.Gramineae[M]. Oxford: Clarendon Press, 1960.
|
| [19] |
龙春玲, 刘腾飞, 于芬, 等. 厚壁毛竹与毛竹叶的光学解剖结构比较分析[J]. 安徽农业大学学报, 2015, 42(1): 39-44. |
| [20] |
赵好战, 马拥军, 王维佳. 竹子引种及应用技术研究报告[J]. 河北林果研究, 2003, 18(3): 262-267. DOI:10.3969/j.issn.1007-4961.2003.03.015 |
| [21] |
胡新生, 王世绩. 树木水分胁迫生理与耐旱性研究进展及展望[J]. 林业科学, 1998, 34(2): 78-89. |
| [22] |
肖文发, 徐德应, 刘世荣, 等. 杉木人工林叶光合与蒸腾作用的时空特征[J]. 林业科学, 2002, 38(5): 38-46. DOI:10.3321/j.issn:1001-7488.2002.05.007 |
| [23] |
刘奉觉, 郑世楷, 巨关升, 等. 树木蒸腾耗水测算技术的比较研究[J]. 林业科学, 1997, 33(2): 117-125. DOI:10.3321/j.issn:1001-7488.1997.02.003 |
| [24] |
黄真娟. 安吉毛竹光合特性及固碳释氧和降温增湿效应的研究[D]. 安吉: 浙江农林大学, 2014.
|
| [25] |
李春霞. 苹果对水分胁迫的反应特点及研究方向[J]. 陕西农业科学, 2010, 56(4): 69-73. DOI:10.3969/j.issn.0488-5368.2010.04.031 |
| [26] |
袁琳, 克热木·伊力. 盐胁迫对阿月浑子可溶性糖、淀粉、脯氨酸含量的影响[J]. 新疆农业大学学报, 2004, 27(2): 19-23. DOI:10.3969/j.issn.1007-8614.2004.02.004 |
| [27] |
李丹丹, 张丹, 张有利, 等. 弱光对黄瓜幼苗叶片光合产物积累的影响[J]. 黑龙江八一农垦大学学报, 2019, 31(1): 1-6. DOI:10.3969/j.issn.1002-2090.2019.01.001 |
| [28] |
李小安. 低温胁迫对青藏扁蓿豆与和田苜蓿种子游离脯氨酸和可溶性糖含量的影响[J]. 青海大学学报(自然科学版), 2011, 29(4): 10-13. DOI:10.3969/j.issn.1006-8996.2011.04.004 |

 2021, Vol. 41
2021, Vol. 41


