文章信息
- 朱静, 樊月, 欧阳玉莹, 洪滔, 陈建忠, 林晗
- ZHU Jing, FAN Yue, OUYANG Yuying, HONG Tao, CHEN Jianzhong, LIN Han
- 铝胁迫对千年桐吸收和运输微量元素的影响
- Effects of aluminum stress on the absorption and transportation of microelement in the roots and leaves of Aleurites montana
- 森林与环境学报,2021, 41(3): 234-241.
- Journal of Forest and Environment,2021, 41(3): 234-241.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2021.03.002
-
文章历史
- 收稿日期: 2021-02-20
- 修回日期: 2021-04-19
2. 福建省高校森林生态系统过程与经营重点实验室, 福建 福州 350002;
3. 建阳市林业局, 福建 建阳 354200
2. Key Lab for Forest Ecosystem Processes and Management in Fujian Province, Fuzhou, Fujian 350002, China;
3. Jianyang Forestry Adiministration, Jianyang, Fujian 354200, China
铝是地壳中含量最丰富的金属元素,约占地壳总质量的7.73%。铝在土壤中的存在形式多种多样,一般情况下以硅酸盐或三氧化二铝为主[1],而在pH值低于4.5的酸性土壤环境中,铝主要以毒性较强的Al3+的形式存在,对植物造成严重的毒害作用[2]。近年来,随着酸雨问题日益严重,加速了土壤酸化及铝的溶出,使土壤环境中活性铝的数量明显上升,加剧了土壤中铝富集[3]。亚热带地区是我国酸性土壤的主要分布区,该地区水热资源极为丰富,林业发展潜力较大,而一系列酸性土壤胁迫因子极大限制了土壤生产潜力的发挥[4-5]。其中,铝毒害已经成为减缓林木生长、导致人工林减产和质量下降的重要原因[6]。
千年桐(Aleurites montana Lour.)属于南方丘陵山地常见的落叶阔叶树种,耐旱、耐瘠且固土能力强,是我国南方酸性土壤上重要的乡土树种[7-8],由于其凋落物养分回归快、维护地力效果好、天然更新能力强,作为生态公益林树种在我国南方林区大面积栽植[9]。然而,南方林区是我国酸雨的主要分布区[10-11],且分布着以红壤为主的酸性富铝化土壤。该区土壤长期遭受铝毒害[12],导致林木产量减少、林分退化,影响了造林和营林工作的顺利开展[13]。例如杉木[Cunninghamia lanceolata (Lamb.) Hook.]因遭受酸铝毒害,凋落物分解受到抑制,出现林木养分循环受阻、地力衰退等现象;马尾松(Pinus massoniana Lamb.)遭受酸铝毒害后会出现光合作用减慢、叶片枯萎及生长迟滞等现象[14-15]。因此,如何提高我国南方林木的耐铝性是林木产业发展中急需解决的问题,而揭示铝毒害对林木的影响是解决这一问题的关键。
根系是植物吸收水分和养分的器官,铝对植物的毒害作用首先表现在根尖上,根尖是铝毒害的关键部位。有研究发现,铝胁迫可抑制花生(Arachis hypogaea Linn.)[16]、油菜(Brassica napus L.)[6]、水稻(Oryza sativa L.)[17]等根系的生长发育。对木本植物铝毒害的研究表明,铝胁迫会显著降低马尾松根系生理指标含量[18],抑制杉木根部DNA合成和根尖细胞分裂[19]。同时,叶片作为对环境变化较敏感且可塑性较强的器官,在植物生长过程中受铝胁迫的影响也较显著。铝胁迫浓度较高时,会影响橡胶[Hevea brasiliensis (Willd. ex A. Juss.) Muell. Arg.]苗叶片的生理指标及光合作用[20],还会造成杉木幼苗叶片细胞膜系统的破坏和活性氧防御系统失衡[12]。因此,了解铝胁迫下植物根系和叶片的养分元素变化具有重要的理论价值和实际意义。微量元素在植物体内尽管含量较少,但其作为许多酶的重要组分和生理过程的活化剂,在植物生命活动过程中发挥十分重要的作用,影响植株代谢活动的变化。鉴于此,本研究以1年生千年桐盆栽苗和水培苗为试验材料,在不同的供铝水平下,测定千年桐苗木根系和叶片中微量元素(Fe、Mn、Cu、Zn)含量,以探索不同介质条件千年桐在不同浓度铝胁迫下微量元素的差异,分析铝胁迫下微量元素在根系和叶片间吸收和运输的规律,为林木抗铝毒研究提供理论依据,以促进我国南方酸性土壤地区林木的可持续发展。
1 材料与方法 1.1 试验材料试验材料为福建省建阳市林业局提供的1年生千年桐苗木[苗高(80.462±9.858) cm,地径(13.23±2.761) mm]。2017年4月,选择地径和苗高较为一致的千年桐苗木,以每盆1株定植于塑料盆(上口径26.0 cm、下口径20.5 cm、高27.0 cm)中,每盆均盛入9 kg黄心土,土壤中有机质含量为8.246 1 mg·g-1,全氮含量为0.173 8 mg·g-1,水解氮含量为0.057 1 mg·g-1;全磷含量为0.347 6 mg·g-1,有效磷含量为0.013 1 mg·g-1。经30 d恢复性生长后供土培盆栽试验。另外,选择地径和苗高较为一致的千年桐苗木50株,以每桶2株放入塑料桶(上口径26.0 cm、下口径20.5 cm、高27.0 cm)中,每桶均盛入9 L Hoagland不完全营养液(pH值=4.5)[21],15 d后供水培试验。
1.2 试验设计土培千年桐铝胁迫试验设计:共设置6个铝胁迫浓度梯度,参考前人方法[22],铝以AlCl3·6H2O配置成溶液,依次为:(CK) 0、(T1)30、(T2)70、(T3)120、(T4)180、(T5)250、(T6)320 mg·L-1,共7个处理,每个处理10个重复,共70株千年桐幼苗。每隔2 d将上述不同处理铝胁迫溶液施入千年桐盆栽中,每次施入200 mL,注意避免直接接触植株而引起烧苗,分5次完成。120 d后开始进行千年桐叶片和根系微量元素的测定。
水培千年桐铝胁迫试验设计:共设置6个铝胁迫浓度梯度,铝以AlCl3·6H2O配置成溶液,溶液中的铝离子浓度通过AlCl3·6H2O的量换算(与土培苗木铝处理浓度相同,单位不同),依次为:(CK)0、(T1)0.124、(T2)0.290、(T3)0.497、(T4)0.746、(T5)1.035、(T6)1.325 mmol·L-1,共7个处理,每个处理4个重复,共28株千年桐幼苗。定植后,每天7:00、15:00、23:00用氧气泵给苗木通气1 h,每隔5 d更换营养液,铝在更换营养液时施入。胁迫45 d后进行千年桐叶片和根系微量元素含量的测定。
1.3 样品采集与处理铝胁迫试验后,每个处理随机选择5株苗木,选取冠部完整健康的成熟叶片和生长正常的细根,每种处理共计叶片30枚、细根30条。用去离子水洗净,70 ℃烘干至质量不再减少,研磨过筛后用于测定叶片和根系中Fe、Mn、Cu、Zn含量。
1.4 测定方法植物根系和叶片Fe、Mn、Cu、Zn含量采用电感耦合等离子体发射光谱仪(美国PE公司Optima 2100 DV型ICP-OES)进行测定。
1.5 数据处理使用SPSS 19.0统计软件进行数据方差分析,采用Duncan′s multiple comparison检验其相关性,显著性水平P=0.05;使用Origin 9.0绘图软件进行图形绘制。
2 结果与分析 2.1 铝胁迫对千年桐盆栽苗根系和叶片微量元素的影响与CK相比,铝处理显著促进了千年桐盆栽苗根系Fe、Mn、Cu、Zn及叶片Zn的积累,而对叶片Fe、Mn、Cu元素含量变化无显著影响(P>0.05),从整体上看,铝处理对千年桐盆栽苗Zn元素含量的影响最大(图 1)。
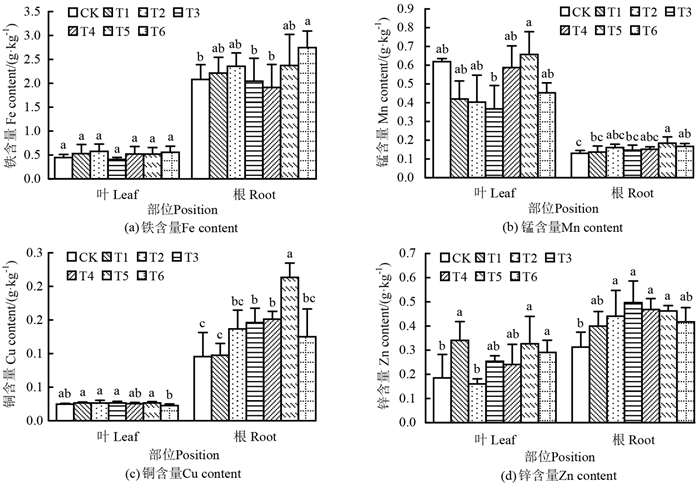
|
注:不同字母代表各铝浓度处理间差异显著(P<0.05)。 Note: different letters indicate significant differences among different aluminum concentration treatments. 图 1 铝胁迫对千年桐盆栽苗叶片和根系微量元素含量的影响 Fig. 1 Effect of different concentrations of Al stress on microelement contents in leaves and roots of the A. montana potted seedlings |
在铝处理下,千年桐盆栽苗微量元素含量的变化趋势不同(图 1)。其中,苗木根系Mn、Cu、Zn含量随铝浓度增加呈先升高后降低的趋势,根系Mn、Cu元素含量均在T5处理时出现峰值,且在T5处理时与CK有显著差异(P<0.05)。根系Zn元素含量在T3处理时出现峰值,且在T3处理时与CK存在显著差异(P<0.05)。
苗木体内大量元素的含量随铝浓度的变化因器官而异。铝处理对盆栽苗叶片Fe、Mn、Cu元素含量变化无显著影响,而对根系Fe、Mn、Cu含量变化有显著影响。在铝浓度为T6时,根系Fe元素含量显著增加(P<0.05);在铝浓度为T5和T6时,根系Mn元素含量显著增加(P<0.05);在铝浓度为T3~T5时,苗木根系Cu含量显著增加(P<0.05)。铝处理下,不同器官Zn元素含量变化整体表现为促进作用,但变化趋势不同。叶片Zn含量随铝浓度增加发生不同程度的波动,变化规律不明显;而根系Zn含量随铝浓度增加呈先升高后降低的趋势。此外,铝处理下千年桐盆栽苗不同器官元素含量的分配也有差异。在所有铝处理中,Fe、Cu、Zn元素含量均表现为根系显著大于叶片,而Mn元素含量则表现为叶片显著大于根系。
2.2 铝胁迫对千年桐水培苗根系和叶片微量元素的影响在铝处理下,千年桐水培苗体内微量元素的变化趋势不同(图 2)。在不同浓度铝处理下,水培苗叶片Fe含量较CK均显著下降(P<0.05),在T6处理时达到最低值;其根系Fe含量在T5处理时与CK呈显著性差异(P<0.05)。水培苗叶片Cu、Zn元素含量随铝浓度增加呈先升后降的趋势,叶片Cu元素含量在T3处理时达到峰值,且与CK有显著差异(P<0.05)。叶片Zn元素含量在T2处理时达到峰值,且与CK有显著差异(P<0.05)。与此相反,水培苗根系Zn含量则随铝浓度增加呈先降后升的趋势,且在T6处理时显著高于CK(P<0.05)。有些元素含量随着各处理波动明显,但未呈现明显趋势,如叶片Mn元素含量。根系Cu元素含量变化随铝浓度增加整体无显著变化,而铝处理会显著促进叶片Cu元素的积累,且随铝浓度增加呈先升后降的趋势。根系Zn含量随铝浓度增加呈先降后升的趋势,而叶片Zn元素含量变化则与根系相反。铝处理显著抑制了千年桐水培苗根叶Mn元素及叶片Fe元素的积累,而促进叶片Cu、Zn元素的增加,且对Mn元素的影响较大。
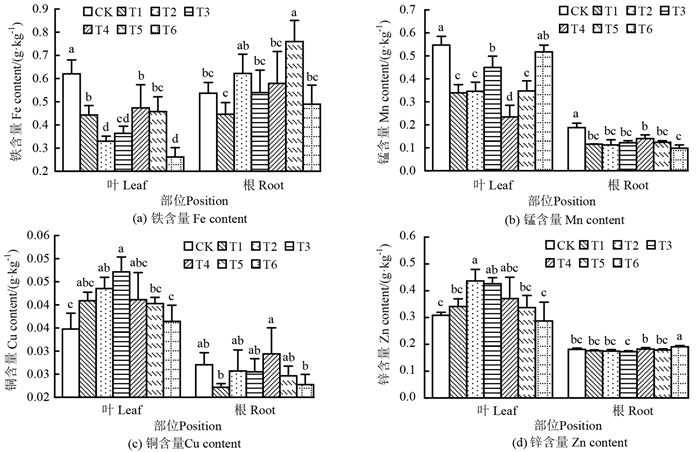
|
注:不同字母代表各铝浓度处理间差异显著(P<0.05)。 Note: different letters indicate significant differences among different aluminum concentration treatments. 图 2 铝胁迫对千年桐水培苗叶片和根系微量元素含量的影响 Fig. 2 Effect of different concentrations of Al stress on microelement contents in leaves and roots of the A. montana hydroponic seedlings |
对铝胁迫下千年桐苗木叶片和根系的微量元素含量进行相关性分析,结果如表 1所示。从表 1可知,千年桐盆栽苗叶片各元素含量间相关性均不显著(P>0.05),根系Cu与Mn元素含量呈显著正相关关系(P<0.05),苗木叶片与根系各微量元素间相关性不显著(P>0.05)。
从表 1可以看出,在铝胁迫处理下,千年桐水培苗叶片Zn与Cu元素含量呈极显著正相关关系(P<0.01),根系各元素间相关性不显著(P>0.05)。根系Mn元素与叶片Fe元素含量呈极显著正相关关系(P<0.01),根系Zn元素与叶片Cu、Zn元素含量均呈显著负相关关系(P<0.05)。
| 栽培方式 Cultivation methods |
指标 Index |
胁迫 Stress |
叶铁含量 Leaf Fecontent |
叶锰含量 Leaf Mncontent |
叶铜含量 Leaf Cucontent |
叶锌含量 Leaf Zncontent |
根铁含量 Root Fecontent |
根锰含量 Root Mncontent |
根铜含量 Root Cucontent |
根锌含量 Root Zncontent |
| 土培 Soil culture seedling |
叶铁含量 Leaf Fe content |
0.332 | 1.000 | |||||||
| 叶锰含量 Leaf Mn ontent |
0.168 | -0.034 | 1.000 | |||||||
| 叶铜含量 Leaf Cu ontent |
-0.490 | -0.215 | -0.102 | 1.000 | ||||||
| 叶锌含量 Leaf Zn ontent |
0.432 | 0.085 | 0.051 | 0.033 | 1.000 | |||||
| 根铁含量 Root Fe ontent |
0.585 | 0.587 | -0.173 | -0.550 | 0.270 | 1.000 | ||||
| 根锰含量 Root Mn ontent |
0.804* | 0.481 | 0.213 | -0.058 | 0.280 | 0.576 | 1.000 | |||
| 根铜含量 Root Cu ontent |
0.599 | 0.091 | 0.384 | 0.313 | 0.264 | 0.083 | 0.846* | 1.000 | ||
| 根锌含量 Root Zn ontent |
0.481 | 0.037 | -0.289 | 0.380 | 0.236 | -0.068 | 0.550 | 0.686 | 1.000 | |
| 栽培方式 Cultivation methods |
指标 Index |
胁迫 Stress |
叶铁含量 Leaf Fecontent |
叶锰含量 Leaf Mncontent |
叶铜含量 Leaf Cucontent |
叶锌含量 Leaf Zncontent |
根铁含量 Root Fecontent |
根锰含量 Root Mncontent |
根铜含量 Root Cucontent |
根锌含量 Root Zncontent |
| 水培 Hydroponic seedling |
叶铁含量 Leaf Fe ontent |
-0.552 | 1.000 | |||||||
| 叶锰含量 Leaf Mn ontent |
-0.032 | 0.009 | 1.000 | |||||||
| 叶铜含量 Leaf Cu ontent |
-0.170 | -0.358 | -0.457 | 1.000 | ||||||
| 叶锌含量 Leaf Zn ontent |
-0.314 | -0.256 | -0.436 | 0.926** | 1.000 | |||||
| 根铁含量 Root Fe ontent |
0.302 | 0.111 | -0.332 | 0.146 | 0.220 | 1.000 | ||||
| 根锰含量 Root Mn ontent |
-0.544 | 0.922** | 0.248 | -0.393 | -0.211 | 0.037 | 1.000 | |||
| 根铜含量 Root Cu ontent |
-0.141 | 0.431 | -0.262 | 0.139 | 0.362 | 0.367 | 0.580 | 1.000 | ||
| 根锌含量 Root Zn ontent |
0.646 | -0.171 | 0.326 | -0.783* | -0.778* | -0.177 | -0.067 | -0.126 | 1.000 | |
| 注:*表示相关性显著(P<0.05),**表示相关性极显著(P<0.01)。Note: *shows significant correlation(P<0.05), **shows highly significant correlation(P<0.01). | ||||||||||
千年桐盆栽苗和水培苗根、叶微量元素含量的大小关系存在显著差异。在铝胁迫下,盆栽苗微量元素Fe、Cu、Zn含量整体表现为根系显著大于叶片。由于土壤颗粒间具有一定的空隙,使土壤环境中通气条件较好,有利于微生物群落的形成,微生物增多会加速土壤养分的分解,同时又促进了根系对养分的吸收[23],这可能是盆栽苗根系微量元素含量较高的原因。与盆栽苗相反,水培苗微量元素Mn、Cu、Zn含量表现为叶片显著大于根系,这可能是由于在非原生环境和铝胁迫的共同作用下,水培苗根系活力减弱,对养分的吸收和逆境的抗性大幅度降低,造成水培苗根系的元素含量偏低。
铝处理也会影响千年桐根系和叶片微量元素的分配差异。与CK相比,铝胁迫促进了盆栽苗Cu元素在根系富集,而对叶片中Cu元素的积累无明显影响,造成微量元素在根系与叶片间的分配差异较明显。但在超过一定胁迫浓度后,盆栽苗根系Cu元素含量开始降低,根系和叶片微量元素含量的差异下降,至T6处理时,根系和叶片Cu元素含量之差与CK相近,表明铝胁迫浓度的高低会影响苗木微量元素在根系和叶片间的分配。这可能是由于铝胁迫后,盆栽苗根尖微量元素离子含量的应激增长导致根系和叶片Cu元素含量分布不均,而当铝浓度较高时,植物通过启动自身的抗逆机制已适应胁迫环境,因此,根系和叶片Cu元素含量逐渐与CK一致。
铝处理会影响微量元素在不同器官间的运输。随着铝浓度的增大,水培苗根系和叶片Zn含量差值逐渐增大,当铝浓度为T2(0.290 mmol·L-1)时,差值最大,其后两者间的差距开始缩小,这表明低铝处理促进苗木Zn元素从根向叶的运输,而铝浓度较高时,则会抑制Zn元素的向上运输,这与前人对马尾松受铝胁迫的研究结果一致[24]。这可能是因为铝浓度较高超出了水培苗的耐受范围,运输Zn元素的转运蛋白或离子通道受到铝胁迫影响[25],阻碍了Zn元素的向上运输。
Fe在维持细胞内物质代谢、蛋白质合成和叶绿体合成等方面具有重要作用[26],Mn、Cu、Zn都是植物体内一些酶的成分或活化剂。有研究认为,铝处理会降低Fe在苗木体内的浓度,使植株出现缺铁失绿症。Al竞争Cu在根表面的同一结合位点,明显减少植物体内Cu的含量[27]。而本研究结果表明,铝处理会增加千年桐盆栽苗根系中Mn、Cu、Zn元素的含量,根系Fe含量在T5和T6处理时也明显提高。苗木根尖中Fe、Cu、Zn元素离子浓度的升高,会促进植物体内蛋白质和非结构性碳水化合物的合成[28],增加功能蛋白的数量,协调渗透调节作用,维持植物细胞的正常代谢[29]。此外,胁迫环境破坏了植物的抗氧化防御系统[29],植物由此产生大量的活性氧诱导氧化[30-31],活性氧的积累加剧了铝对植物的毒害作用,而吴道铭等[32]发现蛋白数量的增加也会缓解铝胁迫引起的氧化胁迫。另外,Cu和Zn也是许多氧化酶的重要成分[29],这些抗氧化酶活性的升高,会有效阻止酚类物质向醌类物质的转化,从而可以减缓铝对植物的毒害[24]。铝胁迫下,盆栽苗根系Mn元素含量显著增加,可能是由于Mn可以有效地与Al竞争根的吸收位点,导致苗木根中Mn元素的含量增加[33]。总之,铝处理对千年桐盆栽苗根系和叶片各微量元素的吸收积累没有明显的不利影响,反而表现为不同程度的促进作用或无明显影响,这在一定程度上反映了千年桐盆栽苗的耐铝性。
与盆栽苗相比,铝胁迫下千年桐水培苗根系Mn、Cu、Zn含量及叶片Fe含量显著降低或无明显变化,且水培苗根叶中Mn元素含量在T1(0.124 mmol·L-1)处理后便开始显著降低。前人对马尾松和龙眼(Dimocarpus longana Lour.)幼苗养分含量的研究也发现,铝胁迫降低了苗木体内微量元素的积累[26, 34],这些研究与本研究的胁迫条件一致,并且也是在水培环境下进行。因此,在不同浓度铝胁迫下,盆栽苗和水培苗微量元素含量差异的一个重要原因就是胁迫试验中培养介质的差异。土培原生环境下,千年桐对铝胁迫具有相对较大的抗性,在胁迫环境下可以充分发挥林木自身的调节机制;而水培环境下,陆生植物由于受低氧胁迫影响,呼吸作用、碳分解和氮代谢等代谢活动减弱,且在水培环境中,根系失去土壤的缓冲与保护,直接裸露在水体环境而使其变得较脆弱,致使千年桐水培苗的耐铝性减弱。因此,在今后的铝胁迫试验中,除了考虑植物自身的抗逆性,也要考虑原生环境的作用。
本研究比较了不同浓度铝胁迫下,千年桐盆栽苗和水培苗微量元素在根叶间吸收和运输的差异。苗木营养器官中微量元素的含量也会受栽培基质内微量元素含量多寡的影响。受时间限制,本试验没有研究基质中微量元素与苗木不同器官吸收微量元素之间的相关性。在今后的研究中,可结合本研究的结果,进一步探索铝胁迫下苗木对基质中微量元素吸收和转化的效率。
4 结论不同浓度铝胁迫对千年桐盆栽苗根系微量元素(Fe、Mn、Cu、Zn)的吸收有不同程度的促进作用,其中, 对Cu和Zn的促进作用最明显; 对盆栽苗叶片微量元素含量的变化总体无显著影响。不同浓度铝胁迫显著抑制了千年桐水培苗根系和叶片Mn元素的积累,对根系Cu、Zn元素无明显影响。
铝胁迫后,盆栽苗不同器官微量元素Fe、Cu、Zn的分配方式与CK相同,表现为根系微量元素含量显著大于叶片。铝胁迫后,水培苗不同器官微量元素Mn、Cu、Zn的分配方式也与CK相同,但叶片微量元素含量显著大于根系。不同浓度铝胁迫下,千年桐盆栽苗与水培苗中根系和叶片微量元素含量的差异与胁迫环境差异导致的植株根系活力下降、生理功能减弱密切相关。
| [1] |
MA J F. Syndrome of aluminum toxicity and diversity of aluminum resistance in higher plants[J]. International Review of Cytology, 2007, 264: 225-252. |
| [2] |
GIANNAKOULA A, MOUSTAKAS M, SYROS T, et al. Aluminum stress induces up-regulation of an efficient antioxidant system in the Al-tolerant maize line but not in the Al-sensitive line[J]. Environmental and Experimental Botany, 2010, 67(3): 487-494. DOI:10.1016/j.envexpbot.2009.07.010 |
| [3] |
LIANG L Z, ZHAO X Q, YI X Y, et al. Excessive application of nitrogen and phosphorus fertilizers induces soil acidification and phosphorus enrichment during vegetable production in Yangtze River Delta, China[J]. Soil Use and Management, 2013, 29(2): 161-168. DOI:10.1111/sum.12035 |
| [4] |
ZHAO X Q, CHEN R F, SHEN R F. Coadaptation of plants to multiple stresses in acidic soils[J]. Soil Science, 2014, 179(10/11): 503-513. |
| [5] |
唐晓芬, 王彬, 王玉杰, 等. 不同酸度模拟酸雨对重庆缙云山2种阔叶树光合特性的影响[J]. 植物资源与环境学报, 2015, 24(4): 45-51. DOI:10.3969/j.issn.1674-7895.2015.04.06 |
| [6] |
韩德鹏, 刘星月, 王馨悦, 等. 铝胁迫对油菜根系形态和生理指标的影响[J]. 核农学报, 2019, 33(9): 1824-1832. |
| [7] |
林晗, 陈辉, 吴承祯, 等. 千年桐与毛竹凋落叶混合分解对土壤酶活性的影响[J]. 应用与环境生物学报, 2012, 18(4): 539-545. |
| [8] |
樊月, 陈志为, 潘云龙, 等. 林龄和坡位对杉桐混交林化学计量特征的影响[J]. 应用与环境生物学报, 2019, 25(2): 246-253. |
| [9] |
林晗, 吴承祯, 陈辉, 等. 杉木-千年桐人工混交林种内种间竞争关系分析[J]. 福建林学院学报, 2014, 34(4): 316-321. DOI:10.3969/j.issn.1001-389X.2014.04.005 |
| [10] |
向仁军. 中国南方典型酸雨区酸沉降特性及其环境效应研究[D]. 长沙: 中南大学, 2012.
|
| [11] |
吴道铭, 傅友强, 于智卫, 等. 我国南方红壤酸化和铝毒现状及防治[J]. 土壤, 2013, 45(4): 577-584. |
| [12] |
罗红艳, 陈潇潇, 石零珊, 等. 不同耐铝型杉木幼苗叶片抗氧化系统对铝胁迫的响应特征[J]. 西北植物学报, 2018, 38(7): 1306-1314. |
| [13] |
张盛楠, 刘亚敏, 刘玉民, 等. 马尾松幼苗生长及生理特性对铝胁迫的响应[J]. 西北植物学报, 2016, 36(10): 2022-2029. DOI:10.7606/j.issn.1000-4025.2016.10.2022 |
| [14] |
汪凤林, 张月全, 陈爱玲, 等. 不同配比的杉木、火力楠凋落物中土壤酶活性的变化及其对凋落物分解的影响[J]. 福建农林大学学报(自然科学版), 2017, 46(5): 576-583. |
| [15] |
吴飞华. 酸沉降导致的钙流失对中国南方地区不同森林物种的影响[D]. 厦门: 厦门大学, 2012.
|
| [16] |
姚昕, 李婧, 何霞, 等. 硅对铝胁迫下花生幼苗根系形态和生理特性的影响[J]. 中国油料作物学报, 2014, 36(6): 815-818. |
| [17] |
周小华, 周泽仪, 李昆志. 铝胁迫下外源抗坏血酸对水稻幼苗抗氧化性能的影响[J]. 核农学报, 2020, 34(10): 2368-2375. DOI:10.11869/j.issn.100-8551.2020.10.2368 |
| [18] |
王水良, 王平, 王趁义. 铝胁迫对马尾松幼苗根系形态及活力的影响[J]. 生态学杂志, 2010, 29(11): 2097-2101. |
| [19] |
马志慧. 铝胁迫下杉木无性系苗若干生理过程及转录组的研究[D]. 福州: 福建农林大学, 2015.
|
| [20] |
安锋, 李昌珍, 张婷婷, 等. 铝胁迫对橡胶苗生理和叶绿素荧光特性的影响[J]. 应用生态学报, 2018, 29(12): 4191-4198. |
| [21] |
谢安强, 洪伟, 吴承祯, 等. 桉树内生真菌对铝毒害胁迫下尾巨桉幼苗抗性特征的影响[J]. 中南林业科技大学学报, 2013, 33(3): 16-20. |
| [22] |
李树斌, 翁闲, 王士亚, 等. 铝胁迫及营养复合作用对杉木幼苗抗氧化酶活性的影响[J]. 福建农林大学学报(自然科学版), 2015, 44(3): 264-269. |
| [23] |
郭辉, 唐卫平. 不同林龄华北落叶松根际与非根际土壤酶和土壤微生物研究[J]. 生态环境学报, 2020, 29(11): 2163-2170. |
| [24] |
纪雨薇. 马尾松铝胁迫生理响应机制[D]. 重庆: 西南大学, 2016.
|
| [25] |
陈文荣, 刘鹏, 黄朝表, 等. 铝对荞麦铝和其它营养元素运输的影响[J]. 水土保持学报, 2006, 20(3): 173-176. DOI:10.3321/j.issn:1009-2242.2006.03.042 |
| [26] |
GREENE R M, GEIDER R J, FALKOWSKI P G. Effect of iron limitation on photosynthesis in a marine diatom[J]. Limnology and Oceanography, 1991, 36(8): 1772-1782. DOI:10.4319/lo.1991.36.8.1772 |
| [27] |
于力. 豇豆(Vigna unguiculata L. )铝毒害及耐性机理[D]. 南京: 南京农业大学, 2012.
|
| [28] |
刘春梅, 罗盛国, 王孟雪, 等. 硒对镉胁迫下寒地水稻Cd、Zn、Fe、Cu、Mn含量的影响[J]. 水土保持学报, 2014, 28(6): 136-142. |
| [29] |
姜涛. 铝胁迫对饭豆根尖营养元素吸收的影响及可能的调控机制[D]. 杭州: 浙江大学, 2013.
|
| [30] |
张然然, 张鹏, 都韶婷. 镉毒害下植物氧化胁迫发生及其信号调控机制的研究进展[J]. 应用生态学报, 2016, 27(3): 981-992. |
| [31] |
RAHMAN A, MOSTOFA M G, NAHAR K, et al. Exogenous calcium alleviates cadmium-induced oxidative stress in rice (Oryza sativa L.) seedlings by regulating the antioxidant defense and glyoxalase systems[J]. Brazilian Journal of Botany, 2016, 39(2): 393-407. DOI:10.1007/s40415-015-0240-0 |
| [32] |
吴道铭, 曹华苹, 沈宏. 生长素及其运输蛋白对植物铝胁迫的响应[J]. 植物生理学报, 2014, 50(8): 1135-1143. |
| [33] |
WANG A Q, HE L F, SHEN Z G, et al. Effects of calcium on the absorption and distribution of nutrient elements of wheat seedlings under aluminum stress[J]. Southwest China Journal of Agricultural Sciences, 2002, 15(2): 42-47. |
| [34] |
肖祥希. 龙眼(Dimocarpus longana Lour. )对铝胁迫的生理化反应及其矫治[D]. 福州: 福建农林大学, 2002.
|

 2021, Vol. 41
2021, Vol. 41


