文章信息
- 袁红梅, 汪东, 吴建飞, 黄六莲, 林珊, 陈礼辉
- YUAN Hongmei, WANG Dong, WU Jianfei, HUANG Liulian, LIN Shan, CHEN Lihui
- 壳聚糖对竹溶解浆溶液流变性能的影响
- Effect of chitosan on rheological properties of bamboo dissolving pulp solution
- 森林与环境学报,2020, 40(2): 211-217.
- Journal of Forest and Environment,2020, 40(2): 211-217.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2020.02.015
-
文章历史
- 收稿日期: 2019-11-06
- 修回日期: 2020-02-12
纤维素由β-1,4-糖苷键连接D-葡萄糖单元(葡糖苷,anhydrous glucose unit,AGU)组成[1-3],是丰富的天然聚合物材料,因其具可再生性、亲水性、生物相容性、优良的机械性能及低成本,被广泛用于制备膜材料[4-7]。但纤维素膜易生长生物活性物质而导致膜生物污染,限制了其应用,因此,亟需对纤维素膜进行抗菌改性[8-10]。近年来,聚合物共混以提高纤维素化学和物理性能受到了研究者们的广泛关注。壳聚糖(chitosan,CS)是几丁质经脱乙酰基获得的阳离子多糖,分子结构与纤维素相似,而且具有广谱抗菌特性[11-13],因此,将其与纤维素共混制备共混膜已成为研究热点。STEFANESCU et al[14]将质量分数6%的纤维素和CS分别溶解在1-丁基-3-甲基咪唑醋酸盐(1-butyl-3-methylimidazolium acetate,BMIMAc)离子液体中制备纤维素和CS溶液,再将两种溶液共混制备纤维素-CS共混膜,但制备过程中CS溶解时间长(需3~4 d),纤维素也需溶解12 h,两种溶液完全共混需要2 d。TRAN et al[15]使用离子液体1-丁基-3-甲基咪唑氯化物(1-butyl-3-methylimmidazolium chloride,BMIMCl)作为绿色溶剂同时溶解并制备纤维素-CS复合材料。此外周永辉[16]也选用离子液体1-乙基-3-甲基咪唑醋酸盐(1-ethyl-3-methylimidazolium acetate,EMIMAc)同时溶解纤维素和CS,制备纤维素-CS复合抗菌膜。但离子液体溶解纤维素和CS存在价格高、溶剂回收成本高等问题。AHAMED et al[17]采用NaOH-硫脲溶解纤维素,再与CS-HCl溶液混合制备纤维素-CS生物复合材料,用于制备大鼠实验伤口的伤口敷料,但该溶解体系须在-5 ℃以下才能溶解纤维素。ZHANG et al[18]也采用NaOH/硫脲体系同时溶解纤维素和CS,制备表面自组装3D合金结构的共混膜,该溶解体系须在-30 ℃以下才能溶解纤维素,制备过程能耗高。LIN et al [10, 19]将纤维素和CS同时溶解在ZnCl2溶液中得到纤维素-CS共混膜,发现共混膜对大肠杆菌[Escherichia coli (E. coli)]有明显的抑菌活性,在膜表面生物偶联纳米银粒子后可进一步提高共混膜的抑菌活性, 但ZnCl2法溶解纤维素存在洗涤过程中产生大量的Zn(OH)2沉淀和溶剂不容易回收等问题。
以N-甲基吗啉-N-氧化物(N-methylmorpholine-N-oxide,NMMO)为溶剂溶解纤维素制备莱赛尔纤维,被誉为“21世纪绿色纤维”。CS在NMMO中可形成凝胶[20-21]。WENG et al[22]在NMMO中同时溶解纤维素和CS制备纤维素-CS复合抗菌纳滤膜,需对CS进行预处理,工艺复杂。本研究采用NMMO为溶剂,CS不进行预处理,与竹溶解浆(bamboo dissolving pulp,BP)分批次加入NMMO溶解体系,制备BP-CS共混溶液,工艺简单。研究表明,纤维素溶液的流变性不仅对后期纺丝或制膜工艺参数的制定至关重要[23-24],而且也会影响最终产品再生纤维或膜的最终性质和性能[25-26]。通过分析CS对NMMO溶解竹溶解浆溶液稳态和动态流变性能的影响,以期为其纺丝或制膜等应用提供理论依据。
1 实验部分 1.1 原料BP, a-纤维素含量98.4%,聚合度(degree of polymerization,DP)560,福建青山纸业股份有限公司提供;NMMO, 分析纯≥97%,购自天津海纳川科技发展有限公司;CS, 脱乙酰度80%~95%,购自上海国药集团化学试剂有限公司;没食子酸丙酯, 分析纯,购自上海阿拉丁试剂有限公司。
1.2 竹溶解浆-壳聚糖共混溶液的制备用粉碎机将竹溶解浆浆板粉碎解离,解离时间3 min,烘至绝干备用,DP为521, 安装好实验装置[2],调节油浴温度至90 ℃。称取80 g NMMO粉末于三颈烧瓶内,并加入15 g去离子水,使NMMO粉末溶解,得到重量含水率15.8%的溶剂,加入质量分数0.1%的没食子酸丙酯作为抗氧化剂,加入CS粉末,再投入BP,提高油浴温度至110 ℃,溶解2~3 h。固定BP用量5 g,改变CS的加入量(表 1),配制成6种不同质量比的BP-CS共混溶液(M1、M2、M3、M4、M5、M6), 降低油浴温度至90 ℃,关闭搅拌器,抽真空或静置脱泡2 h,得到待测BP-CS共混溶液。
| 样品编码Sample code | 竹溶解浆mBP/g | 壳聚糖mCS/g | 壳聚糖:竹溶解浆mCS:mBP |
| M1 | 5 | 0 | 0:1 |
| M2 | 5 | 2.500 | 1:2 |
| M3 | 5 | 1.250 | 1:4 |
| M4 | 5 | 0.830 | 1:6 |
| M5 | 5 | 0.625 | 1:8 |
| M6 | 5 | 0.500 | 1:10 |
采用德国HAAKE MARS Ⅲ型流变仪的锥板模式(C35/2°锥板)对BP-CS共混溶液的稳态和动态流变性能进行测试,每样品重复3次。60 ℃时旋转模式测量的剪切速率(γ)范围为10~200 s-1,振荡模式测量的剪切频率(f)范围为0.1~100 Hz,在f为1 Hz条件下,振荡模式测量的温度(θ)范围为30~70 ℃。
2 结果与分析 2.1 竹溶解浆-壳聚糖共混溶液的稳态流变性质 2.1.1 竹溶解浆-壳聚糖共混溶液随剪切速率的变化图 1为M1~M6溶液的ηa-γ、τ-γ流变曲线(ηa是溶液表观黏度、τ是剪切应力),测试θ为60 ℃。从图 1(a)可见,在BP与NMMO溶解体系中加入少量CS(CS:BP=1:10)后,共混溶液M6的ηa明显降低。BP-CS共混溶液中存在即时物理交联位点:因分子间氢键作用及物理缠结作用和范德华力而形成的即时物理交联位点。由于CS的氨基与NMMO溶剂中的强偶极N+和O-可能以类似于分子间氢键的方式相互作用,阻碍了BP大分子链间即时物理交联位点的形成[27]。此外,在BP与NMMO溶解体系中加入少量的CS,相当于加入与其不相容的高分子聚合物,CS大分子分散于BP的结构单元间,因类似于“润滑”作用,从而降低了BP溶液的ηa。随着CS添加量的增加,BP-CS共混溶液的ηa逐渐增大,这是因为加入的CS在NMMO溶剂中溶胀后体积变大[20-21],润滑作用逐渐减弱,阻碍了BP溶液的流动,导致溶液的ηa增加;另一方面当CS含量增加时,CS与BP大分子链间的相互作用增加,促进了即时物理交联位点的形成,从而增加了ηa [23]。所有溶液的ηa均随着γ的增加而减小,呈现“剪切稀化”现象。随着γ的增加,BP大分子链间、CS与BP大分子链间的即时物理交联位点逐渐被解开。由于即时物理交联位点解体速度大于重建速度,相应的动态平衡就移动。强剪切力使大分子链段承受的应力来不及松弛,大分子链段高度取向于流动方向,链段取向效应减弱了大分子链在流层间的动量传递能力,其间的缠结和分子间作用趋于消失,因此流动阻力随之减小,表现为溶液ηa的下降[16, 23]。强剪切力作用下,BP-CS共混溶液中所有的即时物理交联位点由于分子热运动而处于不断地解体和重建状态[28]。当γ超过158 s-1时,BP-CS共混溶液中所有的即时物理交联位点都被打开,大分子链段已达到了最佳取向位置,溶液的ηa不再随γ的变化而变化。在一定剪切速率γ下,作用在BP-CS共混溶液上的应力可分解为,垂直于剪切面的分量即正应力或法向应力,相切于剪切面的分量即剪切应力(τ)[29]。
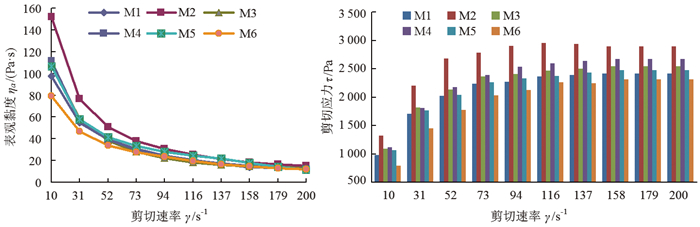
|
图 1 BP-CS共混溶液的ηa-γ曲线和τ-γ柱状图 Fig. 1 ηa-γ curves and τ-γ histograms of the BP-CS blending solutions |
从图 1(b)可见,在BP与NMMO溶解体系中加入少量CS(CS:BP=1:10)后,M6溶液所需τ明显降低。这是因为少量CS阻碍了BP大分子链间即时物理交联位点的形成,导致M6溶液的ηa降低,所需τ也相应降低。随着γ的逐渐增加,促使BP-CS共混溶液液层产生流动所需的τ相应增大,但增大的速率逐渐降低,且BP-CS共混溶液的τ值逐渐趋于一致,这可能是因为加入少量的CS对BP-CS共混溶液τ值的影响不如γ大幅增加所产生的影响。当γ足够高(≥158 s-1)时,BP-CS共混溶液中所有的即时物理交联位点都被打开[30],因此, 溶液流动所需的τ不再随γ的增大而变化,与图 1(a)的结果一致。
2.1.2 竹溶解浆-壳聚糖共混溶液的流体性质Ostwald-de-Waele方程可用于测试BP-CS共混溶液与牛顿流体的偏差程度,公式如下:
| $ \tau = k{\gamma ^n} $ | (1) |
| $ {\rm{lg}}\tau = {\rm{lg}}k + n{\rm{lg}}\gamma $ | (2) |
式中:k为稠度指数,反映BP-CS共混溶液的黏度,黏度越大,k值越大;n为流动特性指数;τ为剪切应力(Pa)[31-32]。M1~M6溶液的n值可根据公式(1)和(2)来计算。
流体流动的类型,按τ与γ的关系可分为两大类:牛顿型流动和非牛顿型流动[33]。牛顿型流动的流体,称为牛顿型流体[34],此时n =1。非牛顿型流动的流体,称为非牛顿型流体,包括假塑性流体、胀塑性流体和宾汉流体[31, 34]。当n < 1时,溶液的ηa随γ的增大而减小,则为剪切稀化的假塑性流体[34];当n >1时,溶液的ηa随γ的增大而增大,则属于剪切增稠的胀塑性流体[31];宾汉流体有一个临界屈服应力τy,当τ < τy时,表现为刚性体,当τ >τy时,它会像黏性流体一样流动,但其ηa不再随γ变化[32]。由表 2可知,M1~M6溶液均属于假塑性流体,与图 1中BP-CS共混溶液的剪切稀化结果相一致。
| 样品编码Sample code | 流动特性指数n | 结构黏度指数Δη |
| M1 | 0.29 | 8.17 |
| M2 | 0.21 | 9.01 |
| M3 | 0.24 | 8.52 |
| M4 | 0.26 | 8.40 |
| M5 | 0.30 | 8.09 |
| M6 | 0.35 | 7.40 |
结构黏度指数(Δη)反映溶液的结构化程度和加工性能,受溶液制备条件的影响[35]。该指标也能反映刮膜溶液中即时物理交联位点的数量。这些即时物理交联位点可能会阻碍CS、BP大分子链在刮膜过程中的取向,从而影响成膜性能。剪切稀化流体在非牛顿区Δη>0,Δη越小,该流体的结构化程度越低,加工性能则越高,即成膜性能越高; 反之,Δη越大,则加工性能越差,成膜性能越差[30]。Δη计算如下:
| $ \Delta \eta = {\rm{dlg}}{\eta _a}/{\rm{d}}{\gamma ^{0.5}} $ | (3) |
由图 2和表 2可见,所有BP-CS共混溶液的Δη>0,均是剪切稀化流体,与图 1分析结果一致。60 ℃测试温度下,加入CS后,溶液的Δη先降低,M6溶液的Δη最低,溶液流动性最好,成膜加工性能最好。这也反映了少量CS可阻碍BP大分子链间的缠结,因此在一定程度上降低了Δη。随着CS质量的增加,溶液的Δη也相应增大。因为CS与BP大分子链间增大的相互作用促进了即时物理交联位点的形成,增加了溶液的Δη,与图 1分析结果一致。M2溶液的Δη最大,成膜加工性能最差。
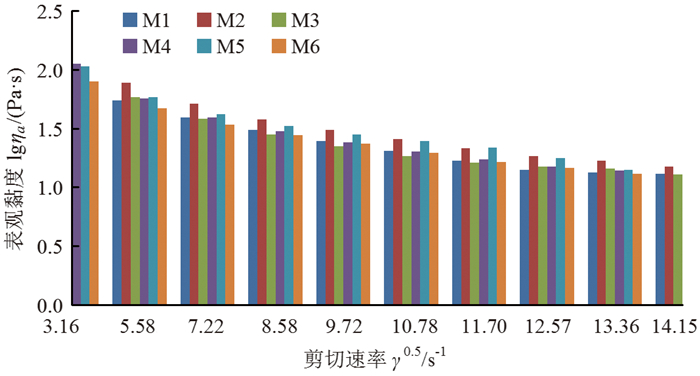
|
图 2 竹溶解浆-壳聚糖共混溶液的lgηa-γ0.5柱状图 Fig. 2 lgηa-γ0.5 histograms of the BP-CS blending solutions |
测量动态模式下BP溶液的流变性能,能表征溶液的弹性和黏性,即复数模量G*。稳态测定中的法向应力差相当于G*的实部G′,即储能模量或动态模量,表征弹性;G*的虚部G″,即损耗模量,表征黏性[36]。BP-CS共混溶液可表现出固体或液体的性质和状态,分别采用G′和G″来确定。G′与BP-CS共混溶液的弹性成分有关,受到CS、BP大分子的交联、缠结或聚集结构等影响;G″与BP-CS共混溶液的黏性有关,受到溶液的类液态组分影响,两者均与溶液的加工性能相关。由图 3可见,60 ℃恒温条件下, M1~M6溶液的G′、G″均随着f的增加而增大。低频范围内(0.1 Hz≤f≤10 Hz)G″>G′,表明溶液流变性质以黏性为主;随着f增大至10 Hz以上时,G′>G″,溶液则主要呈现弹性性质。其中M2溶液的G′和G″最大,表明此溶液中CS、BP大分子链的数量最多,即时物理交联位点也最多,溶液发生形变的力量最大,即G′最大,而CS、BP大分子链也更难运动,需要损耗更多的能量,故G″也很大,成膜加工性能最差。样品溶液的G′和G″值为M2>M3>M4>M5>M1>M6,M6溶液最小,溶液流动性最好,成膜加工性能最好,与图 2分析结果一致。
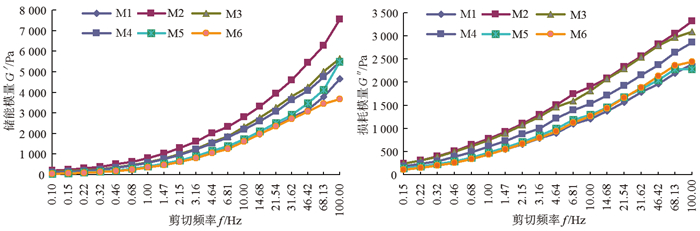
|
图 3 竹溶解浆-壳聚糖共混溶液的G′-f和G″-f曲线 Fig. 3 G′-f curves and G″-f curves of the BP-CS blending solutions |
θ是影响BP-CS共混溶液的一个重要热力学参数。由图 4可见,M1~M6溶液的G′、G″均随着振荡θ的升高而降低。50~70 ℃范围内G″>G′,表明此时BP-CS共混溶液流变性质以黏性为主,分子链段活性较大,解缠倾向较强,分子间相互作用减弱,宏观上表现为溶液黏度不断下降[37],流动性能增加,体系G′和G″减小[38];随着θ的降低, BP-CS共混溶液逐渐趋向凝胶化,此时G′>G″,溶液则主要呈现弹性性质。图 4中M2溶液的G′和G″最大,表明溶液中CS、BP大分子间的即时物理交联位点最多,溶液发生形变的力量最大,即G′最大,而CS、BP大分子链也更难运动,需要损耗更多的能量,故G″也最大。
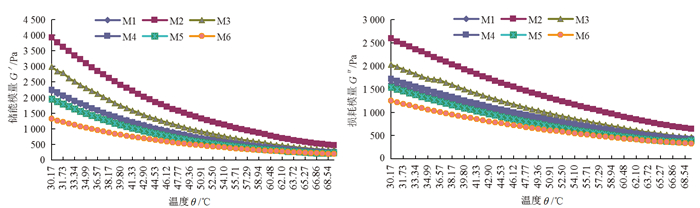
|
图 4 竹溶解浆-壳聚糖共混溶液的G′-θ和G″-θ曲线 Fig. 4 G′-θ curves and G″-θ curves of the BP-CS blending solutions |
表 3列出了不同溶液G′~θ和G″~θ曲线交点对应的温度,即凝胶点温度。BP-CS共混溶液的温度低于凝胶点温度时,溶液体系的G′大于G″,表现为弹性大于黏性,溶液的流动性减弱;溶液温度高于凝胶点温度,G″大于G′,表现为黏性大于弹性,有利于溶液刮膜。表 3中CS的含量从0.500 g(M6)增加到0.830 g(M4)时,溶液的凝胶点温度由33.3 ℃逐渐升高至41.3 ℃,但仍低于样品M1溶液的凝胶点温度(45.3 ℃),表明加入适量的CS后溶液在更宽的温度范围内呈现为黏性性质,有利于刮膜。当CS的添加量逐渐增加,BP-CS共混溶液的凝胶点温度随之升高,M2溶液的凝胶点温度最高(51.7 ℃)。
| 样品编码Sample code | 温度θ/℃ |
| M1 | 45.3 |
| M2 | 51.7 |
| M3 | 46.9 |
| M4 | 41.3 |
| M5 | 40.5 |
| M6 | 33.3 |
对于τ的振幅及相移随f的变化,可用复数黏度(η*)表示, η*是τ与f之间的线性比例系数[39]。图 5(a)中,在60 ℃恒温条件下,随着f的增加,M1~M6溶液的η*均下降,呈现“剪切稀化”现象。因为当f增加时,施加到BP-CS共混溶液的τ相应地增大,因而更容易打开CS、BP大分子链间的即时物理交联位点,溶液的流动阻力减小,η*也减小了。可见M2溶液的η*最大,表明溶液中CS、BP的即时物理交联位点最多,溶液的流动阻力最大。样品溶液的η*值为M2>M3>M4>M5>M1>M6,M6溶液最小,即时物理交联位点最少,溶液发生形变的力量最小,损耗能量较少。这一结论与G′、G″测定结果一致。图 5(b)中,BP-CS共混溶液在低温时弹性大于黏性,溶液流动性差,随着θ的不断升高,M1~M6溶液的η*均下降。在同一剪切频率(f=1 Hz)下,随着θ升高,CS、BP分子链活动能力加强,大分子链间作用力和缠结度减弱,溶液的η*下降。M6溶液的流动阻力最小,故η*最小,且明显低于M1溶液,也表明少量CS阻碍了BP大分子链间即时物理交联位点的形成;M2溶液的η*最大,表明此溶液的流动阻力最大,成膜加工性能最差。这与γ对表观黏度ηa的影响一致。
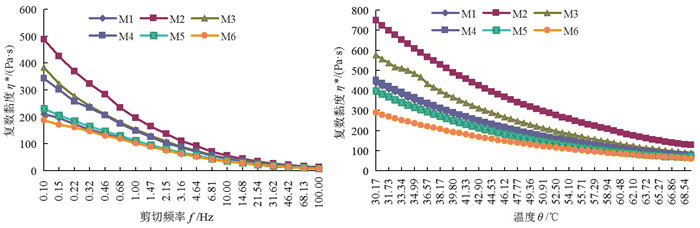
|
图 5 竹溶解浆-壳聚糖共混溶液的η*-f和η*-θ曲线 Fig. 5 η*-f curves and η*-θ curves of the BP-CS blending solutions |
在NMMO溶解体系中,M1~M6溶液的n均小于1,均为假塑性流体,溶液的ηa、η*均分别随着γ、f的增加而下降,呈现出剪切稀化行为。在NMMO溶解BP溶液中,加入少量CS可阻碍BP大分子不同链间即时物理交联位点的形成,改善了共混溶液的流变性能,随着CS添加量的增加,共混溶液的流变性能降低。最佳CS添加量为CS:BP=1:10,此时BP-CS共混溶液的ηa、Δη、η*、G′、G″最小,共混溶液的流变性能最好。在θ为50 ℃以下时,BP-CS共混溶液主要呈现弹性;在θ为50 ℃以上时,BP-CS共混溶液主要呈现黏性。在同一剪切频率(f=1 Hz)下,随着θ的升高,CS、BP分子链活动能力加强,大分子链间作用力和缠结度减弱,BP-CS共混溶液的η*、G′和G″均下降。
| [1] |
THAKUR V K, VOICU S I. Recent advances in cellulose and chitosan based membranes for water purification:a concise review[J]. Carbohydrate Polymers, 2016, 146: 148-165. |
| [2] |
LI S, LIU S N, HUANG F, et al. Preparation and characterization of cellulose-based nanofiltration membranes by interfacial polymerization with piperazine and Trimesoyl chloride[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(10): 13168-13176. |
| [3] |
WENG R G, CHEN L H, XIAO H, et al. Preparation and characterization of cellulose nanofiltration membrane through hydrolysis followed by carboxymethylation[J]. Fibers and Polymers, 2017, 18(7): 1235-1242. |
| [4] |
BAI L M, LIU Y T, DING A, et al. Surface coating of UF membranes to improve antifouling properties:a comparison study between cellulose nanocrystals (CNCs) and cellulose nanofibrils (CNFs)[J]. Chemosphere, 2019, 217: 76-84. |
| [5] |
ABDELLAH M H, PÉREZ-MANRÍQUEZ L, PUSPASARI T, et al. A catechin/cellulose composite membrane for organic solvent nanofiltration[J]. Journal of Membrane Science, 2018, 567: 139-145. |
| [6] |
SUKMA F M, ÇULFAZ-EMECEN P Z. Cellulose membranes for organic solvent nanofiltration[J]. Journal of Membrane Science, 2018, 545: 329-336. |
| [7] |
LI X, LI H C, YOU T T, et al. Fabrication of regenerated cellulose membranes with high tensile strength and antibacterial property via surface amination[J]. Industrial Crops and Products, 2019, 140: 111603. |
| [8] |
ZHANG X M, SHU Y, SU S P, et al. One-step coagulation to construct durable anti-fouling and antibacterial cellulose film exploiting Ag@AgCl nanoparticle-triggered photo-catalytic degradation[J]. Carbohydrate Polymer, 2018, 181: 499-505. |
| [9] |
MENG J Q, ZHANG X, NI L, et al. Antibacterial cellulose membrane via one-step covalent immobilization of ammonium/amine groups[J]. Desalination, 2015, 359: 156-166. |
| [10] |
LIN S, CHEN L H, HUANG L L, et al. Novel antimicrobial chitosan-cellulose composite films bioconjugated with silver nanoparticles[J]. Industrial Crops and Products, 2015, 70: 395-403. |
| [11] |
LI K J, GUAN G L, ZHU J X, et al. Antibacterial activity and mechanism of a laccase-catalyzed chitosan-gallic acid derivative against Escherichia coli and Staphylococcus aureus[J]. Food Control, 2019, 96: 234-243. |
| [12] |
MOZAFARI M, SEYEDPOUR S F, SALESTAN S K, et al. Facile Cu-BTC surface modification of thin chitosan film coated polyethersulfone membranes with improved antifouling properties for sustainable removal of manganese[J]. Journal of Membrane Science, 2019, 588: 117200. DOI:10.1016/j.memsci.2019.117200 |
| [13] |
MIRZAIE A, HASANZADEH M, JOUYBAN A. Cross-linked chitosan/thiolated graphene quantum dots as a biocompatible polysaccharide towards aptamer immobilization[J]. International Journal of Biological Macromolecules, 2019, 123: 1091-1105. |
| [14] |
STEFANESCU C, DALY W H, NEGULESCU I I. Biocomposite films prepared from ionic liquid solutions of chitosan and cellulose[J]. Carbohydrate Polymer, 2012, 87(1): 435-443. |
| [15] |
TRAN C D, DURI S, DELNERI A, et al. Chitosan-cellulose composite materials:preparation, characterization and application for removal of microcystin[J]. Journal of Hazardous Materials, 2013, 252-253: 355-366. |
| [16] |
周永辉.纤维素/壳聚糖抗菌膜的制备与表征[D].福州: 福建农林大学, 2013.
|
| [17] |
AHAMED M I N, SANKAR S, KASHIF P M, et al. Evaluation of biomaterial containing regenerated cellulose and chitosan incorporated with silver nanoparticles[J]. International Journal of Biological Macromolecules, 2015, 72: 680-686. |
| [18] |
ZHANG R H, XIE J Y, YANG B B, et al. Self-assembly of chitosan and cellulose chains into a 3D porous polysaccharide alloy films:co-dissolving, structure and biological properties[J]. Applied Surface Science, 2019, 493: 1032-1041. |
| [19] |
LIN S, CHEN L H, HUANG L L, et al. Preparation and characterization of chitosan/cellulose blend films using ZnCl2·3H2O as a solvent[J]. Bioresources, 2012, 7(4): 5488-5499. |
| [20] |
RAVI K M, SINGH P, DUTTA P. Effect of swelling on chitosan-amine oxide gel in extended release of drug[J]. Indian Drugs, 1999, 36(6): 393-398. |
| [21] |
SHIH C M, SHIEH Y T, TWU Y K. Preparation and characterization of cellulose/chitosan blend films[J]. Carbohydrate Polymers, 2009, 78(1): 169-174. |
| [22] |
WENG R G, CHEN L H, LIN S, et al. Preparation and characterization of antibacterial cellulose/chitosan nanofiltration membranes[J]. Polymers, 2017, 9(4): 116. |
| [23] |
LU F, WANG L J, JI X J, et al. Flow behavior and linear viscoelasticity of cellulose 1-allyl-3-methylimidazolium formate solutions[J]. Carbohydrate Polymers, 2014, 99: 132-139. |
| [24] |
WANG L J, GAO L, CHENG B W, et al. Rheological behaviors of cellulose in 1-ethyl-3-methylimidazolium chloride/dimethylsulfoxide[J]. Carbohydrate Polymers, 2014, 110: 292-297. |
| [25] |
LI W J, ZHANG F Y, WANG W K, et al. Rheological transitions and in-situ IR characterizations of cellulose/LiCl·DMAc solution as a function of temperature[J]. Cellulose, 2018, 25(9): 4955-4968. |
| [26] |
SAARIKOSKI E, RISSANEN M, SEPPÄLÄ J. Effect of rheological properties of dissolved cellulose/microfibrillated cellulose blend suspensions on film forming[J]. Carbohydrate Polymers, 2015, 119: 62-70. |
| [27] |
LI Y, LIU X F, ZHUANG X P, et al. Rheological behavior and spinnability of ethylamine hydroxyethyl chitosan/cellulose co-solution in N-methylmorpholine-N-oxide system[J]. Fibers and Polymers, 2016, 17(5): 778-788. |
| [28] |
LI J B, ZHANG M Y, XIU H J, et al. Rheological characteristics on solution of NMMO/cellulose with different degree of polymerization and its combination[J]. Advanced Materials Research, 2012, 568: 396-399. |
| [29] |
SCHRAMM G.实用流变测量学[M].朱怀江, 译.2版.北京: 石油工业出版社, 2009: 4-18.
|
| [30] |
宋俊, 谭晓瑞, 程博闻, 等. [AMIM]Cl为溶剂的纤维素溶液的流变性能[J]. 纺织学报, 2010, 31(11): 11-15. |
| [31] |
吴英桦. 粘性流体混合及设备[M]. 北京: 中国轻工业出版社, 1993: 4-18.
|
| [32] |
顾国芳, 浦鸿汀. 聚合物流变学基础[M]. 上海: 同济大学出版社, 2000: 93-96.
|
| [33] |
周彦豪. 聚合物加工流变学基础[M]. 西安: 西安交通大学出版社, 1988: 19-27.
|
| [34] |
史铁钧, 吴德峰. 高分子流变学基础[M]. 北京: 化学工业出版社, 2009: 9-11.
|
| [35] |
王丹, 孙东平, 沈新元. 细菌纤维素/LiCl/DMAC溶液体系流变性的研究[J]. 纤维素科学与技术, 2008, 16(3): 61-63. |
| [36] |
郑伟.离子液体法纺制纤维素纤维及中空纤维膜的研究[D].天津: 天津工业大学, 2008.
|
| [37] |
陆飞.纤维素/离子液体浓溶液的流变性能及其双螺杆挤出纺丝成形研究[D].天津: 天津工业大学, 2013.
|
| [38] |
刘娜, 张静文, 王宝春, 等. 二醋酸纤维素/离子液体溶液流变性能的研究[J]. 纤维素科学与技术, 2015, 23(3): 55-60. |
| [39] |
戴干策, 陈敏恒. 化工流体力学[M]. 北京: 化学工业出版社, 1998: 852-876.
|

 2020, Vol. 40
2020, Vol. 40


