文章信息
- 郭钰柬, 王红, 周开兵, 王珮璇, 杨成坤, 陈静
- GUO Yujian, WANG Hong, ZHOU Kaibing, WANG Peixuan, YANG Chengkun, CHEN Jing
- 越南油茶脂肪酸积累及相关基因表达动态分析
- Dynamic changes of fatty acid accumulation and related gene expression in Camellia vietnamensis
- 森林与环境学报,2020, 40(2): 203-210.
- Journal of Forest and Environment,2020, 40(2): 203-210.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2020.02.014
-
文章历史
- 收稿日期: 2019-12-02
- 修回日期: 2020-02-07
目前,国内主要栽培的油茶种包括普通油茶(Camellia oleifera Abel.)、小果油茶(Camellia meiocarpa Hu)和越南油茶(Camellia vietnamensis T. C. Huang ex Hu),其中,越南油茶是栽培面积最小、总产量最低、最具地域特色的树种。越南油茶又称为高州油茶、陆川油茶、华南油茶和大果油茶等。海南省现存40年生以上的老油茶林或零星单株都是越南油茶[1],其栽培历史悠久,所产茶籽油的口感与品质也有别于内地[2],富含脂肪酸种类丰富,营养价值高[3],且价格是内地油茶的3~4倍,因此越南油茶茶籽油是海南省地域特色和市场竞争优势明显、经济价值极高的重要林产品。茶籽油脂肪酸组成是影响其营养和医疗保健价值的重要因素[4-6],因而有必要开展越南油茶茶籽油脂肪酸积累的动态变化特点及其分子机理等问题的研究。
有关普通油茶茶籽油脂肪酸积累过程的动态变化研究较多。在湖南省林业科学研究院油茶种质资源基地,以无性系油茶“湘林78号、湘林11号”种子为试验材料,观测到的脂肪酸主要以不饱和脂肪酸为主,油酸含量最高,其次是亚油酸;饱和脂肪酸以棕榈酸和硬脂酸为主;其中油酸呈明显上升趋势,棕榈酸和亚油酸呈明显下降趋势,硬脂酸呈小幅上升趋势,亚麻酸呈小幅下降趋势[7]。在浙江省金华市东方红试验林场油茶良种试验林,以10年生优质无性系“长林4号、长林40号和长林166号”油茶种子为试验材料,观测到各月份脂肪酸组成差异很大;油酸含量随着种子成熟迅速增加,成熟时占脂肪酸总量的80%;其次为亚油酸,7月份含量较高,但随着种子成熟迅速减少;亚麻酸和棕榈酸都随着种子成熟而降低;硬脂酸含量较低,逐月含量细微升高;棕榈烯酸和顺-11-二十碳烯酸各时期含量都处于较低水平[8]。在玉屏县茅坡油茶试验站,以15年生油茶种子为试验材料,观测到在8月下旬到9月中旬种仁含油率快速上升,棕榈酸和花生酸的消减强度都是随着种仁的成熟而降低,在整个生长发育过程中油脂都含有棕榈酸、硬脂酸、油酸、亚油酸和花生酸[9]。笔者课题组对越南油茶成熟种子的茶籽油脂肪酸组成和不同脂肪酸之间的转化关系已经作过一些研究[10-11],但关于越南油茶茶籽油脂肪酸积累的动态变化特点等问题则尚未见报道。
前人对包括普通油茶在内的油料植物研究表明△9硬脂酰-ACP脱饱和酶(SAD)是硬脂酸去饱和生成油酸的关键酶,脂肪酸脱饱和酶2(FAD2)催化油酸脱氢生成亚油酸,脂肪酸脱饱和酶3(FAD3)是调控亚油酸经催化生成亚麻酸的关键酶,脂肪酸延长酶1(FAE1)调控油酸到花生烯酸的转化[12-14]。因此本文对越南油茶茶籽油在种子生长发育过程中不同脂肪酸含量其关键酶如SAD、FAD2、FAD3和FAE1等的编码基因表达量作动态变化研究,以期初步揭示越南油茶茶籽油脂肪酸积累的分子调控机制。
1 材料与方法 1.1 材料 1.1.1 试验地概况油茶园位于海南省澄迈县福山镇长安村,于2003年采用越南油茶实生苗建园,采用常规管理方法管理,2018年全年未遭遇光、热、水灾害。油茶林地处热带季风及海洋湿润气候区,年平均气温24 ℃,年平均降雨量2 250 mm,年均日照时间1 900 h,终年无霜雪。该园土壤为砖红壤,土壤有机质丰富,富含钾和硒等元素。主要物候期:上一年12月—翌年1月为盛花期,2—4月为末花期和坐果期,5—9月为果实迅速膨大期和花芽分化期,10 —11月为果实成熟期。
1.1.2 试验材料2018年3月,在油茶园内选株产鲜果10 kg以上的健壮单株4株作为试验树,命名编号为HC1、HC2、HC3和HC4,自4月5日坐果后开始取果样,在树冠外围中部四方随机选取大小中等的5个果实挂牌,标记为以后采样的大小参照标准果,此后至10月5日每隔1个月取样1次,在10月下旬果实采收期加采1次,采样日期分别为4月13日、5月8日、6月5日、7月5日、8月5日、9月5日、10月5日、10月24日。每次在每棵树树冠外围中部采果10个,按照不同单株分装,液氮速冻并带回实验室,之后置于-80 ℃超低温冰箱保存备用。因果实8月份才开始硬核,故茶籽油自8月份样品开始提取制备。
1.2 茶籽油提取和脂肪酸含量的测定方法将干种仁研磨成粉并随机挑取2~5 g称重,以石油醚作提取剂,采取索氏提取法制备。按照国家标准GB/T 17376—2008《动植物油脂脂肪酸甲酯制备》[15]的要求制备脂肪酸甲酯。采用刘欢等[10]的气相色谱法检测脂肪酸种类及其含量。混合标样包含C12~C24脂肪酸甲酯,标样组成见表 1。
| 碳链 Carbon chain |
脂肪酸甲酯 Fatty acid methyl ester |
质量百分比 Quanlity percentage/% |
| C12:0 | 月桂酸甲酯Methyl laurate | 0.5 |
| C14:0 | 肉豆蔻酸甲酯Methyl myristate | 0.5 |
| C16:0 | 棕榈酸甲酯Methyl palmitate | 4.0 |
| C16:1 | 棕榈油酸甲酯Methyl palmitoleate | 0.5 |
| C18:0 | 硬脂酸甲酯Methyl stearate | 1.0 |
| C18:1 | 油酸甲酯Methyl oleate | 55.5 |
| C18:2 | 亚油酸甲酯Methyl linoleate | 20.0 |
| C18:3 | 亚麻酸甲酯Methyl linolenate | 10.0 |
| C20:0 | 花生酸甲酯Methyl arachidate | 1.0 |
| C20:1 | 花生一烯酸甲酯Methyl 11-eicosenoate | 2.0 |
| C20:2 | 花生二烯酸甲酯Methyl 11, 14-eicosenoate | 0.5 |
| C22:0 | 山嵛酸甲酯Methyl behenate | 1.0 |
| C22:1 | 芥酸甲酯Methyl erucate | 2.0 |
| C24:0 | 木焦油酸甲酯Methyl lignocerate | 0.5 |
| C24:1 | 二十四碳一烯酸甲酯Methyl nervonate | 1.0 |
取1粒油茶种仁在液氮中研磨至粉末,称取150 mg粉末立即加入1 mL Trizol,充分混匀裂解;加入200 μL氯仿,用力充分振荡混匀,4 ℃ 12 000 r·min-1离心10 min;取上清,加入等体积酚仿,充分振荡混匀,4 ℃ 12 000 r·min-1离心10 min;取上清,加入等体积氯仿,充分振荡混匀,4 ℃ 12 000 r·min-1离心10 min;取上清,加入等体积异丙醇,颠倒混匀,-20 ℃沉淀1 h。4 ℃ 12 000 r·min-1离心15 min;弃上清,加0.5 mL 75%乙醇,4 ℃ 8 000~10 000 r·min-1 5 min;重复上一步骤;弃上清后短暂离心,移液枪吸干乙醇,真空干燥2 min;加20 μL RNA-Free water,室温溶解5 min,混匀后短暂离心得到RNA溶液。电泳检测提取RNA的完整性,NANODROP RNA质量检测仪测定RNA浓度。OD值:A260/A280=1.7~2.1;A260/A230=1.7~2.0,样品浓度≥200 ng·μL-1,样品总量≥2.5μg。
根据已有的普通油茶SAD和FAD2基因序列保守区(GenBank登录号KJ995982.1,KJ995981.1)及内参基因actin(GenBank登录号KC337044.1), 参考相关文献[16-17]及转录组测序数据利用同源比对,筛选出越南油茶SAD和FAD2基因序列,利用Primer 5进行引物设计;FAD3和FAE1引物则参照相关文献[12],引物序列见表 2。将所提取的RNA按照FastQuant RT Kit (with gDNase)说明书合成cDNA,使用ABI step one plus荧光定量PCR仪(美国ABI公司)推荐程序进行荧光定量PCR实验,具体程序为:95 ℃预变性90 s,95 ℃变性5 s,60 ℃退火15 s,72 ℃退火20 s,40个循环,每个反应重复3次。采用2-△△Ct方法分析目的基因相对表达量;采用Excel软件绘制脂肪酸组分和相对含量及相关基因相对表达量的折线分析图。
| 基因名称 Gene name |
正向引物 Forward primer(5′→3′) |
反向引物 Reverse primer(5′→3′) |
PCR产物大小 Length of PCR product/bp |
| SAD | TCTCGCACGGGAACACAG | ATCAAGTGGGCTGGCATAGA | 208 |
| FAD2 | ACACTCATCCTGCTCTGCCT | CTCTTGCCTCCCTCCACATC | 261 |
| FAD3 | GCCAAAAAAATCGGGTC | ATCGCAAAGAATCACTCC | 83 |
| FAE1 | GACACTTCTGGTGTTCCTATCC | TGACGAGCATCTTCTGGTTTAT | 99 |
采用SAS软件ANOVA过程作方差分析,采用Duncan法对不同时期脂肪酸含量和基因相对表达量作多重比较分析;采用CANCORR过程对不同时期脂肪酸相对含量和关键酶编码基因相对表达量作典型性相关分析;采用COR R过程对不同时期脂肪酸相对含量、基因相对表达量等相互间作多元线性相关分析(只求偏向关系式),各变量与脂肪酸含量和基因表达量对应关系见表 3。
| 变量Variable | 基因Gene | 变量Variable | 脂肪酸Fatty acid | |
| x1 | SAD | y1 | C18:0 | |
| x2 | FAD2 | y2 | C18:1 | |
| x3 | FAD3 | y3 | C18:2 | |
| x4 | FAE1 | y4 | C18:3 | |
| y5 | C20:1 |
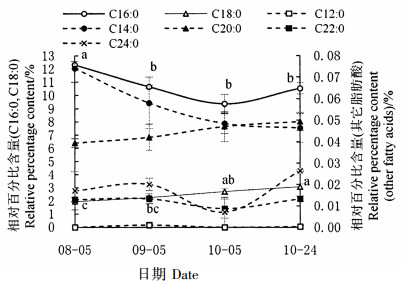
图 1为种子发育过程中饱和脂肪酸组分及含量的动态变化。从茶籽油中共检测出7种饱和脂肪酸,其中以棕榈酸和硬脂酸为主;棕榈酸相对含量整体呈下降趋势,以8月5日最高,以10月5日和10月24日最低,9月5日居中且与最高、最低含量无显著差异;硬脂酸相对含量总体呈与棕榈酸相对含量相反的上升趋势,以8月5日和9月5日最低,以10月24日最高,10月5日居中且与最高、最低含量无显著差异;肉豆蔻酸和花生酸含量在各时期差异不显著;月桂酸、山嵛酸、木焦油酸等3种饱和脂肪酸在越南油茶中都是首次发现,且所占比重极小,各时期脂肪酸相对含量差异不显著。总之,越南油茶茶籽油主要饱和脂肪酸含量在不同时期差异显著,且在脂肪酸转化过程中可能存在棕榈酸向硬脂酸的直接转化。
|
注:不同小写字母表示差异显著(P < 0.05),不带字母表示相互间差异不显著(P≥0.05)。 Note:the different letters show the extremely significant difference at P < 0.05, and no letters show the insignificant difference at P≥0.05. 图 1 饱和脂肪酸组分及含量的动态变化 Fig. 1 Dynamic changes of saturated fatty acid composition and content during seed development |
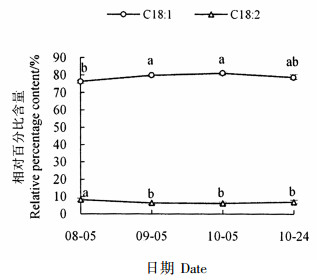
油酸和亚油酸是越南油茶茶籽油的2种含量较高的不饱和脂肪酸,其动态变化如图 2所示。油酸含量极显著高于亚油酸含量;油酸相对含量以9月5日和10月5日显著最高,以8月5日显著最低,10月24日居中且与最高、最低含量无显著差异;亚油酸相对含量在8月5日显著高于其它时期。可见,8月5日到9月5日是油酸快速积累时期,油酸的积累随着种子的成熟而增加,亚油酸的积累随着种子的成熟而减少。
|
注:不同小写字母表示差异显著(P < 0.05),不带字母表示相互间差异不显著(P≥0.05)。 Note:the different letters show the extremely significant difference at P < 0.05, and no letters show the insignificant difference at P≥0.05. 图 2 主要不饱和脂肪酸组分及含量的动态变化 Fig. 2 Dynamic changes of major unsaturated fatty acid composition and content during seed development |
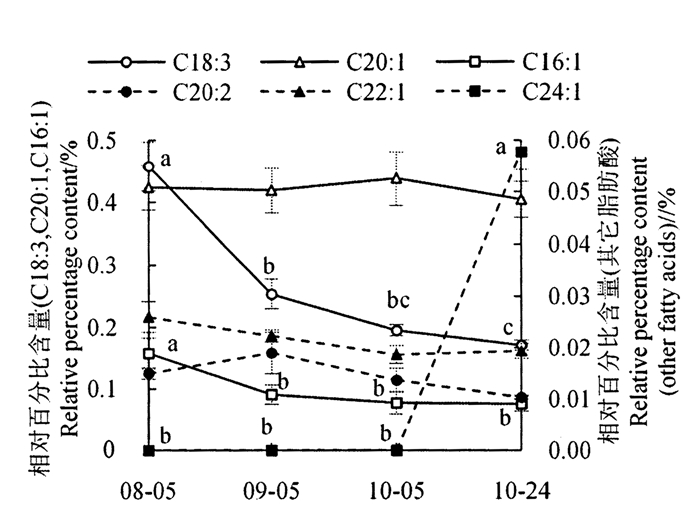
越南油茶茶籽油中还检测出6种低含量不饱和脂肪酸,其含量动态变化如图 3所示。亚麻酸相对含量呈下降趋势,以8月5日最高,9月5日次之,10月24日最低,且差异显著;10月5日与9月5日和10月24日均无显著差异,但其与8月5日差异显著。棕榈油酸相对含量呈下降趋势,且在8月5日显著高于其他时期。花生一烯酸相对含量在各时期差异不显著。花生二烯酸、芥酸和二十四碳一烯酸等3种脂肪酸在越南油茶中都是首次发现,其中花生二烯酸和芥酸相对含量在各时期差异不显著,而二十四碳一烯酸仅在10月24日油茶油样品中发现。可见,越南油茶茶籽油不饱和脂肪酸种类较多,其有可能提升茶籽油营养价值,且不同的低含量不饱和脂肪酸具备不同的积累特点。
|
注:不同小写字母表示差异显著(P < 0.05),不带字母表示相互间差异不显著(P≥0.05)。 Note:the different letters show the extremely significant difference at P<0.05, and no letters show the insignificant difference at P≥0.05. 图 3 低含量不饱和脂肪酸组分及含量的动态变化 Fig. 3 Dynamic changes of low content unsaturated fatty acid composition and content during seed development |
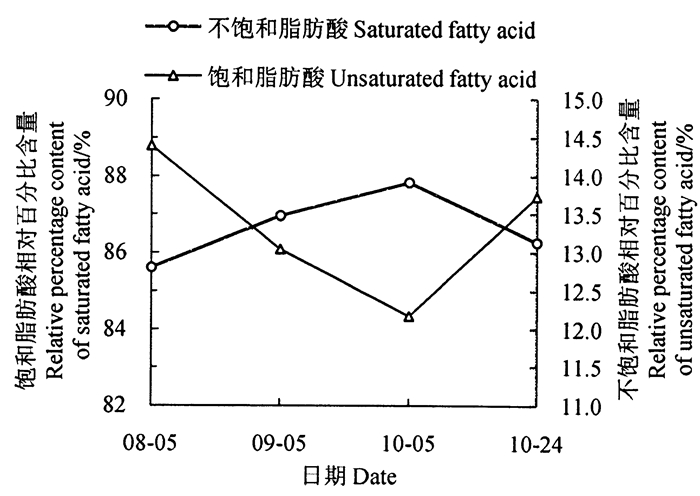
由图 2还可见,油酸和亚油酸含量动态变化呈极显著线性负相关(R2=0.934 9,P < 0.000 1),说明在脂肪酸积累过程中可能存在油酸向亚油酸的转化,油酸积累增加可能与其向亚油酸转化受抑制有关。由图 4可见,饱和脂肪酸和不饱和脂肪酸含量动态变化也存在极显著负相关关系(R2=1,P < 0.000 1),说明可能存在饱和脂肪酸向不饱和脂肪酸的转化,并且选择合适的采果日期应该是提高茶籽油不饱和脂肪酸比例的有效手段之一。
|
图 4 饱和脂肪酸和不饱和脂肪酸含量的动态变化 Fig. 4 Dynamic changes of saturated fatty acid and unsaturated fatty acid content during seed development |
由图 5可见,SAD基因相对表达量呈现先上升后缓慢下降的趋势,以8月5日显著最低,以9月5日显著最高,10月5日和10月24日居中且与最高、最低表达量无显著差异;FAD2基因相对表达量呈上升趋势,且8月5日显著低于其他各时期;FAD3和FAE1等的基因的相对表达量在各时期无显著异。可见,SAD基因相对表达量与油酸相对含量的动态变化趋势一致;FAD2基因相对表达量和亚油酸相对含量动态变化在8月5日—9月5日呈相反趋势,此后与亚油酸含量动态变化一致,即再无显著变化。FAD3基因相对表达量一直处于较低水平且各时期差异不显著,这与亚麻酸含量较低和与其动态变化趋势一致;FAE1基因相对表达量各时期无显著差异,也与花生一烯酸相对含量动态变化趋势一致。说明不同脂肪酸的积累特点与控制其转化的关键酶基因表达效率动态变化特点基本一致。
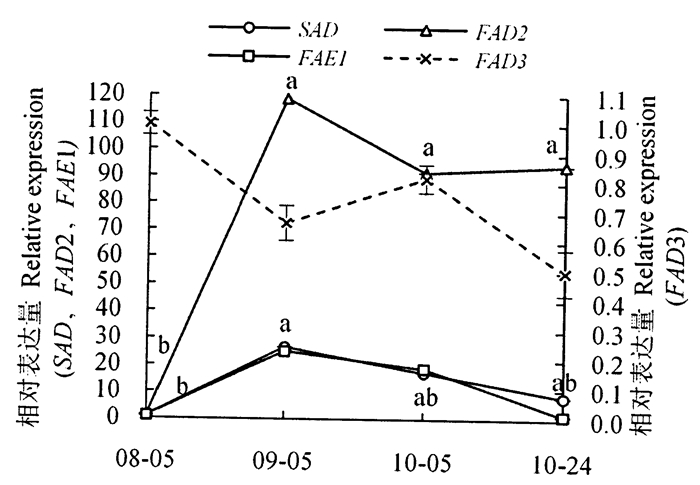
|
注:不同小写字母表示差异显著(P < 0.05),不带字母表示相互间差异不显著(P≥0.05)。 Note:the different letters show the extremely significant difference at P < 0.05, and no letters show the insignificant difference at P≥0.05. 图 5 不同时期脂肪酸合成相关基因相对表达量 Fig. 5 Relative expression of genes related to fatty acid |
对4种关键酶基因相对表达量与5种相关的脂肪酸含量作典型性相关分析,得到4对典型性相关变量,但只有第一对典型性相关变量呈极显著相关(P=0.002 9),说明典型性相关分析效果极其理想,典型性相关变量如下:
| $ U = - 2.181\;8{x_1} + 2.000\;1{x_2} + 0.511\;4{x_3} + 0.130\;6{x_4} $ | (1) |
| $ V = 0.736\;2{y_1} - 0.063\;8{y_2} + 0.554\;6{y_3} - 0.358\;1{y_4} - 0.429\;2{y_5} $ | (2) |
各变量与典型性相关变量之间的相关系数如表 4,可见,主要是x2(FAD2基因相对表达量)、x3(FAD3基因相对表达)、x4(FAE1基因相对表达)与y1(硬脂酸含量)、y4(亚麻酸含量)、y5(花生一烯酸含量)的相关性,说明这些关键酶基因的表达效率可能受最开始的底物和最终的生成物的积累所调节,并反过来决定原始底物和最终产物的积累水平。
| 典型性相关变量Typical related variable | x1 | x2 | x3 | x4 | y1 | y2 | y3 | y4 | y5 |
| U | -0.031 3 | 0.426 8 | 0.225 9 | -0.286 0 | 0.814 8 | 0.114 1 | -0.133 0 | -0.569 2 | -0.540 5 |
| V | -0.029 8 | 0.407 4 | 0.215 6 | -0.273 0 | 0.853 5 | 0.119 5 | -0.139 3 | -0.596 2 | -0.566 2 |
对4种关键酶基因相对表达量与5种相关的脂肪酸含量作典型性相关分析,其中具有显著性的偏相关系数如表 5所示。SAD基因相对表达量与硬脂酸含量呈负相关,而SAD是催化硬脂酸向油酸转化的关键酶,说明SAD基因表达效率提高促进硬脂酸向油酸转化而导致硬脂酸含量降低;FAD2基因相对表达量和硬脂酸含量呈正相关,说明硬脂酸积累对FAD2基因表达可能存在正调控作用;SAD与FAD2、FAD3基因相对表达量均呈正相关,FAD2是催化油酸向亚油酸转化的关键酶,FAD3是催化亚油酸向亚麻酸转化的关键酶,图 6显示FAD2基因相对表达量很高,这造成油酸向亚油酸的转化速率很高,说明SAD基因通过正调控作用促进FAD2和FAD3基因表达,进而促进硬脂酸向油酸、油酸向亚油酸和亚油酸向亚麻酸的一系列转化,这也与表 5结果所显示的油酸与亚油酸含量间呈负相关一致;亚油酸含量与FAD3基因相对表达量呈正相关,说明亚油酸积累对FAD3基因表达具正调控作用。
| 变量 Variable |
偏相关系数 Partial correlation coefficient |
显著性P |
| x1, y1 | -0.684 1 | 0.042 1 |
| x2, y1 | 0.746 9 | 0.020 7 |
| x3, y3 | 0.659 6 | 0.049 3 |
| x1, x2 | 0.937 6 | 0.000 2 |
| x1, x3 | 0.693 7 | 0.038 2 |
| y2, y3 | -0.858 3 | 0.003 1 |
前人在越南油茶茶籽油脂肪酸组分的研究上一般只检测出5~7种脂肪酸[11, 18],而本文共检测出15种脂肪酸酸,除主要成分如油酸、亚油酸、棕榈酸和硬脂酸等外,多出了一些有益于人体健康的不饱和脂肪酸。前人研究结果表明不同方法提取茶籽油对脂肪酸组成没有显著影响[19-22],所以推测可能是不同产地导致的,这意味着海南省越南油茶茶籽油营养更加丰富。其中油酸是衡量食用油品质的重要指标[23],具有降低血脂水平和预防心血管疾病的作用,是人和哺乳动物生长发育所必需的一种脂肪酸[24]。亚油酸与亚麻酸都属于人和动物生长所必需的不饱和酸,在体内不能合成,必须在食物中获取,其中亚油酸具有降低血清LDL-C水平的作用[24]。另外所测得的油茶籽油中,月桂酸、山嵛酸、芥酸、木焦油酸、肉豆蔻酸、二十四碳一烯酸等对人体有害的脂肪酸含量均远低于《油茶籽油》(GB/T11765—2018)国家质量标准。因此,海南产区的越南油茶茶籽油是具有鲜明地方特色的高品质食用油。
研究结果表明,8月5日到9月5日是油酸积累的关键时期,而亚油酸相对含量在8月5日之后呈下降趋势,由于7月5日未从种子中提取出油脂,所以推测海南越南油茶亚油酸合成高峰期应在7月5日至8月5日之间,这与前人在普通油茶上的研究结果一致[8]。本文研究结果还表明油酸和亚油酸、饱和脂肪酸和不饱和脂肪酸等之间可能存在前者向后者的转化关系,这与前人研究结果一致[25];其中油酸和亚油酸存在此消彼长的关系,说明可能存在亚油酸向油酸转化,其内在联系需要进一步研究。并且油茶不饱和脂肪酸与饱和脂肪酸的比例在10月5日达到最大值,说明选择合适的采果日期是提高油茶油不饱和脂肪酸比例的有效手段之一,这为不同越南油茶产区确定合理的采收时间提供了一定的科学参考。
核桃主要不同脂肪酸相互转化模式图如图 6所示[26],说明这3种酶影响着底物(硬脂酸)和产物(亚麻酸和花生一烯酸)之间的关系,底物含量越多则会促进整个反应的进行,并且整个反应的相关酶基因表达量越高,本文结果表明硬脂酸含量与典型性相关变量U和V的相关系数均最大,说明底物对整个反应过程影响最大,取得与此一致的结果。
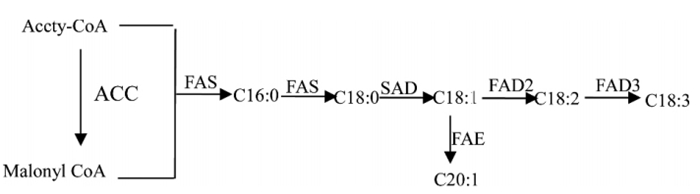
|
图 6 核桃主要不同脂肪酸相互转化模式图 Fig. 6 Mutual transformation pattern of different fatty acids in walnutss |
SAD基因是催化饱和脂肪酸第一步去饱和生成油酸的关键基因[27],决定着C18以上不饱和脂肪酸的总含量及油脂中饱和与不饱和脂肪酸的比例[12];本研究结果表明,8至9月SAD基因相对表达量迅速上升,SAD基因相对表达量与硬脂酸含量呈显著负相关,硬脂酸积累和SAD基因表达均对FAD2基因表达具备正调控作用,其原因可能是,SAD基因上调表达促进油酸的积累增多而导致硬脂酸积累减少,有可能推进下游反应的进行,从而促进下游基因FAD2相对表达量升高。FAD2基因持续高表达但和亚油酸相对含量动态变化呈相反趋势,这可能是由于亚油酸中的一部分转化为亚麻酸导致的,事实上表明亚油酸积累会促进FAD3基因表达增强。本文结果还表明亚麻酸相对含量与FAD3基因相对表达量动态变化趋势不符,这可能是由于FAD3基因的拷贝数目多个[28],且油脂中油酸的合成速率要远远大于油酸转化为亚油酸的速率,亚麻酸的转化速率也因此受到影响,因此有关FAD基因家族对越南油茶脂肪酸的调控机制还需进一步研究。基于此,SAD基因表达增强促进硬脂酸向油酸转化,硬脂酸含量对FAD2基因表达、亚油酸含量对FAD3基因表达、SAD基因表达对FAD2基因表达等均表现正调控作用,这初步揭示了越南油茶茶籽油脂肪酸转化的分子机制和不同组成的成因,为越南油茶品质育种和优质栽培提供了新思路。
4 结论研究结果表明,越南油茶茶籽油的营养品质具有鲜明的地方特色,茶籽油存在棕榈酸向硬脂酸、硬脂酸向油酸、油酸向亚油酸和亚油酸向亚麻酸的直接转化过程;油茶不饱和脂肪酸与饱和脂肪酸的比例在10月5日达到最大值,说明选择合适的采果日期是提高茶籽油饱不和脂肪酸比例的有效手段之一;SAD基因表达增强促进硬脂酸向油酸转化,硬脂酸含量对FAD2基因表达、亚油酸含量对FAD3基因表达、SAD基因表达对FAD2基因表达和SAD基因表达对FAD3基因表达等均表现正调控作用。本文研究结果初步揭示了越南油茶茶籽油脂肪酸转化的分子机制,在越南油茶品质育种和优质栽培技术的制定上具有一定的参考价值。
| [1] |
周开兵, 吴友根, 符碧海, 等. 越南油茶"琼海优"品系实生选种研究初报[J]. 热带生物学报, 2016, 7(3): 353-357. |
| [2] |
郑道君, 潘孝忠, 谢良商, 等. 海南省油茶产业发展现状调查与分析[J]. 经济林研究, 2015, 33(1): 131-135. |
| [3] |
郭钰柬, 王珮璇, 周开兵, 等. 海南省不同产区对越南油茶栽培性状的影响分析[J]. 森林与环境学报, 2019, 39(4): 431-437. |
| [4] |
SU M H, SHIH M C, LIN K H. Chemical composition of seed oils in native Taiwanese Camellia species[J]. Food Chemistry, 2014, 156(3): 369-373. |
| [5] |
LEE C P, YEN G C. Antioxidant activity and bioactive compounds of tea seed (Camellia oleifera Abel.) oil[J]. Journal of Agricultural and Food Chemistry, 2006, 54: 779-784. |
| [6] |
FEAS X, ESTEVINHO L M, SALINERO C, et al. Tria-cylglyceride, antioxidant and antimicrobial features of virgin Camellia oleifera, C. reticulata and C. sasanqua oils[J]. Molecules, 2013, 18(4): 4573-4587. DOI:10.3390/molecules18044573 |
| [7] |
王小艺, 曹一博, 张凌云, 等. 油茶生长发育过程中脂肪酸成分的测定分析[J]. 中国农学通报, 2012, 28(13): 76-80. |
| [8] |
周长富, 姚小华, 林萍, 等. 油茶种子发育过程组分含量动态研究[J]. 中国油料作物学报, 2013, 35(6): 680-685. |
| [9] |
贵州林科所林化研究室, 玉屏县茅坡油茶研究站. 油茶种仁生长发育过程油分的形成、转化和积累的探讨[J]. 贵州林业科技, 1980(4): 25-30. |
| [10] |
刘欢, 于靖, 吴友根, 等. 大果油茶实生树茶籽油脂肪酸组成分析[J]. 热带作物学报, 2017, 38(5): 843-848. |
| [11] |
陈静, 周开兵. 越南油茶实生树茶籽油主要脂肪酸组成变异分析[J]. 森林与环境学报, 2018, 38(3): 101-106. |
| [12] |
吴波, 阮成江, 熊朝伟, 等. 油茶种子油酸合成积累相关基因的表达模式分析[J]. 分子植物育种, 2019, 17(5): 1493-1502. |
| [13] |
江南, 谭晓风, 张琳, 等. 基于RNA-Seq的油茶种子α-亚麻酸代谢途径及相关基因分析[J]. 林业科学, 2014, 50(8): 68-75. |
| [14] |
刘祾悦, 阮成江, 王莉, 等. 文冠果种仁油脂脂肪酸形成的多基因协同调控[J]. 分子植物育种, 2019, 17(6): 1834-1842. |
| [15] |
国家粮食局.动植物油脂脂肪酸甲酯制备: GB/T 17376-1998[S].北京: 中国标准出版社, 1998.
|
| [16] |
彭邵锋, 陈永忠, 陈隆升, 等. 油茶SAD基因原核表达载体构建[J]. 中国农学通报, 2010, 26(24): 133-136. |
| [17] |
谭晓风, 陈鸿鹏, 张党权, 等. 油茶FAD2基因全长cDNA的克隆和序列分析[J]. 林业科学, 2008, 44(3): 70-75. |
| [18] |
朱勇, 王湘莹, 马锦林, 等. 不同物种油茶籽仁含油率及其茶油的脂肪酸组成[J]. 经济林研究, 2013, 31(2): 134-137. |
| [19] |
黄鑫, 张利军, 张保艳. 油茶籽油提取方法对比分析[J]. 中国油脂, 2019, 44(6): 9-13. |
| [20] |
陈颖慧. 5种提取方法对茶油品质的影响[J]. 粮食与油脂, 2019, 32(2): 33-37. |
| [21] |
杨辉, 赵曼丽, 范亚苇, 等. 不同提取方法所得茶油的品质比较[J]. 食品工业科技, 2012, 33(11): 267-274. |
| [22] |
王小媛, 马宝晨, 纵伟. 不同提取方法对杜仲籽油质量的影响[J]. 食品工业科技, 2019, 40(23): 119-124. |
| [23] |
吴小娟, 李红冰, 逢越, 等. 山茶和油茶种子中脂肪酸的分析[J]. 大连大学学报, 2006, 27(4): 56-58. |
| [24] |
柏云爱, 宋大海, 张富强, 等. 油茶籽油与橄榄油营养价值的比较[J]. 中国油脂, 2008, 33(3): 39-41. |
| [25] |
刘星星, 肖萍, 罗火林, 等. 油茶种子发育过程中脂肪酸的变化研究[J]. 现代食品科技, 2015, 31(6): 322-328. |
| [26] |
陈虹, 潘存德, 王蓓, 等. 核桃种子发育主要营养物质积累之间的关系及脂肪酸动态变化[J]. 河北农业大学学报, 2016, 39(1): 57-62. |
| [27] |
章文乐, 蒲婧懿, 朱梦媛, 等. 黄连木PcSAD基因的克隆及分析[J]. 基因组学与应用生物学, 2013, 32(4): 503-509. |
| [28] |
宋志波.油茶内参基因的筛选与油脂合成相关酶基因的表达特征分析[D].长沙: 中南林业科技大学, 2014: 1-77.
|

 2020, Vol. 40
2020, Vol. 40


