文章信息
- 汪远秀, 李快芬, 丁贵杰, 刘海燕
- WANG Yuanxiu, LI Kuaifen, DING Guijie, LIU Haiyan
- 铝对马尾松菌根苗生长及营养元素吸收的影响
- Effects of Aluminum on growth and nutrient element absorption of mycorrhizal Pinus massoniana seedlings
- 森林与环境学报,2020, 40(2): 119-125.
- Journal of Forest and Environment,2020, 40(2): 119-125.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2020.02.002
-
文章历史
- 收稿日期: 2019-12-24
- 修回日期: 2020-01-28
2. 贵州省森林资源与环境研究中心,贵州 贵阳 550025;
3. 贵州省植物园,贵州 贵阳 550004
2. Institute for Forest Resources and Environment of Guizhou, Guiyang, Guizhou 550025, China;
3. Guizhou Botanical Garden, Guiyang, Guizhou 550004, China
通常情况下,铝离子主要以A13+、Al (OH)2+和Al (OH) 2+形态存在于土壤中,其中A13+的毒性最强,对植物危害最大[1-2]。有研究表明,活性铝易对植物产生毒害作用,抑制植物的生长[3-4]。铝毒害通过抑制植物根尖细胞的伸长和分裂,减弱植物对必需元素和微量元素的吸收,改变植物原有的有机酸分泌、细胞活动、酶活性及光合作用等生理活动来抑制植物生长[1]。研究发现,外生菌根真菌可以增强宿主植物的抗铝性[5]。王明霞等[6-7]通过对比4种外生菌根真菌吸收Al3+的情况发现褐环乳牛肝菌[Suillus luteus (L. ex Fr.) Gray, SL]的耐铝性优于其它3种外生菌根真菌。李慧等[8]发现接种褐环乳牛肝菌后,樟子松(Pinus sylvestris var. mongolica Litv.)和油松(Pinus tabulaeformis Carrière)的根际土壤菌群结构发生了变化。油松接种褐环乳牛肝菌后的生长量、生物量积累及针叶和根系中的保护酶活性均好于接种红汁乳菇(Lactarius hatsudake Tanaka, LH)的[9]。
马尾松是我国南方主要的乡土工业用材树种,具有分布广、耐干旱、耐瘠薄、适应性强等特性[10-11]。我国南方主要是富铁铝化酸性土壤[12],当土壤酸化时,存在于固相部分的铝会释放到土壤溶液中或以交换性铝形式吸附在土壤表面的阳离子交换位上,诱发重金属和铝毒害[13-14]。铝毒害影响了马尾松的生长,甚至导致马尾松大面积衰退和死亡。国内学者对菌根化马尾松的研究主要集中在干旱胁迫、种子萌发和根际土壤微生物等方面[15-17],对铝胁迫的研究较少,如何增强马尾松苗木对铝的耐受性是目前马尾松研究过程中亟待解决的重要问题。为探明铝对菌根化和非菌根化马尾松幼苗生长及营养元素吸收的影响,揭示和掌握马尾松菌根苗对铝的适应机制,为缓解马尾松苗木在土壤酸化地区的铝毒害提供理论和技术参考,开展了本研究。
1 材料与方法 1.1 供试菌株与菌剂供试材料为褐环乳牛肝菌(Suillus luteus, SL)。将来自贵州省龙里林场马尾松林下的褐环乳牛肝菌菌株的子实体接种于Pachlewski液体培养基中,在(25±1) ℃条件下培养21 d后备用。
用100 mL三角瓶装Pachlewski液体培养基50 mL,封口后置于121 ℃高压灭菌锅中灭菌30 min,冷却后将6 mm的菌片接种于液体培养基中,每瓶装2个菌片,封口后置于25 ℃培养箱中暗培养21 d备用[18]。
1.2 供试幼苗种子采自贵州省都匀市马鞍山马尾松国家良种基地的优良半同胞家系单株。将选好的种子用质量分数为0. 5%高锰酸钾溶液消毒1 h后用无菌水冲洗3~5次,然后将其浸入初始温度40 ℃无菌水中24 h,待露白后取出放在发芽盒内并置于25 ℃人工气候箱内催芽,基质为灭菌后的蛭石,出芽45 d后移植至苗床,发芽盒和苗床中处理组均洒菌剂,对照组不洒菌剂。
1.3 试验设计采用水培法,选取长势一致的菌根化幼苗(SL)和非菌根化幼苗(CK)为试验材料,移栽固定于水培盆中,每个处理5盆,每盆移栽40株,在马尾松苗龄180 d时,用体视显微镜观测接种褐环乳牛肝菌的马尾松幼苗根系是否成功侵染,当侵染率大于55%时开始铝胁迫,采用不同Al3+浓度的1/4 Hoagland完全营养液培养,共设置0、0. 2、0. 4、0. 8和1. 2 mmol · L,-15个Al3+浓度梯度,以AlCl3 的形式加入Al3+,pH值设置为5. 0±0. 5,每7 d更换1次营养液,具体方法参考李快芬[19]的方法处理。
1.4 试验设计铝处理60 d后用直尺测量幼苗苗高,之后整株取样,用去离子水将菌根化和非菌根化幼苗按地上部分(叶、茎)和地下部分(根)洗净后称鲜重,然后放入80 ℃的烘箱烘干至恒重以测定其生物量。根系形态用根系扫描仪分析,根、茎、叶中的N、P、K、Al含量分别采用靛酚蓝比色法、钼锑抗比色法、火焰光度计法和分光光度计法测定[19]。
1.5 数据处理数据用Excel 2013进行处理和作表,用SPSS 18. 0软件进行统计分析,用Sigmaplot 12. 0和Adobe Illustrator CS6软件作图。
2 结果与分析 2.1 Al3+对马尾松幼苗苗高的影响图 1为Al3+对菌根化和非菌根化马尾松幼苗苗高的影响。由图 1可知,在不同浓度Al3+处理下,菌根苗的苗高均高于非菌根苗,与未接种马尾松幼苗相比,Al3+浓度为0、0. 2、0. 4、0. 8和1. 2 mmol · L-1时,苗高依次增加7. 09%、10. 37%、15. 90%、10. 91%和9. 53%。接种和未接种苗高均随Al3+浓度的增大表现为先升后降再升的趋势。Al3+浓度为0. 2 mmol · L-1时,促进作用最强,但随着Al3+浓度的增大,逐渐转为抑制作用,且抑制作用逐渐增强,当Al3+浓度为1. 2 mmol · L-1时,抑制作用最强,与Al3+浓度为0. 8 mmol · L-1时相比,未接种和接种马尾松幼苗的苗高均有小幅增长,但在P=0. 05时无显著性差异。
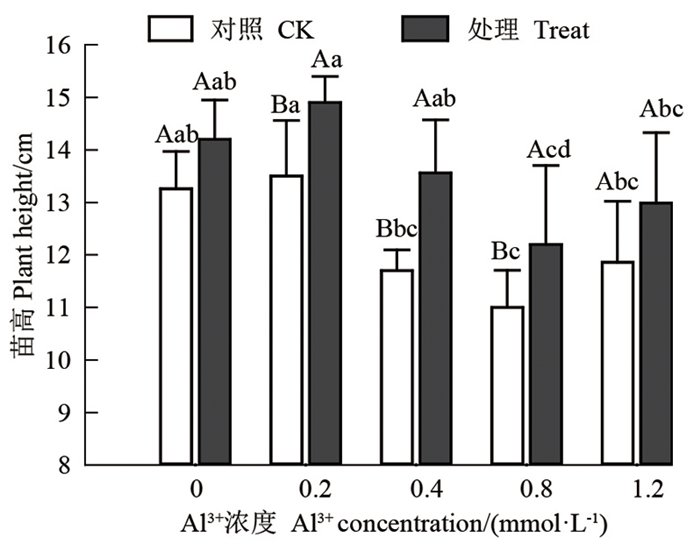
|
不同大写字母表示Al3+浓度相同, 在P=0.05时存在显著性差异,不同小写字母表示Al3+浓度不同,在P=005时存在显著性差异 different uppercase letters mean that there was a significant difference at the same concentration of Al3+ at P=0. 05, and different lowercase letters mean that there was a significant difference with different concentrations of Al3+ at P=0. 05 图 1 Al3+对马尾松幼苗苗高的影响 Fig. 1 Effects of Al3+ concentrations on the growth of mycorrhizaland non-mycorrhizal P. massoniana seedlings |
Al3+对马尾松幼苗地上及地下生物量的影响如图 2所示。从图 2可知,不同浓度Al3+处理下,菌根苗的地上和地下部分生物量均高于非菌根苗,且差异显著。与未接种的马尾松幼苗相比,接种的幼苗地上生物量分别增加了37. 93%、60. 87%、58. 06%、41. 18%和45. 57%,地下生物量分别增加了50. 00%、57. 14%、33. 33%、100. 00%和50. 00%。接种和未接种马尾松幼苗生物量均随Al3+浓度的增加表现为先升后降再升的趋势。当Al3+浓度为0. 2 mmol · L-1时,促进作用达最大,但随着Al3+浓度继续增加,逐渐抑制幼苗生长,当Al3+浓度为0. 8 mmol · L-1时,抑制作用最强;当Al3+浓度为1. 2 mmol · L-1时未接种和接种的幼苗生物量均有小幅增长,但在P=0. 05时无显著性差异。
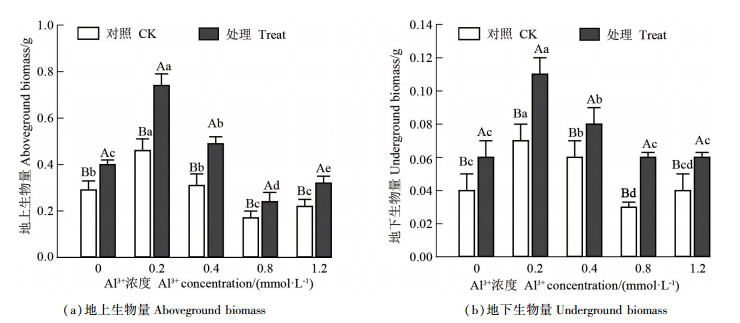
|
不同大写字母表示Al3+浓度相同, 在P=0.05时存在显著性差异,不同小写字母表示Al3+浓度不同,在P=005时存在显著性差异 different uppercase letters mean that there was a significant difference at the same concentration of Al3+ at P=0. 05, and different lowercase letters mean that there was a significant difference with different concentrations of Al3+ at P=0. 05 图 2 Al3+对马尾松幼苗地上及地下生物量的影响 Fig. 2 Effects of Al3+ on aboveground and underground biomass of mycorrhizal and non-mycorrhizal P. massoniana seedlings |
Al3+对马尾松菌根苗和非菌根苗根系形态的影响如表 1所示。由表 1可知,不同浓度Al3+处理,菌根苗根尖数、根表面积、根总长度和根体积均高于非菌根苗,但平均直径变化不明显。随Al3+浓度增大,根尖数、根表面积、根总长度和平均直径均呈现先升后降再升的趋势,低浓度Al3+对这4个根系形态参数均有促进作用,但随着Al3+浓度的增大,Al3+对这4个根系形态参数产生抑制作用,当Al3+浓度为0. 8 mmol · L-1时,抑制作用最强。当Al3+浓度为1. 2 mmol · L-1时,与Al3+浓度为0. 8 mmol · L-1时相比,接种的马尾松幼苗和未接种的马尾松幼苗的根系总长度、根系表面积、平均直径和根尖数等均有低幅增长,但在P=0. 05时无显著性差异。
| 幼苗类型 Seedling type |
处理浓度 Treatment concentration/(mmol·L-1) |
根尖数 Root tip number |
平均直径 Average diameter/cm |
根表面积 Root surface area/cm2 |
根总长度 Total root length/cm |
根体积 Root volume/cm3 |
| 非菌根苗CK | 0 | 46.25±12.42Abc | 0.89±0.07Aa | 13.61±5.38Aab | 53.82±20Aa | 0.32±0.08Aab |
| 0.2 | 67.75±5.74Aab | 0.91±0.08Ba | 14.25±1.81Aab | 63.29±7.94Ba | 0.36±0.24Aab | |
| 0.4 | 43.50±17.81Abc | 0.88±0.13Aa | 10.65±3.27Bbc | 45.88±9.53Aab | 0.16±0.10Ac | |
| 0.8 | 29.50±13.68Ac | 0.80±0.09Aa | 7.17±1.51Ac | 34.21±7.56Ab | 0.22±0.05Bbc | |
| 1.2 | 39.75±8.7Abc | 0.88±0.07Aa | 10.51±1.23Abc | 44.50±5.18Aab | 0.43±0.25Ba | |
| 菌根苗SL | 0 | 62.00±15.35Aab | 0.86±0.10Ab | 12.85±3.24Aab | 58.91±15.31Ab | 0.52±0.39Ab |
| 0.2 | 78.25±23.01Aa | 1.18±0.32Aa | 17.16±6.22Aa | 82.08±23.82Aa | 0.20±0.04Ac | |
| 0.4 | 75.25±9.12Aa | 0.86±0.08Ab | 17.90±4.94Aa | 60.68±14.93Ab | 0.21±0.07Ac | |
| 0.8 | 38.00±10.44Abc | 0.76±0.09Ab | 9.84±0.84Abc | 44.14±8.64Abc | 0.76±0.09Aa | |
| 1.2 | 44.25±11.30Aab | 0.80±0.08Ab | 10.73±2.52Abc | 52.32±8.86Abc | 0.80±0.08Aa | |
| 不同大写字母表示Al3+浓度相同, 在P=0.05时存在显著性差异,不同小写字母表示Al3+浓度不同,在P=0.05时存在显著性差异 different uppercase letters mean that there was a significant difference at the same concentration of Al3+ at P=0.05, and different lowercase letters mean that there was a significant difference with different concentrations of Al3+ at P=0.05 |
||||||
Al3+对菌根苗和非菌根苗根茎叶中N含量的影响如图 3 (a)所示。在不同浓度Al3+处理下,菌根苗各器官中N的含量均高于非菌根苗。与未接种的幼苗相比,当Al3+浓度为0、0. 2、0. 4、0. 8和1. 2 mmol · L-1时,接种的马尾松幼苗根中N含量分别增加34. 26%、23. 69%、9. 27%、12. 81%和11. 97%,茎中N的含量分别增加10. 70%、20. 87%、45. 37%、19. 45%和23. 33%,叶中N含量分别增加25. 98%、29. 21%、33. 15%、32. 33%和30. 49%。接种和未接种马尾松幼苗根、茎、叶中的N含量总体呈现先升后降趋势,当Al3+浓度为0. 2 mmol · L-1时,接种和未接种马尾松幼苗根、茎、叶中的N含量最高,之后,随着Al3+浓度增加,接种和未接种马尾松幼苗根、茎、叶中的N含量总体呈下降趋势,Al3+对幼苗各器官N元素的吸收,基本呈现随浓度增加抑制作用逐渐增强。
2.4.2 Al3+对马尾松幼苗根茎叶中P含量的影响Al3+对菌根苗和非菌根苗根茎叶中P含量的影响如图 3 (b)所示。在不同浓度Al3+处理下,菌根苗各器官P的含量均高于非菌根苗,与未接种的马尾松幼苗相比,当Al3+浓度为0、0. 2、0. 4、0. 8和1. 2 mmol · L-1时,接种的马尾松幼苗根中P含量分别增加16. 23%、33. 63%、12. 13%、7. 49%和12. 09%。茎中的P含量在Al3+浓度为0、0. 2、0. 4和1. 2 mmol · L-1时,分别增加了4. 47%、0. 80%、5. 01%和0. 76%,叶中P含量分别增加5. 44%、16. 18%、2. 07%、6. 99%和1. 85%。当Al3+浓度为0. 2 mmol · L-1时,接种和未接种马尾松幼苗根、茎、叶中的P含量最高,随着Al3+浓度升高,幼苗根、茎、叶中的P含量逐渐减少。
2.4.3 Al3+对马尾松幼苗根茎叶中K含量的影响Al3+对菌根苗和非菌根苗根茎叶中K含量的影响如图 4 (a)所示。在不同浓度Al3+处理下,菌根化幼苗根茎叶中的K含量均高于非菌根化幼苗,与未接种的马尾松幼苗相比,当Al3+浓度为0、0. 2、0. 4、0. 8和1. 2 mmol · L-1时,菌根幼苗根中K含量分别增加41. 71%、38. 52%、36. 13%、23. 93%和40. 17%,茎中K含量增加28. 33%、25. 31%、23. 73%、13. 21%和21. 92%,叶中K含量增加18. 26%、17. 96%、16. 13%、22. 26%和10. 70%。随Al3+浓度增加,接种和未接种马尾松幼苗茎中K含量呈下降趋势,根、叶中K含量呈先升后降趋势。当Al3+浓度为0. 2 mmol · L-1时,接种和未接种马尾松幼苗根系和叶片中K含量最高,此后逐渐下降。
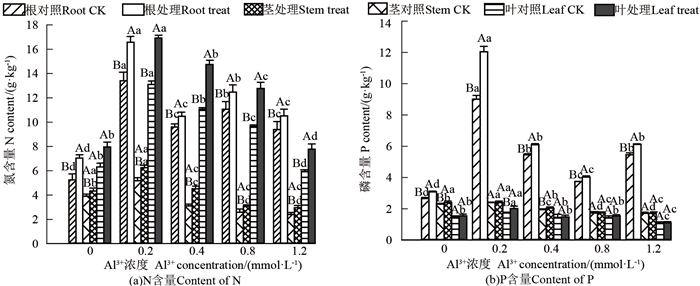
|
不同大写字母表示Al3+浓度相同, 在P=0. 05时存在显著性差异,不同小写字母表示Al3+浓度不同,在P=0. 05时存在显著性差异 different uppercase letters mean that there was a significant difference at the same concentration of Al3+ at P=0. 05, and different lowercase letters mean that there was a significant difference with different concentrations of Al3+ at P=0. 05 图 3 Al3+对马尾松幼苗根茎叶中N和P含量的影响 Fig. 3 Effects of Al3+ on N and P contents in roots, stems and leaves of mycorrhizal and non-mycorrhizal seedlings |
马尾松幼苗根茎叶中的Al含量分布如图 4 (b)所示。在不同浓度Al3+处理下,菌根化幼苗根、茎、叶中的Al含量均低于非菌根化幼苗。与未接种马尾松幼苗相比,菌根苗根中Al含量在Al3+浓度为0 mmol · L-1时增加了5. 67%,之后在Al3+浓度为0. 2、0. 4、0. 8和1. 2 mmol · L-1时分别下降32. 32%、13. 09%、25. 18%和13. 75%,当Al3+浓度为0、0. 2、0. 4、0. 8和1. 2 mmol · L-1时,茎中Al含量分别下降5. 83%、31. 58%、25. 13%、19. 38%和38. 35%,叶中Al含量分别下降11. 27%、16. 63%、13. 79%、12. 76%和16. 10%。与无Al3+处理相比,接种和未接种马尾松幼苗根、茎、叶片中的Al含量随着Al3+浓度的增加均呈现先增后降的趋势,根增幅最明显,各器官中Al含量分配均为根>茎>叶。
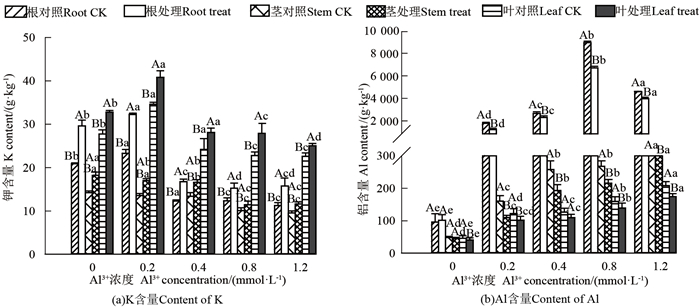
|
不同大写字母表示Al3+浓度相同, 在P=0.05时存在显著性差异,不同小写字母表示Al3+浓度不同,在P=0. 05时存在显著性差异 different uppercase letters mean that there was a significant difference at the same concentration of Al3+ at P=0. 05, and different lowercase letters mean that there was a significant difference with different concentrations of Al3+ at P=0. 05 图 4 Al3+对马尾松幼苗根茎叶中K和Al含量的影响 Fig. 4 Effect of Al3+ on K and Al content in roots, stems and leaves of mycorrhizal and non-mycorrhizal seedlings |
植物生物量反应了植物的生长状况,可作为评估植物抗逆性的重要指标。研究表明,植物根系具有重要的生理功能,如吸收传输水分、合成运输养分和固持植物体等[20]。MARULAND et al [21]、王艺等[22]研究发现在干旱胁迫下,外生菌根通过侵染植物根系改变根形态,增加根系吸收面积,促进植物根系吸收水分和养分,提高植物矿质元素含量,从而促进马尾松苗木的生长。本研究发现,在相同浓度Al3+处理下,马尾松菌根苗的苗高、根系形态和生物量均优于非菌根苗,铝胁迫下,接种褐环乳牛肝菌有利于马尾松幼苗生长。
N、P、K元素均为植物体生长发育过程中的重要元素。SMITH et al [23]研究发现,接种褐环乳牛肝菌对植物吸收营养物质和增强宿主植物抗逆性有利。喻田甜[24]研究发现,外生菌根真菌吸附铝的能力远大于植物根系细胞,它能有效阻止铝进入植物细胞内,从而影响植物生长。本研究结果表明,当Al3+浓度相同时,马尾松菌根苗各器官中的N、P、K含量均比非菌根苗高,而Al含量比非菌根苗低,与上述研究结果相似。这种现象可能是因为接种褐环乳牛肝菌后,改变了马尾松苗根系形态,增大了根系吸收养分范围。菌根苗中的Al含量低于非菌根苗,可能是因为在Al3+胁迫下,褐环乳牛肝菌能分泌草酸、苹果酸和柠檬酸等低分子量有机酸,与Al3+形成环状稳定结构,鳌合Al3+以降低土壤中的Al3+活性来减轻对植物的危害[25]。
此外,不同Al3+浓度处理下,接种和未接种马尾松幼苗苗高、根系形态、生物量积累表现均为先升后降再升的趋势。当Al3+浓度为0. 2 mmol · L-1时,Al3+对接种和未接种马尾松幼苗苗高、根系形态、生物量和N、P、K营养元素的吸收转运等的促进作用达到最强,当Al3+浓度大于0. 2 mmol · L-1时,Al3+对根系形态、生物量和营养元素吸收等的抑制作用逐渐凸显。有研究发现,低浓度的Al3+可维持细胞膜的稳定性,减少细胞内的外渗物,对植物生长有利[26]。纪雨薇[27]的研究也得出,Al3+能明显抑制马尾松的生长,并随浓度的增大抑制作用加强,而本研究中,与Al3+浓度为0. 8 mmol · L-1时相比,当Al3+浓度为1. 2 mmol · L-1时,接种和未接种马尾松幼苗苗高、生物量和根系形态均有小幅增长,其原因可能是在高浓度Al3+胁迫下,马尾松通过吸收根际H+使根尖周围的pH值快速上升,从而使Al3+转化为Al (OH) 3或磷酸铝沉淀而减轻植物受Al3+的毒害[28],因此,本研究中Al3+浓度为1. 2 mmol · L-1时马尾松幼苗出现小幅度增长。辜夕容等[29]研究得出接种双色蜡蘑LbS238N和LbS238A后,植物根系的磷含量均低于对照,但叶片含磷量却显著提高,接种外生菌根真菌促进了磷从根系向地上部位转移。而本研究中马尾松苗根系中磷含量高于茎叶,这种现象可能是马尾松根中的Al3+与进入根细胞的P发生了络合反应,抑制了P向地上部分运输,或者是因为接种的外生菌根种类不同所致。随Al3+浓度增加,马尾松菌根苗和非菌根苗根、茎、叶Al3+含量呈逐渐提高趋势,Al3+含量在根、茎叶、中的分配为根>茎>叶,即根系中的Al3+含量明显大于茎和叶,表明了Al3+被植物吸收后,大部分被累积在根系中,这与刘玉民[30]研究发现,加入外源铝后,马尾松中Al3+的积累量为根>茎>叶的研究结果一致。
4 结论接种褐环乳牛肝菌的马尾松幼苗苗高、生物量、根系形态及根茎叶中营养元素的吸收均高于未接种苗,对Al的吸收低于非菌根化苗,说明接种褐环乳牛肝菌能增强马尾松幼苗的耐铝性,促进铝胁迫下马尾松幼苗的生长。低浓度的Al3+处理对马尾松苗的苗高、生物量、根系生长及营养元素的吸收有一定促进作用,随着Al3+浓度的增加,Al3+逐渐抑制马尾松幼苗苗高、生物量积累、根系形态及营养元素的吸收。
| [1] |
仝雅娜, 丁贵杰. 铝对植物生长发育及生理活动的影响[J]. 西部林业科学, 2008, 37(4): 56-60. DOI:10.3969/j.issn.1672-8246.2008.04.010 |
| [2] |
RYAN P R, RAMAN H, GUPTA S, et al. A second mechanism for aluminum esistance in wheat relies on the constitutive efflux of citrate from roots[J]. Plant Physiology, 2009, 149(1): 340-351. DOI:10.1104/pp.108.129155 |
| [3] |
MANDAL C, GHOSH N, MAITI S, et al. Antioxidative responses of Salvinia (Salvinia natans Linn.) to aluminium stress and it′s modulation by polyamine[J]. Physiology and Molecular Biology of Plants, 2013, 19(1): 91-103. DOI:10.1007/s12298-012-0144-4 |
| [4] |
SUN C L, LIU L J, YU Y, et al. Nitric oxide alleviates aluminum-inducedoxidative damage through regulating the ascorbate-glutathione cycle in roots of wheat[J]. Journal of Integrative Plant Biology, 2015, 57(6): 550-561. DOI:10.1111/jipb.12298 |
| [5] |
辜夕容, 梁国仕, 黄建国. 外生菌根提高植物抗铝性机理研究进展[J]. 中国农学通报, 2005, 21(9): 218-221. DOI:10.3969/j.issn.1000-6850.2005.09.064 |
| [6] |
王明霞, 袁玲, 黄建国, 等. 4株外生菌根真菌对Al3+吸收与吸附的研究[J]. 环境科学, 2015, 36(9): 3 479-3 485. |
| [7] |
王明霞, 袁玲, 周志峰, 等. 铝对外生菌根真菌草酸分泌及氮磷钾吸收的影响[J]. 林业科学, 2012, 48(2): 82-88. DOI:10.3969/j.issn.1672-8246.2012.02.014 |
| [8] |
李慧, 姚庆智, 张星, 等. 褐环乳牛肝菌对樟子松和油松根际土壤真菌多样性的影响[J]. 菌物学报, 2019, 38(7): 1 071-1 081. |
| [9] |
祁金玉, 邓继峰, 尹大川, 等. 外生菌根菌对油松幼苗抗氧化酶活性及根系构型的影响[J]. 生态学报, 2019, 39(8): 2 826-2 832. |
| [10] |
张盛楠, 刘亚敏, 刘玉民, 等. 马尾松幼苗生长及生理特性对铝胁迫的响应[J]. 西北植物学报, 2016, 36(10): 2 022-2 029. |
| [11] |
丁贵杰, 周志春, 王章荣, 等. 马尾松纸浆用材林培育与利用[M]. 北京: 中国林业出版社, 2006.
|
| [12] |
仝雅娜, 丁贵杰. 木荷和鹅掌楸萃取物及其活性铝溶液对马尾松种子发芽的影响[J]. 浙江林业科技, 2010, 30(2): 40-44. DOI:10.3969/j.issn.1001-3776.2010.02.009 |
| [13] |
仝雅娜, 丁贵杰. 1, 2代马尾松林土壤不同形态铝含量[J]. 林业科学, 2012, 48(6): 8-11. |
| [14] |
赵志刚, 丁贵杰, 唐敏. 酸、铝胁迫对马尾松种子萌发与芽苗生长的影响[J]. 林业科学研究, 2007, 20(1): 111-115. DOI:10.3321/j.issn:1001-1498.2007.01.021 |
| [15] |
罗晓蔓, 丁贵杰, 翟帅帅, 等. 褐环乳牛肝菌对马尾松幼苗根际土壤微环境的影响[J]. 中南林业科技大学学报, 2016, 36(10): 60-64. |
| [16] |
王艺, 丁贵杰. 干旱胁迫下外生菌根真菌对马尾松幼苗生长和微量元素吸收的影响[J]. 浙江农林大学学报, 2012, 29(6): 822-828. |
| [17] |
张婷, 文晓鹏. 混合接种外生菌根菌对马尾松种子萌发及幼苗生长的影响[J]. 种子, 2016, 35(10): 1-5. DOI:10.3969/j.issn.1000-8071.2016.10.001 |
| [18] |
周德庆. 微生物学教程[M]. 北京: 高等教育出版社, 1993.
|
| [19] |
李快芬.菌根化马尾松幼苗对铝胁迫的响应[D].贵阳: 贵州大学, 2019.
|
| [20] |
周思婕, 王平, 张敏, 等. 酸胁迫对马尾松幼苗生长及根际铝形态的影响[J]. 应用与环境生物学报, 2019, 25(6): 1 0292-1 300. |
| [21] |
MARULAND A, AZCÒ R, RUIZ-LOZANO J M. Contribution of six arbuscular mycorrhizal fungal isolates to water uptake by Lactuca sativa plants under drought stress[J]. Physiologia Plantarum, 2003, 119(4): 526-533. DOI:10.1046/j.1399-3054.2003.00196.x |
| [22] |
王艺, 丁贵杰. 水分胁迫下外生菌根对马尾松幼苗养分吸收的影响[J]. 林业科学研究, 2013, 26(2): 227-233. DOI:10.3969/j.issn.1001-1498.2013.02.015 |
| [23] |
SMITH S E, READ D J. Mycorrhizal symbiosis[M]. Cambridge: Academic Press, 2018: 191-192.
|
| [24] |
喻田甜.外生菌根真菌对铝胁迫的响应[D].重庆: 西南大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10635-1014259275.htm
|
| [25] |
江亚男, 辜夕容, 周倩, 等. 铝胁迫下两种外生菌根真菌的有机酸分泌与吸收动力学特征[J]. 生态学杂志, 2019, 38(11): 3 441-3 449. |
| [26] |
刘鹏, 徐根娣, 姜雪梅, 等. 铝对大豆种子萌发的影响[J]. 种子, 2003(1): 30-32. |
| [27] |
纪雨薇.马尾松铝胁迫生理响应机制[D].重庆: 西南大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10635-1016767186.htm
|
| [28] |
王水良, 王平, 王趁义. 铝胁迫下马尾松幼苗有机酸分泌和根际pH值的变化[J]. 生态与农村环境学报, 2010, 26(1): 87-91. DOI:10.3969/j.issn.1673-4831.2010.01.017 |
| [29] |
辜夕容, 梁国仕, 杨水平, 等. 接种双色蜡蘑对马尾松幼苗生长、养分和抗铝性的影响[J]. 林业科学, 2005, 41(4): 199-203. DOI:10.3321/j.issn:1001-7488.2005.04.034 |
| [30] |
刘玉民.酸铝环境马尾松根系分泌物特性及其缓解铝毒的根际效应[D].重庆: 西南大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10635-1019818193.htm
|

 2020, Vol. 40
2020, Vol. 40


