文章信息
- 胡亚楠, 陈奶莲, 张辉, 马祥庆, 吴鹏飞, 邹显花
- HU Yanan, CHEN Nailian, ZHANG Hui, MA Xiangqing, WU Pengfei, ZOU Xianhua
- 低磷胁迫下不同杉木家系根系H+流动态变化
- Dynamic changes of H+ flow in roots of Chinese fir under low phosphorous stress conditions
- 森林与环境学报,2020, 40(2): 113-118.
- Journal of Forest and Environment,2020, 40(2): 113-118.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2020.02.001
-
文章历史
- 收稿日期: 2019-08-21
- 修回日期: 2019-12-12
磷是植物生长不可缺少的重要元素,是植物体内核酸、蛋白质等主要有机大分子的必须构成成分,在光合作用、呼吸作用以及酶的调节过程中起重要作用[1]。我国南方以酸性土壤为主,土壤中全磷含量很高,但磷元素在酸性土壤中易被铁铝氧化物或氢氧化物固定,土壤有效磷含量降低,使得林木可吸收利用的土壤有效磷极度匮乏,导致植物“遗传学缺磷”现象严重[2]。研究表明,植物在长期的低磷适应过程中,为了最大限度地挖掘土壤中的有限磷资源形成特有的响应机制,可通过根系生理生化的变化调整,如分泌有机酸、氨、酶、H+等物质与生长环境进行物质交流,对生长微区进行改造[3-4],使根际土壤酸化、提高根际微生物活性等,加快植物对土壤有效磷的吸收和利用。植物根系分泌的H+具有调节根际土壤pH值、氧化还原电位等作用,影响根际营养元素的有效性[5]。国内外学者对大豆[Glycine max (Linn.) Merr.][6]、小麦(Triticum aestivum L.)[7]、玉米(Zea mays Linn.)[8]等农作植物也进行了大量的研究,表明植物根系的H+分泌会加速难溶性无机磷的分解和利用。可见,提高植物自身吸收利用土壤磷的能力成为解决磷缺乏问题的重要途径。
杉木[Cunninghamia lanceolata (Lamb.) Hook.]是我国南方重要的造林树种之一,在人工林中占有重要地位。土壤有效态磷匮乏是导致南方杉木人工林地力衰退的重要原因之一,已严重影响了杉木人工林的持续经营[9]。传统生产中施用大量磷肥,增加生产成本的同时也会导致磷矿资源浪费、土壤退化和水体污染[10],因此,充分发掘植物自身潜力来适应土壤有效磷的匮乏是新的研究趋势。研究发现,在缺磷条件下通过分泌H+,增加根际酸化能力,促进环境中难溶性磷的利用这一抗逆性策略在杉木中已得到了印证[11]。然而,传统研究方法中的琼脂指示法、电极法、酸碱中和滴定法等均是通过pH值的变化间接换算来推论H+的分泌情况,难以准确定量研究离子流的动态变化,因此无法深入揭示杉木应对低磷胁迫的内在机制。可见,如何应用精确测定根系pH值变化的方法来进行高效利用磷杉木根系分泌H+与提高土壤磷利用效率方面的研究显得极为迫切。近年来,非损伤微测技术(non-damage micromeasurement technique,NMT)在林业上的应用为该研究提供了技术支持,该技术利用特异性离子/分子选择电极,能够在不伤害活体样品的情况下,实时、动态地获取进出样品离子的流速等信息,能够准确测量植物组织和细胞离子平衡调控的信息[12]。鉴于此,本研究选择M28与M32两个不同磷利用效率杉木家系幼苗作为供试材料,通过设置正常供磷(high phosphorus supply,H-P)、中度缺磷(low phosphorus supply,L-P)与重度缺磷(no phosphorus supply,N-P)3种不同的磷浓度肋迫及3、8、15 d三个不同时间梯度的处理,利用NMT分析不同家系杉木在不同处理条件下完整根系及不同部位的H+流动态变化规律,比较不同磷利用效率杉木根系在低磷胁迫下H+分泌差异,研究其适应低磷胁迫的H+流机制,为杉木林区土壤磷素的充分利用提供理论依据。
1 材料与方法 1.1 供试材料选择福建省漳平五一国有林场杉木无性系种子园M28、M32单系采种培育的长势均一、根系完整、无病害的半胞家系幼苗为试验材料,其平均地径为1.6 mm,平均苗高为9.5 cm。供试幼苗在温室内培育5个月,平均室温20.3 ℃,相对湿度78%。
1.2 研究方法供试幼苗预先进行室内水培模拟试验,在水培环境中缓苗15 d,缓苗后选取生长状况相近的幼株,用去离子水仔细清洗,去除根系残留物质。将处理好的幼株移入装有2 L营养液的塑料桶中,每盆移入两株杉木幼苗,设置3种不同的磷浓度处理[H-P(31 mg·L-1)、L-P(16 mg·L-1)、N-P(0 mg·L-1)]和3个处理时间梯度(3、8、15 d),每处理4盆,每盆两株,然后在每株苗上选取两条根进行测试。以KH2PO4作为磷源供应的营养液浓度:H-P(1.0 mmol·L-1KH2PO4)、L-P(0.5 mmol·L-1KH2PO4)、N-P(0 mmol·L-1 KH2PO4),其中,L-P与N-P处理的钾浓度用KCl补齐至正常供磷相同的水平,以消除处理间钾水平的差异。其它营养元素采用吴鹏飞[2]改良的1/2 Hoagland营养液配方,即5.0 mmol·L-1 KNO3、2.0 mmol·L-1 MgSO4·7H2O、5.0 mmol·L-1Ca(NO3)2·4H2O、1 mL·L-1 Fe-EDTA、Arnon微量元素(46.3 μmol·L-1 H3BO3、0.3 μmol·L-1 CuSO4·5H2O、0.8 μmol·L-1 ZnSO4·7H2O、9.1 μmol·L-1 MnCl2·4H2O、0.4 μmol ·L-1H2MO4·4H2O),调节营养液pH值至5.0。每隔7 d换1次营养液,每隔4 h通气20 min,以保证苗木供氧充足。在温室大棚内进行供磷处理试验,试验期间大棚内温度27~30 ℃,相对湿度75%,每天平均光照14 h。
1.3 指标测定在不同浓度的磷胁迫下,分别在3、8、15 d用NMT法对不同供试幼苗根系进行H+测试。为降低根系表面的附着离子对待测离子试验结果的影响,测定前根系用去离子水小心冲洗干净,放入基本测试液(0.1 mmol·L-1KCl、0.1 mmol·L-1 CaCl2、0.1 mmol·L-1MgCl2、0.5 mmol·L-1 NaCl、0.3 mmol·L-1 MES和0.2 mmol·L-1Na2SO)平衡20 min。平衡后将供试幼苗放入10 mm培养皿底部,等待基本测试液完全浸过根系,用H+选择性电极沿根系方向进行测试。根系根尖到根端区域均分为根端、中上、中下、根尖4个部位,共计4个样点。每个样点的数据采集直至离子流稳定,完整根系离子流数据为每个测定区域内数个测定位置离子流的平均值。
1.4 数据分析使用SPSS软件对数据进行统计与分析,Excel软件进行绘图。离子流速根据旭月科技有限公司开发的Mageflux软件进行计算。
2 结果与分析 2.1 不同供磷处理对杉木完整根系H+流的影响由图 1可见,M28、M32在不同供磷和不同时间处理下,完整根系对H+均表现为吸收,但2个杉木家系H+的净内流量存在差异。M32在不同供磷和不同时间处理下,H+流的变化均无显著差异(P>0.05)。M28在L-P处理8 d下,根系H+的净内流量显著高于H-P处理(P<0.05),其他各处理间H+流的变化差异不显著(P>0.05);在相同时间不同供磷处理下,H+吸收量均为在L-P处理下最大。同一供磷处理下,M28在处理8 d时对H+的吸收量最大,且在不同供磷处理下,根系H+的内流均符合先增强后减弱的趋势,总体表现为8 d>15 d>3 d。
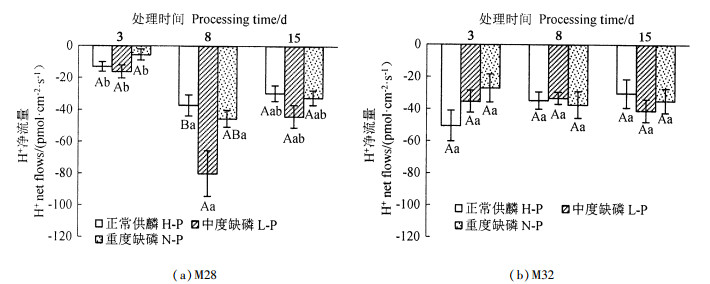
|
不同大写字母表示同一处理时间不同处理水平的H+净流量差异达到显著水平(P<0.05);不同小写字母表示同一处理水平不同处理时间的H+净流量差异达到显著水平(P<0.05) different capital letters indicate that the difference of the H+ net flow reaches a significant level (P < 0.05) with different treatment levels at the same treatment time. Different lowercase letters indicate that the difference of the H+ net flow reaches a significant level (P < 0.05) with the same treatment level at different treatment times. 图 1 不同杉木家系完整根系H+流随处理时间的变化 Fig. 1 Comparison of H+ flow changes of complete root systems of different Chinese fir families with time |
由表 1可见,根系的不同部位在不同供磷处理下,吸收及外排H+的能力各不相同。除处理3 d外,L-P和N-P处理8、15 d,M28、M32根系各部位对H+都表现为吸收,其中,根尖部位的吸收量显著大于根系中下、中上及根端3个部位(P<0.05),而其他3个部位的H+吸收量差异不显著(P>0.05)。M28在处理8 d时的这一规律表现得尤为明显,在L-P与N-P处理下的根尖H+吸收量分别达到最低值的6和5.5倍。低磷处理3 d,M28与M32均表现出不同程度的H+外排现象。其中,M28根系根端部位在L-P处理下出现H+外排现象,在N-P处理下,其根系中上、中下部位均有H+外排,但两个部位的排放量无显著差异(P>0.05)。M32仅表现为根系中上部在N-P处理时出现H+外排。在处理第8天,M28在L-P处理下根尖、中下与中上部位的H+的吸收量显著大于其他处理的相同部位,M28、M32根系的同一部位在其他不同供磷处理下,总体上表现为差异不显著。两个家系杉木在不同处理时间和不同供磷处理下各部位对H+的吸收总体表现为根尖>中下>中上,根端的吸收量大于中上部。
| 杉木家系 Chinese fir family |
处理时间 Processing time/d |
不同供磷处理 Different phosphorous treatments |
根系不同部位H+流速 H+ flow rates in different parts of the root system/(pmol·cm-2·s-1) | |||
| 根尖 Root tip |
中下 The middle and lower parts |
中上 The middle and upper part |
根基 Base areas |
|||
| M28 | 3 | 正常供磷H-P | -25.07±8.33Aa | -8.97±5.30ABa | -4.68±1.33Ba | -13.71±6.55ABa |
| 中度缺磷L-P | -58.42±19.59Aa | -7.07±1.42Ba | -4.79±3.20Ba | 4.54±3.46Bb | ||
| 重度缺磷N-P | -23.41±6.57Aa | 1.86±1.95Bb | 2.17±3.51Ba | -2.65±3.61Bab | ||
| 8 | 正常供磷H-P | -97.90±16.24Ab | -15.45±1.77Bb | -17.93±2.83Ba | -20.06±6.55Ba | |
| 中度缺磷L-P | -231.19±39.05Aa | -50.92±14.99Ba | -47.30±9.10Ba | -38.51±7.23Ba | ||
| 重度缺磷N-P | -106.90±26.61Ab | -19.07±3.86Bab | -11.94±4.84Ba | -41.69±14.34Ba | ||
| 15 | 正常供磷H-P | -56.11±12.40Aa | -22.81±4.76Ba | -23.88±7.98Ba | -13.72±3.75Ba | |
| 中度缺磷L-P | -97.03±18.34Aa | -29.47±10.40Ba | -15.22±6.84Ba | -34.04±9.49Ba | ||
| 重度缺磷N-P | -67.83±7.42Aa | -29.06±5.99Ba | -16.49±0.84Ba | -23.41±3.64Ba | ||
| M32 | 3 | 正常供磷H-P | -111.75±20.36Aa | -28.26±6.43Ba | -8.24±2.77Ba | -32.81±11.61Ba |
| 中度缺磷L-P | -97.04±20.37Aa | -11.62±6.51Ba | -8.95±2.54Ba | -27.09±8.21Ba | ||
| 重度缺磷N-P | -84.64±19.29Aa | -9.61±1.81Ba | 14.88±12.39Ba | -23.93±10.79Ba | ||
| 8 | 正常供磷H-P | -83.51±15.69Aa | -27.44±5.96Ba | -11.63±2.03Ba | -16.83±4.32Bb | |
| 中度缺磷L-P | -62.01±10.30Aa | -18.88±9.16Ba | -12.96±2.38Ba | -25.38±7.13Bab | ||
| 重度缺磷N-P | -67.94±18.39Aa | -10.70±4.57Ba | -13.53±4.80Ba | -57.36±17.21ABa | ||
| 15 | 正常供磷H-P | -55.50±11.74Aa | -27.02±13.93ABa | -17.35±2.99Ba | -10.91±4.38Bb | |
| 中度缺磷L-P | -62.79±16.65Aa | -52.21±16.09ABa | -24.31±9.45Ba | -16.96±5.15Bab | ||
| 重度缺磷N-P | -63.11±10.00Aa | -28.69±10.68ABa | -15.00±4.84Ba | -32.15±10.56ABa | ||
| 同列数据后不同大写字母表示同一处理根系不同部位的H+净流量差异达到显著水平(P<0.05);不同小写字母表示根系同一部位在不同处理条件下的H+净流量差异达到显著水平(P<0.05);正值表示H+外排,负值表示H+吸收 different capital letters indicate that the difference of the H+ net flow reaches a significant level (P<0.05)at different sites of the same root system. Different lowercase letters indicate that the difference of the H+net flow reaches a significant level (P<0.05)at the same site of the root system with different treatment levels. Positive values represent the efflux of H+, and negative values represent the absorption of H+ |
||||||
在植物生长的发育过程中,植物根系是吸收和代谢的重要器官,根系周围土体微域更是植物与土壤进行无声交流的重要界面,根系一方面从生长介质中吸收养分,另一方面也和生长介质进行大量不同的H+、离子交换等。研究表明,在逆境胁迫下植物根系H+流会发生改变[13-14],影响根系生长微域,且不同植物或者同一植物的不同品系根系H+流对环境的适应策略也不同,在磷胁迫下植物根系主要表现为H+外排,BERTRAND et al[15]认为在石灰性土壤中,植物可以通过增强H+的释放来响应低磷胁迫。NEUMANN et al[16]等发现缺磷显著增加了番茄(Lycopersicon esculentum Mill.)、鹰嘴豆(Cicer arietinum)和白羽扇豆(Lupinus albus)根的H+净释放。张振海等[6]发现低磷胁迫导致不同基因型大豆的根系均能主动向外界释放H+。但本研究发现M28、M32在不同供磷和不同时间处理下,完整根系对H+均表现为吸收。除处理3 d外,在L-P、N-P处理8 d与15 d,M28、M32根系各部位对H+都表现为吸收。
研究表明,根系分泌物H+外排是一种应激反应,例如李佳等[17]研究了拟南芥[Arabidopsis thaliana (L.) Heynh.]在感知外界环境变化时,根系H+的外排和内流会发生变化,在水分胁迫处理4 h后,根系距离静止中心0~150的H+由吸收变为外排。此外,在磷缺乏诱导根际释放H+的机制研究中,魏源等[18]检测了AHA1、AHA2和AHA7三种基因型拟南芥,发现在低磷胁迫4 h根系H+外排达到峰值,其后植物根系释放H+量开始下降。在本研究中两个杉木家系暴露于低磷条件下3 d时,M28、M32中上、中下及根端部位有少量的H+外流现象,M28在L-P处理下开始出现这种现象,M32在N-P处理下才发现H+外排。可见,M28对外界磷环境的感应比M32更为敏感。这种现象随着时间的推移发生了改变,在处理8 d、15 d,不同供磷处理均未观测到H+的外排。据推测,植物的H+外排受到植物其他代谢策略抑制的影响,在短期应激反应后根系中H+外排逐渐减弱[17-18]。进一步证实了在L-P和N-P处理下根系H+外排是一种应激反应,推测在L-P、N-P处理3 d内,M28、M32根系处于H+释放状态,在短期应激反应后则表现出因代谢受逆境胁迫抑制植株生命代谢活动而受到影响,H+流由外排转变为吸收。
众所周知,土壤中难溶性磷的存在是根系分泌H+来提高其应对低磷胁迫的能力的先决条件,然而,大多数研究并未考虑到难溶性磷会被根系分泌的H+营造的酸化环境所溶解,这是低磷胁迫下植物的适应性反应。在根际没有难溶性磷的情况下,根系分泌的H+不会对土壤有效磷产生影响。即在胁迫初期,植物还未启动相应的响应策略时,M28、M32都有H+应激性外排以酸化环境,增加根际环境中有效磷含量,然而,M28、M32根系分泌H+没有增加根系中磷的含量,因为环境中不存在难溶性磷。因此,推测在根系H+外排未达到预期效果时,根据植物成本-收益理论[19],M28、M32可能通过其他策略以适应低磷胁迫环境。研究表明,杉木可以通过增强叶片和根系酸性磷酸酶活性、加强保护酶活性、降低叶片光合固氮量、改变根部形态等途径提高土壤磷的使用效率和促进植物磷的利用,用以应对低磷环境[20]。
研究表明,质膜H+ -ATPase酶在调节离子和植物代谢物转运中起着重要的作用,是细胞与外界环境之间物质和能量交换的第一道屏障。它通过水解ATP产生能量将H+主动泵出细胞,在细胞膜内外形成了H+浓度梯度,从而建立了细胞膜电位,细胞外大量的H+则形成质子驱动力,帮助养分离子运输进入细胞[21],但胞膜H+ -ATPase酶活性会在外界环境发生改变时随之发生变化。在本研究中,在处理的第3天有发现H+外排,在处理8、15 d发现H+全部内流。郭奇梅等[22]发现紫花苜蓿根系质膜H+ -ATPase酶活性在酸、缺Fe2+和富Fe2+等胁迫下均发生明显的变化,质膜H+ -ATPase酶活性在胁迫初期升高,但随着处理时间的增加酶活性呈现不同程度的下降。在本研究中培养基质为pH值为5的酸性基质,在试验中后期抑制了胞膜H+ -ATPase酶活性,且基质中存在大量的H+,会在细胞膜内外形成H+浓度梯度。故M28、M32根系H+在试验初期发生应激性外排,这和前人研究结果相似,酸胁迫下根系质膜H+ -ATPase酶活性呈现暂时性提高,根系某些部位H+发生外排。处理8、15 d,H+ -ATPase酶活性降低,M28与M32根系不同部位表现为H+内流。研究表明,养分阴离子跨膜运输需要逆着细胞膜内外的电势差[23],因此,需要细胞膜质子泵提供质子驱动力,并且外界浓度越低需要的质子驱动力越大。植物吸收养分磷的主要形式是磷酸一氢根(HPO42-)或磷酸二氢根(H2PO4-),需要结合2~3个H+,在质子驱动力的作用下,通过细胞膜磷转运蛋白进入植物细胞。故在酸性环境下,磷酸根离子进入细胞根系需要大量的H+,M28、M32完整根系表现为根系H+内流。
研究表明,H+通量的来源和植物根部对阳离子和阴离子的差异摄取有关[24]。由于南方林地土壤缺乏有效磷,在长期的进化过程中,一些植物对低磷环境产生多种适应方式和适应特征, 当植物遭受低磷胁迫时, 植物自身有一定的调节能力[25]。在本研究中,两个杉木家系完整根系在L-P和N-P处理8、15 d时对H+的吸收大于H-P处理。有研究发现,当植物感受到缺磷信号时,储存在液泡中的磷被转运到细胞质中,供给细胞生命活动所需要的磷营养,同时维持胞质中磷的平衡[26]。在这种策略下杉木在消耗磷酸根离子时,本身的补偿机制迫使根系会从外界汲取更多的H+以平衡细胞质酸碱环境。磷素在细胞中多以磷酸根负离子的形式存在,在感受到低磷胁迫后,磷酸根离子从液泡中跑出参与植物的生理代谢供植物正常生长发育,导致胞质阴阳离子比例失调。有研究表明,无论阳离子-阴离子平衡和根细胞中的电荷-pH值调节所涉及的确切机制是什么,当阴离子多于阳离子时,会有OH-释放或者H+被吸收,通过有效的pH-stat系统将细胞质pH值维持在约7.3的小范围内[24]。即植物细胞质中磷酸根离子增加时,短暂的打破了根系中阴阳离子的平衡,随之H+会被从外界吸收以补偿进入胞质的过量负电荷,维持细胞离子平衡,故在L-P和N-P处理下杉木完整根系对H+的吸收大于H-P处理。
综上所述,在酸性培养环境中,不同杉木家系会通过H+内流来适应低磷胁迫,且处理的第8、15天时L-P和N-P处理下杉木完整根系对H+的吸收大于H-P处理。结合根系不同部位H+的流向分析得出,M28与M32分别在L-P和N-P处理3 d时开始表现出少量H+外排现象,其中,M28根系H+流对低磷环境的响应比M32更为敏感。随着时间的推移,处理8、15 d后,均未在L-P和N-P处理下观测到H+的外排,可见低磷条件下根系H+外排是一种应激反应。在这一研究结果基础上,下一阶段将针对低磷胁迫3 d内杉木根系的H+外排与吸收情况进行更为详尽的研究,以进一步揭示杉木根系H+流适应低磷胁迫的内在机制。
| [1] |
于姣妲, 李莹, 殷丹阳, 等. 杉木对低磷胁迫的响应和生理适应机制[J]. 林业科学研究, 2017, 30(4): 566-575. |
| [2] |
吴鹏飞. P高效利用杉木无性系适应环境磷胁迫的机制研究[D].福州: 福建农林大学, 2009.
|
| [3] |
叶思诚, 谭晓风, 袁军. 植物低磷适应机制研究进展[J]. 经济林研究, 2012, 30(2): 128-133. |
| [4] |
KATO-NOGUCHI H, INO T, SATA N, et al. Isolation and identification of a potent allelopathic substance in rice root exudates[J]. Physiologia Plantarum, 2002, 115(3): 401-405. DOI:10.1034/j.1399-3054.2002.1150310.x |
| [5] |
毛佳, 徐仁扣, 万青, 等. 不同水平硝态氮对蚕豆根系H+释放量的影响[J]. 中国生态农业学报, 2010, 18(5): 950-953. |
| [6] |
张振海, 陈琰, 韩胜芳, 等. 低磷胁迫对大豆根系生长特性及分泌H+和有机酸的影响[J]. 中国油料作物学报, 2011, 33(2): 135-140. |
| [7] |
范晓晖, 刘芷宇. 稻、麦根系H+的分泌与介质磷水平的关系[J]. 植物生理学报, 1991, 17(2): 125-132. DOI:10.3321/j.issn:1671-3877.1991.02.013 |
| [8] |
ZHANG Y, PENG Y U, PENG Y F, et al. Fine root patterning and balanced inorganic phosphorus distribution in the soil indicate distinctive adaptation of maize plants to phosphorus deficiency[J]. Pedosphere, 2012, 22(6): 870-877. DOI:10.1016/S1002-0160(12)60073-3 |
| [9] |
马祥庆, 梁霞. 植物高效利用磷机制的研究进展[J]. 应用生态学报, 2004, 15(4): 712-716. DOI:10.3321/j.issn:1001-9332.2004.04.035 |
| [10] |
WU P F, MA X Q, TIGABU M, et al. Root morphological plasticity and biomass production of two Chinese fir clones with high phosphorus efficiency under low phosphorus stress[J]. Canadian Journal of Forest Research, 2011, 41(2): 228-234. DOI:10.1139/X10-198 |
| [11] |
余健.磷胁迫下林木分泌的有机酸及对土壤磷的活化[D].南京: 南京林业大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10298-2005102920.htm
|
| [12] |
宋雪皎, 李岩, 张春庆. 非损伤微测技术及其应用[J]. 分析仪器, 2017(2): 78-83. |
| [13] |
KOUAS S, DEBEZ A, SLATNI T, et al. Root proliferation, proton efflux, and acid phosphatase activity in common bean (Phaseolus vulgaris) under phosphorus shortage[J]. Journal of Plant Biology, 2009, 52(5): 395-402. DOI:10.1007/s12374-009-9050-x |
| [14] |
JARVIS S C, HATCH D J. Rates of hydrogen ion efflux by Nodulated legumes grown in flowing solution culture with continuous pH monitoring and adjustment[J]. Annals of Botany, 1985, 55(1): 41-51. DOI:10.1093/oxfordjournals.aob.a086876 |
| [15] |
BERTRAND I, HINSINGER P, JAILLARD B, et al. Dynamics of phosphorus in the rhizosphere of maize and rape grown on synthetic, phosphated calcite and goethite[J]. Plant and Soil, 1999, 211(1): 111-119. DOI:10.1023/A:1004328815280 |
| [16] |
NEUMANN G, RǒMHELD V. Root excretion of carboxylic acids and protons in phosphorus-deficient plants[J]. Plant and Soil, 1999, 211(1): 121-130. DOI:10.1023/A:1004380832118 |
| [17] |
李佳, 黄梦静, 任艳, 等. 水分胁迫对向水性突变体rhe2根生长与响应的影响[J]. 土壤, 2015, 47(5): 858-862. |
| [18] |
YUAN W, ZHANG D P, SONG T, et al. Arabidopsis plasma membrane H+ -ATPase genes AHA2 and AHA7 have distinct and overlapping roles in the modulation of root tip H+ efflux in response to low-phosphorus stress[J]. Journal of Experimental Botany, 2017, 68(7): 1 731-1 741. DOI:10.1093/jxb/erx040 |
| [19] |
LYNCH J P. Root phenes for enhanced soil exploration and phosphorus acquisition:tools for future crops[J]. Plant Physiology, 2011, 156(3): 1 041-1 049. DOI:10.1104/pp.111.175414 |
| [20] |
陈智裕, 吴鹏飞, 邹显花, 等. 低磷胁迫下杉木幼苗生长特性与内源激素的关系[J]. 林业科学, 2016, 52(2): 57-66. |
| [21] |
ARANGO M, GÉVAUDANT F, OUFATTOLE M, et al. The plasma membrane proton pump ATPase:the significance of gene subfamilies[J]. Planta, 2003, 216(3): 355-365. DOI:10.1007/s00425-002-0856-8 |
| [22] |
郭奇梅, 孙吉雄, 安渊, 等. 酸和铁胁迫对紫花苜蓿根系质膜H+-ATPase活性的影响[J]. 草原与草坪, 2009(3): 12-15. DOI:10.3969/j.issn.1009-5500.2009.03.003 |
| [23] |
SERRANO R. Structure and function of plasma membrane ATPase[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1989, 40: 61-94. DOI:10.1146/annurev.pp.40.060189.000425 |
| [24] |
HAYNES R J. Active ion uptake and maintenance of cation-anion balance:a critical examination of their role in regulating rhizosphere pH[J]. Plant and Soil, 1990, 126(2): 247-264. DOI:10.1007/BF00012828 |
| [25] |
饶丽莎, 许珊珊, 黄田盛, 等. 不同逆境胁迫下杉木Cu/Zn-SOD基因表达分析[J]. 森林与环境学报, 2018, 38(1): 7-12. |
| [26] |
LEE R B, RATCLIFFE R G, SOUTHON T E. 31P NMR measurements of the cytoplasmic and vacuolar Pi content of mature maize roots:relationships with phosphorus status and phosphate fluxes[J]. Journal of Experimental Botany, 1990, 41(9): 1 063-1 078. DOI:10.1093/jxb/41.9.1063 |

 2020, Vol. 40
2020, Vol. 40


