文章信息
- 周成城, 杨德明, 李士坤, 万佳艺, 荣俊冬, 郑郁善
- ZHOU Chengcheng, YANG Deming, LI Shikun, WAN Jiayi, RONG Jundong, ZHENG Yushan
- 18份樱属材料亲缘关系的ISSR分析
- Genetic relationship analysis of 18 Cerasus materials based on inter-simple sequence repeat molecular marker
- 森林与环境学报,2020, 40(1): 46-53.
- Journal of Forest and Environment,2020, 40(1): 46-53.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2020.01.007
-
文章历史
- 收稿日期: 2019-08-28
- 修回日期: 2019-10-07
2. 福建农林大学林学院, 福建 福州 350002;
3. 漳平市林业局, 福建 漳平 364400
2. College of Forestry, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China;
3. Forestry Bureau of Zhangping City, Zhangping, Fujian 364400, China
樱花(Cerasus spp.)属于蔷薇科(Roasaceae)李亚科(Prunoideae)樱属(Cerasus)落叶乔木或小乔木,花盛开于冬末和初春,是世界上著名早春观花树种之一[1]。目前樱花有200多种,主要来自日本和中国[2],其花色丰富,树形优美,是优良的园林观赏树种。随着樱花种植的发展,我国本土的樱花资源不断得到重视,其中福建山樱花[Cerasus campanulata (Maxim.) Yu et Li]是国产樱花的代表之一[3],分布于我国的福建、江西、广西、广东、台湾等省,国内有众多种源地[4]。福建山樱花近年来在很多园林景观建设中得以应用[5-8],可为我国樱花园林应用提供更多优质的资源。但现阶段樱花研究开展了较多杂交育种工作,市场上已有新种质或新品种出现,从形态学的角度难以进行准确分辨,为更好地保存、开发和利用国内樱花种质资源,从分子层面进行遗传多样性分析和种质资源鉴别很有必要。
简单重复序列间扩增(inter-simple sequence repeat,ISSR)分子标记技术由ZIETKIEWICZ et al[9]在1994年基于简单重复序列扩增(simple sequence repeat,SSR)分子标记技术所建立的,其基本原理是在SSR的3或5端嵌入1组1~4个嘌呤或嘧啶碱基,并以此为引物对DNA序列具有反向排列SSR的两侧进行扩增,通过电泳、染色和分析显像观察谱带的有无以及相对位置来判断植物物种和品种间的遗传多态性[10-12]。该分子标记技术结合了SSR和随机扩增多态性DNA标记(random amplified polymorphic DNA,RAPD)两个技术的优点,具有操作便捷、稳定性好、多态性丰富等特点,在种质资源分类和鉴别方面有较高的效率[13]。
在樱花的培育中,人工培育后的品种鉴别困难,表型差异不明显,需从基因层面对其鉴别。近年来,ISSR分子标记法逐渐被使用在品种鉴定的研究中[14-15],如蒋冬月等[16]针对不同省份的樱亚属园艺品种进行了ISSR品种鉴定;林立等[17]对39个国内常见樱花品种进行了分类研究,均取得了较好的效果。本研究收集了福建省漳平市内18个观赏樱花树种材料,利用ISSR分子标记法分析试验材料的遗传多样性及亲缘关系,构建樱花指纹图谱,以期为种质资源的品种鉴定、分类、利用和杂交育种亲本的选配等方面提供理论依据,加快国内樱花的良种选育和商品化。
1 材料与方法 1.1 试验材料18份樱属材料包括福建山樱花、11份日本樱花(Cerasus yedoensis)和6份选优材料(表 1)。其中选优材料为福建省漳平市各苗木基地人工培育,亲本为福建山樱花和日本樱花杂交,2019年6—7月采集于福建省漳平市内樱花观赏品种栽培试验区。采集生长健壮、无病虫害的植物幼嫩叶片,用自封袋装置于冰盒中,放置在实验室-80 ℃冰箱保存备用。
| 编号No. | 名称Name | 花型Flower form | 花色Flower colour | 花期Florescene |
| 1 | 福建山樱花C. campanulata | 单瓣Single | 玫红色Rose red | 3月上旬Early March |
| 2 | 选优1号No.1 selected material | 重瓣Double | 红色Red | 3月上旬Early March |
| 3 | 选优2号No.2 selected material | 重瓣Double | 红色Red | 3月上旬Early March |
| 4 | ‘河津樱’C. × kanzakura ‘Kawazu-zakura’ | 单瓣Single | 紫红色Fuchsia | 3月上旬Early March |
| 5 | 选优3号No.3 selected material | 单瓣Single | 红色Red | 3月中旬Mid-March |
| 6 | ‘椿寒樱’C. pseudocerasus ‘Introrsa’ | 重瓣Double | 粉红色Pink | 3月上旬Early March |
| 7 | ‘飞寒樱’C. campanulata ‘Feihan’ | 单瓣Single | 玫红色Rose red | 3月中旬Mid-March |
| 8 | ‘大渔樱’C. ×kanzakura ‘Tairyo-zakura’ | 单瓣Single | 淡红紫色Light fuchsia | 4月上旬Early April |
| 9 | 选优4号No.4 selected material | 单瓣Single | 紫红色Fuchsia | 4月中旬Mid-April |
| 10 | 选优5号No.5 selected material | 重瓣Double | 红色Red | 3月中旬Mid-March |
| 11 | ‘染井吉野’C. ×yedoensis ‘Somei-yoshino’ | 单瓣Single | 淡红色Light red | 3月下旬Late March |
| 12 | 选优6号No.6 selected material | 单瓣Single | 粉红色Pink | 3月下旬Late March |
| 13 | ‘一叶’C. serrulata var. lannesiana ‘Hisakura’ | 重瓣Double | 淡红色Light red | 4月中旬Mid-April |
| 14 | ‘松月’C. serrulata var. lannesiana ‘Superba’ | 重瓣Double | 淡红色Light red | 4月下旬Late April |
| 15 | ‘普贤象’C. serrulata var. lannesiana ‘Albo-rosea’ | 重瓣Double | 白色White | 4月下旬Late April |
| 16 | ‘阳光樱’C. campanulata ‘Youkou’ | 重瓣Double | 淡红紫色Light fuchisia | 3月下旬Late March |
| 17 | ‘八重红彼岸’C. ×subhirtella ‘Yaebeni-higan’ | 重瓣Double | 淡粉色Light pink | 3月下旬Late March |
| 18 | ‘八重红枝垂’C. spachiana ‘Plena Rosea’ | 重瓣Double | 粉白色Pink white | 3月下旬Late March |
采用Bioflux DNA提取试剂盒(杭州博日公司提供)提取18份樱属材料的总DNA,用NANODROP 2000 C紫外分光光度计分析质量和浓度,经1.5%的琼脂糖凝胶电泳后用透射紫外灯照相观察并分析总DNA纯度,于-20 ℃保存。
1.2.2 ISSR引物筛选与PCR扩增根据加拿大哥伦比亚大学设计并公布的ISSR引物序列[18],试验所用引物由上海尚亚生物有限公司合成。聚合酶链式反应(polymerase chain reaction,PCR)体系包括100 ng模板DNA、2 μL(10 μmol·L-1)引物、15 μL PCR反应混合物(Taq酶、dNTPs、MgCl2以及反应缓冲液预先配制成2倍浓度的混合物),加入去离子水达到25 μL。反应程序:95 ℃预变性5 min,95 ℃变性1 min,50~55 ℃退火30 s(每次下降1 ℃),72 ℃延伸2 min,30个循环,最后72 ℃延伸10 min,4 ℃保存。采用1.5%琼脂糖凝胶加入10 μL PCR扩增产物,筛选出能扩增出清晰条带的引物。基于肖琳等[19]和冯晨静等[20]对蔷薇科植物ISSR-PCR扩增体系的优化条件,对各供试材料总DNA进行扩增,产物和100 bp DNA ladder、1 kb DNA ladder通过1.5%琼脂糖凝胶电泳,Gold view核酸染色剂进行染色,电泳仪上恒压150 V电泳1.5 h,在透射紫外灯下观察照相。
1.2.3 数据处理统计试验扩增引物在琼脂糖凝胶上条带显示的位置,有条带显示记为1,没有条带显示记为0。统计数据输入Excel表格,建立ISSR扩增谱带矩阵数据库,利用POPGENE 32软件分析遗传多样性,对每一条引物扩增结果建立二元数据矩阵,统计总位点数和多态性位点数并构建指纹图谱。对此0、1矩阵进行分析,分析指标有多态位点百分率(percentage of polymorphic bands,PPB)、观测等位基因数(observed number of alleles,Na)、有效等位基因数(effective number of alleles,Ne)、Nei′s遗传多样性指数、Shannon多样性指数、基因多样性指数、遗传分化系数、遗传距离与遗传相似度。利用NTSYSpc 2.10e软件进行Jaccard相似性系数计算,并作出聚类图。
2 结果与分析 2.1 DNA提取效果利用DNA提取试剂盒提取18份樱属材料的DNA, 结果均是一条清晰的条带(图 1),无RNA污染、拖尾和弥散现象,利用紫外分光光度计测得DNA的质量浓度为100~300 ng·μL-1。提取的DNA可以满足ISSR-PCR反应对模板DNA的质量要求。
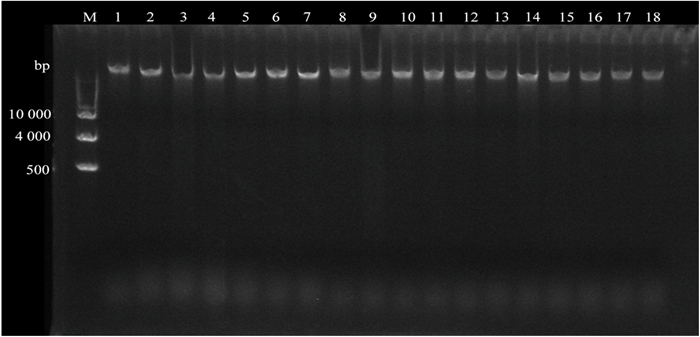
|
注:M为1 kb DNA ladder;1~18为樱花材料编号。 Note: M.1 kb DNA ladder; 1-18.material numbers. 图 1 18份樱属材料DNA电泳图 Fig. 1 The DNA electrophoregram of 18 Cerasus materials |
从表 2可知,对100条ISSR引物进行筛选,最终选出12条条带清晰、明亮度好、多态性丰富的引物,在所有引物的占比为12%。18份樱属材料共扩增出144个重复性好、清晰稳定的位点,其中多态性位点数135个,占总位点数的93.75%;各引物扩增出的位点数在10~15个之间,平均12个位点;多态性位点数在9~13个之间,平均11.25个;各引物扩增结果的PPB在84.62%~100%之间,平均为93.75%。综上可得,12条ISSR引物均能扩增出高多态性的位点,由此显示18份樱属材料具有丰富的多态性。从图 2可知,各引物检测出的DNA片段大小范围在300~1 500 bp之间,说明樱花有适中长度的基因组。
| 引物Primer | 碱基序列Base sequence | 退火温度Annealing temperature/℃ | 扩增位点数Number of amplified bands | 多态性位点数Number of polymorphic bands | 多态性比率Polymorphic rate/% |
| UBC808 | (AG)8G | 55 | 12 | 12.00 | 100.00 |
| UBC810 | (GA)8T | 53 | 10 | 9.00 | 90.00 |
| UBC812 | (GA)8C | 54 | 12 | 12.00 | 100.00 |
| UBC817 | (CA)8A | 53 | 11 | 10.00 | 90.91 |
| UBC823 | (TC)8C | 53 | 10 | 10.00 | 100.00 |
| UBC825 | (AC)8G | 53 | 13 | 11.00 | 84.62 |
| UBC835 | (AG)8YC | 55 | 12 | 12.00 | 100.00 |
| UBC841 | (GA)8YC | 53 | 13 | 12.00 | 100.00 |
| UBC847 | (CA)8RC | 55 | 11 | 10.00 | 90.91 |
| UBC861 | (ACC)6 | 53 | 12 | 12.00 | 100.00 |
| UBC866 | (CTC)6 | 55 | 11 | 10.00 | 90.91 |
| UBC881 | (GGGT)3G | 55 | 15 | 13.00 | 86.67 |
| 总计Total | 144 | 135.00 | |||
| 平均Average | 12 | 11.25 | 93.75 |
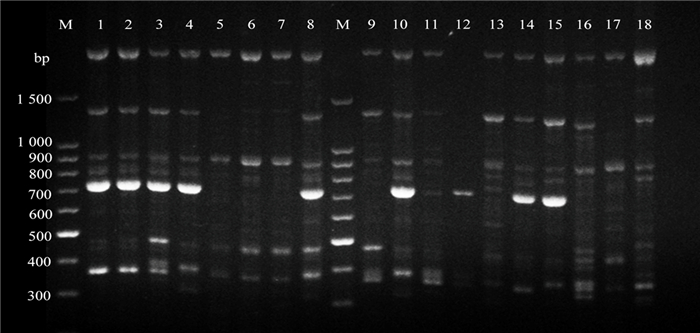
|
注:M为100 bp DNA ladder;1~18为樱花材料编号。 Note: M.1k bp DNA ladder, 1-18.material numbers. 图 2 引物UBC835扩增效果图 Fig. 2 The amplification results by primer UBC835 |
PPB是衡量植物种群间遗传变异水平的重要指标,如果一个植物种群的PPB值高则说明该种群能够更好地适应当地环境,能繁衍下去;若PPB值低则说明其环境适应能力较弱,有灭绝的可能性,需要及时对其采取适当的保护措施[21]。18份樱属材料的PPB差异性较小,PPB值在84.62%~100%之间,平均为93.75%,说明这18份樱属材料的适应性强,遗传多样性丰富,遗传基础较宽,在福建省漳平市有较好的适应力。利用POPGENE 32软件分别对18份樱属材料的遗传多样性进行总体和单独分析。结果显示:18份樱花供试材料Na值为1.979 2,Ne值为1.603 3,Nei′s遗传多样性指数为0.347 8,Shannon多样性指数为0.518 2,显示了供试材料间丰富的遗传多样性。
2.4 亲缘关系分析由表 3可知,18份樱属材料间的遗传相似性系数在0.453 2~0.833 3之间,平均为0.633 7,遗传距离在0.182 3~0.765 1之间,平均为0.462 7。其中‘一叶樱’和‘松月’两个品种的遗传相似性系数最大,值为0.833 3,说明两者的亲缘关系较近,福建山樱花和‘八重彼岸’的遗传相似性系数最小,值为0.453 2,说明两者存在较大的遗传差异。
| 编号No. | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | 0.652 8 | 0.680 6 | 0.694 4 | 0.548 6 | 0.659 7 | 0.541 7 | 0.611 1 | 0.618 1 | 0.562 5 | 0.597 2 | 0.520 8 | 0.500 0 | 0.576 4 | 0.569 4 | 0.562 5 | 0.453 2 | 0.590 3 | |
| 2 | 0.426 5 | 0.736 1 | 0.708 3 | 0.673 6 | 0.659 7 | 0.652 8 | 0.708 3 | 0.645 8 | 0.631 9 | 0.666 7 | 0.576 4 | 0.583 3 | 0.562 5 | 0.638 9 | 0.576 4 | 0.465 3 | 0.604 2 | |
| 3 | 0.384 8 | 0.306 4 | 0.722 2 | 0.673 6 | 0.729 2 | 0.541 7 | 0.708 3 | 0.645 8 | 0.576 4 | 0.597 2 | 0.520 8 | 0.527 8 | 0.534 7 | 0.527 8 | 0.562 5 | 0.493 1 | 0.673 6 | |
| 4 | 0.364 6 | 0.344 8 | 0.325 4 | 0.645 8 | 0.673 6 | 0.597 2 | 0.708 3 | 0.631 9 | 0.618 1 | 0.680 6 | 0.618 1 | 0.541 7 | 0.562 5 | 0.597 2 | 0.604 2 | 0.465 3 | 0.673 6 | |
| 5 | 0.600 4 | 0.395 1 | 0.395 1 | 0.437 2 | 0.680 6 | 0.701 4 | 0.673 6 | 0.638 9 | 0.597 2 | 0.701 4 | 0.694 4 | 0.548 6 | 0.597 2 | 0.631 9 | 0.569 4 | 0.527 8 | 0.625 0 | |
| 6 | 0.415 9 | 0.415 9 | 0.315 9 | 0.395 1 | 0.384 8 | 0.645 8 | 0.729 2 | 0.736 1 | 0.597 2 | 0.659 7 | 0.625 0 | 0.548 6 | 0.555 6 | 0.645 8 | 0.611 1 | 0.597 2 | 0.666 7 | |
| 7 | 0.613 1 | 0.426 5 | 0.613 1 | 0.515 5 | 0.354 7 | 0.437 2 | 0.722 2 | 0.756 9 | 0.743 1 | 0.675 3 | 0.756 9 | 0.569 4 | 0.645 8 | 0.763 9 | 0.770 8 | 0.590 3 | 0.576 4 | |
| 8 | 0.492 5 | 0.344 8 | 0.344 8 | 0.344 8 | 0.395 1 | 0.315 9 | 0.325 4 | 0.798 6 | 0.631 9 | 0.722 2 | 0.631 9 | 0.555 6 | 0.548 6 | 0.666 7 | 0.590 3 | 0.548 6 | 0.604 2 | |
| 9 | 0.481 2 | 0.437 2 | 0.437 2 | 0.459 0 | 0.448 0 | 0.306 4 | 0.278 5 | 0.224 9 | 0.736 1 | 0.729 2 | 0.555 6 | 0.520 8 | 0.527 8 | 0.631 9 | 0.736 1 | 0.569 4 | 0.555 6 | |
| 10 | 0.575 4 | 0.459 0 | 0.551 0 | 0.481 2 | 0.515 5 | 0.515 5 | 0.297 0 | 0.459 0 | 0.306 4 | 0.729 2 | 0.652 8 | 0.618 1 | 0.652 8 | 0.701 4 | 0.750 0 | 0.527 8 | 0.666 7 | |
| 11 | 0.515 5 | 0.405 5 | 0.515 5 | 0.384 8 | 0.354 7 | 0.415 9 | 0.182 3 | 0.325 4 | 0.315 9 | 0.315 9 | 0.743 1 | 0.611 1 | 0.645 8 | 0.763 9 | 0.729 2 | 0.576 4 | 0.659 7 | |
| 12 | 0.652 3 | 0.551 0 | 0.652 3 | 0.481 2 | 0.364 6 | 0.470 0 | 0.278 5 | 0.459 0 | 0.587 8 | 0.426 5 | 0.297 0 | 0.659 7 | 0.694 4 | 0.701 4 | 0.666 7 | 0.513 9 | 0.555 6 | |
| 13 | 0.693 1 | 0.539 0 | 0.639 1 | 0.613 1 | 0.600 4 | 0.600 4 | 0.563 1 | 0.587 8 | 0.652 3 | 0.481 2 | 0.492 5 | 0.415 9 | 0.833 3 | 0.638 9 | 0.673 6 | 0.590 3 | 0.604 2 | |
| 14 | 0.551 0 | 0.575 4 | 0.626 0 | 0.575 4 | 0.515 5 | 0.587 8 | 0.437 2 | 0.600 4 | 0.639 1 | 0.426 5 | 0.437 2 | 0.364 6 | 0.207 6 | 0.701 4 | 0.694 4 | 0.569 4 | 0.611 1 | |
| 15 | 0.563 1 | 0.448 0 | 0.639 1 | 0.515 5 | 0.459 0 | 0.437 2 | 0.269 3 | 0.405 5 | 0.459 0 | 0.354 7 | 0.269 3 | 0.354 7 | 0.448 0 | 0.354 7 | 0.701 4 | 0.659 7 | 0.687 5 | |
| 16 | 0.575 4 | 0.551 0 | 0.575 4 | 0.503 9 | 0.563 1 | 0.492 5 | 0.260 3 | 0.527 2 | 0.306 4 | 0.287 7 | 0.315 9 | 0.405 5 | 0.395 1 | 0.364 6 | 0.354 7 | 0.569 4 | 0.611 1 | |
| 17 | 0.652 3 | 0.765 1 | 0.707 1 | 0.765 1 | 0.639 1 | 0.515 5 | 0.527 2 | 0.600 4 | 0.563 1 | 0.639 1 | 0.551 0 | 0.665 7 | 0.527 2 | 0.563 1 | 0.415 9 | 0.563 1 | 0.569 4 | |
| 18 | 0.527 2 | 0.503 9 | 0.395 1 | 0.395 1 | 0.470 0 | 0.405 5 | 0.551 0 | 0.503 9 | 0.587 8 | 0.405 5 | 0.415 9 | 0.587 8 | 0.503 9 | 0.492 5 | 0.374 7 | 0.492 5 | 0.563 1 | |
| 注:遗传相似性系数(右上方),遗传距离(左下方);1~18为樱花材料编号。Note:similarity coefficient matrix (above diagonal),genetic distance (below diagonal);1-18. materials number. | ||||||||||||||||||
基于ISSR扩增结果,按照非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类进行遗传关系分析,得到18份樱属材料的亲缘关系树状图(图 3)。从图 3可知,设定遗传相似性系数为0.589 9时,群体可分为4个类群(Ⅰ、Ⅱ、Ⅲ、Ⅳ),其中类群Ⅰ有9份樱属材料,类群Ⅱ有8份樱属材料,‘飞寒樱’和‘八重红彼岸’分别归为一个类群,说明这两个材料与其他材料的亲缘关系较远。当遗传相似性系数为0.701 1时,群体则分为12个类群,差异数为8个,在遗传相似性系数变化程度较小时,聚类差异明显,说明18份樱属材料的遗传多样性丰富。
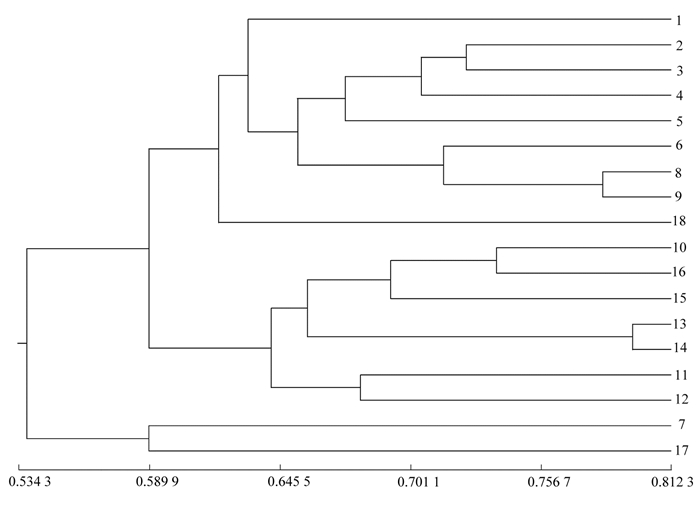
|
遗传相似性系数Genetic similarity coefficie注:1~18为樱花材料编号。 Note: 1-18.material numbers. 图 3 18份樱属材料的聚类图 Fig. 3 UPGMA dendrogram for 18 Cerasus materials |
基于18份樱属材料的遗传相似性系数,利用NTSYSpc软件进行主坐标分析,第一、第二、第三主坐标的贡献率分别为16.17%、11.27%和10.14%。对18份樱属材料做主坐标分析并构建二维散点图(图 4),散点分布规律与聚类分析得出的结果基本一致,只有11号‘染井吉野’品种在散点分布上与聚类分析中的规律有一些差异。在UPGMA聚类中,‘染井吉野’品种聚于类群Ⅱ中,而主坐标分析结果却显示该品种与亚类群Ⅲ中‘飞寒樱’亲缘关系更近,这种差异的出现可能由于在主坐标分析中还有第四、第五等其他贡献值的影响。
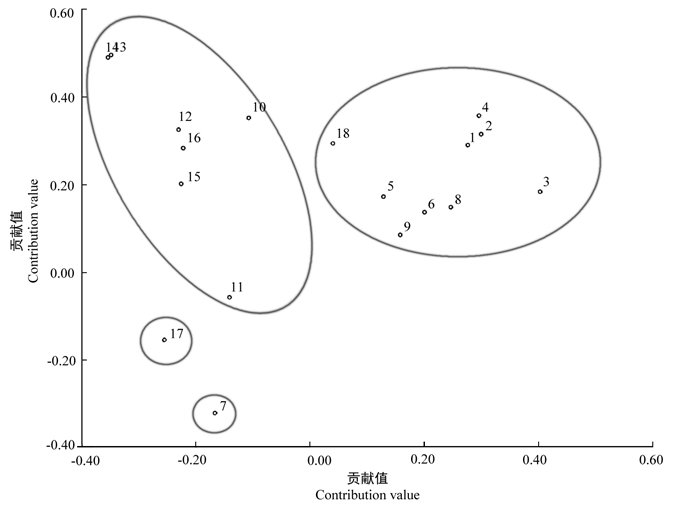
|
注:1~18为樱花材料编号。 Note: 1-18.material numbers. 图 4 18份樱属材料的主坐标分析图 Fig. 4 Principal coordinate analysis for 18 Cerasus materials |
通过对筛选出的12个ISSR引物,发现引物UBC808和UBC835两者对18份樱属材料能够完全鉴别出来,有较好的鉴别效果。将扩增结果进行数字转化(有条带记为1,无条带记为0),形成了特有的分子身份证编码,构建出18份樱属材料的DNA指纹图谱(表 4),可用于种质资源的分类与鉴定。
| 编号No. | DNA指纹图谱DNA fingerprint | ||
| UBC808 | UBC835 | ||
| 1 | 000011110100 | 111110000010 | |
| 2 | 001111001101 | 111110000010 | |
| 3 | 111000011100 | 111110001110 | |
| 4 | 100110011100 | 111110000011 | |
| 5 | 010110011110 | 101000000010 | |
| 6 | 001000001101 | 101100001010 | |
| 7 | 000100111100 | 101000001010 | |
| 8 | 101000011100 | 111111001010 | |
| 9 | 101000011100 | 111000001010 | |
| 10 | 001010011100 | 111110000100 | |
| 11 | 000100111100 | 111000000110 | |
| 12 | 000100110100 | 000010000000 | |
| 13 | 000000110100 | 111101000000 | |
| 14 | 000000110100 | 111010000010 | |
| 15 | 000100111100 | 111110000100 | |
| 16 | 000000110100 | 111000011111 | |
| 17 | 000000110110 | 101001001000 | |
| 18 | 010010011100 | 111100100101 | |
在遗传多样性研究、品种鉴定、辅助育种等方面,分子标记技术具有重要意义[22]。18份樱属材料ISSR标记结果显示,12条ISSR引物共扩增出144个多态性位点,其中多态性位点135个,多态性位点占93.75%,平均Nei′s遗传多样性指数为0.348 7,表明所选的樱花材料间存在丰富的遗传变异,并且ISSR分子标记在樱花材料间的扩增位点多态性主要由种间的差异引起,可有效地反映种间的亲缘关系, 这与其他樱属的分子标记技术应用研究相符合。如蒋冬月等[16]和林立等[17]的研究中,PPB值分别为93.58%和94.03%,说明具有丰富的多态性和较高的区分度。而在其他分子标记技术应用研究里,陈芳等[23]、ÖZ et al[24]和苏倩[25]运用RFLP、SSR和RAPD等分子标记技术对樱属的植物进行了遗传多样性分析,均表现出较高的遗传多样性。因此,以ISSR为主的分子标记法可以作为樱花种质资源亲缘关系和遗传多样性分析的有效手段。
在18份樱属材料的聚类分析和主坐标分析中,各材料间的遗传相似性系数差异较大,选优材料与母本的遗传相似性系数并未十分相近,说明通过杂交等育种手段培育后,樱属材料的遗传多样性高,但从总体而言,通过聚类分析和主坐标分析等数据分析手段,能够清楚地区分各材料的亲缘关系类群,而选优材料在樱花种或品种间的区分和鉴别上有着相当大的困难,同一地区内由于栽培人员的多年人工培育,很多疑似新品种和选优材料在外形上十分相似,只有在花瓣或叶片上有细微差别,已经无法确认其亲本以及亲缘关系。在本次研究中,采集的福建省漳平市各苗木基地的18份樱属材料,其中有6份是选优材料,通过分子标记进行亲缘鉴定,研究中UPGMA聚类分析的结果从分子生物学层面对18份材料进行了有效的区分和鉴别。选优1号、选优2号、选优3号和‘河津’、福建山樱花遗传相似性系数较高,在花型、花色上存在较大相似性,但花期略有不同,且存在连续性,能够为樱花观赏期的延长提供可能;选优4号和‘大渔樱’遗传相似度较高,但选优材料在花色上更加鲜艳亮丽,花期更长,这对国外引进品种的本土化品种改良有一定参考价值;而‘河津’、‘大渔樱’和福建山樱花又有着较高遗传相似性,与国内樱花种有较近亲缘关系的国外引进品种,选育出优良品种的可能性更大;与选优5号、选优6号有较高遗传相似性系数的‘染井吉野’和‘阳光樱’在福建省漳平市生长情况比选优品种更差,说明国外引进品种与福建山樱花杂交后的选优材料在适应性上可能更强。从表型难以准确鉴别的选优材料,通过遗传相似性分析和聚类分析可以较好地区分出樱花不同种或品种,为以后国内樱花的良种选育、辅助育种、新品种鉴定、品种命名和难以分辨的品种鉴别提供了有力证据,还能够为国内樱花的培育者在今后更加规范的品种商品化、产业化道路上提供理论依据。
樱花在我国的种质资源分布也十分丰富,据统计,樱属植物达到48种[26],国内主要的观赏樱花还是以日本引进为主,而国内樱花种类在我国各省份已经有较多生长优良、观赏价值高的品种种源地,如福建、江西、广东等省。但我国的樱花产业起步晚,品种鉴定、良种选育、品种改良等能力还不够,严重影响了国内樱花品种商品化、产业化的推广。本研究利用了ISSR分子标记技术,在分子生物学水平上揭示了同一种源地不同樱花材料具有丰富的遗传多样性,区分和鉴别了不同国内樱花材料的亲缘关系,证明了ISSR分子标记法对于分析国内樱花的遗传多样性一个效果较好方法。因此,可利用ISSR分子标记法对国内各个樱花种源地的品种进行全面分析,查清遗传关系,建立科学、规范的命名标准和品种资源信息库,开展国内樱花的资源开发、良种选育、优良品种应用、品种产业化等工作。
| [1] |
王贤荣. 中国樱花品种图志[M]. 北京: 科学出版社, 2014: 8-18.
|
| [2] |
KATOS, MATSUMOTO A, YOSHIMURA K, et al. Clone identification in Japanese flowering cherry (Prunus subgenus Cerasus) cultivars using nuclear SSR markers[J]. Breeding Science, 2012, 62(3): 248-255. |
| [3] |
詹林星. 福建山樱花播种育苗种植试验[J]. 现代农业科技, 2018(19): 164-165. |
| [4] |
陈雅静, 唐丽, 蒋冬月, 等. 福建山樱花种子生物学特性研究[J]. 种子, 2019, 38(4): 70-73. |
| [5] |
钱永平, 吴承祯, 周俊新, 等. 福建山樱花果用品种选育研究初报[J]. 林业科技通讯, 2018(3): 29-30. |
| [6] |
陈璋. 福建山樱花形态多样性分化的研究[J]. 植物遗传资源学报, 2007, 8(4): 411-415. |
| [7] |
张迎辉, 荣俊冬, 李书平, 等. 低温胁迫对福建山樱花几种生化指标的影响[J]. 福建林学院学报, 2013, 33(4): 326-329. |
| [8] |
吴小刚. 福建省蔷薇科木本植物观赏资源调查分析[J]. 江西农业大学学报, 2003, 25(3): 388-392. |
| [9] |
ZIETKIEWICZ E, RAFALSKI A, LABUDA D. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J]. Genomics, 1994, 20(2): 176-183. |
| [10] |
MURTY S G, PATEL F, PUNWAR B S, et al. Comparison of RAPD, ISSR, and DAMD markers for genetic diversity assessment between accessions of Jatropha curcas L. and its related species[J]. Journal of Agricultural Science and Technology, 2013, 15(5): 1007-1022. |
| [11] |
TIKENDRA L, AMOM T, NONGDAM P. Molecular genetic homogeneity assessment of micropropagated Dendrobium moschatum Sw.:a rare medicinal orchid, using RAPD and ISSR markers[J]. Plant Gene, 2019, 19: 100196. |
| [12] |
刘颖嘉, 黄宇, 荣俊冬, 等. 巴戟天遗传多样性的ISSR分析[J]. 福建林学院学报, 2011, 31(3): 203-206. |
| [13] |
谢玥, 夏惠, 梁东, 等. 25个猕猴桃材料遗传多样性分析及DNA指纹图谱的建立[J]. 分子植物育种, 2018, 16(15): 5001-5007. |
| [14] |
LUO C, HE X H, CHEN H, et al. Genetic diversity of mango cultivars estimated using SCoT and ISSR markers[J]. Biochemical Systematics and Ecology, 2011, 39(4/5/6): 676-684. |
| [15] |
SHI S, LI J L, SUN J H, et al. Phylogeny and classification of Prunus sensu lato(Rosaceae)[J]. Journal of Integrative Plant Biology, 2013, 55(11): 1069-1079. |
| [16] |
蒋冬月, 沈凤强, 徐卢雨, 等. 樱亚属部分园艺品种遗传多样性的ISSR分析[J]. 西南林业大学学报, 2018, 38(3): 21-30. |
| [17] |
林立, 王志龙, 付涛, 等. 39个樱花品种亲缘关系的ISSR分析[J]. 植物研究, 2016, 36(2): 297-304. |
| [18] |
杨峰, 李跃建, 李晓梅, 等. 利用ISSR和SSR标记分析不同抽薹性萝卜的遗传多样性[J]. 西南农业学报, 2019, 32(8): 1708-1716. |
| [19] |
肖琳, 曾艳玲, 刘卫东. 采用正交设计方法优化观赏桃ISSR-PCR反应体系[J]. 经济林研究, 2017, 35(4): 136-140. |
| [20] |
冯晨静, 苏智海, 刘威生, 等. 李ISSR反应体系的优化[J]. 河北林果研究, 2005, 20(1): 30-33. |
| [21] |
FARSANI T M, ETEMADI N, SAYED-TABATABAEI B E, et al. Assessment of genetic diversity of bermudagrass (Cynodon dactylon) using ISSR markers[J]. International Journal of Molecular Sciences, 2012, 13(1): 383-392. |
| [22] |
段媛媛, 卢超, 郭杰, 等. 铁皮石斛及霍山石斛ISSR鉴定体系的建立与优化[J]. 分子植物育种, 2019, 17(13): 4360-4366. |
| [23] |
陈芳, 周春玲, 韩德铎. 樱花基因组DNA提取及RAPD反应体系的优化[J]. 江苏农业科学, 2007(2): 85-88. |
| [24] |
ÖZ M H, VURGUN H, BAKIR M, et al. Molecular analysis of East Anatolian traditional plum and cherry accessions using SSR markers[J]. Genetics and Molecular Research, 2013, 12(4): 5310-5320. |
| [25] |
苏倩.福建山樱花种源遗传多样性研究[D].南京: 南京林业大学, 2007.
|
| [26] |
时玉娣.樱属品种资源调查及分类研究[D].南京: 南京林业大学, 2007: 106-110.
|

 2020, Vol. 40
2020, Vol. 40


