文章信息
- 卢胜旭, 许恩兰, 吴东梅, 陆宇明, 郭剑芬, 杨玉盛
- LU Shengxu, XU Enlan, WU Dongmei, LU Yuming, GUO Jianfen, YANG Yusheng
- 米槠人工林土壤微生物群落组成对凋落物输入的响应
- Response of soil microbial community composition on litterfall input in a Castanopsis carlesii plantation
- 森林与环境学报,2020, 40(1): 16-23.
- Journal of Forest and Environment,2020, 40(1): 16-23.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2020.01.003
-
文章历史
- 收稿日期: 2019-09-26
- 修回日期: 2019-11-07
2. 福建师范大学地理研究所, 福建 福州 350007
2. Institute of Geography, Fujian Normal University, Fuzhou, Fujian 350007, China
土壤微生物作为分解者,在森林生态系统养分循环中扮演着重要的角色;而土壤微生物群落组成受到森林净初级生产力、植物碳分配、根际活动和凋落物输入量等的共同影响[1]。其中凋落物输入是森林土壤碳(C)、氮(N)库的重要来源[2],且调控土壤微生物的生理和代谢过程[3]。因此凋落物输入量的微小变化都会引起土壤微生物群落生物量、结构和活性的变化[4]。
当前不断加剧的气候变化对植物净初级生产力产生了积极或消极的影响。如CO2升高[5]、氮沉降[6]和温度增加[7]均对植物生产力有促进作用,而O3升高[8]、干旱[9]和酸沉降[10]普遍降低了生产力。初级生产力的变化可能会引起地上凋落物输入的数量和质量发生变化,从而改变凋落物层的物理、化学和生物特性,进而影响土壤微生物生物量、群落结构和活性。虽然有关凋落物变化对土壤微生物影响的研究较多,但并未能达成一致的认识。PREVOST-BOURE et al[11]研究表明凋落物输入处理对土壤微生物生物量的影响不显著,另外还有研究结果表明凋落物输入处理影响土壤微生物生物量和活性,还会影响其群落组成[12-13]。可见,土壤微生物对凋落物输入变化响应仍存在不确定性,因此有必要开展更进一步的研究。
我国中亚热带地区常绿阔叶林是全球同纬度的“绿洲”,其生物量和生产力非常高,对全球陆地生态系统碳吸存有着极其重要的贡献[14]。该地区常绿阔叶林年凋落量大,约可达11 t·hm-1·a-1,这为土壤微生物提供了丰富的底物来源。为了深入研究地上凋落物输入对土壤微生物的影响,本研究以三明市格氏栲自然保护区米槠[Castanopsis carlesii(Hemsl.) Hayata]人工林为研究对象,通过磷脂脂肪酸(Phospholipid fatty acid,PLFA)技术分析该人工林凋落物加倍与去除处理的土壤微生物群落组成的差异,并分析主要影响因素,有助于深入理解全球气候变化背景下凋落物输入变化对该地区森林土壤养分循环的影响机制。
1 研究区概况研究区域位于福建省三明市格氏栲自然保护区(117°28′E,26°11′N),海拔305~315 m,坡度15°~20°。该保护区属中亚热带季风气候,具冬冷夏热、水热同期、湿润多雨等特点,年均气温20.1 ℃,年均降水量1 670 mm。土壤为砂岩发育的山地红壤,表层疏松,土层深厚。本试验研究的米槠人工林前身为米槠[Castanopsis carlesii(Hemsl.) Hayata]天然林,20世纪60年代经皆伐、火烧、挖穴后造林和幼林抚育而形成,其林下植被主要有硃砂根(Ardisia crenata Sims)、香花崖豆藤(Millettia dielsiana Harms)、狗骨柴[Diplospora dubia(Lindl.)Masam]和黄楠(Machilus grijsii Hance)等。
2 研究方法 2.1 土壤样品采集2012年6月,在亚热带米槠人工林设置3个大小为20 m × 20 m的样方,分别在各样方内随机设置3个1 m × 1 m的小区,分别作如下处理,即:(1)保留凋落物(control treatment,CT),不做任何处理;(2)去除凋落物(no litter,NL),在小区上方0.5 m高处放置1.5 m × 1.5 m大小的正方形尼龙网去除小区地表全部凋落物;(3)凋落物加倍(double litter,DL),将NL处理截留的凋落物移至添加凋落物处理的小区内。每种处理设3个重复,共9个小区。
2017年11用内径2 cm的土钻采用“S”型混合采样方法取样,采集各小区0~10 cm土层土样,5根土芯混成一个混合样,使用塑料自封袋保存,运回福建三明生态系统与全球变化研究站实验室,挑除肉眼可见的砾石和动植物残体后充分混匀。其他原状土样过2 mm(孔径)筛后再分成3部分:第一部分保存于-20 ℃环境,用于土壤微生物指标测定;第二部分保存于4 ℃环境,用于测定土壤的基本理化性质等;第三部分自然风干,用于测定土壤有机碳、全氮、pH值等。
2.2 土壤理化性质测定方法土壤含水率(重量含水率,gravimetric water content,GWC/%)采用105 ℃烘干24 h测定;土壤pH值以土水比(1:2.5)为标准,采用pH测试仪测定;土壤有机碳(soil organic carbon,SOC)和全氮(total nitrogen,TN)用过100目风干土,采用土壤碳氮元素分析(Elemental Analyzer Vario ELIII,Germany)测定,单位为g·kg-1;土壤可溶性有机碳(dissolved organic carbon,DOC)、可溶性有机氮(dissolved organic nitrogen,DON)采用20 mL去离子水浸提5 g鲜土,振荡离心后用0.45 μm玻璃纤维滤膜抽滤,用总有机碳分析仪(TOC-VCPH,Shimadzu)测定滤液中DOC浓度,采用连续流动分析仪(Skalar San++,Netherlands)测定DON浓度,单位为mg·kg-1;土壤矿质氮、铵态氮和硝态氮(Mineral N、NH4+-N和NO3--N)测定以20 mL 2 mol·L-1 KCL溶液浸提5 g鲜土,振荡离心后,过0.45 μm中速定量滤纸,使用连续流动分析仪(Skalar San++,Netherlands)测定,单位均为mg·kg-1。有效磷(AP)由M3浸提液提取,并用连续流动分析仪测定。
2.3 土壤微生物生物量碳、氮及微生物群落结构测定采用氯仿熏蒸-浸提法测定土壤微生物生物量碳(microbial biomass carbon,MBC)、微生物生物量氮(microbial biomass nitrogen,MBN)[15]。简要步骤如下:称取两份5 g鲜土,一份用氯仿熏蒸24 h,另一份不作处理;然后按1:4 (土:溶液)比例用0.5 mol·L-1K2SO4溶液浸提,滤液经振荡、离心、过滤后使用总有机碳分析仪(TOC-VCPH,Shimadzu)测定有机碳含量,使用连续流动分析仪(Skalar San++,Netherlands)测定有机氮含量。计算公式如下:
| $ {{C}_{\text{MBC}}}/(\text{mg}\cdot \text{k}{{\text{g}}^{-1}})={{E}_{\text{C}}}/{{k}_{\text{EC}}} $ | (1) |
| $ {{C}_{\text{MBN}}}/(\text{mg}\cdot \text{k}{{\text{g}}^{-1}})={{E}_{\text{N}}}/{{k}_{\text{EN}}} $ | (2) |
其中:EC为熏蒸和未熏蒸处理的有机碳含量的差值,kEC是MBC的浸提系数0.45;EC为熏蒸和未熏蒸处理的有机氮含量的差值,kEN是MBN的浸提系数0.54。
微生物磷脂脂肪酸(PLFA)的提取参考BUYER et al[16]的方法,调整后的简要步骤如下:
① 取3 g冻干土置入25 mL特氟龙管,加入4 mL 50 mmol·L-1磷酸缓冲液(pH值=7.4)、10 mL甲醇和5 mL氯仿,室温下超声10 min、避光振荡2 h、离心(2 500 r·min-1)10 min。
② 液相移入干净的特氟龙试管,加入3 mL氯仿和3 mL磷酸缓冲液,涡旋混匀,静置过夜分层。
③ 底部液相用N2吹干,加入适量氯仿,洗入已用5 mL氯仿润洗后的萃取小柱中,依次加入5 mL氯仿和10 mL丙酮洗去中性脂和极性脂,收集用5 mL甲醇洗脱的磷脂,最后用N2吹干。
④ 样品中加入1 mL 1:1(甲醇:甲苯)溶液、1 mL 0.2 mol·L-1甲基化KOH,涡旋后37 ℃水浴15 min,加入2 mL正己烷、0.3mL 1 mol·L-1冰醋酸和2 mL无菌水,涡旋后离心分层,吸取顶部液相,残液再加2 mL色谱纯正己烷提取,然后合并收集的顶部液相用N2吹干,收集N2,封口膜密封,置于-20 ℃保存。
上机测样前,用200 μL含有19:0甲酯的内标液将样品洗入GC小瓶,用GC-MIDI系统进行磷脂脂肪酸的鉴定。计算采用19:0内标法,每单位干土所含脂肪酸含量nmol·g-1。具体的土壤微生物种群磷脂脂肪酸标志物及其特征比值详见表 1[17-21]。
| 微生物类型Microorganism type | 磷脂脂肪酸标志物Phosphatidic fatty acid markers | 参考文献Reference |
| 丛枝菌根真菌Arbuscular mycorrhizal fungi (AMF) | 16:1ω5c | [17-19] |
| 革兰氏阳性菌Gram-positive bacteria | 14:0 iso,15:0 anteiso,15:0 iso,16:0 iso,17:0 anteiso,17:0 iso | [20-21] |
| 革兰氏阴性菌Gram-negative bacteria (-)] | 16:1ω7c,17:0 cyclo,18:1ω7c,19cy,16:1ω9c,18:1ω5c | [20-21] |
| 放线菌Actinomycetes (ACT) | 16:0 10-methyl,17:0 10-methyl,18:0 10-methyl | [22-23] |
| 真菌Fungi (F) | 18:1ω9c,18:2ω6 c | [24] |
数据经过Microsoft Excel 2013软件整理后,采用SPSS 21.0统计软件对土壤各指标进行统计分析。采用单因素方差分析(one-way ANOVA)检验不同处理之间土壤理化性质,土壤微生物生物量及群落组成的差异。采用Canoco Software 5.0软件,以土壤微生物PLFA为响应变量,以土壤理化性质及微生物生物量为解释变量做冗余度分析(redundancy analysis,RDA);绘图由Origin 9.0软件完成。
3 结果与分析 3.1 土壤基本理化性质由表 2可以看出,与对照处理相比(CT),加倍凋落物处理(DL)显著提高铵态氮和硝态氮含量(P < 0.05),而去除凋落物处理(NL)显著降低了硝态氮含量(P < 0.05)。DL处理土壤全氮、铵态氮和有效磷含量显著高于NL处理(P < 0.05)。不同凋落物输入处理下土壤有机碳和可溶性有机碳含量差异不显著。DL和NL处理下土壤pH值(表 2)和土壤微生物生物量碳含量(图 1)均明显高于CT,可溶性有机氮(表 2)和微生物生物量氮含量均显著低于CT(图 1)。而微生物生物量碳氮在DL和NL处理之间差异不显著。
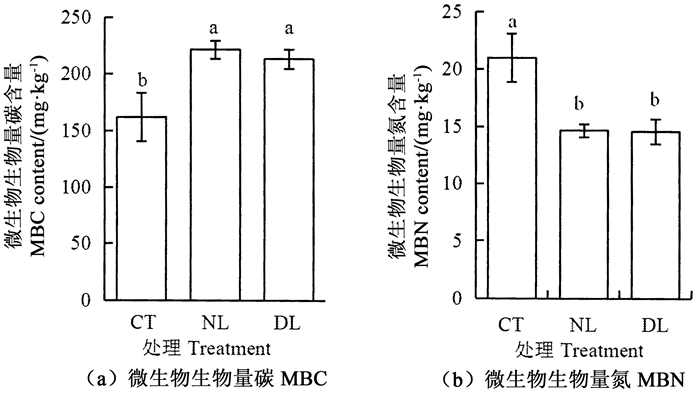
|
注:不同小写字母表示处理间差异显著,P<0.05。 Notes: different lowercase letters indicate significant difference among treatments, P < 0.05. 图 1 不同凋落物量输入处理土壤微生物生物量碳氮含量 Fig. 1 Soil microbial biomass carbon and nitrogen contents at different litter input treatments |
| 处理Treatment | pH值pH value | 土壤有机碳含量SOC content /(g·kg-1) | 全氮含量TN content /(g·kg-1) | 有效磷含量AP content /(g·kg-1) | 铵态氮含量NH4+-N content /(mg·kg-1) | 硝态氮含量NO3--N content /(mg·kg-1) | 可溶性有机碳含量DOC content /(mg·kg-1) | 可溶性有机氮含量DON content /(mg·kg-1) |
| CT | 4.01±0.04b | 21.51±1.07a | 1.48±0.01ab | 4.43±0.12ab | 23.01±0.22b | 6.28±0.27a | 46.25±4.76a | 1.45±0.17a |
| NL | 4.11±0.01a | 20.47±1.58a | 1.41±0.04b | 4.10±0.06b | 21.25±2.14b | 4.39±0.32b | 39.05±5.21a | 1.29±0.24b |
| DL | 4.09±0.03a | 23.50±1.21a | 1.59±0.06a | 4.67±0.24a | 27.69±0.64a | 6.57±0.48a | 42.54±1.70a | 0.79±0.22b |
| 注:同列不同小写字母表示处理间差异显著,P<0.05。Note: different lowercase letters within the same column indicate significant difference among treatments,P<0.05. | ||||||||
DL处理不同程度增加了土壤各类微生物PLFA组成的含量,而NL处理则反之(图 2)。具体表现为,DL处理土壤丛枝菌根真菌(AMF)、革兰氏阳性菌、革兰氏阴性菌、放线菌(ACT)、真菌(F)、总磷脂脂肪酸(TPLFA)含量均显著高于NL处理(P < 0.05),但与CT处理差异不显著。同DL处理土壤相比,NL处理土壤显著提高了G(+):G(-)比值(P < 0.05),但与CT处理差异不显著。凋落物输入变化中F:B比值随凋落物去除而升高,表现为NL处理明显高于CT和DL处理的土壤F:B比值(P < 0.05)。
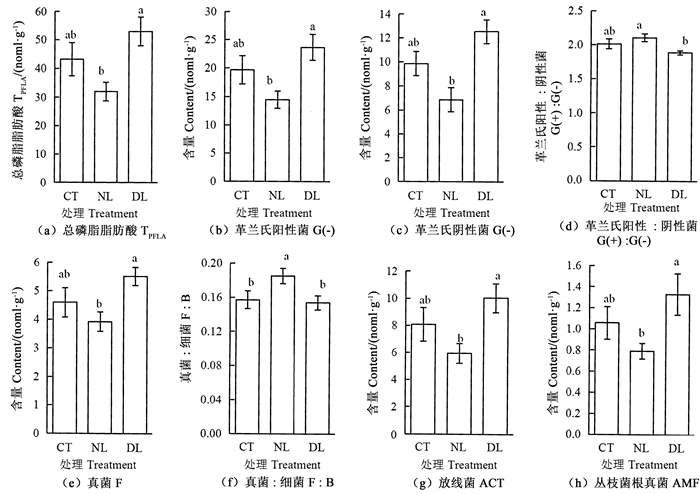
|
注:不同小写字母表示处理间差异显著,P<0.05。 Note: different lowercase letters indicate significant difference among treatments, P < 0.05. 图 2 不同凋落物量输入处理土壤磷脂脂肪酸含量及其特征比值 Fig. 2 Different litter quantity input on soil phospholipid fatty acids and their characteristic ratios |
以土壤微生物PLFA作为响应变量,土壤的理化性质作为环境解释变量进行冗余度分析。由图 3可以看出,冗余度分析的第一轴和第二轴分别解释了变量的82.62%和0.59%。土壤NH4+-N、MBN、TN对土壤微生物群落结构有显著影响,其中NH4+-N影响最大,解释了土壤微生物群落结构变化的57.9%(P=0.006),并且NH4+-N与TPLFA、G(-)、G(+)、ACT、AMF和F呈显著正相关。
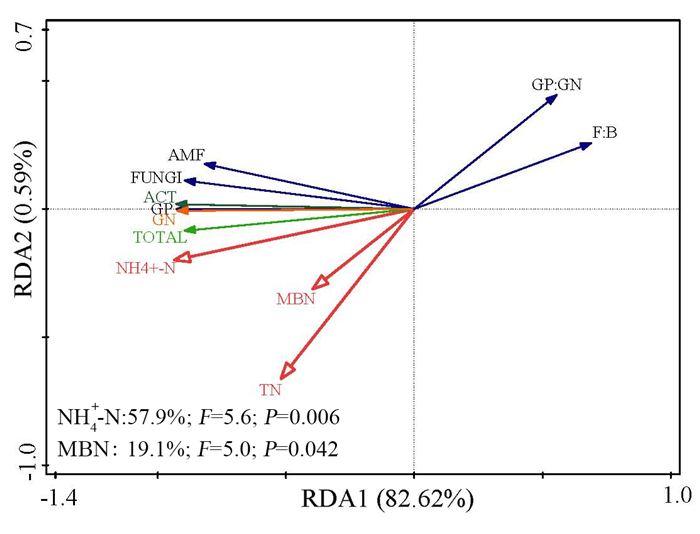
|
图 3 土壤微生物群落组成与环境因子的冗余度分析 Fig. 3 Redundancy analyses of soil microbial community composition and environmental factors |
凋落物输入是土壤元素循环利用的关键过程[25]。本研究中加倍凋落物处理对土壤SOC和DOC含量没有明显影响(表 1)。这可能由于凋落物加倍为微生物提供了丰富的底物来源,对土壤有机质产生“正激发效应”,从而提高了微生物对土壤SOC和DOC的分解,使加倍凋落物处理与对照处理SOC和DOC差异不显著[26]。也可能由于土壤DOC随季节变化较大[27-28],而本研究取样的季节为秋季,此时降雨较少,淋溶作用弱。不同的是,本研究凋落物加倍处理显著提高了土壤TN、铵态氮和硝态氮含量,而凋落物去除降低了硝态氮含量,表明凋落物增加或减少显著影响土壤N的有效性,这与我们前期研究一致[29]。
土壤微生物在土壤养分的获取和转移中起着重要的作用[30]。有研究表明,凋落物添加与去除明显改变了土壤微生物生物量碳(MBC)含量[31-32]。本研究凋落物加倍处理下土壤MBC含量增加31.44%,这与HOOKER和STARK[33]在美国怀俄明州3个不同生态系统的研究结果类似,他们发现添加凋落物使土壤MBC含量增加13%。但亦有学者研究显示,添加或去除凋落物对土壤MBC含量没有显著影响[34]。不同研究结果差异可能与所处气候、森林类型、土壤状况、凋落物输入量差异等有关。其原因可能在于温带森林对凋落物的处理往往不如热带和亚热带森林敏感,这是由于温带森林土壤C循环速度较慢,导致微生物生物量和活性较低。也可能由于森林类型不同,对比杉木而言,本研究凋落物为米槠叶(低C /N、低木质素/N、低纤维素含量),这些高质量的有机质输入添加使土壤微生物更容易利用的植物碳来源增加[35],从而使微生物生物量碳增加。
4.2 土壤微生物群落组成对凋落物输入变化的响应凋落物作为土壤有机质的重要来源,凋落物输入量变化可通过改变土壤有机碳和养分含量等,从而影响土壤微生物群落组成[36]。有研究表明微生物的特征PLFA含量与养分的可利用性呈现正相关关系[37]。本研究发现,与去除凋落物处理相比,加倍凋落物处理下AMF、G(+)、G(-)、ACT、F和TPLFA含量增加(图 2),并且微生物PLFA与TN、AP、NO3--N和NH4+-N变化趋势一致,这与ZHAO et al[38]研究结果不一致。因其研究样地位于养分贫瘠的沙土上,虽然凋落物的添加为这些土壤提供了大量不稳定的C底物,促进微生物的生长,从而促进营养物质的矿化,但是添加凋落物增加了土壤微生物和树木之间的氮、磷竞争。这种土壤微生物群落与树木之间的竞争可能会增加氮、磷养分限制,从而降低氮、磷养分含量。
F:B和G(+):G(-)的比值常被用作指示微生物群落结构变化的重要指标,F:B可表征真菌和细菌两个种群的相对丰富程度消长状况[39]。细菌分解主要发生在养分充足的土壤中,这些土壤富含容易分解的有机质,碳周转和养分循环速度较快;而真菌分解为慢周转方式,多存在于酸性土壤中,偏好低营养、以及高碳氮比的有机物[40]。当易分解有机质输入减少使土壤微生物更容易利用的植物碳来源减少,微生物需要转而利用土壤中较难利用的碳组分,此时真菌相对细菌的优势显著[36]。在本研究中,去除凋落物时,F:B的比例显著增加(图 2),NL处理的F:B为0.19,而CT和DL处理的F:B分别为0.16和0.15,表明去除凋落物后土壤微生物由细菌分解型转换为真菌分解型。WANG et al[41]研究表明,亚热带针叶林的NL处理的F:B高于CT和DL处理。
G(-)和G(+)是微生物群落结构变化的指示器,在不同的环境变化下,养分的倾向性和生长策略不同[42]。G(-)更加依赖于新鲜有机质的输入,而G(+)更倾向于养分有效性低的环境中生长[43]。在本研究中,NL处理的真菌和细菌含量显著低于DL处理(图 2),表明去除凋落物对微生物群落有抑制作用。但NL处理的G(+):G(-)的比值却显著上升,因为G(-)更依赖于易分解的C源,生长较快,去除凋落物减少了新鲜有机质的输入,为了适应有效养分减少的限制,NL处理下的微生物细菌群落发生了转移。
RDA分析表明NH4+-N是影响不同凋落物输入处理下表层土壤微生物群落组成变化主要环境因子。HUANG et al[44]和张坤[45]等研究亦发现有效性氮是微生物活动和分解的主要制约因素。凋落物作为森林生态系统的养分储存库,通过分解逐渐向土壤中输入养分,是土壤氮的重要来源[46]。本研究中,NH4+-N含量与TPLFA、G(-)、G(+)、F和ACT呈显著正相关,这说明凋落物输入变化显著影响着土壤有效性氮含量,进而影响了土壤微生物生物量增减。罗达等[47]对亚热带格木人工纯林进行研究后亦得出相似结论。总之,凋落物输入变化对微生物群落组成的影响较为复杂,这可能由于不同研究地区气候条件、林分状况、土壤性质以及实验周期的长短等因素所造成。
| [1] |
PAN F J, ZHANG W, LIANG Y M, et al. Increased associated effects of topography and litter and soil nutrients on soil enzyme activities and microbial biomass along vegetation successions in karst ecosystem, southwestern China[J]. Environmental Science and Pollution Research, 2018, 25(17): 16979-16990. DOI:10.1007/s11356-018-1673-3 |
| [2] |
SAUVADET M, CHAUVAT M, FANIN N, et al. Comparing the effects of litter quantity and quality on soil biota structure and functioning:application to a cultivated soil in Northern France[J]. Applied Soil Ecology, 2016, 107: 261-271. DOI:10.1016/j.apsoil.2016.06.010 |
| [3] |
MUELLER K E, HOBBIE S E, OLEKSYN J, et al. Do evergreen and deciduous trees have different effects on net N mineralization in soil?[J]. Ecology, 2012, 93(6): 1463-1472. DOI:10.1890/11-1906.1 |
| [4] |
万晓华, 黄志群, 何宗明, 等. 改变碳输入对亚热带人工林土壤微生物生物量和群落组成的影响[J]. 生态学报, 2016, 36(12): 3582-3590. |
| [5] |
JUNG M, REICHSTEIN M, SCHWALM C R, et al. Compensatory water effects link yearly global land CO2 sink changes to temperature[J]. Nature, 2017, 541(7638): 516-520. DOI:10.1038/nature20780 |
| [6] |
IVERSEN C, NORBY R. Terrestrial plant productivity and carbon allocation in a changing climate[M]. .
|
| [7] |
XU X T, PIAO S L, WANG X H, et al. Spatio-temporal patterns of the area experiencing negative vegetation growth anomalies in China over the last three decades[J]. Environmental Research Letters, 2012, 7(3): 035701. DOI:10.1088/1748-9326/7/3/035701 |
| [8] |
COUTURE J J, MEEHAN T D, RUBERT-NASON K F, et al. Effects of elevated atmospheric carbon dioxide and tropospheric ozone on phytochemical composition of trembling aspen (Populus tremuloides) and Paper Birch (Betula papyrifera)[J]. Journal of Chemical Ecology, 2017, 43(1): 26-38. |
| [9] |
ZHAO M S, RUNNING S W. Drought-induced reduction in global terrestrial net primary production from 2000 through 2009[J]. Science, 2010, 329(5994): 940-943. DOI:10.1126/science.1192666 |
| [10] |
LIU X, FU Z Y, ZHANG B, et al. Effects of sulfuric, nitric, and mixed acid rain on Chinese fir sapling growth in Southern China[J]. Ecotoxicology and Environmental Safety, 2018, 160: 154-161. DOI:10.1016/j.ecoenv.2018.04.071 |
| [11] |
PREVOST-BOURE N C, MARON P A, RANJARD L, et al. Seasonal dynamics of the bacterial community in forest soils under different quantities of leaf litter[J]. Applied Soil Ecology, 2011, 47(1): 14-23. DOI:10.1016/j.apsoil.2010.11.006 |
| [12] |
NADELHOFFER K J, BOONE R D, BOWDEN R D, et al. The DIRT experiment:litter and root influences on forest soil organic matter stocks and function[M]. .
|
| [13] |
TÓTH J A, LAJTHA K, KOTROCZÓZ, et al. The effect of climate change on soil organic matter decomposition[J]. Acta Silvatica et Lignaria Hungarica, 2007, 3: 75-85. |
| [14] |
吴君君, 杨智杰, 翁发进, 等. 米槠天然林和人工林土壤呼吸的比较研究[J]. 环境科学, 2014, 35(6): 2426-2432. |
| [15] |
VANCE E D, BROOKES P C, JENKINSON D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707. DOI:10.1016/0038-0717(87)90052-6 |
| [16] |
BUYER J S, TEASDALE J R, ROBERTS D P, et al. Factors affecting soil microbial community structure in tomato cropping systems[J]. Soil Biology and Biochemistry, 2010, 42(5): 831-841. DOI:10.1016/j.soilbio.2010.01.020 |
| [17] |
OLSSON P A. Signature fatty acids provide tools for determination of the distribution and interactions of mycorrhizal fungi in soil[J]. FEMS Microbiology Ecology, 1999, 29(4): 303-310. DOI:10.1111/j.1574-6941.1999.tb00621.x |
| [18] |
ZANG H D, BLAGODATSKAYA E, WANG J Y, et al. Nitrogen fertilization increases rhizodeposit incorporation into microbial biomass and reduces soil organic matter losses[J]. Biology and Fertility of Soils, 2017, 53(4): 419-429. DOI:10.1007/s00374-017-1194-0 |
| [19] |
PARRENT J L, VILGALYS R. Biomass and compositional responses of ectomycorrhizal fungal hyphae to elevated CO2 and nitrogen fertilization[J]. New Phytologist, 2007, 176(1): 164-174. DOI:10.1111/j.1469-8137.2007.02155.x |
| [20] |
FROSTEGÅRD Å, TUNLID A, BÅÅTH E. Use and misuse of PLFA measurements in soils[J]. Soil Biology and Biochemistry, 2011, 43(8): 1621-1625. DOI:10.1016/j.soilbio.2010.11.021 |
| [21] |
SWALLOW M, QUIDEAU S A, MACKENZIE M D, et al. Microbial community structure and function:the effect of silvicultural burning and topographic variability in northern Alberta[J]. Soil Biology and Biochemistry, 2009, 41(4): 770-777. DOI:10.1016/j.soilbio.2009.01.014 |
| [22] |
胡嵩, 张颖, 史荣久, 等. 长白山原始红松林次生演替过程中土壤微生物生物量和酶活性变化[J]. 应用生态学报, 2013, 24(2): 366-372. |
| [23] |
ZHOU X Q, CHEN C R, WANG Y F, et al. Soil extractable carbon and nitrogen, microbial biomass and microbial metabolic activity in response to warming and increased precipitation in a semiarid Inner Mongolian grassland[J]. Geoderma, 2013, 206: 24-31. DOI:10.1016/j.geoderma.2013.04.020 |
| [24] |
李延茂, 胡江春, 汪思龙, 等. 森林生态系统中土壤微生物的作用与应用[J]. 应用生态学报, 2004, 15(10): 1943-1946. DOI:10.3321/j.issn:1001-9332.2004.10.048 |
| [25] |
GARCÍA-PALACIOS Pablo, IVÁN Prieto, JEAN-MARC Ourcival, et al. Disentangling the litter quality and soil microbial contribution to leaf and fine root litter decomposition responses to reduced rainfall[J]. Ecosystems, 2016, 19(3): 490-503. DOI:10.1007/s10021-015-9946-x |
| [26] |
LYU M, XIE J S, VADEBONCOEUR M A, et al. Simulated leaf litter addition causes opposite priming effects on natural forest and plantation soils[J]. Biology and Fertility of Soils, 2018, 54(8): 925-934. DOI:10.1007/s00374-018-1314-5 |
| [27] |
CLEVELAND C C, NEFF J C, TOWNSEND A R, et al. Composition, dynamics, and fate of leached dissolved organic matter in terrestrial ecosystems:results from a decomposition experiment[J]. Ecosystems, 2004, 7(3): 275-285. |
| [28] |
CROW S E, LAJTHA K, BOWDEN R D, et al. Increased coniferous needle inputs accelerate decomposition of soil carbon in an old-growth forest[J]. Forest Ecology and Management, 2009, 258(10): 2224-2232. DOI:10.1016/j.foreco.2009.01.014 |
| [29] |
魏翠翠, 刘小飞, 林成芳, 等. 凋落物输入改变对亚热带两种米槠次生林土壤酶活性的影响[J]. 植物生态学报, 2018, 42(6): 692-702. |
| [30] |
RICHARDSON A E. Prospects for using soil microorganisms to improve the acquisition of phosphorus by plants[J]. Australian Journal of Plant Physiology, 2001, 28(9): 897-906. |
| [31] |
FENG W T, ZOU X M, SCHAEFER D. Above-and belowground carbon inputs affect seasonal variations of soil microbial biomass in a subtropical monsoon forest of southwest China[J]. Soil Biology and Biochemistry, 2009, 41(5): 978-983. DOI:10.1016/j.soilbio.2008.10.002 |
| [32] |
LI Y Q, XU M, SUN O J, et al. Effects of root and litter exclusion on soil CO2 efflux and microbial biomass in wet tropical forests[J]. Soil Biology and Biochemistry, 2004, 36(12): 2111-2114. DOI:10.1016/j.soilbio.2004.06.003 |
| [33] |
HOOKER T D, STARK J M. Soil C and N cycling in three semiarid vegetation types:response to an in situ pulse of plant detritus[J]. Soil Biology and Biochemistry, 2008, 40(10): 2678-2685. DOI:10.1016/j.soilbio.2008.07.015 |
| [34] |
BRANT J B, SULZMAN E W, MYROLD D D. Microbial community utilization of added carbon substrates in response to long-term carbon input manipulation[J]. Soil Biology and Biochemistry, 2006, 38(8): 2219-2232. DOI:10.1016/j.soilbio.2006.01.022 |
| [35] |
桑昌鹏, 万晓华, 余再鹏, 等. 凋落物和根系去除对滨海沙地土壤微生物群落组成和功能的影响[J]. 应用生态学报, 2017, 28(4): 1184-1196. |
| [36] |
CROW S E, LAJTHA K, FILLEY T R, et al. Sources of plant-derived carbon and stability of organic matter in soil:implications for global change[J]. Global Change Biology, 2009, 15(8): 2003-2019. DOI:10.1111/j.1365-2486.2009.01850.x |
| [37] |
张圣喜, 陈法霖, 郑华. 土壤微生物群落结构对中亚热带三种典型阔叶树种凋落物分解过程的响应[J]. 生态学报, 2011, 31(11): 3020-3026. |
| [38] |
ZHAO Q, CLASSEN A T, WANG W W, et al. Asymmetric effects of litter removal and litter addition on the structure and function of soil microbial communities in a managed pine forest[J]. Plant and Soil, 2017, 414(1/2): 81-93. |
| [39] |
赵盼盼, 周嘉聪, 林开淼, 等. 海拔梯度变化对中亚热带黄山松土壤微生物生物量和群落结构的影响[J]. 生态学报, 2019, 39(6): 2215-2225. |
| [40] |
楚海燕, 李若南, 李靖雯, 等. 中亚热带森林转换对土壤微生物群落结构的影响[J]. 应用与环境生物学报, 2019, 25(1): 23-28. |
| [41] |
WANG Q K, HE T X, WANG S L, et al. Carbon input manipulation affects soil respiration and microbial community composition in a subtropical coniferous forest[J]. Agricultural and Forest Meteorology, 2013, 178-179: 156-160. |
| [42] |
FENG X J, SIMPSON M J. Temperature and substrate controls on microbial phospholipid fatty acid composition during incubation of grassland soils contrasting in organic matter quality[J]. Soil Biology and Biochemistry, 2009, 41(4): 804-812. DOI:10.1016/j.soilbio.2009.01.020 |
| [43] |
DJUKIC I, ZEHETNER F, WATZINGER A, et al. In situ carbon turnover dynamics and the role of soil microorganisms therein:a climate warming study in an Alpine ecosystem[J]. FEMS Microbiology Ecology, 2013, 83(1): 112-124. DOI:10.1111/j.1574-6941.2012.01449.x |
| [44] |
HUANG C Y, JIEN S H, CHEN T H, et al. Soluble organic C and N and their relationships with soil organic C and N and microbial characteristics in moso bamboo (Phyllostachys edulis) plantations along an elevation gradient in Central Taiwan[J]. Journal of Soils and Sediments, 2014, 14(6): 1061-1070. DOI:10.1007/s11368-014-0870-z |
| [45] |
张坤, 包维楷, 杨兵, 等. 林下植被对土壤微生物群落组成与结构的影响[J]. 应用与环境生物学报, 2017, 23(6): 1178-1184. |
| [46] |
潘萍, 赵芳, 欧阳勋志, 等. 马尾松林两种林下植被土壤碳氮特征及其与凋落物质量的关系[J]. 生态学报, 2018, 38(11): 3988-3997. |
| [47] |
罗达, 史作民, 李东胜. 枯落物处理对格木林土壤碳氮转化和微生物群落结构的短期影响[J]. 应用生态学报, 2018, 29(7): 2259-2268. |

 2020, Vol. 40
2020, Vol. 40


