文章信息
- 李建鹃, 罗扬, 周柳婷, 白莹, 李键, 吴承祯
- LI Jianjuan, LUO Yang, ZHOU Liuting, BAI Ying, LI Jian, WU Chengzhen
- 连栽木麻黄根际微生物群落结构和功能特征
- Microbial community structure and functional characteristics of rhizosphere soil in different generations of Casuarina equisetifolia plantations
- 森林与环境学报,2020, 40(1): 9-15.
- Journal of Forest and Environment,2020, 40(1): 9-15.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2020.01.002
-
文章历史
- 收稿日期: 2019-06-26
- 修回日期: 2019-12-20
2. 福建农林大学生命科学学院, 福建 福州 350002
2. College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
木麻黄(Casuarina equisetifolia L.)是我国重要的沿海沙地防护林和经济用材林树种,在防海浪侵蚀、保持水土、改良沙地土壤、恢复海岸带生态系统等方面发挥着重要作用[1]。然而,木麻黄存在严重的连栽障碍,表现为在同一地块连续多代种植后,木麻黄林生物量、林分净生产力均呈下降趋势,植株生长发育不良,幼苗存活率显著降低。连栽障碍造成木麻黄的产量和质量逐代下降,严重制约了我国沿海防护林生态效益和经济效益。目前国内许多树种均存在连栽障碍问题,如杉木[Cunninghamia lanceolata (Lamb.) Hook.],桉树(Eucalyptus robusta Smith)和毛白杨(Populus tomentosa Carr.)等。由于滨海沙地适生树种较少,目前尚无可替代木麻黄的优质树种,因此,木麻黄连栽障碍问题成为亟待解决的林业问题。
近年来关于木麻黄连栽障碍的研究成果较多,不同学者所持观点不一。大量研究表明,木麻黄人工林连续多代栽种后,由于树种单一,在林分稳定性、抗病虫害和抗干扰能力上有所下降,在发挥森林生态效益方面存在不足[2]。研究指出,引起植物连栽障碍的原因主要包括3个方面:(1)土壤理化性质恶化、肥力衰退;(2)植物化感自毒作用;(3)土壤微生物群落结构和功能退化,微生态失衡。针对土壤肥力下降问题,人们普遍选择施加肥料的措施,虽然能够在一定程度上增加木麻黄的产量,但无法从根源上解决连栽障碍问题[3]。在植物化感自毒作用方面,发现木麻黄根系分泌的化感物质会抑制其幼苗生长[4-6]。在土壤微生物群落方面,学者提出化感物质除产生自毒作用外,还对根际微生物群落结构有选择塑造作用[7]。根际微生物群落能积极响应植物化感物质释放、土壤营养物质循环等生态过程,进而间接影响植物生长发育[8]。因此,植物-土壤-微生物之间的相互作用成为连栽障碍研究的热点[9]。
然而,绝大部分微生物难以培养,传统的微生物研究方法只能培养1%的土壤微生物。与传统研究方法相比,BIOLOG微平板和磷脂脂肪酸(phospholipid fatty acid,PLFA)技术克服了传统培养方法的局限性,具有简便、高效、定量的特点,被广泛应用于土壤微生物群落结构和功能研究。BIOLOG微平板技术通过统计土壤微生物对不同碳源的利用效率,分析微生物群落功能变化;磷脂脂肪酸技术根据微生物磷脂含量与生物量存在固定的比例关系,分析土壤微生物群落结构变化。本研究结合BIOLOG微平板和磷脂脂肪酸(PLFA)技术,探讨连栽木麻黄根际土壤微生物群落结构和功能多样性变化,以期为进一步揭示木麻黄连栽障碍奠定理论基础。
1 材料与方法 1.1 研究区概况试验样地位于福建省惠安赤湖国有防护林场(118°55′E,24°35′N),该林场占地面积432.7 hm2,地处中国南亚热带气候区,年均温19.8 ℃,极端低温1 ℃,极端高温35 ℃,年降雨量1 029 mm,年蒸发量2 000 mm。该林场栽植有3个不同代数的木麻黄人工林,其中第1代(the first rotation plantation,FCP)木麻黄林栽植于1987年,第2代(the second rotation plantation,SCP)栽植于2011年,第3代(the third rotation plantation,TCP)栽植于2014年。不同代数木麻黄林的主要伴生树种均为少量的台湾栾树[Koelreuteria elegans (Seem.) A.C.Smith]和潺槁木姜子[Litsea glutinosa (Lour.) C.B.Rob.],林下植被均为霍香蓟(Ageratum conyzoides L.)和鬼针草(Bidens pilosa L.)。该林地土壤为红壤性风积沙土、泥炭性风积沙土及风积黄沙土,土层较厚。
1.2 土壤样品的采集2018年10月,在FCP、SCP和TCP设立3个林地概况相近的20 m×20 m试验样地,每个样地设3个重复样方,共9个样方。采用“抖落法”收集木麻黄根际土壤,沿“S”形路径在每个样方内选择20株平均胸径、树高相近的木麻黄,去除其落叶层后逐层挖去上层覆土,剪下细根分枝并轻轻抖动,仍粘在细根上的即为根际土壤,将每个样方内取得的20份根际土壤混匀为1份土样,用小毛刷收集到自封袋中保存备用,共获得9份土壤样品。土样通过2 mm筛选后,一部分保存于-80 ℃冰箱,另一部分土样4 ℃冰箱保存用于测定土壤中微生物多样性。土壤理化性质测定参照吴则焰等[10-11]的方法。
1.3 土壤微生物碳源利用测定分析称取5 g鲜土置高压灭菌后的三角瓶中,加入体积分数0.85%的NaCl无菌水100 mL,封口,120 r·min-1振荡30 min,冰浴中静置2 min。取上清液5 mL置100 mL灭菌三角瓶中,加入45 mL无菌水,重复稀释3次,制得1:1 000提取液。将BIOLOG微平板预热到28 ℃,用移液器取150 μL提取液于各孔中,28 ℃恒温避光培养,在第1、2、3、4、5、6和7天用ELISA反应微平板读数器读取590 nm光密度值。BIOLOG微平板每孔平均颜色变化率(average well color development,AWCD)是检验微生物生理活动强度的一个重要指标。
称量鲜土10 g与20 mL含有0.2 mol·L -1KOH的甲醇溶液加入50 mL离心管中,充分震荡均匀后37 ℃温育1 h(每隔10 min将样品震荡1次)。加入1.0 mol·L -1的醋酸3 mL中和pH值,充分混匀后漩涡振荡1 min。加10 mL正己烷,600 r·min-1离心15 min。用移液器将上层清液转到新试管,用冷冻干燥仪将溶剂挥发至全干。将PLFA溶解于1 mL正己烷/甲基丁基醚溶液(体积比为1:1)。加入10 μL浓度为1 μg·mL -1的内标i19: 0,过滤后用于GC-MS检测。采用全自动进样装置Varian 240 GC-MS检测PLFA,条件为:二阶程序升高柱温,70 ℃起始1 min,再以20 ℃·min-1升温至170 ℃,维持2 min后以5 ℃·min-1升温至280 ℃,持续5 min,以40 ℃·min-1升温至300 ℃,1.5 min后结束。进样分流比为20:1。
磷脂脂肪酸命名方式及原则参照FROSTEGAR et al[12]。PLFA是一种具备标记性质的脂肪酸,可显示不同微生物群体的相对特征。从已有的研究中可知i17: 0,i18: 0,i15: 0,16: 1ω9c,a15: 0等可用于革兰氏阳性菌[G (+)]鉴定,16: 1ω7c,cy17: 0,cy19: 0,16: 1ω9t等可用于革兰氏阴性菌[G (-)]鉴定;18: 1ω9c,18: 3ω6c (6, 9, 12),18: 3ω3等可用于真菌鉴定;10Me16: 0,9Me18: 0,10Me18: 0等可用于放线菌的鉴定[13]。采用峰面积法和内标曲线法测算PLFA含量(μg·g-1),i19: 0作为内标。
1.5 数据统计分析采用EXCEL 2016进行数据处理,方差分析和多样性指数分析采用SPSS 22软件,冗余度分析(redundancy analysis,RDA)采用Canoco 4.5软件。参考郑洁等[14]的方法,利用PLFA数据计算土壤微生物群落多样性。
2 结果与分析 2.1 不同代数木麻黄根际土壤理化性质不同代数木麻黄根际土壤理化性质见表 1。pH值随着连栽代数增加略有上升。不同代数木麻黄根际土壤养分含量存在差异,TN、AN、TP均呈现出FCP>SCP>TCP的规律,即连栽导致土壤地力衰退。其中TN从FCP的0.52 g·kg-1下降到TCP的0.27 g·kg-1,损失量达48.08%。从FCP至TCP,AN、TP的损失量分别为62.11%、30.00%,即连栽导致木麻黄生长所必需的N、P营养元素均有一定程度下降。
| 连栽代数Different rotations | pH值pH value | 全氮含量TN /(g·kg-1) | 速效氮含量AN /(mg·kg-1) | 全磷含量TP /(g·kg-1) | 速效磷含量AP /(mg·kg-1) | 全钾含量TK /(g·kg-1) | 速效钾含量AK /(mg·kg-1) |
| 第1代FCP | 3.81±0.03b | 0.52±0.03a | 8.63±1.76a | 0.40±0.02a | 1.35±0.05a | 0.21±0.02a | 197.20±1.10a |
| 第2代SCP | 4.01±0.02a | 0.37±0.08b | 5.83±0.76b | 0.39±0.04a | 1.23±0.03a | 0.20±0.01a | 201.74±1.99a |
| 第3代TCP | 4.03±0.07a | 0.27±0.03c | 3.27±0.40c | 0.28±0.02b | 1.34±0.15a | 0.21±0.01a | 202.64±1.90a |
| 注:同列数据后不同字母表示不同代数间差异显著(P<0.05)。Note:different letters in the same column indicate significant differences among different rotations (P<0.05). | |||||||
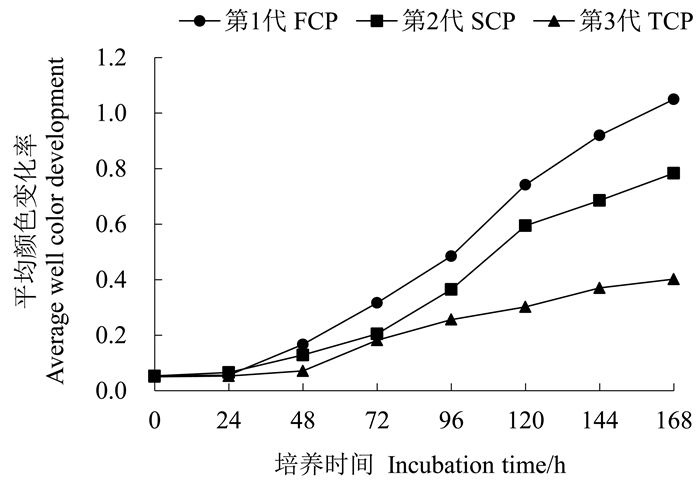
不同代数木麻黄土壤微生物群落平均颜色变化率见图 1。随培养时间的延长,土壤微生物对碳源的利用量随时间增加而增加,到168 h时基本趋于稳定。FCP土壤的AWCD最高,表明FCP根际微生物对碳源的利用能力显著高于SCP和TCP。TCP土壤的AWCD最低,表明连栽显著降低了根际微生物对碳源的利用率。
|
图 1 不同代数木麻黄根际微生物平均颜色变化率 Fig. 1 Average well color development of microbial communities in the rhizosphere of different rotation plantations of C.equisetifolia |
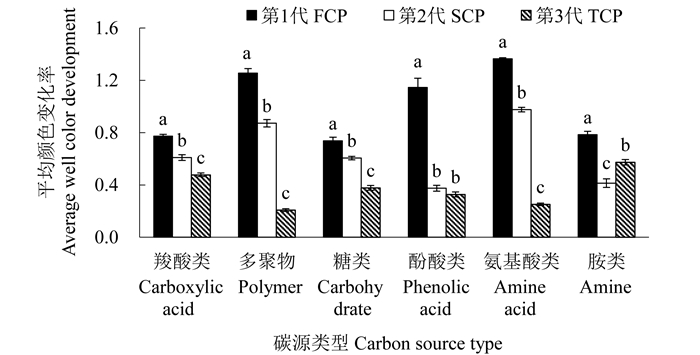
BIOLOG微平板的31种碳源可分成6大类,即羧酸类、多聚物、糖类、酚酸类、氨基酸类、胺类。通过分析不同代数木麻黄根际微生物对不同类型碳源利用情况(图 2)可知,根际微生物对不同碳源利用程度存在显著差异。除胺类呈现FCP>TCP>SCP趋势外,SCP和TCP根际微生物对其他5种碳源利用程度较FCP都呈现显著下降趋势。
|
注:不同字母表示不同代数间差异显著(P<0.05)。 Note:different letters indicate significant differences among different rotations (P < 0.05). 图 2 不同代数木麻黄根际微生物对不同类型碳源利用情况 Fig. 2 Utilization of different carbon source type by microbial community in the rhizosphere of different rotation plantations of C.equisetifolia |
PLFA分析共检测到11种标记性脂肪酸(表 2)。在FCP土壤中检测到11种PLFA,总含量为246.74±1.45 μg·g-1;SCP土壤检测到11种PLFA,总含量为241.85±0.08 μg·g-1;TCP土壤检测到10种PLFA,总含量为228.19±3.21 μg·g-1。从FCP至SCP磷脂脂肪酸生物标记总含量下降了2.99%,从SCP到TCP下降了6.65%,可见连栽导致木麻黄根际土壤微生物种类与含量逐代降低。从表 2可知,不同类型PLFA含量具有明显差异,但不同代数木麻黄根际土壤的PLFA种类差别不大。在3代不同的木麻黄根际土壤中,完全分布的PLFA生物标记有10种,包括18: 1ω9c、a15: 0、i16: 0、20: 0ω等。而16: 1ω9仅在FCP和SCP土壤中分布,属于不完全分布。
| 序号No. | 生物标记Biomarkers | 微生物类群Microbial group | 微生物含量Microbial content/(μg·g-1) | ||||
| 第1代FCP | 第2代SCP | 第3代TCP | |||||
| 1 | 18:1ω9c | 真菌Fungus | 17.66±0.29c | 27.89±0.52b | 44.39±0.82a | ||
| 2 | a15:0 | 革兰氏阳性菌G(+) | 30.95±0.33a | 23.51±0.40b | 15.91±0.76c | ||
| 3 | i16:1ω5c | 革兰氏阳性菌G(+) | 26.09±0.24a | 21.02±0.27b | 18.90±0.31c | ||
| 4 | i15:0ω | 革兰氏阳性菌G(+) | 18.31±0.19a | 13.60±0.19b | 11.87±0.39c | ||
| 5 | i16:0 | 革兰氏阳性菌G(+) | 44.24±1.58b | 54.92±0.73ab | 65.26±1.03a | ||
| 6 | 16:1ω7c | 革兰氏阴性菌G(-) | 13.13±0.15a | 8.31±0.06b | 6.53±0.07c | ||
| 7 | 20:0ω | 细菌Bacterium | 15.19±0.36a | 12.28±0.18b | 9.25±0.28c | ||
| 8 | 16:1ω9 | 革兰氏阴性菌G(-) | 24.65±0.86b | 27.25±0.83a | |||
| 9 | 15:0ω | 细菌Bacterium | 23.78±0.26a | 16.76±0.20b | 12.12±0.65c | ||
| 10 | 10Me17:0 | 放线菌Actinomycete | 20.63±0.26b | 21.23±0.56b | 23.87±0.57a | ||
| 11 | 10Me18:0 | 放线菌Actinomycete | 12.11±0.33c | 15.08±0.21b | 20.09±0.25a | ||
| 合计Total | 246.74±1.45a | 241.85±0.08b | 228.19±3.21c | ||||
| 注:同行数据后不同字母表示不同代数间差异显著(P<0.05)。Note:different letters in the same line indicate significant differences among different rotations (P<0.05). | |||||||
有表 2可知,FCP土壤中最多的脂肪酸是i16: 0,其含量为44.24±1.58 μg·g-1 (17.93%);在SCP和TCP土壤中,含量最多的脂肪酸同为i16: 0,其含量分别为54.92±0.73 μg·g-1 (22.71%)、65.26±1.03 μg·g-1 (28.60%),表明其在不同代数木麻黄根际土壤中起主要作用,在土壤中占绝对优势。i16: 0、a15: 0、i16: 1ω5c和16: 1ω9是FCP土壤中含量较多的4种PLFA,占总PLFA含量的51.04%;i16: 0、18: 1ω9c、16: 1ω9和a15: 0这4种脂肪酸在SCP土壤中含量较多,占总PLFA含量的55.23%;在TCP土壤中,i16: 0、18: 1ω9c、10Me17: 0和10Me18: 0这4种PLFA占总PLFA含量的67.32%。总体而言,不同代数土壤中含量较高的PLFA种类大致相同,以i16: 0、a15: 0和18: 1ω9c为主。
2.3.3 连栽木麻黄根际土壤特征微生物的磷脂脂肪酸分布由表 2可知,不同代数木麻黄根际特征微生物PLFA含量存在较大差异,呈现细菌>放线菌>真菌的规律。分别统计它们的PLFA总含量及其比值,结果如表 3所示。不同代际木麻黄根际土壤中,G (+)的PLFA总量均高于G (-)、真菌、放线菌。G (+)和G (-)之间、真菌和细菌之间标记性脂肪酸的含量存在较大差异,尤其是G (+)与G (-)之间比值较大。G (+)、G (-)在FCP土壤中含量最高,TCP土壤最低,大小排序FCP>SCP>TCP;真菌、放线菌在TCP土壤中含量最高,FCP土壤最低,大小排序TCP>SCP>FCP。G (+) /G (-)大小排序为TCP>SCP>FCP;真菌/细菌大小排序为TCP>SCP>FCP。
| 连栽代数Different rotations | PLFA含量Content of PLFA/(μg·g-1) | 比值Ratio | ||||||||
| 细菌Bacterium | 革兰氏阳性菌G(+) | 革兰氏阴性菌G(-) | 真菌Fungus | 放线菌Actinomycete | G(+)/G(-) | 真菌/细菌Fungus/Bacterium | ||||
| 第1代FCP | 193.31±9.80a | 119.59±1.64a | 37.78±1.01a | 17.66±0.29c | 32.74±0.53b | 3.16 | 0.09 | |||
| 第2代SCP | 184.09±1.44a | 113.05±1.05b | 35.57±0.81b | 27.89±0.52b | 36.31±0.43b | 3.17 | 0.15 | |||
| 第3代TCP | 139.85±2.39b | 111.94±1.50c | 6.53±0.07c | 44.39±0.82a | 43.95±0.34a | 17.14 | 0.31 | |||
| 注:同列数据后不同字母表示不同代数间差异显著(P<0.05)。Note:different letters in the same column indicate significant differences among different rotations (P<0.05). | ||||||||||
由表 4可知,FCP土壤的Simpson指数、Shannon指数、Brillouin指数和McIntosh指数均高于SCP、TCP,且FCP、SCP、TCP根际微生物群落的4项多样性指数的差异均达显著性水平,总体趋势是FCP>SCP>TCP,即连栽条件下木麻黄土壤微生物群落多样性逐年衰退。
| 连栽代数Different rotations | Simpson指数Simpson index | Shannon指数Shannon index | Brillouin指数Brillouin index | McIntosh指数McIntosh index |
| 第1代FCP | 0.899±0.001a | 3.356±0.005a | 3.227±0.003a | 0.722±0.002a |
| 第2代SCP | 0.886±0.001b | 3.277±0.003b | 3.142±0.002b | 0.702±0.001b |
| 第3代TCP | 0.733±0.000c | 2.972±0.002c | 2.852±0.007c | 0.645±0.001c |
| 注:同列数据后不同字母表示不同代数间差异显著(P<0.05)。Note:different letters in the same column indicate significant differences among different rotations (P<0.05). | ||||
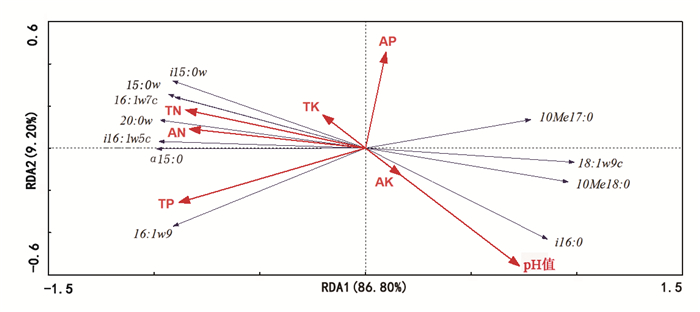
冗余度(RDA)分析用于解释不同变量对土壤微生物群落多样性的影响。图 3可以看出,第一、第二、第三和第四轴的特征值分别为0.868、0.092、0.016和0.002。第一个RDA轴解释了物种数据中的大部分方差,物种-环境相关值为0.998。RDA结果表明,不同代数微生物的含量受总氮(TN),速效氮(AN),总磷(TP)和土壤酸碱度(pH值)的显著影响。
|
图 3 土壤微生物与土壤理化性质冗余度分析 Fig. 3 Redundancy analysis of the soil microorganism and soil physic-chemical properties |
土壤微生物对森林生态系统的物质循环和能量流动具有重要影响。本研究结果表明,在连续多代种植后,木麻黄根际微生物群落结构及其功能多样性发生退化。BIOLOG微平板技术结果表明,不同代数的土壤微生物对各类碳源的利用程度存在显著差异,连栽后木麻黄根际土壤微生物群落对碳源利用能力显著下降,均呈现FCP>SCP>TCP趋势。根系分泌物是植物与根际微生物相互作用的媒介,也是微生物重要的营养来源,直接或间接影响着根际微生物的代谢和生长发育,进而对根际微生物的种类和分布产生影响[15]。本研究中木麻黄连栽后对各类碳源利用率均有所下降,其原因还有待探究,将在后续的研究中进一步探索。磷脂是所有生物活细胞重要的膜组分,根据磷脂脂肪酸的种类和比例可以鉴别土壤微生物群落结构和功能的多样性[16-17]。木麻黄人工林连栽导致土壤微生物群落多样性下降,土壤微生物群落结构发生巨大改变。PLFA生物标记的总含量在FCP中最高,其次是SCP,TCP中最低。除此之外,木麻黄人工林连栽后土壤微生物群落结构也发生了变化。真菌/细菌比值通常受土壤养分含量影响,当土壤养分降低时,更能适应恶劣环境的真菌能够较好的生存,而细菌含量则会降低。
木麻黄根际土壤微生物与土壤理化性质冗余分析表明,不同代数根际土壤微生物的含量受到总氮、速效氮、总磷和土壤pH值的显著影响,这和钟文辉等[18]提出的观点一致。前人研究发现氮、磷等元素的供应与转换影响着土壤微生物群落结构的变化[19-20];与此同时,土壤微生物结构对氮、磷等元素的代谢循环也起着关键作用,进而间接影响植物的生长发育进程[21-23]。由此推测,木麻黄连栽后其氮、磷等元素含量的变化在一定程度上影响了根际土壤微生物群落结构,微生物群落结构失衡造成木麻黄连栽障碍。此外,RDA分析表明速效磷和全钾与根际微生物含量无显著相关性,可见土壤理化性质虽是构成植物根际微生物群落多样性的关键因素,但并不是唯一因素。土壤理化性质对根际微生物群落结构有选择塑造作用,根际不同微生物群落结构对土壤养分的需求具有独特性;反之,根际微生物群落多样性对土壤营养循环也有反作用,进而间接影响植物生长发育过程。但是本研究仍存在一些不足之处,如微生物群落变化受何种根系分泌物影响、根系分泌物如何介导微生物群落结构变化等问题尚不明确,需进一步研究。
木麻黄连栽障碍给我国沿海防护林造成巨大的经济损失,但如何有效克服至今仍是一个悬而未决的难题。在木麻黄连栽障碍成因及作用机理尚未明确的情况下,前人研究多集中于土壤养分衰竭和木麻黄化感自毒作用方面的研究。然而,土壤养分衰竭和化感自毒物质都只是诱因,都需要通过土壤微生物转化、加工,间接影响受体植物的生长发育,导致植物发生连栽障碍[24]。本研究从植物-土壤-微生物互作角度作为切入点,深入揭示木麻黄连栽障碍形成过程中对根际土壤微生物群落结构和功能特征变化的影响,阐明连栽木麻黄根际微生态退化规律,不仅对于破解木麻黄连栽障碍有重要理论意义,而且对林业生产和经营管理也有重要的应用前景。
| [1] |
李慧敏, 曹婷婷, 顾美子, 等. 不同林龄木麻黄林地特有细菌代谢产物及其化感潜力[J]. 应用与环境生物学报, 2016, 22(5): 808-814. |
| [2] |
WARDLE D A, BARDGETT R D, KLIRONOMOS J N, et al. Ecological linkages between aboveground and belowground biota[J]. Science, 2004, 304(5677): 1629-1633. DOI:10.1126/science.1094875 |
| [3] |
叶功富, 徐俊森, 林武星, 等. 木麻黄连栽林地土壤肥力动态与地力维持[J]. 防护林科技, 1996(S1): 49-53. |
| [4] |
林武星. 自身他感作用物对木麻黄幼苗叶绿素及糖类的影响[J]. 浙江农林大学学报, 2007, 24(1): 12-16. DOI:10.3969/j.issn.2095-0756.2007.01.003 |
| [5] |
林武星. 木麻黄自毒作用物对其幼苗内源激素的影响[J]. 中国农学通报, 2009, 25(19): 100-103. |
| [6] |
李键, 刘奕, 洪涛, 等. 2种化感成分对木麻黄幼苗小枝活性氧含量和保护酶活性的影响[J]. 植物资源与环境学报, 2013, 22(2): 30-38. DOI:10.3969/j.issn.1674-7895.2013.02.04 |
| [7] |
PATERSON E, GEBBING T, ABEL C, et al. Rhizodeposition shapes rhizosphere microbial community structure in organic soil[J]. New Phytologist, 2007, 173(3): 600-610. DOI:10.1111/j.1469-8137.2006.01931.x |
| [8] |
INDERJIT, BAJPAI D, RAJESWARI M S. Interaction of 8-Hydroxyquinoline with soil environment mediates its ecological function[J]. Plos One, 2010, 5(9): 12852. DOI:10.1371/journal.pone.0012852 |
| [9] |
BADRI D V, WEIR T L, LELIE VAN DE D, et al. Rhizosphere chemical dialogues:plant-microbe interactions[J]. Current Opinionin Biotechnology, 2009, 20(6): 642-650. DOI:10.1016/j.copbio.2009.09.014 |
| [10] |
吴则焰, 林文雄, 陈志芳, 等. 武夷山国家自然保护区不同植被类型土壤微生物群落特征[J]. 应用生态学报, 2013, 24(8): 2301-2309. |
| [11] |
吴则焰, 林文雄, 陈志芳, 等. 武夷山不同海拔植被带土壤微生物PLFA分析[J]. 林业科学, 2014, 50(7): 105-112. |
| [12] |
FROSTEGARD A, TUNLID A, BAATH E. Phospholipid fatty acid composition, biomass and activity of microbial communities from two soil types experimentally exposed to different heavy metals[J]. Applied and Environmental Microbiology, 1993, 59(11): 3605-3617. DOI:10.1128/AEM.59.11.3605-3617.1993 |
| [13] |
KIEFT T L, RINGELBERG D B, WHITE D C. Changes in ester-linked phospholipid fatty acid profiles of subsurface bacteria during starvation and desiccation in a porous medium[J]. Applied and Environmental Microbiology, 1994, 60(9): 3292-3299. DOI:10.1128/AEM.60.9.3292-3299.1994 |
| [14] |
郑洁, 刘金福, 吴则焰, 等. 闽江河口红树林土壤微生物群落对互花米草入侵的响应[J]. 生态学报, 2017, 37(21): 7293-7303. |
| [15] |
曾令杰, 林茂兹, 李振方, 等. 连作对太子参光合作用及药用品质的影响[J]. 作物学报, 2012, 38(8): 1522-1528. DOI:10.3969/j.issn.1000-2561.2012.08.036 |
| [16] |
KOURTEV P S, EHRENFELD J G, HGGBLOM M. Exotic plant species alter the microbial community structure and function in the soil[J]. Ecology, 2002, 83(11): 3152-3166. DOI:10.1890/0012-9658(2002)083[3152:EPSATM]2.0.CO;2 |
| [17] |
张重义, 李明杰, 陈建新, 等. 地黄连作障碍机制的研究进展与消减策略[J]. 中国现代中药, 2013, 15(1): 38-44. DOI:10.3969/j.issn.1673-4890.2013.01.009 |
| [18] |
钟文辉, 蔡祖聪. 土壤管理措施及环境因素对土壤微生物多样性影响研究进展[J]. 生物多样性, 2004, 12(4): 456-465. DOI:10.3321/j.issn:1005-0094.2004.04.010 |
| [19] |
南雄雄, 田霄鸿, 张琳, 等. 小麦和玉米秸秆腐解特点及对土壤中碳、氮含量的影响[J]. 植物营养与肥料学报, 2010, 16(3): 626-633. |
| [20] |
赵紫檀, 郑洁, 吴则焰, 等. 互花米草入侵下红树林土壤微生物群落特征[J]. 森林与环境学报, 2017, 37(2): 169-173. |
| [21] |
刘志刚, 朱晨曦, 陈敏健, 等. 施用生物炭对杉木人工林土壤碳氮的影响[J]. 森林与环境学报, 2018, 38(4): 393-399. |
| [22] |
王珍, 曹光球, 张月全, 等. 凋落物配比对杉木土壤微生物碳代谢多样性的影响[J]. 森林与环境学报, 2017, 37(2): 148-154. |
| [23] |
林宝平, 林思祖, 何宗明, 等. 不同碳输入方式对沿海防护林土壤氮库的影响[J]. 森林与环境学报, 2016, 36(4): 385-391. |
| [24] |
HARLEEN K, RAJWANT K, SURINDER K, et al. Taking ecological function seriously:soil microbial communities can obviate allelopathic effects of released metabolites[J]. PLOS ONE, 2018, 4(3): 4700. |

 2020, Vol. 40
2020, Vol. 40


