文章信息
- 刘莉娜, 张卫强, 黄芳芳, 甘先华, 唐成波, 丘鹏基
- LIU Lina, ZHANG Weiqiang, HUANG Fangfang, GAN Xianhua, TANG Chengbo, QIU Pengji
- 盐胁迫对银叶树幼苗光合特性与叶绿素荧光参数的影响
- Effects of NaCl stress on the photosynthesis and cholorophyll fluorescence of Heritiera littoralis seedlings
- 森林与环境学报,2019, 39(6): 601-607.
- Journal of Forest and Environment,2019, 39(6): 601-607.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.06.006
-
文章历史
- 收稿日期: 2019-07-11
- 修回日期: 2019-08-13
2. 广东省森林培育与保护利用重点实验室, 广东 广州 510520;
3. 广东省林业科学研究院, 广东 广州 510520
2. Guangdong Provincial Key Laboratory of Silviculture, Protection and Utilization, Guangzhou, Guangdong 510520, China;
3. Guangdong Academy of Forestry, Guangzhou, Guangdong 510520, China
银叶树(Heritiera littoralis Dryand.)隶属于梧桐科银叶树属, 是热带、亚热带海岸红树林植物, 生长于潮间带与陆地, 不具有胎萌、气生根及耐高渗透压等特征[1], 学者们多将其归为半红树植物[2]。深圳市盐灶银叶树种群分布较集中, 是中国最古老的银叶树种群, 已表现出濒危或易危的特征, 尤其是滨海沼泽生境银叶树群落呈现为逐渐衰退的趋势[3-4]。目前, 银叶树研究主要集中在生物学特性、群落分布、群落结构与多样性、遗传多样性等[3-6]方面, 而银叶树幼苗耐盐性研究较少[7]。
盐胁迫是一种主要的非生物胁迫, 是限制植物生长和农业生产的主要因素之一。土壤的盐渍化会引起许多生态问题, 诸如水土流失、植被减少和生物多样性降低等问题[8]。盐分胁迫会诱导植物体内某些结构和功能发生变化, 进而影响植物的光合生理特性, 维持光合作用的能力是判断植物是否耐盐的重要指标之一[9]。叶绿素荧光参数作为联系光合作用和环境关系的内在指标, 被广泛应用在植物抗逆性研究中[10]。目前, 盐胁迫对不同植物光合生理的研究主要集中在农作物和草本植物上[11-12], 对沿海植物研究较少, 针对盐分胁迫对植物光系统和光化学效率的影响分析也有不同的结论[13-14]。本研究以银叶树实生苗为研究对象, 通过测定不同浓度盐处理下银叶树叶片叶绿素含量、叶片光合特性、叶绿素荧光动力学参数, 揭示银叶树在盐逆境胁迫下其光合生理变化规律, 以期为广东沿海适宜盐分区域银叶树栽培提供科学依据。
1 材料与方法 1.1 研究区概况试验地设在广东省林业科学研究院苗圃内, 其海拔25 m, 为典型亚热带季风气候, 年平均温度23 ℃, 最低月平均气温13.3 ℃(1月), 最高月平均气温38.1 ℃(8月), 年降水量1 638 mm, 4—9月的降水量占全年的80%, 年平均相对湿度79%。
1.2 试验设计2018年9月, 选取120株长势良好且一致的1年生实生苗移栽于上口径16 cm、下口径11.5 cm、高13.5 cm的容器, 单株定植, 栽培基质(黄心土与泥炭土, 配置比例为5:1)一致, 基质土壤pH值为5.9, 有机质含量为30.55 mg·g-1, 全氮、全磷及全钾含量分别为1.26、0.28及8.81 mg·g-1。容器苗置于连栋大棚内(大棚四周距地面留有1 m宽的通风口), 进行常规栽培管理, 水肥管理一致。2019年3月1日, 选择长势一致、无病虫害的健康植株进行盐处理, 实生苗平均树高28.5 cm, 平均地径0.68 cm。盐分处理总共为4个处理, 为不施盐组和每周施盐1次、2次及3次, 每次100 mL 2.5%盐水, 每个处理设置30株, 连续施盐60 d。施盐期间苗木正常浇水, 施盐结束一周后进行土壤盐分含量测定, 不同处理土壤含盐量分别为0(CK)、1.2%(N1)、1.5%(N2)和1.8%(N3)。
1.3 光合参数测定试验于2019年5月初进行, 每处理挑选4盆长势一致的植株, 每株上选取2片长势一致的叶片。采用LI-COR公司生产的LI-6800型便携式光合测定仪测定叶片净光合速率等光合参数。使用开放气路, 空气流速为0.5 L·min-1。光辐射强度为1 000 μmol·m-2·s-1。测定前叶片在1 000 μmol·m-2·s-1光强下诱导30 min, 采用CO2注入系统控制叶室CO2浓度, 维持在400 μmol·mol-1左右。观测时间均为上午9:00—11:00, 每叶片重复3次, 连续测定3 d。测定参数包括单叶净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等参数。计算得到水分利用效率(water use efficiency, WUE)=Pn/Tr。
1.4 叶绿素荧光参数测定在测定光合参数的同时, 利用LI-6800型便携式光合测定仪对叶片荧光动力学参数进行测定。测定前采用铝箔纸包裹叶片暗适应, 先测定初始荧光(Fo)、最大荧光(Fm)、光能转换效率(Fv/Fo), 最大PSⅡ的光能转换效率(Fv/Fm), 然后打开活化光(1 800 μmol·m-2·s-1)测定光适应下初始荧光(Fo′)、光适应下最大荧光(Fm′)、光适应下稳态荧光(FS)、光适应下最大可变荧光(Fv′), 并计算光化学淬灭(qP)、非光化学淬灭系数(qN)、非光化学猝灭(non-photochemical quenching, NPQ)和表观量子传递速率(electron transport rate, ETR)等参数。测定时间均为上午9:00—11:00和下午14:00—16:00, 每叶片重复3次, 连续测定3 d。吸收光能用于天线热耗散(D)/%=(1-Fv′/Fm′)×100, 光化学耗散(P)/%=qPFv′/Fm′×100, PSⅡ反应中心非光化学能量耗散(E)/%=Fv′(1-qP)/Fm′×100[15]。
1.5 叶绿素含量测定施盐结束后, 随机选取对照与不同处理的银叶树各6株, 摘取新鲜叶片, 擦拭干净, 去主脉, 剪碎混匀。称取0.2 g, 每处理3次重复, 以95%丙酮研磨、提取、过滤, 定容至25 mL, 采用分光光度计测定提取液的吸收光谱, 然后读出各提取液分别在664、647、466 nm处的吸光度。计算每克叶片的叶绿素a(Chl a)、叶绿素b(Chl b)、叶绿素[Chl (a+b))]含量和叶绿素a/叶绿素b(Chl a/Chl b)比值[16]。
1.6 数据分析与统计方法利用Microsoft Excel 2016整理原始数据, 采用SPSS16.0统计软件进行方差分析, 用Duncan法对各参数进行显著性检验。
2 结果与分析 2.1 盐胁迫对银叶树叶绿素的影响随着土壤盐含量的增加, 银叶树幼苗叶片叶绿素含量呈现出先升高后降低的趋势(表 1)。与对照相比, 土壤盐含量为1.2%时, Chl a、Chl b、Chl (a+b)含量分别升高了13.9%、12.5%和13.6%, 叶绿素a/叶绿素b仅增加1.6%;当盐浓度由1.2%升高到1.8%, Chl a、Chl b、Chl(a+b)和Chl a/Chl b逐渐降低, 与对照相比, 分别下降22.1%、10.0%、19.1%和11.8%。不同处理间Chl b和Chl a/Chl b差异不显著(P>0.05), 而1.8%盐浓度下叶Chl a和Chl(a+b)显著低于对照(P<0.05)。
| 处理 Treatment |
叶绿素a含量 Chl a content/(mg·g-1) |
叶绿素b含量 Chl b content/(mg·g-1) |
叶绿素(a+b)含量 Chl(a+b) content/(mg·g-1) |
叶绿素a/叶绿素b Chl a/Chl b |
| CK | 1.22±0.04bc | 0.40±0.01a | 1.62±0.04bc | 3.05±0.13a |
| N1 | 1.39±0.05c | 0.45±0.02a | 1.84±0.07c | 3.10±0.07a |
| N2 | 1.08±0.10ab | 0.36±0.04a | 1.44±0.14ab | 3.09±0.21a |
| N3 | 0.95±0.06a | 0.36±0.05a | 1.31±0.10a | 2.69±0.20a |
| 注:同列数据后不同小写字母表示差异显著, P<0.05。Note: different small letters in the same column indicate significant difference, P<0.05. | ||||
随着盐胁迫浓度升高, 银叶树叶片净光合速率(Pn)、蒸腾速率(Tr)及气孔导度(Gs)呈逐渐下降的趋势, 水分利用效率(WUE)呈先升后降的趋势, 胞间CO2浓度(Ci)呈先下降后升高的趋势(表 2)。与对照相比, Pn在不同盐胁迫处理下分别下降了28.6%、42.2%和56.4%;Gs分别下降了33.6%、54.2%和57.0%;Tr分别下降了36.7%、54.9%和60.5%;胞间CO2浓度(Ci)分别下降了7.0%、19.7%和3.4%;盐胁迫一定程度提升了WUE, 但不同处理间WUE差异不显著(P>0.05)。CK组Pn、Tr与Gs显著高于盐处理(P<0.05)。
| 处理 Treatment |
净光合速率 Pn/(μmol·m-2·s-1) |
蒸腾速率 Tr/(mmol·m-2·s-1) |
水分利用效率 WUE/(μmol·mmol-1) |
气孔导度 Gs/(mol·m-2·s-1 |
胞间CO2浓度 Ci/(μmol·mol-1) |
| CK | 10.77±0.48c | 3.19±0.21d | 3.56±0.29a | 0.107±0.006c | 224.41±5.51b |
| N1 | 7.69±0.94b | 2.02±0.25c | 3.86±0.23a | 0.071±0.009b | 208.77±7.45ab |
| N2 | 6.23±0.51ab | 1.44±0.12b | 4.45±0.27a | 0.049±0.004a | 180.28±6.27a |
| N3 | 4.70±0.79a | 1.26±0.13a | 3.58±0.47a | 0.046±0.005a | 216.85±17.38b |
| 注:同列数据后不同小写字母表示差异显著, P<0.05。Note: different small letters in the same column indicate significant difference, P<0.05. | |||||
从表 3可知, 不同处理间银叶树Fo、Fm、Fv及Fv/Fo差异不显著(P>0.05), 与CK相比, Fo、Fm及Fv在盐胁迫下均有不同程度的降低, 其中, 降幅最大的为N1处理。Fv/Fo表示PSⅡ的潜在活性, 可以反映PSⅡ最大量子效率[17], 与对照相比, 不同盐处理下Fv/Fo值均不同程度的升高, 其增幅分别为10.8%(N1)、5.4%(N2)和9.6%(N3)。
| 处理 Treatment |
初始荧光 Fo |
最大荧光 Fm |
可变荧光 Fv |
光能转换效率 Fv/Fo |
| CK | 1 050.08±14.74a | 5 513.11±92.93a | 4 463.03±78.27a | 4.25±0.02a |
| N1 | 897.10±53.65a | 5 105.62±229.28a | 4 208.52±178.18a | 4.71±0.12a |
| N2 | 959.74±82.14a | 5 198.88±246.88a | 4 239.15±203.34a | 4.48±0.32a |
| N3 | 916.82±23.95a | 5 174.16±85.50a | 4 257.35±101.57a | 4.66±0.22a |
| 注:同列数据后不同小写字母表示差异显著, P<0.05。Note: different small letters in the same column indicate significant difference, P<0.05. | ||||
Fv/Fm为PSⅡ最大原初光化学量子效率, 是光化学反应的重要参数, 高等植物在正常环境中Fv/Fm值一般在0.80~0.84[10];Fv′/Fm′是PSⅡ反应中心有效光化学量子产量, 反映开放的PSⅡ反应中心原初光能捕获转化效率[17]。从图 1可知, 不同处理下银叶树Fv/Fm值介于0.81~0.83之间, 随着盐浓度的增加, Fv/Fm呈不同程度的上升, 但不同处理间银叶树Fv/Fm值差异不显著(P>0.05), 这表明银叶树幼苗叶片PSⅡ反应中心并没有受到盐胁迫伤害, Fv′/Fm′随盐浓度增加呈现出先升后降的趋势, 1.8%盐浓度下Fv′/Fm′值显著低于其它处理(P<0.05), 表明1.8%盐浓度胁迫对PSⅡ反应中心有效光化学量子产量影响显著。
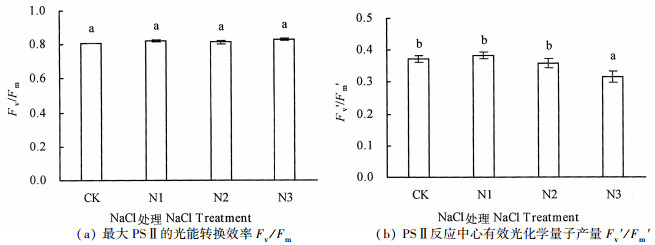
|
注:不同字母标记表示不同处理差异显著, P<0.05。 Note: different letters indicate significant differences among treatments, P < 0.05. 图 1 盐胁迫对银叶树Fv/Fm与Fv′/Fm′的影响 Fig. 1 Effects of NaCl stress on Fv/Fm and Fv′/Fm′ of H. littoralis |
ΦPSⅡ反映植物叶片在光下用于电子传递的能量占吸收光能的比例, 其值越大说明电子传递活性与传递速率越大。ETR是光合机构吸收光能发生电荷分离产生电子并沿电子传递链向下传递的速率, 反映实际光强条件下的表观电子传递效率[18]。从图 2可知, 在不同处理下, PSⅡ实际光合效率(ΦPSⅡ)与表观光合量子传递效率(ETR)变化趋势基本一致, 随着盐浓度的增加ΦPSⅡ和ETR均呈下降的趋势, 与对照相比, 不同盐浓度处理ΦPSⅡ与ETR下降幅度均为7.5%(N1)、27.0%(N2)及44.5%(N3), ΦPSⅡ和ETR降幅一致, 银叶树在N1处理下ΦPSⅡ处于较高水平, 有利于更多光能参与光化学反应。同样, 在N1处理下ETR处于较高水平, 表明在1.2%盐浓度胁迫下, 银叶树PSⅡ反应中心能保持较高活性。CK、N1及N2处理间ΦPSⅡ、ETR差异不显著(P>0.05), 而CK与N1处理ΦPSⅡ、ETR显著高于N3处理(P<0.05)。研究表明, N3处理显著降低了PSⅡ反应中心电子传递活性及传递速率。
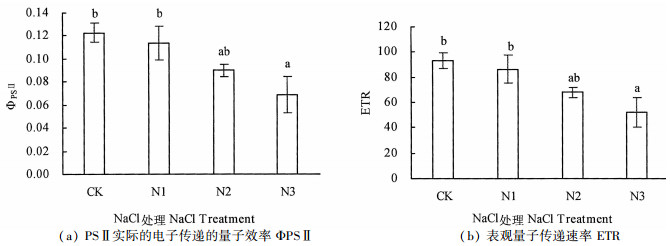
|
注:不同字母标记表示不同处理差异显著, P<0.05。 Note: different letters indicate significant difference among treatments, P < 0.05. 图 2 盐胁迫对银叶树ΦPSⅡ和ETR的影响 Fig. 2 Effects of NaCl stress on ΦPSⅡ and ETR of H. littoralis |
光化学猝灭系数(qP)反映了PSⅡ天线色素吸收的光能用于光化学电子传递的份额, 也在一定程度上反映了PSⅡ反应中心的开放程度, qP越大, 表明PSⅡ的电子传递活性越大[19]。从图 3可知, 随着盐浓度的增加qP呈下降的趋势, 而qN呈先降后升的趋势;与对照相比, qP下降幅度分别为11.4 %(N1)、25.0%(N2)及36.4%(N3), 表明PSⅡ的电子传递活性随着盐胁迫的增加呈下降趋势, CK处理下银叶树qP显著高于N3处理(P<0.05), 而与N1和N2处理间差异不显著(P>0.05), 表明在N1和N2处理对银叶树PSⅡ的电子传递活性影响不明显, 而N3处理对PSⅡ的电子传递活性减弱影响明显。非光化学淬灭系数(qN)反映的是天线色素吸收的光能不能用于电子传递而以热的形式耗散掉的部分光能, 是植物保护PSⅡ的重要机制。不同处理间银叶树qN值差异不显著(P>0.05), 其值随着盐胁迫的增加呈微弱上升, 表明在较高盐浓度下银叶树通过增加热耗散来保护PSⅡ反应中心免受伤害的作用不明显。非光化学淬灭(NPQ)是PSⅡ天线色素吸收的不能用于光合电子传递而以热能的形式耗散掉的光能部分, 反映光系统对过剩光能的耗散能力[17]。从图 3可知, 银叶树NPQ随盐胁迫的增加均有不同程度的降低, 但不同处理间银叶树NPQ差异不显著(P>0.05), 与对照相比, 不同盐处理下降幅度介于0.78%~3.81%之间, 表明银叶树幼苗叶片PSⅡ过剩光能通过非光化学途径以热的形式耗散的比例降低, 可能存在过剩光能对其光系统的破坏的风险。
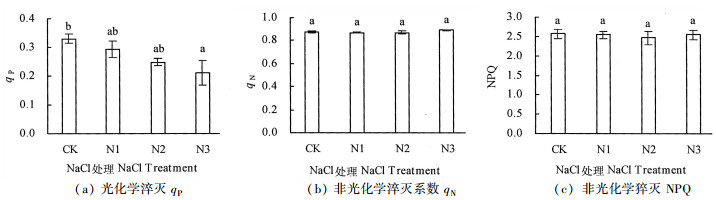
|
注:不同字母标记表示不同处理差异显著, P<0.05。 Note: different letters indicate significant differences among treatments, P < 0.05. 图 3 盐胁迫对银叶树qP、qN及NPQ的影响 Fig. 3 Effects of NaCl stress on qP, qN and NPQ of H. littoralis |
植物叶片吸收的光能可分为天线热耗散的能量(D)、光化学反应耗散的能量(P)及反应中心有非光化学反应耗散的能量(E)[20]。分析吸收光能的分配将有利于了解植物叶片对吸收光能的分配策略[21]。从表 4可知, 光化学反应耗散表现为:CK>N1>N2>N3, CK处理光化学反应耗散显著高于N3处理(P<0.05), 表明CK处理银叶树叶片将吸收的光能较多的分配于光化学反应部分, 光化学反应能量利用率最大, 而N3处理叶片吸收的光能用于参与光化学反应耗散的份额为最低。天线热耗散表现为:N3>N2>CK>N1, N3处理天线热耗散值显著高于其它处理(P<0.05), 说明叶片此时具有较高的可调控生理代谢, 能够将过剩的光能较多地分配给热耗散, 用于光化学反应耗散降低。非光化学反应耗散随着盐浓度的增加表现出先升后降趋势, 不同处理间差异不显著(P>0.05)。研究表明, 在CK处理下, 银叶树幼苗叶片吸收的能量约63%用于热耗散, 约25%用于非光化学反应, 有12%的能量用于光化学反应, 银叶树主要光保护机制为PSⅡ天线色素吸收光能通过热的形式耗散, 以此削弱反应中心过量的激发能。
| 处理 Treatment |
天线热耗散 Fraction of photons dissipated in the antenna/% |
光化学反应耗散 Fraction of photons utilized in PSⅡ photochemistry/% |
非光化学反应耗散 Fraction of absorbed photons by PSⅡneither used in photochemistry nordissipated in the PSⅡ/% |
| CK | 62.55±0.85a | 12.33±0.83b | 25.12±0.35a |
| N1 | 61.64±1.04a | 11.38±1.46b | 26.98±0.55a |
| N2 | 63.95±1.44a | 8.95±0.53ab | 27.10±1.17a |
| N3 | 68.47±1.81b | 6.83±1.57a | 24.70±0.67a |
| 注:不同字母标记表示不同处理差异显著, P<0.05。Note: different letters indicate significant differences among treatments, P<0.05. | |||
叶绿素作为光合色素中重要的色素分子, 能够摄取外界光源保证植物叶片顺利进行光合作用, 并参与光合作用中光能的吸收、传递和转化[17]。本实验结果显示, 银叶树幼苗叶片Chl a、Chl b、Chl(a+b)及Chl a/Chl b随着盐胁迫的增加呈先升后降的趋势, 这与乌凤章[22]实验中发现盐胁迫下高丛越橘幼苗叶绿素变化趋势一致。在盐浓度为1.8%时达到最低值, 这可能是较高浓度盐胁迫下植物体内活性氧大量产生, 破坏了叶绿体的结构, 使叶绿素的合成缓慢导致叶绿素含量降低[23], 盐分胁迫致使叶绿素水解酶活性增大, 叶绿素合成减少, 分解增加, 从而影响光能吸收、转化, 导致光合速率下降[24-25]。
3.2 盐胁迫对光合参数的影响随着盐胁迫增加, 银叶树叶片的净光合速率(Pn)、蒸腾速率(Tr)及气孔导度(Gs)呈逐渐下降的趋势, Gs的变化规律与Pn、Tr相似, 表明在盐胁迫下, Pn与Tr的胁迫效应很大程度上来源于气孔因素抑制;而胞间CO2浓度(Ci)表现出先下降后升高的趋势, 这主要由于盐胁迫使银叶树叶片气孔导度下降, 轻度盐胁迫下光合速率的下降主要是受气孔关闭的制约, 而盐胁迫加重时叶肉细胞中CO2浓度升高的情况下, 净光合速率仍下降, 此时非气孔限制是影响银叶树净光合速率下降的主要因子, 可能是由于Na+和Cl-的大量积累对光合酶活性产生了直接的毒害作用[26]。
3.3 盐胁迫对叶绿素荧光参数的影响Fo(初始荧光)与Fm(最大荧光)分别指光系统PSⅡ反应中心处于完全开放和完全关闭时的荧光产量[17, 27];可变荧光(Fv)为Fm与Fo的差值, 代表原初电子受体(QA)的还原状态[28]。叶绿素荧光与光合作用效率密切相关, 环境因素对光合作用的影响可以通过叶绿素荧光反映出来[29]。Fv/Fm是PSⅡ最大光化学量子产量, 反映PSⅡ反应中心最大PSⅡ的光能转换效率[30]。正常情况下, 没有遭受环境胁迫并经过充分暗适应的植物叶片Fv/Fm是比较恒定的, 一般为0.80~0.85[31], 当Fv/Fm值低于0.8时, 外界胁迫可能对PSⅡ反应中心造成一定损伤[32], 研究发现, 不同处理下银叶树Fv/Fm介于0.81~0.83之间, 其Fv/Fm值均高于0.8, 表明不同盐浓度(1.2%、1.5%和1.8%)胁迫没有对银叶树PSⅡ反应中心造成损伤, 其潜在活性和原初光能转换效率并没有减弱, 银叶树发生光抑制作用不明显, 表明银叶树作为半红树具有一定的耐盐性。不同盐胁迫下ΦPSⅡ、ETR、qP变化趋势一致, 随盐胁迫增加均呈下降的趋势, 其中1.8%盐浓度处理下降幅度最大, 表明盐胁迫显著降低了银叶树幼苗叶片银叶树幼苗叶片光合电子传递活性、电子传递效率及吸收的光能转换的能力。与对照相比, 银叶树NPQ呈下降趋势, 但不同盐浓度处理间差异不显著(P>0.05), 可能是盐胁迫抑制叶黄素循环的关键酶活性, 影响了叶黄素循环, 削弱了PSⅡ天线热耗散的保护能力[33-34]。在盐胁迫下, 银叶树叶片吸收的能量约64.7%用于热耗散, 约26.3%用于非光化学反应, 仅有9.1%的能量用于光化学反应, 表明在盐胁迫逆境中, 银叶树光保护机制为PSⅡ天线色素吸收光能通过热的形式耗散。
综上所述, 叶绿素含量、光合参数及叶绿素荧光特征可作为快速准确的判断银叶树幼苗的耐盐程度的重要指标。盐胁迫降低了银叶树净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs), 轻度盐分胁迫下净光合速率的下降主要是受气孔关闭的制约, 而胁迫增加时, 非气孔限制是影响银叶树净光合速率下降的主要因子;盐胁迫降低了银叶树幼苗叶片实际光量子效率与表观光合电子传递速率, 导致银叶树光化学效率与表观净光合速率降低;在盐胁迫下, 银叶树启动光保护机制, 以热耗散途径为主的PSⅡ调节性能量耗散, 以保护光合机构免受伤害;不同盐浓度(1.2%、1.5%和1.8%)胁迫下Fv/Fm值均高于0.8, 表明盐胁迫没有对银叶树PSⅡ反应中心造成损伤, 说明银叶树作为半红树具较强的耐盐性能。
| [1] |
曾聪, 范航清. 红树植物银叶树果实和种子的形态结构研究[J]. 广西科学, 2006, 13(2): 147-150. DOI:10.3969/j.issn.1005-9164.2006.02.019 |
| [2] |
王伯荪, 廖宝文, 王勇军, 等. 深圳湾红树林生态系统及其持续发展[M]. 北京: 科学出版社, 2002: 253-297.
|
| [3] |
简曙光, 韦强, 唐恬, 等. 深圳盐灶银叶树种群的生物学特性研究[J]. 华南农业大学学报, 2005, 26(4): 84-87, 91. DOI:10.3969/j.issn.1001-411X.2005.04.021 |
| [4] |
陈晓霞, 李瑜, 茹正忠, 等. 深圳坝光银叶树群落结构与多样性[J]. 生态学杂志, 2015, 34(6): 1487-1498. |
| [5] |
简曙光, 唐恬, 张志红, 等. 中国银叶树种群及其受威胁原因[J]. 中山大学学报(自然科学版), 2004, 43(S1): 91-96. |
| [6] |
JIAN S G, SHI S H, ZHONG Y, et al. Genetic diversity among south China Heritiera littoralis detected by inter-simple sequence repeats (ISSR) analysis[J]. Journal of Genetics and Molecular Biology, 2002, 13(4): 272-276. |
| [7] |
王秀丽.广东银叶树种源幼苗生长差异及耐盐机理研究[D].湛江: 广东海洋大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10566-1014361264.htm
|
| [8] |
孙玉芳, 宋福强, 常伟, 等. 盐碱胁迫下AM真菌对沙枣苗木生长和生理的影响[J]. 林业科学, 2016, 52(6): 18-27. |
| [9] |
BRUGNOLI E, LAUTERI M. Effects of salinity on stomatal conductance, photosynthetic capacity, and carbon isotope discrimination of salt-tolerant (Gossypium hirsutum L.) and salt-sensitive (Phaseolus vulgaris L.) C3 non-halophytes[J]. Plant Physiology, 1991, 95(2): 628-635. DOI:10.1104/pp.95.2.628 |
| [10] |
张国盛, 郝蕾, 闫子娟, 等. 6种树种叶片叶绿素荧光动力学参数对土壤水分变化的响应[J]. 生态学杂志, 2017, 36(11): 3079-3085. |
| [11] |
孙景宽, 陆兆华, 夏江宝, 等. 盐胁迫对二色补血草光合生理生态特性的影响[J]. 西北植物学报, 2013, 33(5): 992-997. DOI:10.3969/j.issn.1000-4025.2013.05.019 |
| [12] |
孙璐, 周宇飞, 李丰先, 等. 盐胁迫对高粱幼苗光合作用和荧光特性的影响[J]. 中国农业科学, 2012, 45(16): 3265-3272. DOI:10.3864/j.issn.0578-1752.2012.16.005 |
| [13] |
YANG X H, LU C M. Photosynthesis is improved by exogenous glycinebetaine in salt-stressed maize plants[J]. Physiologia Plantarum, 2005, 124(3): 343-352. |
| [14] |
贾婷婷, 常伟, 范晓旭, 等. 盐胁迫下AM真菌对沙枣苗木光合与叶绿素荧光特性的影响[J]. 生态学报, 2018, 38(4): 1337-1347. |
| [15] |
EHLERT B, HINCHA D K. Chlorophyll fluorescence imaging accurately quantifies freezing damage and cold acclimation responses in Arabidopsis leaves[J]. Plant Methods, 2008, 4: 2. |
| [16] |
PIRES M V, ALMEIDA A A F, FIGUEIREDO A L, et al. Photosynthetic characteristics of ornamental passion flowers grown under different light intensities[J]. Photosynthetica, 2011, 49(4): 593-602. |
| [17] |
闫芳, 王勤礼, 郭有燕, 等. NaCl胁迫对祁连山野生黄瑞香叶片光合叶绿素荧光特性的影响[J]. 西北植物学报, 2016, 36(6): 1182-1189. |
| [18] |
史彦江, 罗青红, 宋锋惠, 等. 高温胁迫对新疆榛光合参数和叶绿素荧光特性的影响[J]. 应用生态学报, 2012, 23(9): 2477-2482. |
| [19] |
VAN KOOTEN O, SNEL J F H. The use of chlorophyll fluorescence nomenclature in plant stress physiology[J]. Photosynthesis Research, 1990, 25(3): 147-150. DOI:10.1007/BF00033156 |
| [20] |
DEPUYDT S, TRENKAMP S, FERNIE A R, et al. An integrated genomics approach to define niche establishment by Rhodococcus fascians[J]. Plant Physiology, 2009, 149(3): 1366-1386. DOI:10.1104/pp.108.131805 |
| [21] |
胡文海, 张斯斯, 肖宜安, 等. 两种杜鹃花属植物对长期遮阴后全光照环境的生理响应及其光保护机制[J]. 植物生态学报, 2015, 39(11): 1093-1100. DOI:10.17521/cjpe.2015.0106 |
| [22] |
乌凤章. NaCl胁迫对高丛越橘幼苗生长和光合生理特性的影响[J]. 西北植物学报, 2015, 35(11): 2258-2265. DOI:10.7606/j.issn.1000-4025.2015.11.2258 |
| [23] |
AGASTIAN P, KINGSLEY S J, VIVEKANANDAN M. Effect of salinity on photosynthesis and biochemical characteristics in mulberry genotypes[J]. Photosynthetica, 2000, 38(2): 287-290. DOI:10.1023/A:1007266932623 |
| [24] |
李海波, 陈温福, 李全英. 盐胁迫下水稻叶片光合参数对光强的响应[J]. 应用生态学报, 2006, 17(9): 1588-1592. DOI:10.3321/j.issn:1001-9332.2006.09.007 |
| [25] |
HOSHIDA H, TANAKA Y, HIBINO T, et al. Enhanced tolerance to salt stress in transgenic rice that overexpresses chloroplast glutamine synthetase[J]. Plant Molecular Biology, 2000, 43(1): 103-111. |
| [26] |
郑国琦, 许兴, 徐兆桢, 等. 盐胁迫对枸杞光合作用的气孔与非气孔限制[J]. 西北植物学报, 2002, 22(6): 1355-1359. DOI:10.3321/j.issn:1000-4025.2002.06.012 |
| [27] |
周丹丹, 刘德玺, 李存华, 等. 盐胁迫对朴树和速生白榆幼苗光合特性及叶绿素荧光参数的影响[J]. 西北植物学报, 2016, 36(5): 1004-1011. |
| [28] |
张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报, 1999, 16(4): 444-448. DOI:10.3969/j.issn.1674-3466.1999.04.021 |
| [29] |
惠红霞, 许兴, 李前荣. 外源甜菜碱对盐胁迫下枸杞光和功能的改善[J]. 西北植物学报, 2003, 23(12): 2137-2142. DOI:10.3321/j.issn:1000-4025.2003.12.015 |
| [30] |
王文林, 万寅婧, 刘波, 等. 土壤逐渐干旱对菖蒲生长及光合荧光特性的影响[J]. 生态学报, 2013, 33(13): 3933-3940. |
| [31] |
许大全. 光合作用学[M]. 北京: 科学出版社, 2013: 187.
|
| [32] |
DAWSON S P, DENNISON W C. Effects of ultraviolet and photosynthetically active radiation on five seagrass species[J]. Marine Biology, 1996, 125(4): 629-638. DOI:10.1007/BF00349244 |
| [33] |
陈梅, 唐运来. 低温胁迫对玉米幼苗叶片叶绿素荧光参数的影响[J]. 内蒙古农业大学学报, 2012, 33(3): 20-24. |
| [34] |
卢广超, 许建新, 薛立, 等. 干旱胁迫下4种常用植物幼苗的光合和荧光特性综合评价[J]. 生态学报, 2013, 33(24): 7872-7881. |

 2019, Vol. 39
2019, Vol. 39


