文章信息
- 丁文沙, 魏志超, 孟李群, 刘志刚, 刘爱琴
- DING Wensha, WEI Zhichao, MENG Liqun, LIU Zhigang, LIU Aiqin
- 生物炭对杉木人工林土壤细菌多样性的影响
- Effects of biochar on soil bacterial diversity in Chinese fir plantations
- 森林与环境学报,2019, 39(6): 584-592.
- Journal of Forest and Environment,2019, 39(6): 584-592.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.06.004
-
文章历史
- 收稿日期: 2019-04-11
- 修回日期: 2019-09-23
2. 福建省杉木种质创新工程研究中心, 福建 福州 350002
2. State Forestry Administration Engineering Research Center of Chinese Fir, Fuzhou, Fujian 350002, China
杉木[Cunninghamia lanceolata (Lamb.) Hook.]广泛分布于中国南方地区,是一种重要的造林速生树种,具有材质好、生长快、纹理直、加工方便等特点,是主要的建筑、家具用材[1]。然而杉木养分吸收多、归还少,凋落物分解缓慢,导致土壤理化性质恶化和肥力低下,有研究表明,杉木连栽导致杉木人工林地力衰退的现象日趋突出,尤其是连栽导致土壤细菌功能活性下降,多样性指数降低[2]。目前针对杉木连栽地力衰退研究主要从施肥、栽培制度等营林措施方面入手[3]。微生物是土壤中不可缺少的活性部分,它参与土壤中有机质的分解、养分循环与平衡、土壤污染物质修复等过程[4]。
生物炭是农林废弃物在低氧或厌氧的条件下,通过高温裂解,将碳素锁住的一种富含孔隙、具有芳香烃结构的高碳固体物质[5]。生物炭可通过提高土壤养分含量来维持土壤结构和养分平衡,从而促进作物对养分吸收,进而提高作物产量[6]。目前的研究表明,生物炭对土壤生态系统功能的影响十分复杂,不仅影响土壤物理及化学性质,同时能够影响土壤微生物群落区系组成[7]。土壤中微生物群落的多样性影响了土壤转化和保存不同养分的能力,往往与土壤肥力存在明显的相关性。生物炭通过影响土壤环境,间接影响土壤微生物数量、种类[8]。虽然目前添加生物炭对土壤微生物活力的影响已有较多报道,但研究者在其对土壤细菌影响方面的观点却不一致[9-10]。因此,生物炭对土壤细菌的影响机制目前并不明确,特别是生物炭对不同林龄杉木人工林土壤细菌结构及多样性的影响方面的研究鲜有报道。鉴于此,本研究基于高通量测序技术对聚合酶链式反应(polymerase chain reaction,PCR)所扩增的16S rDNA序列的V3+V4区域进行测定,对施用生物炭处理后的杉木人工林土壤细菌群落进行培养,加大测序的深度和覆盖度,为添加生物炭对杉木人工林土壤细菌种类、群落结构及其功能的影响机制提供理论依据,对杉木人工林不同发育阶段林木生产能力及生态系统恢复等具有重要的科学价值和现实意义。
1 材料与方法 1.1 试验地概况试验地位于三明市莘口镇福建农林大学教学林场(北纬26°09′,东经117°28′),该林场多为山地丘陵,平均海拔400 m, 土壤类型为粉砂岩发育的山地红壤,气候为中亚热带季风气候,年平均降水量1 620 mm。选择立地条件相近的杉木幼龄林(2005年造林,7年生,林分密度为1 317株·hm-2)、中龄林(1995年造林,17年生,林分密度为911株·hm-2)、成熟林(1978年造林,34年生,林分密度为894株·hm-2)3个发育阶段杉木人工林,其表层土壤性质见表 1[11]。
| 发育阶段 Plantation stage |
全碳含量 Total carbon/(g·kg-1) |
全氮含量 Total nitrogen/(g·kg-1) |
pH值 pH value |
全磷含量 Total phosphorus/(g·kg-1) |
全钾含量 Total potassium/(g·kg-1) |
水解性氮含量 Dissolved organic nitrogen/(mg·kg-1) |
有效磷含量 Available phosphorus/(mg·kg-1) |
速效钾含量 Available potassium/(mg·kg-1) |
| 幼龄林 Young forest |
21.56 | 1.09 | 4.17 | 0.59 | 20.65 | 172.78 | 7.39 | 91.3 |
| 中龄林 Medium age forest |
17.79 | 1.08 | 4.07 | 0.6 | 21.94 | 188.36 | 10.59 | 91.34 |
| 成熟林 Mature forest |
24.4 | 1.08 | 4.03 | 0.53 | 20.85 | 151.75 | 8.94 | 86.14 |
每个发育阶段杉木人工林均选择2代杉木林,经1代杉木人工林采伐完成后均经过炼山处理,施炭前,该3种林地经营管理方式相同。设计施用木炭(CM)、竹炭(CZ)和不施炭(CB)处理,样地大小为20 m×20 m,每个处理重复3次,3个林龄共设27块样地。2012年12月,对标准样地进行施炭处理,采用人工撒施的方式,按照12 t·hm2的标准施炭。试验所用生物炭为个体农户传统土窑生产,其中竹炭以毛竹为材料,木炭以杉木为原材料,表 2为所施生物炭的基本理化性质[11]。
| 生物炭类型 Biochar type |
氮含量 Nitrogen/(g·kg-1) |
碳含量 Carbon/(g·kg-1) |
磷含量 Phosphorus/(g·kg-1) |
钾含量 Potassium/(g·kg-1) |
pH值 pH value |
灰分含量 Ash content/% |
碳氮比 C/N/% |
| 木炭Chinese fir biochar | 7.75 | 753.20 | 0.77 | 21.32 | 8.44 | 7.79 | 97.24 |
| 竹炭Bamboo biochar | 8.58 | 664.30 | 2.01 | 32.10 | 9.56 | 12.72 | 78.26 |
2015年12月,即施炭后第3年,在不同发育阶段杉木人工林样地内,采用“S”型布点,利用取土钻采集0~20 cm土层土壤,同一样地土壤混合均匀后,用冰袋保存带回室内。一部分通过2 mm筛,放入4 ℃冰箱中冷藏保存,用于土壤细菌测定;另一部分经风干过筛后用于测定土壤化学性质。
1.4 土壤化学性质测定土壤pH值采用水土比为2.5:1,用pH计进行测定;全磷(total phosphorus,TP)、全钾(total potassium,TK)使用马弗炉碱熔法消煮,TP含量采用钼锑抗比色法测定,TK含量采用火焰光度计测定;水解性氮(dissolved organic nitrogen,DON)含量采用碱解-扩散法测定;速效钾(available potassium,AK)含量用乙酸铵浸提-火焰光度计测定;有效磷(available phosphorus,AP)含量用氟化铵-盐酸浸提测定[12];土壤全氮(total nitrogen,TN)、全碳(total carbon,TC)含量采用CN元素分析仪(德国元素分析系统有限公司,vario MAX cube CN型)测定;土壤铵态氮(NH4+)、硝态氮(NO3-)含量使用流动分析仪(AA3型,德国)进行测定[13]。
1.5 土壤微生物测定 1.5.1 DNA提取土壤采样完成后使用DNA提取试剂盒(DNeasy PowerSoil HTP 96 Kit,Mobio,USA)提取DNA,并在提取完成后取5~10 μL DNA进行1.0%琼脂糖凝胶电泳,分析其完整性;测定DNA浓度使用微量分光光度计(ND-1000,NanDrop Technologies,USA)。
1.5.2 16S rDNA的扩增与测序样品经过富集菌体后,使用纯化试剂盒(DP304,天根生化科技有限公司,中国)提取纯化基因组DNA。提取的细菌基因组DNA使用细菌V3+V4区通用引物序列,经PCR扩增基因组上16S rDNA的V3+V4区序列(扩增片段为465 bp左右)。PCR反应条件为94 ℃ 2 min; 94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,30个循环; 72 ℃ 5 min,4 ℃保存,然后进行2%的琼脂糖凝胶电泳检测。将400~500 bp区域的片段纯化回收,测定DNA浓度,然后将这些片段加接头建库测序,使用illuminaMiSeq测序仪与illumina建库。其中,测序引物序列为Primer-F:5′-CCTACGGGNGGCWGCAG-3′; Primer-R:5′-GGACTACHVGGGTATCTAAT-3′。
1.5.3 细菌数据分析利用Mothur软件对tag序列进行去冗余处理,并对tags在97%的相似度下进行操作分类单位(operational taxonomic unit,OUT)聚类,统计各个土壤样品每个OUT中的丰度信息。
1.6 统计分析根据OUT聚类结果,使用物种指数方法计算土壤细菌群落的功能多样性,即Alpha多样性,包括chao1、Ace、Shannon以及Simpson指数等。:利用Excel 2016软件进行基础数据整理与制图;用SPSS 20软件对土壤基本化学性质、土壤细菌Alpha多样性和细菌群落丰度等进行统计和单因素方差分析;利用LSD在置信度为95%下检验显著性;用Canoco 4.5软件对土壤性质养分含量及土壤细菌群落相对丰度做冗余分析(redundancy analysis,RDA),得到其中的相关关系。
2 结果与分析 2.1 生物炭对杉木人工林土壤化学性质的影响由表 3可见,生物炭能明显改善杉木人工林土壤化学性质,总体上施用竹炭效果优于木炭,对不同发育阶段土壤化学性质的影响表现为杉木幼龄林优于中龄林和成熟林。施炭处理会使土壤pH值及AK、DON、NH4+、TC、TN、AP、TK和TP含量改变,但在不同发育阶段间存在差异。
| 发育阶段 Plantation stage |
处理方式 Treatment |
pH值 pH value |
速效钾含量AK /(mg·kg-1) |
有效磷含量AP /(mg·kg-1) |
水解性氮含量 DON/(mg·kg-1) |
铵态氮含量NH4+ /(g·kg-1) |
硝态氮含量NO3- /(g·kg-1) |
全氮含量TN /(g·kg-1) |
全碳含量TC /(g·kg-1) |
全钾含量TK /(g·kg-1) |
全磷含量TP /(g·kg-1) |
| 幼龄林 | CB | 4.16±0.01Aab | 125.09±4.57Aa | 13.94±3.71Aa | 113.13±61.46Ab | 26.13±1.74Aa | 6.94±0.11ABa | 1.98±0.10Ab | 27.60±0.85Ab | 7.00±0.85Bb | 0.14±0.00Ca |
| Young | CM | 4.15±0.04Ab | 98.38±15.63Aab | 9.40±1.21Ab | 155.07±2.43Aab | 21.82±4.85Aa | 7.14±0.25ABa | 2.29±0.14Ba | 31.88±4.42Aab | 8.85±1.20Aa | 0.17±0.02Ba |
| forest | CZ | 4.21±0.05Aa | 58.65±12.29Ab | 15.79±1.48Aa | 186.49±26.73Aa | 28.57±1.21Aa | 7.04±1.19Aa | 2.53±0.01Aa | 34.26±1.63Aa | 6.30±1.13Bb | 0.14±0.04Ba |
| 中龄林 | CB | 4.02±0.09ABa | 63.37±12.28Ba | 9.22±0.00Aa | 153.15±9.51Aa | 19.94±3.25Aa | 5.92±0.03Ba | 2.14±0.22Aa | 22.13±3.02Aa | 9.70±0.14Aa | 0.29±0.01Ba |
| Medium | CM | 4.07±0.08Aa | 78.89±13.37ABa | 7.21±1.69ABa | 114.97±39.01Aa | 21.49±7.77Aa | 6.22±0.66Ba | 1.97±0.17Aa | 18.83±3.01Ba | 9.15±0.35Aa | 0.37±0.07Aa |
| age forest | CZ | 4.11±0.06Ba | 78.37±4.52Aa | 6.35±0.68Ba | 169.0±2.41Aa | 24.21±2.64Aa | 6.49±0.31Aa | 2.12±0.03Ba | 22.62±3.15Aa | 9.45±0.64Aa | 0.29±0.03Aa |
| 成熟林 | CB | 3.95±0.03Ba | 65.45±4.11Ba | 9.35±1.97Aa | 129.06±4.95Ac | 23.05±1.35Aa | 8.17±0.47Aa | 1.99±0.02Aa | 22.19±0.13Aa | 8.60±0.14Ab | 0.42±0.11Aa |
| Mature | CM | 4.01±0.00Aa | 66.25±4.86Ba | 5.40±1.38Bb | 139.56±19.64Abc | 23.09±0.81Aa | 7.83±0.96Aa | 2.00±0.09Aa | 23.77±1.93Ba | 9.80±0.14Aab | 0.27±0.02ABb |
| forest | CZ | 3.88±0.00Ca | 70.73±5.58Aa | 7.69±0.00Bab | 204.8±4.96Aa | 21.45±0.35Aa | 7.28±0.69Aa | 2.24±0.03Ba | 27.83±.49Aa | 10.15±0.21Aa | 0.29±0.09Ab |
| 注:同列数据后相同字母表示差异不显著;小写字母表示同一发育阶段不同处理差异显著(P<0.05);大写字母表示同一处理不同发育阶段差异显著(P<0.05)。Note: the same letter in the same column indicates no significant difference; different lowercase letters indicate significant differences among different treatments in the same plantation stage (P<0.05); and different capital letters indicate significant differences among different plantation stages with the same treatment (P<0.05). | |||||||||||
施用木炭处理后,AK、AP、TN、TC、NO3-和TP含量在不同发育阶段存在显著差异,AK、AP、TN和TC含量在幼龄林土壤中最高,NO3-含量在成熟林土壤中最高,TP含量在中龄林土壤中最高;施用竹炭处理后,AP、TN、TC、TK和TP含量在不同发育阶段存在显著差异,AP、TN和TC含量表现为幼龄林>成熟林>中龄林,TK和TP含量表现为成熟林>中龄林>幼龄林。说明施炭处理对土壤中AP、TN和TC含量在幼龄林中影响最显著,对土壤中TK和TP含量在成熟林中影响最大。
2.2 生物炭对杉木人工林土壤细菌多样性分析 2.2.1 土壤细菌绝对丰度分析通过对不同林龄以及不同生物炭处理的土壤样品进行高通量测序,各样品均按照97%相似性对非重复序列(不含单序列)进行OTU聚类分析。通过对高通量测序获得的原始数据进行整理、去噪和去除嵌合体处理,得到了56 651~83 575条有效序列,有效序列百分比均在92%以上,OUT数量集中在5 670~7 252之间,表明对照组和处理组样本中物种分布均匀,可用于多样性分析。
2.2.2 生物炭对杉木人工林土壤细菌多样性的影响表 4为施用不同生物炭不同发育阶段杉木人工林土壤的群落丰富度指数,如Chao1、Ace指数,群落多样性指数,如Shannon、Simpson指数。不施炭处理以及生物炭处理的土壤Chao1、Ace和Shannon指数在各发育阶段无显著差异;中龄林中Ace指数在不同处理间存在显著差异,表现为竹炭处理显著高于不施炭处理及木炭处理,说明在中龄林中,竹炭处理能显著增加土壤微生物群落。在不施炭处理及木炭处理时,不同发育阶段的Simpson指数存在显著差异,表现出幼龄林>中龄林>成熟林,说明施炭处理对幼龄林土壤细菌多样性的影响明显高于对中龄林和成熟林的影响。覆盖率代表着各样本的文库覆盖率,其数值越高,则样本中序列被测出的概率越高,即没有被测出的概率越低[14]。由表 4可知,各样本覆盖率均在95%以上,说明对样本中的细菌覆盖率较高,测序深度适合,足以满足细菌多样性的分析需求。
| 发育阶段 Plantation stage |
处理方式 Treatment |
Chao1指数 Chao1 index |
Ace指数 Ace index |
Shannon指数 Shannon index |
Simpson指数 Simpson index |
覆盖率 Coverage rate/% |
| 幼龄林 | CB | 12 392.89±787.99Aa | 16 061.78±811.45Aa | 6.83±0.25Aa | 0.009±0.006Aa | 95.2±0.2 |
| Young forest | CM | 11 206.27±703.78Aa | 14 224.82±658.01Aa | 6.71±0.25Aa | 0.019±0.016Aa | 95.4±0.6 |
| CZ | 11 500.61±1 359.15Aa | 14 665.79±2 027.32Aa | 6.75±0.32Aa | 0.010±0.006Aa | 96.1±0.6 | |
| 中龄林 | CB | 12 054.71±836.34Aa | 15 794.00±1 003.14Aab | 6.82±0.04Aa | 0.005±0.001Ba | 95.3±0.5 |
| Medium age forest | CM | 11 236.02±241.19Aa | 14 598.59±244.92Ab | 6.79±0.11Aa | 0.006±0.002Ba | 96.0±0.5 |
| CZ | 12 959.92±1 820.50Aa | 17 121.86±1 870.46Aa | 6.85±0.33Aa | 0.006±0.003Aa | 95.2±0.6 | |
| 成熟林 | CB | 10 798.72±698.02Aa | 13 972.42±595.01Aa | 6.63±0.23Aa | 0.007±0.003Ba | 96.0±0.6 |
| Mature forest | CM | 11 376.50±1 116.75Aa | 14 863.89±1 829.79Aa | 6.86±0.24Aa | 0.005±0.003Ba | 95.4±0.9 |
| CZ | 11 641.87±48.61Aa | 15 029.07±496.26Aa | 6.74±0.11Aa | 0.009±0.006Aa | 95.9±0.6 | |
| 注:同列数据后相同字母表示差异不显著;小写字母表示同一发育阶段不同处理差异显著(P<0.05);大写字母表示同一处理不同发育阶段差异显著(P<0.05)。Note: the same letter in the same column indicates no significant difference; different lowercase letters indicate significant differences among different treatments in the same plantation stage (P<0.05); and different capital letters indicate significant differences among different plantation stages with the same treatment (P<0.05). | ||||||
通过聚类分析后,将土壤细菌种类在门分类水平上进行统计,其中至少有一个处理的丰度在2%以上的主要有6种,如表 5所示,分别为泉古菌门(Crenarchaeota)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、变形菌门(Proteobacteria)和疣微菌门(Verrucomicrobia)。6种细菌门累计丰度均在87%以上,能够较好地代表土壤中主要细菌门丰度的变化。酸杆菌门与变形菌门细菌是土壤中细菌丰度最高的两种细菌门,酸杆菌门丰度在不同发育阶段和不同处理间均无显著差异,除中龄林外,在各发育不同处理间整体表现出施炭处理的相对丰度低于不施炭处理。变形菌门在各阶段的不同处理间无显著差异,但在同一处理中的不同发育阶段间存在显著差异。不施炭处理时,幼龄林、中龄林与成熟林间变形菌门相对丰度存在显著差异,具体表现为幼龄林>中龄林>成熟林;木炭处理和竹炭处理后变形菌门相对丰度在不同发育阶段也存在显著差异,表现为幼龄林>成熟林>中龄林,说明施炭处理对中龄林土壤中变形菌门相对丰度影响不同于幼龄林和成熟林,且施炭处理对变形菌门丰度影响在幼龄林中效果最显著。施炭处理对土壤中绿弯菌门相对丰度有抑制作用,在幼龄林和中龄林的不同处理间绿弯菌门相对丰度无明显差异;在成熟林中,施炭处理与不施炭处理间绿弯菌门丰度存在显著差异,木炭处理与竹炭处理分别比对照低58.34%和54.31%,说明竹炭处理对绿弯菌门相对丰度影响高于木炭处理及不施炭处理。泉古菌门、放线菌门和疣微菌门在不同发育阶段和不同处理间均无明显差异。P/A值是变形菌门与酸杆菌门的比值,变形菌门与酸杆菌门作为土壤细菌总数量中所占丰度超过70%的细菌门,两者之间的比值在一定程度上表示土壤的肥力程度,一般情况下P/A数值越低,代表土壤肥力越高[15]。在杉木人工林幼龄林和成熟林中,施炭处理的P/A值均高于不施炭处理;在中龄林中,施炭处理与对不施炭处理的P/A值无显著差异。说明施炭处理对杉木人工林幼龄林和成熟林土壤肥力有促进作用,而对中龄林无明显影响。
| 发育阶段 Plantation stage |
处理方式 Treatment |
土壤细菌类群丰度Abundance/% | P/A | 累计丰度 Cumulative abundance/% |
|||||
| 酸杆菌门 Acidobacteria |
放线菌门 Actinobacteria |
绿弯菌门 Chloroflexi |
变形菌门 Proteobacteria |
疣微菌门 Verrucomicrobia |
泉古菌门 Crenarchaeota |
||||
| 幼龄林 | CB | 33.98±12.1Aa | 7.02±2.8Aa | 6.52±3.2Aa | 41.44±14.6Aa | 1.86±0.7Aa | 0.73±0.003Aa | 1.42±0.51Aa | 92 |
| Young | CM | 31.51±6.1Aa | 5.23±1.0Aa | 5.04±2.1Aa | 46.29±6.1Aa | 2.38±1.3Aa | 0.22±1.0Aa | 1.53±0.29Aa | 91 |
| forest | CZ | 31.25±12.7Aa | 6.72±3.3Aa | 4.52±4.1Aa | 45.18±16.1Aa | 1.51±1.3Aa | 0.85±1.0Aa | 1.79±0.87Aa | 91 |
| 中龄林 | CB | 40.90±8.2Aa | 6.40±1.9Aa | 6.59±1.7Aa | 31.03±9.7ABa | 0.71±0.4Aa | 2.62±1.8Aa | 0.81±0.22Aa | 88 |
| Medium | CM | 43.52±8.3Aa | 5.61±2.1Aa | 6.28±0.3Aa | 27.88±7.1Ba | 1.80±0.1Aa | 1.85±1.9Aa | 0.67±0.15Aa | 87 |
| age forest | CZ | 43.16±1.5Aa | 4.91±1.0Aa | 8.03±2.1Aa | 27.08±3.4Ba | 1.96±1.5Aa | 1.68±1.0Aa | 0.63±0.05Ba | 87 |
| 成熟林 | CB | 47.11±6.6Aa | 5.17±0.7Aa | 9.17±2.1Aa | 23.05±2.7Ba | 2.17±0.9Aa | 1.95±1.8Aa | 0.50±0.06Aa | 89 |
| Mature | CM | 42.65±6.6Aa | 4.62±0.9Aa | 3.82±2.1Ab | 35.32±4.8ABa | 1.86±0.4Aa | 1.76±0.9Aa | 0.85±0.12Aa | 90 |
| forest | CZ | 37.69±2.7Aa | 5.30±0.4Aa | 4.19±2.0Aab | 39.33±0.8ABa | 1.39±0.4Aa | 1.42±0.5Aa | 1.05±0.04ABa | 89 |
| 注:同列数据后相同字母表示差异不显著;小写字母表示同一发育阶段不同处理差异显著(P<0.05);大写字母表示同一处理不同发育阶段差异显著(P<0.05)。Note: the same letter in the same column indicates no significant difference; different lowercase letters indicate significant differences among different treatments in the same plantation stage (P<0.05); and different capital letters indicate significant differences among different plantation stages with the same treatment (P<0.05). | |||||||||
在细菌纲水平上,主要检测到13种主要纲(相对丰度至少在1个样品中大于2%,其余的归为其他),其中有9种在各处理及各龄林中均被检测到,分别为酸杆菌纲(Acidobacteriia)、DA052、索利氏菌纲(Solibacteres)、放线菌纲(Actinobacteria)、纤线杆菌纲(Ktedonobacteria)、α-变形菌纲(α-proteobacteria)、β-变形菌纲(β-proteobacteria)、δ-变形菌纲(δ-proteobacteria)、γ-变形菌纲(γ-proteobacteria)。如图 1所示,在各发育阶段的杉木人工林土壤中,酸杆菌纲、DA052、α-变形菌纲、γ-变形菌纲所占比重最大。在不施炭处理土壤中,酸杆菌纲、DA052的相对丰度在各发育阶段中表现出幼龄林>成熟林>中龄林,α-变形菌纲和γ-变形菌纲表现为幼龄林>中龄林>成熟林。在幼龄林中,施炭处理对α-变形菌纲、γ-变形菌纲、索利氏菌纲的相对丰度有促进作用;对DA052纲、放线菌纲、纤线杆菌纲、β-变形菌纲有抑制作用。在中龄林中,施木炭处理后酸杆菌纲丰度与对照相比提高了37.39%,其余各纲的丰度与不施炭处理间无显著差异,竹炭处理后酸杆菌纲、DA052和纤线杆菌纲的相对丰度都有提高。成熟林中,木炭处理使酸杆菌纲、DA052、索利氏菌纲、放线菌纲、α-变形菌纲、β-变形菌纲、δ-变形菌纲、γ-变形菌纲比不施炭处理的相对丰度提高;竹炭处理后酸杆菌纲、DA052、放线菌纲和纤线菌纲的相对丰度分别比不施炭处理低;而索利氏菌纲、α-变形菌纲、β-变形菌纲、δ-变形菌纲、γ-变形菌纲则分别比不施炭处理高。在3个发育阶段中不同处理间对土壤细菌丰度的影响不同是由于不同发育阶段土壤基本性质不同造成的。
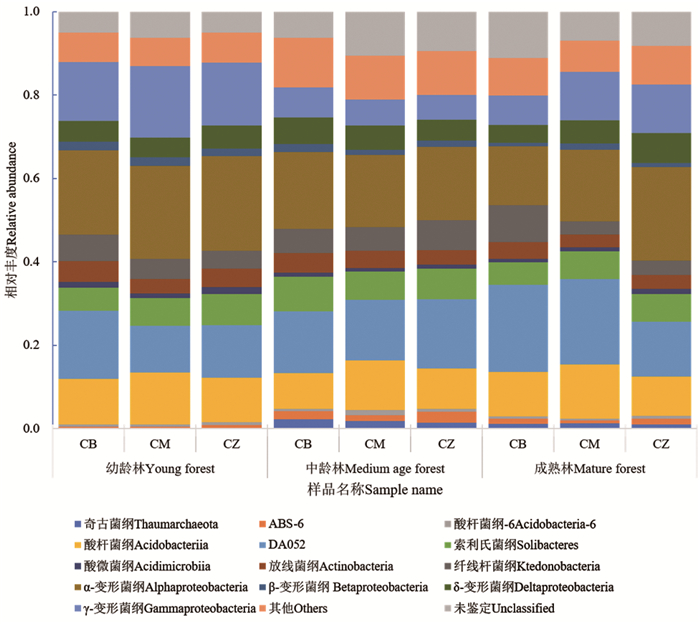
|
图 1 不同土壤样品细菌纲水平物种组成 Fig. 1 Community composition of bacteria at the class level in different soil samples |
土壤性质对土壤细菌的群落结构和群落多样性有着重要作用,图 2为土壤性质与门水平和纲水平上土壤细菌的冗余分析, 红色箭头代表土壤性质及化学组分含量,箭头越长代表影响越显著。由图 2可知,在门水平上变形菌门丰度与土壤TP呈负相关与TN和TC呈正相关;绿弯菌门与土壤可溶性氮呈负相关,放线菌门和疣微菌门与土壤pH值和AP、AK、NH4+和pH值呈正相关, 与TK呈负相关。在纲水平上,DA052与纤线杆菌纲与NO3-呈现正相关,与DON呈负相关;酸杆菌纲,放线菌纲、β-变形菌纲、γ-变形菌纲与pH值、NH4+呈正相关,与TK呈负相关;α-变形菌纲、δ-变形菌纲、索利氏菌纲与AP、TC呈正相关,与TP呈负相关。Forward Selection结果显示在土壤细菌门水平上,TP对细菌的群落分布影响最为显著(F=27.635,P=0.003),其次是TC(F=26.294,P=0.002);在细菌纲水平上,对细菌的群落分布影响最显著的土壤因子是TP(F=13.995,P=0.002)和TC(F=11.255,P=0.003)。
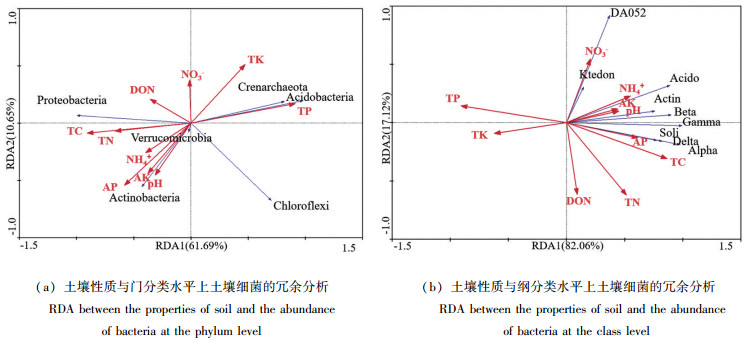
|
注:Ktedon代表纤线杆菌属;Acido代表酸杆菌纲;Soli代表索利氏菌纲;Actin代表放线菌纲;Alpha代表α-变形菌纲;Beta代表β-变形菌纲;Delta代表δ-变形菌纲;Gamma代表γ-变形菌纲。 Note: Ktedon indicates Ktedonobacteria; Acido indicates Acidobacteriia; Soli indicates Solibacteres; Alpha indicates α-proteobacteria; Beta indicates β-proteobacteria; Delta indicates δ-proteobacteria; Gamma indicates γ-proteobacteria. 图 2 土壤化学性质与细菌群落结构冗余分析 Fig. 2 RDA between the abundance of bacteria and the chemical properties of soil |
生物炭富含C、N、P、K等多种营养元素,本试验结果表明, 施加生物炭使土壤中C、N、P等元素的含量以及pH值增加,这与陈义轩等[16]的试验结果一致,其原因是生物炭本身的TC、TN、TP含量较高,且生物炭呈碱性,施用生物炭会增高土壤pH值以及土壤有机碳和TN、TP含量[17]。本研究中NH4+和NO3-含量与土壤细菌群落组成显著相关,是因为生物炭表面积巨大,表面有丰富的正负电荷,具有很强的吸附力,因此能吸附固定一些矿物和有机质,从而影响土壤养分和元素含量,且生物炭对土壤中的NH4+和NO3-有吸附固定的作用[18]。在本研究中,土壤pH值与土壤TC等土壤性质与土壤细菌群落组成呈显著的相关性,说明生物炭通过影响土壤性质从而对土壤细菌群落组成和丰度造成影响。
土壤细菌群落组成也与土壤性质相关,目前大多数研究都表明生物炭对土壤细菌类群丰度存在影响。本研究结果表明,生物炭会使土壤pH值和一些土壤元素含量发生变化,进而影响土壤细菌群落组成。在幼龄林和成熟林中,施用生物炭后酸杆菌门细菌丰度较不施炭处理低,与姚钦[19]的研究结果一致,说明土壤施用生物炭后,对酸杆菌门群落丰度有一定的抑制作用,其原因是酸杆菌门细菌更适合在低pH值土壤环境中生长[20];在两个不同生物炭的处理间,酸杆菌门细菌丰度都表现出上升的趋势,与施炭后pH值变化趋势一致,而木炭pH值较竹炭低,因此木炭对酸杆菌门细菌抑制作用比竹炭弱[21];在施用生物炭后变形菌门相对丰度显著提高,说明施加生物炭对变形菌门群落丰度有促进作用,这与大部分研究结果一致,其原因可能是生物炭孔隙大,且具有多孔性,有利于微生物的生长和繁殖,进而增加细菌丰度,且其相对丰度与土壤TC、TN呈正相关,其原因是变形菌门大多数菌群都具有固氮的作用[22]。施用生物炭后,绿弯菌门细菌丰度显著降低,生物炭对土壤中绿弯菌门细菌丰度有抑制作用,与一些研究结果不同,其原因可能是有些木质原料制备的生物炭可利用性营养物质较低, 氮素不足而不能支撑细菌生长代谢过程, 从而降低细菌相对丰度[23]。在中龄林中,施炭处理后各细菌门丰度的变化趋势与成熟林和幼龄林均表现出相反的趋势,说明生物炭对不同发育阶段土壤细菌丰度的影响不同,其原因可能是中龄林的土壤TC含量低于幼龄林和成熟林,从而进一步影响土壤本底理化性质以及微生物群落,而造成这种本底差异的原因可能是由于中龄林阶段处于杆材期,林木竞争力大,天然整枝强度大,凋落物较多,进一步影响土壤理化性质与土壤微生物群落组成[24]。本研究与目前已有许多研究都表明不同来源生物炭对不同土壤细菌群落组成有不同影响[25-26]。在本研究中,木炭和竹炭对土壤中一些细菌纲丰度的影响不同,如木炭的添加促进了酸杆菌纲的细菌丰度,而竹炭的添加却抑制了酸杆菌纲细菌的相对丰度,其原因可能是因为施加的生物炭具有不同的理化性质并对不同土壤细菌的影响不同[16]。
不同生物炭对不同发育阶段土壤细菌多样性影响不同,主要表现为细菌群落的丰富度和多样性,影响程度也与生物炭种类密切相关, 因此会提高土壤中细菌的丰度。有研究表明施用生物炭对土壤微生物多样性无明显影响[27],也有研究认为施用生物炭会使土壤细菌OUT数和细菌丰富度指数(Chao1)提高[28],还有研究表明生物炭会使细菌多样性降低[29]。在本研究中,两种生物炭的施用都对细菌多样性和细菌丰富度没有显著影响,其原因可能是生物炭中的金属离子等无机盐会抑制微生物的生命代谢活动,使得微生物群落丰富度受到影响[30]。
由于生物炭自身属性,施用生物炭能明显改善杉木人工林土壤化学性质,使杉木人工林土壤pH值以及土壤C、N、P含量提高,且总体上施用竹炭效果大于木炭;生物炭对不同发育阶段土壤化学性质的影响表现为杉木幼龄林优于中龄林和成熟林;施用生物炭能改变细菌群落丰度,使杉木人工林土壤中酸杆菌门、放线菌门、绿弯菌门和泉古菌门的细菌丰度下降,变形菌门和疣微菌门的细菌丰度提高;竹炭对土壤细菌丰度的影响高于木炭的影响,且土壤化学性质与土壤细菌群落间存在显著相关性,泉古菌门与土壤TP呈负相关与TN和TC呈正相关;绿弯菌门与DON呈负相关,放线菌门和疣微菌门与土壤pH值和AP、AK、NH4+呈正相关, 与TK呈负相关,其中TP和TC对土壤细菌群落分布影响最大。
综上所述,生物炭通过改变土壤理化性质进而影响土壤细菌群落分布,且施用竹炭对杉木土壤理化性质以及土壤细菌影响更明显,对土壤质量改善作用更明显。
| [1] |
俞月凤, 宋同清, 曾馥平, 等. 杉木人工林生物量及其分配的动态变化[J]. 生态学杂志, 2013, 32(7): 1660-1666. |
| [2] |
杨承栋, 张小泉, 焦如珍, 等. 杉木连栽土壤组成、结构、性质变化及其对林木生长的影响[J]. 林业科学, 1996, 32(2): 175-181. |
| [3] |
李延茂, 胡江春, 张晶, 等. 杉木连栽土壤微生物多样性的比较研究[J]. 应用生态学报, 2005, 16(7): 1275-1278. |
| [4] |
王利利, 董民, 张璐, 等. 不同碳氮比有机肥对有机农业土壤微生物生物量的影响[J]. 中国生态农业学报, 2013, 21(9): 1073-1077. |
| [5] |
CAYUELA M L, SÁNCHEZ-MONEDERO M A, ROIG A, et al. Biochar and denitrification in soils:when, how much and why does biochar reduce N2O emissions?[J]. Scientific Reports, 2013, 3: 1732. |
| [6] |
陈乐, 周乾聪, 刘梦洁, 等. 不同原料和热解条件制备的生物炭的性质及其对Cu2+、Cd2+的吸附效果[J]. 江西农业大学学报, 2018, 40(5): 1068-1077. |
| [7] |
王国兵, 王瑞, 徐瑾, 等. 生物炭对杨树人工林土壤微生物生物量碳、氮、磷及其化学计量特征的影响[J]. 南京林业大学学报(自然科学版), 2019, 43(2): 1-6. |
| [8] |
ZHANG J N, LÜ F, LUO C H, et al. Humification characterization of biochar and its potential as a composting amendment[J]. Journal of Environmental Sciences, 2014, 26(2): 390-397. |
| [9] |
DAS K C, GARCIA-PEREZ M, BIBENS B, et al. Slow pyrolysis of poultry litter and pine woody biomass:impact of chars and bio-oils on microbial growth[J]. Journal of Environmental Science and Health, Part A, 2008, 43(7): 714-724. |
| [10] |
吕伟波.生物炭对土壤微生物生态特征的影响[D].杭州: 浙江大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10335-1012318179.htm
|
| [11] |
孟李群.施用生物炭对杉木人工林生态系统的影响研究[D].福州: 福建农林大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10389-1014322871.htm
|
| [12] |
中国土壤学会农业化学专业委员会. 土壤农业化学常规分析方法[M]. 北京: 科学出版社, 1983.
|
| [13] |
PREIDIS G A, AJAMI N J, WONG M C, et al. Composition and function of the undernourished neonatal mouse intestinal microbiome[J]. The Journal of Nutritional Biochemistry, 2015, 26(10): 1051-1057. |
| [14] |
杨俊花, 赵志辉, 郭文博, 等. 应用Illumina-MiSeq高通量测序技术分析脱氧雪腐镰刀菌烯醇对小鼠肠道菌群的影响[J]. 动物营养学报, 2017, 29(1): 158-167. |
| [15] |
SMIT E, LEEFLANG P, GOMMANS S, et al. Diversity and seasonal fluctuations of the dominant members of the bacterial soil community in a wheat field as determined by cultivation and molecular methods[J]. Applied and Environmental Microbiology, 2001, 67(5): 2284-2291. |
| [16] |
陈义轩, 宋婷婷, 方明, 等. 四种生物炭对潮土土壤微生物群落结构的影响[J]. 农业环境科学学报, 2019, 38(2): 394-404. |
| [17] |
赵殿峰.不同生物炭施用量对烤烟土壤理化性状及烤烟生长的影响[D].杨凌: 西北农林科技大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10712-1014440001.htm
|
| [18] |
WARNOCK D D, LEHMANN J, KUYPER T W, et al. Mycorrhizal responses to biochar in soil-concepts and mechanisms[J]. Plant and Soil, 2007, 300(1/2): 9-20. |
| [19] |
姚钦.生物炭施用对东北黑土土壤理化性质和微生物多样性的影响[D].长春: 中国科学院东北地理与农业生态研究所, 2017. http://cdmd.cnki.com.cn/Article/CDMD-80062-1017930187.htm
|
| [20] |
GRIFFITHS R I, THOMSON B C, JAMES P, et al. The bacterial biogeography of British soils[J]. Environmental Microbiology, 2011, 13(6): 1642-1654. |
| [21] |
王春香, 田宝玉, 吕睿瑞, 等. 西双版纳地区热带雨林土壤酸杆菌(Acidobacteria)群体结构和多样性分析[J]. 微生物学通报, 2010, 37(1): 24-29. |
| [22] |
林标声, 范锦琳, 宋昭昭, 等. 巨菌草不同生长时期的内生固氮菌群组成分析[J]. 微生物学通报, 2018, 45(7): 1479-1490. |
| [23] |
LIAO N, LI Q, ZHANG W, et al. Effects of biochar on soil microbial community composition and activity in drip-irrigated desert soil[J]. European Journal of Soil Biology, 2016, 72: 27-34. |
| [24] |
赵辉, 周运超, 任启.不同林龄马尾松人工林土壤微生物群落结构和功能多样性演变飞[J/OL].土壤学报, 2019.[2019-07-08].http://kns.cnki.net/kcms/detail/32.1119.P.20181210.1619.002.html.
|
| [25] |
王佩雯, 朱金峰, 陈征, 等. 高通量测序技术下连作植烟土壤细菌群落与土壤环境因子的耦合分析[J]. 农业生物技术学报, 2016, 24(11): 1754-1763. |
| [26] |
周之栋, 卜晓莉, 吴永波, 等. 生物炭对土壤微生物特性影响的研究进展[J]. 南京林业大学学报(自然科学版), 2016, 40(6): 1-8. |
| [27] |
PIETIKÄINEN J, KIIKKILÄ O, FRITZE H. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus[J]. Oikos, 2000, 89(2): 231-242. |
| [28] |
武爱莲, 丁玉川, 焦晓燕, 等. 玉米秸秆生物炭对褐土微生物功能多样性及细菌群落的影响[J]. 中国生态农业学报, 2016, 24(6): 736-743. |
| [29] |
MARRIS E. Putting the carbon back:black is the new green[J]. Nature, 2006, 442(7103): 624-626. |
| [30] |
ZHU X M, CHEN B L, ZHU L Z, et al. Effects and mechanisms of biochar-microbe interactions in soil improvement and pollution remediation:a review[J]. Environmental Pollution, 2017, 227: 98-115. |

 2019, Vol. 39
2019, Vol. 39


