文章信息
- 叶江华, 张奇, 林生, 罗盛财, 贾小丽, 何海斌
- YE Jianghua, ZHANG Qi, LIN Sheng, LUO Shengcai, JIA Xiaoli, HE Haibin
- 大红袍茶树生长及鲜叶品质与土壤特性的相关性
- Correlation of growth and fresh leaf quality of Dahongpao tea tree with soil characteristics
- 森林与环境学报,2019, 39(5): 488-496.
- Journal of Forest and Environment,2019, 39(5): 488-496.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.05.007
-
文章历史
- 收稿日期: 2019-06-24
- 修回日期: 2019-07-23
2. 福建省农业生态过程与安全监控重点实验室, 福建 福州 350002;
3. 武夷山市农业局, 福建 武夷山 354300
2. Fujian Provincial Key Laboratory of Agroecological Processing and Safety Monitoring, Fuzhou, Fujian 350002, China;
3. Agriculture Bureau of Wuyishan City, Wuyishan, Fujian 354300, China
国家标准《武夷岩茶地理标志产品》对武夷岩茶定义为“独特的武夷山自然生态环境条件下选用适宜的茶树品种进行无性繁育和栽培,并用独特的传统加工工艺制作而成,具有岩韵(岩骨花香)品质特征的乌龙茶”。福建武夷山是武夷岩茶的发源地,其中的大红袍是中国十大名茶之一,久负盛名。武夷岩茶历来有“正岩、半岩和洲茶”之区别,其品质有“正岩为上,半岩为中,洲茶为下”之传统说法[1-4]。传统的正岩区一般都在武夷山自然保护区核心区,国家保护政策严禁开垦新茶园和扩大旧茶园种植面积,甚至老茶树死亡补种新茶苗都要经管理部门核实后报备。因此进一步扩展“正岩”种植区已无可能。为了满足消费者需求,武夷山茶农在非正岩区大量开垦新茶园,或改造农田为茶园。通过茶园管理以提高洲茶品质,是武夷岩茶发展的必然之路。
武夷山生态自然环境是形成武夷岩茶优异品质的重要原因[5-6]。土壤是茶树生长的基础,土壤肥力、土壤酶及矿质元素是影响茶树生长及其茶叶品质的主要因素。福建省农业科学研究院茶叶研究所土肥室调查认为,正岩区茶园土壤含砂砾量较多,质地以轻壤为主,土层较厚,土壤疏松,孔隙度在50%左右,通透性好,土壤有机质极为丰富,pH值适中,钾锰含量高,因此正岩茶岩韵明显、香气馥郁。半岩区土壤主要是厚层岩红土,土层较薄,铝含量高,钾特少,酸度较高,质地较粘重,岩韵略逊于正岩茶[7]。洲茶区也称丹岩区,其土壤主要为含砾量少的黄壤土、冲积土,品质最低。姚月明[3]的分析结果表明,正岩区茶园土壤磷钾最高,其次是半岩区,最低是洲茶区,而茶园氮素含量正好相反。孙威江等[8-9]研究表明,丹岩区与名岩区茶园土壤钾、锌、交换性镁含量和pH值差异极显著,鲜叶锰、锌、镁含量差异极显著,认为适当增施有机肥和钾肥、锰肥、锌肥和镁肥能提高武夷岩茶香气物质含量。林贵英[10]分析结果表明,正岩区茶园土壤有效镁和速效钾的含量较高,各理化指标均衡,符合茶园土壤中矿质元素的合理比例,镁和钾元素有助于提高茶树橙花叔醇、橙花醇、雪松醇等特征香气组分的含量。正岩和洲茶茶叶品质的显著差异,还体现在二者茶青收购价格相差10~20倍。为此,正岩区以品质为上,茶园施肥相对谨慎,主要以有机肥为主,辅助以补充有机质。而洲茶区以产量为准,化肥用量相对较多。通过施肥措施调控土壤肥力,增强土壤酶活性,改善土壤结构,提高茶树产量品质的研究,一直是茶研究人员关注的热点[11-15]。相比之下,对武夷岩茶不同茶园土壤肥力水平、土壤酶活性对茶树生长及品质影响的相关性程度的综合分析相对较少[8-9, 16]。鲜叶品质是优质武夷岩茶的源头,为比较不同种植区土壤特性对茶青品质的影响,本文以武夷山不同区域种植的大红袍茶树为研究对象,分析其土壤理化性质及茶树生长光合与品质指标,比较之间的差异并分析各类指标之间的相关性,为合理管理不同区域茶园,提高鲜叶品质提供研究基础。
1 材料与方法 1.1 茶园选择本研究选择大红袍茶树品种来源可靠、种植历史清晰、茶园管理规范,且有政府认定资质的3个茶树种质资源保护区。正岩区为武夷山风景区御茶园(北纬27°38′42″~27°38′45″,东经117°56′38″~117°56′44″)。半岩区为武夷山风景区梅子桥龟岩茶园(北纬27°36′26″~27°36′34″,东经117°57′52″~117°58′01″)。洲茶区为武夷山旗山科技工业园茶园(北纬27°42′51″~27°43′37″,东经117°59′58″~118°00′26″)。本研究样品采集均在2014年4—5月茶叶采摘季节进行。
1.2 方法与步骤茶园土壤取样:采用等距离取样法,将长条形大红袍种植区分为5等分,取每等分中心位置的三颗茶树为1个样本,取3个样本。在茶树主根部半径20 cm周围,收集5~35 cm深度土壤。鲜土参照“土壤酶及其研究法”[17],测定过氧化氢酶、蔗糖酶、脲酶、酸性、多酚氧化酶和蛋白酶活性。重复3次。土壤样品自然风干碾碎,去除残枝残根,过60目筛,四分法取1 kg为测定样。土壤的理化指标参照“土壤农化分析手册”[18],测定土壤pH值、总氮、总磷、总钾、有效氮、有效磷和有效钾。土壤有机质采用重铬酸钾-硫酸消化法测定[19]。重复3次。测定结果参照中华人民共和国农业行业标准—“茶叶产地环境技术条件”[20]确定土壤肥力等级。
1.3 茶树叶片生长与光合指标测定以取样点之茶树为样本,于茶叶采摘前对大红袍茶树的着叶数、芽梢密度、叶面积、百芽重等生长指标进行测定。着叶数:于大红袍种植区内随机选取20个成熟新梢观察叶片数,重复3次。芽梢密度:于大红袍种植区内随机放置面积为0.1 m2的测定框,调查框内的发芽密度,重复6次。叶面积:于大红袍种植区内随机选取成熟新梢叶片20片,测量叶长和叶宽,按长×宽×0.7计算叶面积,重复3次。百芽重:于大红袍种植区内随机选取驻芽3~4叶的标准芽梢100个,称其重量,重复3次。茶树叶片光合指标采用LI-6400XT便携式光合仪(美国LI-COR)测定;叶绿素含量采用叶绿素仪(日本SPAD-502 PLUS),测定时间为有阳光的上午9 : 00—11 : 00点,茶叶采摘前选取成熟新梢叶片第2片功能叶,重复6次。
1.4 茶树叶片品质指标测定取当年成熟新梢叶片为样本,采用等距离取样法,将长条形的茶树种植区分为5等分,取每等分中心位置的5株茶树为1个样本,取3个样本。采摘标准为顶叶小开面,一芽三叶。鲜叶于105 ℃下杀青15 min,80 ℃烘干至至足干,研磨,过60目筛,3个重复。参照中华人民共和国国家标准测定茶多酚和儿茶素[21]、游离氨基酸[22]、茶氨酸[23]、咖啡碱[24]、水浸出物[25]含量。可溶性糖含量的测定参照李合生[26]的方法。鲜叶在105 ℃条件干燥60 min,80 ℃烘干至足干。
1.5 数据处理采用EXCEL 2010对数据进行统计与方差分析,采用DPS 7.05数据处理系统对数据进行显著性与相关性分析。
2 结果与分析 2.1 茶树土壤理化指标分析大红袍茶树土壤理化指标测定结果表明(表 1):土壤的pH值和总氮为旗山>龟岩>御茶园,且三者之间存在显著性差异(P < 0.05);总磷和有效氮为旗山>龟岩≈御茶园,旗山与其他两个茶园之间存在显著性差异(P < 0.05);总钾、有效钾和有机质为御茶园>龟岩>旗山,且三者之间存在显著性差异(P < 0.05);有效磷为龟岩>御茶园>旗山,且三者之间存在显著性差异(P < 0.05)。总体上看,3个茶园的土壤pH值均在4.5~5.0之间,符合茶树生长最适酸度范围。参照中华人民共和国农业行业标准—“茶叶产地环境技术条件”(NY/T853,2005)确定3个茶园肥力指数。氮磷钾含量虽然存在差异,但都达到茶树种植的Ⅰ级肥力优良水平。在有机质含量上,御茶园为Ⅰ级肥力水平,龟岩为Ⅱ级肥力水平,而旗山为Ⅲ级肥力水平。御茶园有机质含量是旗山的1.86倍。
| 茶园 Plantation |
pH值pH value | 总氮含量 Total N content /(g·kg-1) |
总磷含量 Total P content /(g·kg-1) |
总钾含量 Total K content /(g·kg-1) |
有效氮含量 Available N content /(mg·kg-1) |
有效磷含量 Available P content /(mg·kg-1) |
有效钾含量 Available K content /(mg·kg-1) |
有机质含量 Organic matter content /(g·kg-1) |
| 御茶园Yu | 4.57±0.01c | 1.21±0.01c | 0.86±0.01b | 12.14±0.03a | 134.23±0.55b | 13.22±0.13b | 135.73±1.17a | 17.16±0.08a |
| 龟岩Guiyan | 4.75±0.01b | 1.25±0.02b | 0.85±0.01b | 10.30±0.04b | 135.63±1.05b | 13.83±0.03a | 130.37±2.22b | 13.28±0.06b |
| 旗山Qishan | 4.80±0.01a | 1.30±0.02a | 0.90±0.02a | 10.11±0.03c | 140.52±1.67a | 12.56±0.01c | 120.49±1.98c | 9.21±0.05c |
| 注:小写字母表示不同茶园差异显著, P < 0.05。Note: the lowercases represent a significant difference in the different plantations, P < 0.05. | ||||||||
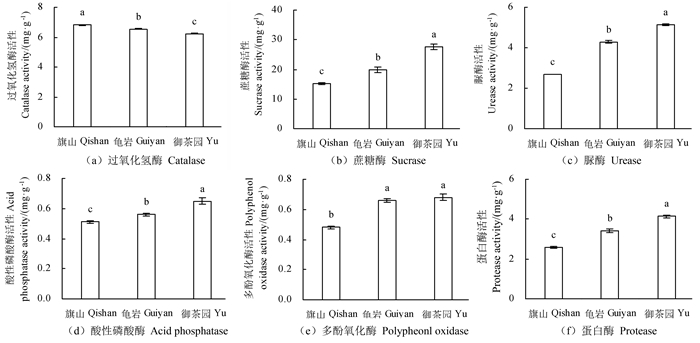
大红袍茶树土壤酶活性测定结果表明(图 1):过氧化氢酶活性为旗山>龟岩>御茶园,且3个茶园之间存在显著性差异(P < 0.05);蔗糖酶、脲酶、酸性磷酸酶和蛋白酶活性为御茶园>龟岩>旗山,且3个茶园之间存在显著性差异(P < 0.05);多酚氧化酶活性御茶园≈龟岩>旗山,旗山与其他两个茶园之间存在显著性差异(P < 0.05)。总体上看,多酚氧化酶的趋势与其他土壤酶趋势相反。
|
注:不同小写字母表示不同茶园差异显著,P < 0.05。Note:different lowercases mean significant difference, P < 0.05 in the different plantations. 图 1 不同茶园茶树土壤酶活性 Fig. 1 The soil enzymatic activity of the tea tree in the different plantations |
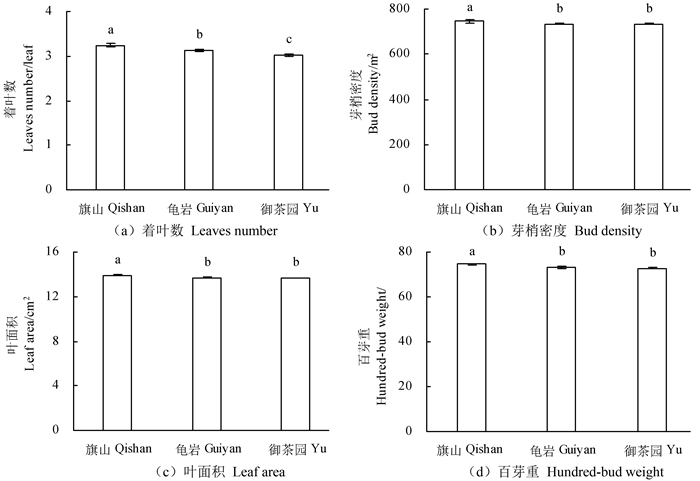
大红袍茶树生长指标测定结果表明(图 2):着叶数为旗山>龟岩>御茶园,且3个茶园之间达到显著性差异(P < 0.05);芽梢密度、叶面积和百芽重为旗山>龟岩≈御茶园,旗山与龟岩和御茶园之间达到显著性差异(P < 0.05)。总体上看,以旗山的大红袍茶树生长最为旺盛,茶青产量为最高。
|
注:不同小写字母表示不同茶园差异显著,P < 0.05。Note:different lowercases mean significant difference in the different plantations,P < 0.05. 图 2 不同茶园茶树生长指标 Fig. 2 Growth parameter of tea tree in the different plantations |
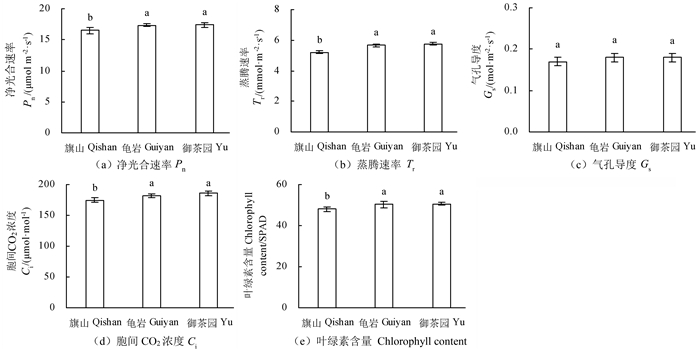
大红袍叶片光合指标测定结果表明(图 3):3个茶园之间的光合作用速率、胞间CO2浓度、蒸腾速率和叶绿素含量均为御茶园≈龟岩>旗山,御茶园和龟岩与旗山之间具有显著性差异(P < 0.05),而气孔导度在3个茶园之间没有显著差异。总体上看,御茶园和龟岩的大红袍叶片光合作用比旗山为强。
|
注:不同小写字母表示不同茶园差异显著,P < 0.05。Note:different lowercases mean significant difference in the different plantations,P < 0.05. 图 3 不同茶园茶树叶片光合指标 Fig. 3 Photosynthesis parameter of tea leaves in the different plantations |
茶树叶片品质指标测定结果表明(表 2),叶片中茶多酚、可溶性糖、水浸出物、儿茶素含量均为御茶园>龟岩>旗山,且3个茶园之间存在显著性差异;游离氨基酸总量和茶氨酸含量为龟岩>御茶园>旗山,且3个茶园之间存在显著性差异;咖啡碱含量为旗山>御茶园>龟岩,且3个茶园之间存在显著性差异;御茶园茶树叶片茶多酚、游离氨基酸、可溶性糖、水浸出物、儿茶素、茶氨酸含量分别是旗山茶树叶片的1.39、1.56、1.05、1.21、1.30、1.83倍(表 2)。从总体上看,御茶园大红袍的叶片品质最高,龟岩次之,旗山为最低。
| 茶园 Plantation |
茶多酚含量 Tea polyphenol content/% |
游离氨基酸含量 Free amino acid content/% |
咖啡碱含量 Caffeine content/% |
可溶性糖含量 Soluble sugar content/% |
水浸出物含量 Aqueous extracts content/% |
儿茶素含量 Catechin content /(mg·g-1) |
茶氨酸含量 Theanine content /(mg·g-1) |
| 御茶园Yu | 24.55±0.37a | 2.73±0.09b | 2.26±0.05b | 8.44±0.04a | 46.71±0.77a | 95.29±2.38a | 16.84±0.17b |
| 龟岩Guiyan | 21.50±0.29b | 3.31±0.06a | 2.03±0.03c | 8.25±0.07b | 44.07±1.09b | 85.14±1.81b | 17.85±0.46a |
| 旗山Qishan | 17.71±0.05c | 1.75±0.01c | 3.12±0.08a | 8.03±0.07c | 38.73±0.09c | 73.03±1.04c | 9.19±0.20c |
| 注:同列数值后不同小写字母表示不同茶园差异显著,P < 0.05。Note:different lowercases in the same column mean significant difference in the different plantations,P < 0.05. | |||||||
茶树土壤理化指标与土壤酶活性相关性分析结果表明(表 3),土壤过氧化氢酶活性与土壤pH值、总氮和有效氮呈显著(P < 0.05)或极显著(P < 0.01)正相关,而与有效钾和有机质呈显著(P < 0.05)或极显著(P < 0.01)负相关。其他土壤酶活性与pH值、总氮和有效氮呈显著(P < 0.05)或极显著(P < 0.01)负相关,而与总钾、有效钾和有机质呈显著(P < 0.05)或极显著(P < 0.01)正相关。与总磷和有效磷也呈现同样趋势但相关性不显著。总体上看,土壤pH值、总氮和有效氮有利于土壤过氧化氢酶,而不利于其他土壤酶活性,而总钾、有效钾和有机质不利于土壤过氧化氢酶活性,但有利于其他土壤酶。
| 指标 Index |
pH值pH value | 总氮含量 Total N content |
总磷含量 Total P content |
总钾含量 Total K content |
有效氮含量 Available N content |
有效磷含量 Available P content |
有效钾含量 Available K content |
有机质含量 Organic matter content |
| 过氧化氢酶Catalase | 0.95* | 1.00** | 0.76 | -0.91 | 0.95* | -0.52 | -0.99* | -1.00** |
| 蔗糖酶Sucrase | -0.98* | -0.98* | -0.66 | 0.96* | -0.90 | 0.40 | 0.95* | 0.99* |
| 脲酶Urease | -0.88 | -0.99** | -0.86 | 0.81 | -0.99** | 0.66 | 1.00** | 0.99* |
| 酸性磷酸酶Acid phosphatase | -0.99* | -0.97* | -0.64 | 0.96* | -0.89 | 0.37 | 0.95 | 0.98* |
| 多酚氧化酶Polyphenol oxidase | -0.73 | -0.93 | -0.96 | 0.64 | -0.99** | 0.83 | 0.97* | 0.91 |
| 蛋白酶Protease | -0.94 | -1.00** | -0.78 | 0.89 | -0.96* | 0.55 | 0.99** | 1.00** |
| 注:*表示显著相关,P<0.05,**表示极显著相关,P<0.01。Note: * and ** represent a significant correlation level at P < 0.05 and at P < 0.01, respectively. | ||||||||
茶园土壤指标与茶树生长指标的相关性分析结果表明(表 4),土壤pH值与着叶数,总氮与着叶数和叶面积,有效氮与芽梢密度、叶面积和百芽重,以及总磷与芽捎密度、百芽重呈显著(P < 0.05)或极显著(P < 0.01)正相关,总钾和有机质与着叶数,有效钾与叶面积、百芽重呈显著(P < 0.05)或极显著(P < 0.01)负相关。土壤过氧化氢酶与着叶数呈显著(P < 0.05)正相关,而其他酶与茶树生长指标主要呈显著(P < 0.05)或极显著(P < 0.01)负相关。总体上看,土壤pH值、总氮、有效氮和总磷,以及土壤过氧化氢酶有利于茶树生长,而总钾、有效钾和有机质,以及土壤其他酶不利于茶树生长。
| 指标Index | pH值pH value | 总氮含量 Total N content |
总磷含量 Total P content |
总钾含量 Total K content |
有效氮含量 Available N content |
有效磷含量 Available P content |
有效钾含量 Available K content |
有机质含量 Organic matter content |
过氧化氢酶活性Catalase activity | 蔗糖酶活性 Sucrase activity |
脲酶活性 Urease activity |
酸性磷酸酶活性 Acid phosphatase activity |
多酚氧化酶活性Polyphenol oxidase activity | 蛋白酶活性 Protease activity |
| 着叶数Leaf number | 0.99* | 0.97* | 0.63 | -0.96* | 0.89 | -0.37 | -0.94 | -0.98* | 0.99* | -1.00** | -0.94 | -1.00** | -0.82 | -0.98* |
| 芽梢密度Bud density | 0.67 | 0.90 | 0.98* | -0.58 | 0.98* | -0.87 | -0.94 | -0.88 | 0.87 | -0.79 | -0.94 | -0.78 | -1.00** | -0.89 |
| 叶面积Leaf area | 0.77 | 0.95* | 0.94 | -0.68 | 1.00** | -0.80 | -0.98* | -0.93 | 0.93 | -0.87 | -0.98* | -0.86 | -1.00** | -0.94 |
| 百芽重Hundred-bud weight | 0.75 | 0.94 | 0.95* | -0.66 | 1.00** | -0.82 | -0.97* | -0.92 | 0.92 | -0.85 | -0.97* | -0.84 | -1.00** | -0.93 |
| 净光合速绿Pn | -0.72 | -0.92 | -0.97* | 0.63 | -0.99* | 0.84 | 0.96* | 0.90 | -0.90 | 0.83 | 0.96* | 0.81 | 1.00** | 0.91 |
| 气孔导度Gs | -0.67 | -0.90 | -0.98* | 0.57 | -0.98* | 0.88 | 0.94 | 0.87 | -0.87 | 0.79 | 0.94 | 0.77 | 1.00** | 0.89 |
| 胞间CO2浓度Ci | -0.88 | -0.99** | -0.86 | 0.82 | -0.99** | 0.66 | 1.00** | 0.99* | -0.98* | 0.95 | 1.00** | 0.94 | 0.97* | 0.99** |
| 蒸腾速率Tr | -0.79 | -0.96* | -0.93 | 0.71 | -1.00** | 0.78 | 0.98* | 0.94 | -0.94 | 0.88 | 0.99* | 0.87 | 1.00** | 0.95* |
| 叶绿素含量Chlorophyll content | -0.75 | -0.94 | -0.95* | 0.66 | -1.00** | 0.81 | 0.97* | 0.92 | -0.92 | 0.85 | 0.97* | 0.84 | 1.00** | 0.93 |
| 注:*表示显著相关,P<0.05,**表示极显著相关,P<0.01。Note: * and ** represent a significant correlation level at P < 0.05 and at P < 0.01, respectively. | ||||||||||||||
茶园土壤指标与茶树叶片光合指标的相关性分析结果表明(表 4),总氮与胞间CO2浓度、蒸腾速率,总磷与光合速率、气孔导度和叶绿素含量,有效氮与5个光合指标呈显著(P < 0.05)或极显著(P < 0.01)负相关。有效钾与4个光合指标(除气孔导度外),有机质与胞间CO2浓度呈显著(P < 0.05)或极显著(P < 0.01)正相关。土壤过氧化氢酶与胞间CO2浓度呈显著(P < 0.05)负相关,脲酶与4个光合指标(除气孔导度外),多酚氧化酶与5个光合指标,以及蛋白酶与胞间CO2浓度、蒸腾速率呈显著(P < 0.05)或极显著(P < 0.01)正相关。而pH值、总钾、有效磷、蔗糖酶和酸性磷酸酶与光合指标的相关性不显著。总体上看,土壤总氮、总磷、有效氮以及土壤过氧化氢酶不利于茶树叶片光合作用,而有效钾、有机质和脲酶、多酚氧化酶和蛋白酶有利于茶树叶片光合作用。
茶园土壤指标与茶树叶片品质指标的相关性分析结果表明(表 5),土壤总氮和有效氮与茶多酚、可溶性糖、水浸出物和儿茶素呈显著(P < 0.05)或极显著(P < 0.01)负相关。有效钾和有机质与茶多酚、可溶性糖、水浸出物和儿茶素呈极显著(P < 0.01)正相关。总磷与游离氨基酸和茶氨酸、有效磷与咖啡碱呈显著(P < 0.05)或极显著(P < 0.01)负相关,而总磷与咖啡碱、有效磷与游离氨基酸极显著(P < 0.01)正相关。土壤pH值与所有品质指标(除咖啡碱外)的相关性系数为负值,但都没有达到显著性水平。土壤过氧化氢酶与茶多酚、可溶性糖、水浸出物和儿茶素呈显著(P < 0.05)或极显著(P < 0.01)负相关。而蔗糖酶、脲酶、酸性磷酸酶和蛋白酶与茶多酚、可溶性糖、水浸出物和儿茶素呈显著(P < 0.05)或极显著(P < 0.01)正相关。多酚氧化酶与咖啡碱呈显著(P < 0.05)负相关,而与茶氨酸呈显著(P < 0.05)正相关。总体上看,总氮和总磷以及过氧化氢酶不利于茶叶品质提高,而有效钾和有机质和其他土壤酶有利于茶叶品质提高。
| 指标Index | pH值pH value | 总氮 Total N |
总磷 Total P |
总钾 Total K |
有效氮 Available N |
有效磷 Available P |
有效钾 Available K |
有机质 Organic matter |
过氧化氢酶 Catalase |
蔗糖酶 Sucrase |
脲酶 Urease |
酸性磷酸酶 Acid phosphatase |
多酚氧化酶 Polyphenol oxidase |
蛋白酶 Protease |
| 茶多酚Tea polyphenol | -0.93 | -1.00** | -0.80 | 0.88 | -0.97* | 0.57 | 0.99** | 1.00** | -1.00** | 0.98* | 0.99** | 0.97* | 0.93 | 1.00** |
| 游离氨基酸Free amino acid | -0.35 | -0.67 | -0.98* | 0.23 | -0.83 | 0.99** | 0.74 | 0.63 | -0.62 | 0.51 | 0.75 | 0.49 | 0.89 | 0.65 |
| 咖啡碱Caffeine | 0.51 | 0.79 | 1.00** | -0.40 | 0.92 | -0.96* | -0.85 | -0.76 | 0.75 | -0.65 | -0.86 | -0.63 | -0.96* | -0.77 |
| 可溶性糖Soluble sugar | -0.94 | -1.00** | -0.78 | 0.89 | -0.96* | 0.56 | 0.99** | 1.00** | -1.00** | 0.98* | 0.99** | 0.98* | 0.92 | 1.00** |
| 水浸出物Aqueous extracts | -0.94 | -1.00** | -0.78 | 0.89 | -0.96** | 0.56 | 0.99** | 1.00** | -1.00** | 0.98* | 0.99** | 0.98* | 0.92 | 1.00** |
| 儿茶素Catechin | -0.93 | -1.00** | -0.79 | 0.88 | -0.97* | 0.56 | 0.99** | 1.00** | -1.00** | 0.98* | 0.99** | 0.98* | 0.93 | 1.00** |
| 茶氨酸Theanine | -0.59 | -0.84 | -1.00** | 0.48 | -0.95 | 0.92 | 0.90 | 0.82 | -0.81 | 0.72 | 0.90 | 0.70 | 0.98* | 0.83 |
| 注:*表示显著相关,P<0.05,**表示极显著相关,P<0.01。Note: * and ** represent a significant correlation level at P < 0.05 and at P < 0.01, respectively. | ||||||||||||||
本文系统研究了武夷山大红袍在御茶园、龟岩和旗山3个种植区的地下部(土壤)和地上部(茶树)相关指标的相关性。结果表明,3个不同种植区的大红袍茶树土壤的氮磷钾元素都达到茶树Ⅰ级肥力指标(表 1),说明了3个茶园之茶树都不缺乏营养元素。但在有机质含量上存在明显差异,表现在御茶园的有机质达到Ⅰ级标准,旗山只达到Ⅲ级标准,二者相差接近2倍。从叶片品质指标上看(表 2),御茶园的综合品质最高,龟岩居中,旗山最低。大量研究表明武夷山不同种植区域的茶叶品质符合正岩>半岩>洲茶,且茶叶品质与土壤理化性质存在明显的相关性[2-6, 9-10, 16, 27]。因此土壤有机质含量是本研究中影响大红袍鲜叶品质的主要因素之一。
土壤酶在土壤养分的循环、转化、利用上发挥着重要的作用,是衡量土壤肥力及土壤中物质代谢的重要指标之一[28-31]。pH值、氮素及有机质是影响山地土壤酶活性的主要因素[32-34]。值得注意的是,旗山茶树土壤的pH值和氮素含量都显著高于其他两个茶园,这个结果与孙威江等[9]报道的丹岩区氮高于名岩区的结果一致。然而,土壤pH值、氮素和过氧化氢酶活性的趋势为旗山>龟岩>御茶园,与大红袍叶片品质指标的趋势正好相反。相关性分析结果表明(表 3),土壤pH值和氮素与土壤过氧化氢酶活性呈显著正相关,而与其他土壤酶活性呈显著负相关,钾和有机质与过氧化氢酶活性的相关性正好相反。孙慧等[35]研究表明土壤pH和有机质是过氧化氢酶活性的主导作用因子,氮素其次。李贞霞等[13]研究结果表明,土壤过氧化氢酶活性与土壤碱解氮、有机质、速效钾、NH4+-N呈显著负相关。氮素过多,水解速度加快,使局部土壤pH值上升,氨态氮挥发并产生亚硝酸盐[17]。过氧化氢酶促进土壤中对植物有害的自由基过氧化氢分解为水和氧气。氧气过多可能使亚硝酸盐转化为硝酸盐,硝酸盐积累的副作用是抑制蛋白酶活性和有机氮的转化[17]。因此高pH值和高氮促进了土壤过氧化氢酶活性,抑制了土壤其他酶活性,不利于土壤营养元素的循环、转化与利用。茶树叶片品质指标与氮素和土壤过氧化氢酶活性呈显著负相关,而与钾、有机质以及土壤酶活性(过氧化氢酶除外)呈显著正相关(表 3)。因此,御茶园大红袍品质高于旗山茶园,是与土壤理化指标及土壤酶活性呈一致性有关联的。
土壤理化性质和酶活性也影响茶树生长。土壤pH值、氮素与过氧化氢酶活性与着叶数、叶面积呈显著正相关(表 4)。旗山大红袍生长指标为最高(图 2),与其土壤高pH值、高氮和高过氧化氢酶活性(表 1、图 2)是一致的。高氮可使局部土壤pH值上升,过氧化氢酶活性增强,虽然有利于茶树叶片生长,但其他土壤酶活性降低了,使养分和有机质的循环转化利用降低,进而影响了叶片光合作用,降低了初生代谢和次生代谢物质合成,叶片品质下降。从武夷山茶农的实践看,正岩区茶园以品质为上,少施或不施化肥,多施有机肥是主要的施肥方案。而洲茶区以产量(卖茶青)为目的,多施氮肥提高产量进而提高效益是主要目的。鉴于此,从提高品质上,武夷山洲茶区茶园应以“减氮控磷补钾,增加有机质”,以施有机肥为主要措施,可有效提高洲茶区茶叶品质。通过合理间作套作绿肥等植物,也能改良土壤并提高茶叶产量与品质[36]。
需要指出的是,除了土壤理化性质,土壤质地、施肥结构与管理模式、植茶年限、凋落物以及不同茶园的生态环境等,都影响着土壤酶活性,进而影响茶树生长与品质[11-15, 37-40]。本文主要是基于现有茶园的原位取样,研究武夷山不同种植区大红袍的土壤理化性质、土壤酶活性和茶树生长与鲜叶品质之间的相关性。根据不同种植区土壤质地与肥力状况,结合具体茶园实际,通过综合管理措施,以兼顾武夷岩茶的产量与品质,还需要做更深入的研究。以大红袍为代表的武夷岩茶品质与茶园地理位置和管理模式相关[2-6, 9-10, 16, 27, 41-44],因此研究不同茶园土壤特性与鲜叶品质的相关性,在现有茶园生态条件下,通过改良土壤性质,可以有效提高武夷岩茶茶叶品质。
| [1] |
陆羽. 茶经[M]. 南京: 凤凰出版社, 2007.
|
| [2] |
林心炯, 李元钦, 吴静如. 武夷岩茶品质与生态环境初步的研究[J]. 茶叶科学简报, 1986(1): 25-28. |
| [3] |
姚月明. 形成武夷岩茶品质特征的相关因子[J]. 福建茶叶, 1997(3): 25-26. |
| [4] |
叶乃兴, 郑乃辉, 杨江帆. 福建名茶与原产地保护[J]. 福建农林大学学报(自然科学版), 2004, 33(4): 459-462. |
| [5] |
陈岱卉, 郭雅玲. 大红袍研究进展[J]. 福建茶叶, 2011, 33(1): 28-31. DOI:10.3969/j.issn.1005-2291.2011.01.008 |
| [6] |
陈华葵, 杨江帆. 武夷岩茶不同岩区品质形成研究进展[J]. 食品安全质量检测学报, 2016, 7(1): 257-262. |
| [7] |
冯卫虎. 武夷岩茶"岩韵"形成的体会[J]. 福建茶叶, 2000(4): 43. DOI:10.3969/j.issn.1005-2291.2000.04.028 |
| [8] |
孙威江, 陈泉宾. 武夷岩茶[M]. 北京: 中国轻工业出版社, 2006: 32-34.
|
| [9] |
孙威江, 陈泉宾, 林锻炼, 等. 武夷岩茶不同产地土壤与茶树营养元素的差异[J]. 福建农林大学学报(自然科学版), 2008, 37(1): 47-50. |
| [10] |
林贵英. 土壤理化性状对武夷岩茶品质的影响[J]. 福建茶叶, 2005(3): 23-25. DOI:10.3969/j.issn.1005-2291.2005.03.012 |
| [11] |
杨广容, 王秀青, 谢瑾, 等. 云南古茶园和现代茶园土壤养分与茶叶品质成分关系的研究[J]. 茶叶科学, 2015, 35(6): 574-582. DOI:10.3969/j.issn.1000-369X.2015.06.009 |
| [12] |
朱旭君, 王玉花, 张瑜, 等. 施肥结构对茶园土壤氮素营养及茶叶产量品质的影响[J]. 茶叶科学, 2015, 35(3): 248-254. DOI:10.3969/j.issn.1000-369X.2015.03.008 |
| [13] |
李贞霞, 陈倩倩, 胡宏赛, 等. 信阳茶区不同植茶年限土壤酶活性演变[J]. 生态环境学报, 2018, 27(6): 1076-1081. |
| [14] |
王利民, 李卫华, 范平, 等. 长期培肥下红黄壤区茶园土壤酶活性的变化[J]. 茶叶科学, 2012, 32(4): 347-352. DOI:10.3969/j.issn.1000-369X.2012.04.010 |
| [15] |
王利民, 黄东风, 李清华, 等. 不同培肥方式对茶园土壤团聚体中有机碳和全氮分布的影响[J]. 茶叶科学, 2018, 38(4): 342-352. DOI:10.3969/j.issn.1000-369X.2018.04.002 |
| [16] |
叶江华, 罗盛财, 张奇, 等. 武夷山不同茶园茶树茶青品质的差异[J]. 福建农林大学学报(自然科学版), 2017, 46(5): 495-501. |
| [17] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986.
|
| [18] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.
|
| [19] |
中华人民共和国农业行业标准.土壤有机质测定法: NY/T 85-1988[S].1988.
|
| [20] |
中华人民共和国农业部.茶叶产地环境技术条件: NY/T 853-2004[S].北京: 中国农业出版社, 2005.
|
| [21] |
中华全国供销合作总社.茶叶中茶多酚和儿茶素类含量的检测方法: GB/T 8313-2008[S].北京: 中国标准出版社, 2008.
|
| [22] |
中华全国供销合作总社.茶: 游离氨基酸总量的测定: GB/T 8314-2013[S].北京: 中国标准出版社, 2013.
|
| [23] |
国家食品质量安全监督检验中心.茶叶中茶氨酸的测定高效液相色谱法: GB/T 23193-2008[S].北京: 中国标准出版社, 2008.
|
| [24] |
中华全国供销合作总社.茶: 咖啡碱测定: GB/T 8312-2013[S].北京: 中国标准出版社, 2013.
|
| [25] |
中华全国供销合作总社.茶: 水浸出物测定: GB/T 8305-2013[S].北京: 中国标准出版社, 2013.
|
| [26] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
|
| [27] |
陈泉宾, 孙威江. 武夷岩茶品质影响因素的研究现状[J]. 福建茶叶, 2003(3): 44-46. DOI:10.3969/j.issn.1005-2291.2003.03.027 |
| [28] |
ZHANG Z C, HE X L, LI T X. Status and evaluation of the soil nutrients in tea plantation[J]. Procedia Environmental Sciences, 2012, 12: 45-51. DOI:10.1016/j.proenv.2012.01.245 |
| [29] |
LI W, ZHENG Z C, LI T X, et al. Effect of tea plantation age on the distribution of soil organic carbon fractions within water-stable aggregates in the hilly region of western Sichuan, China[J]. CATENA, 2015, 133: 198-205. DOI:10.1016/j.catena.2015.05.017 |
| [30] |
HILL B H, ELONEN C M, SEIFERT L R, et al. Microbial enzyme stoichiometry and nutrient limitation in US streams and rivers[J]. Ecological Indicators, 2012, 18: 540-551. DOI:10.1016/j.ecolind.2012.01.007 |
| [31] |
杨敏芳, 朱利群, 韩新忠, 等. 耕作措施与秸秆还田对稻麦两熟制农田土壤养分、微生物生物量及酶活性的影响[J]. 水土保持学报, 2013, 27(2): 272-275, 281. |
| [32] |
李涵诗, 邢世和, 骆杰宇, 等. 不同利用方式下山地土壤酶活性对有机物输入的响应[J]. 森林与环境学报, 2015, 35(4): 317-323. |
| [33] |
郑钰铟, 胡素萍, 陈辉, 等. 油茶饼粕生物炭和有机肥对土壤酶活性的影响[J]. 森林与环境学报, 2018, 38(3): 348-354. |
| [34] |
索沛蘅, 杜大俊, 王玉哲, 等. 杉木连栽对土壤氮含量和氮转化酶活性的影响[J]. 森林与环境学报, 2019, 39(2): 113-119. |
| [35] |
孙慧, 张建锋, 胡颖, 等. 土壤过氧化氢酶对不同林分覆盖的响应[J]. 土壤通报, 2016, 47(3): 605-610. |
| [36] |
MA Y H, FU S L, ZHANG X P, et al. Intercropping improves soil nutrient availability, soil enzyme activity and tea quantity and quality[J]. Applied Soil Ecology, 2017, 119: 171-178. DOI:10.1016/j.apsoil.2017.06.028 |
| [37] |
叶江华, 王海斌, 李远华, 等. 不同树龄茶树根际土壤酶活性的变化分析[J]. 中国土壤与肥料, 2016(5): 25-29. |
| [38] |
WANG S P, LI T X, ZHENG Z C, et al. Effects of tea plantation age on soil aggregate-associated C-and N-cycling enzyme activities in the hilly areas of Western Sichuan, China[J]. CATENA, 2018, 171: 145-153. DOI:10.1016/j.catena.2018.07.010 |
| [39] |
GUO J H, LIU X J, ZHANG Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 32(7): 1008-1010. |
| [40] |
王理德, 王方琳, 郭春秀, 等. 土壤酶学硏究进展[J]. 土壤, 2016, 48(1): 12-21. |
| [41] |
陈躬瑞, 林惠玉, 刘志彬, 等. 武夷岩茶的感官定量描述分析[J]. 中国食品学报, 2013, 13(7): 222-228. |
| [42] |
吕世懂, 吴远双, 姜玉芳, 等. 不同产区乌龙茶香气特征及差异分析[J]. 食品科学, 2014, 35(2): 146-153. |
| [43] |
柴斐, 郭雯飞. 烘干大红袍和冰冻大红袍香气成分分析与比较[J]. 浙江大学学报(理学版), 2010, 37(4): 459-462. DOI:10.3785/j.issn.1008-9497.2010.04.020 |
| [44] |
刘建福, 高俊杰, 田奥磊, 等. 武夷岩茶氨基酸组分及含量分析[J]. 热带作物学报, 2017, 38(2): 283-287. DOI:10.3969/j.issn.1000-2561.2017.02.016 |

 2019, Vol. 39
2019, Vol. 39


