文章信息
- 粟春青, 蒋霞, 亢亚超, 赵苹羽, 王凌晖, 滕维超
- SU Chunqing, JIANG Xia, KANG Yachao, ZHAO Pingyu, WANG Linghui, TENG Weichao
- 金花茶幼苗对铅胁迫的生长生理响应
- Growth and physiological response of Camellia petelotii seedlings to Pb stress
- 森林与环境学报,2019, 39(5): 467-474.
- Journal of Forest and Environment,2019, 39(5): 467-474.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.05.004
-
文章历史
- 收稿日期: 2019-04-17
- 修回日期: 2019-06-22
2. 广西南宁树木园, 广西 南宁 530000
2. Guangxi Nanning Arboretum, Guangxi Zhuang Autonomous Region, Nanning, Guangxi 530000, China
铅(Pb)是植物生长非必需元素,但研究表明,植物对铅胁迫具有调节机制,对于较低程度的铅毒害可以自我恢复,但当土壤铅含量过高时,则会抑制植物生长[1]。现今铅是世界范围内最常见、危害最大的重金属元素之一[2],随着工农业生产的进一步发展,大气污染和杀虫剂使用等带来了大量铅沉积,而有关降低铅毒害方面,传统的技术已有很多研究,如隔离包埋、固化稳定、化学稳定、微生物修复等,却不一定都切实有效,植物修复是一种很有前景、相对简单高效的替代方法[3]。有关铅胁迫的研究始于20世纪60年代,主要集中在探讨铅对植物生长发育、生理生化、富集转运及缓解等方面,但试验植物多为作物和经济树种[4-5],而园林树种铅污染方面的研究较少。
金花茶[Camellia petelotii (Merr.) Sealy]是山茶科山茶属常绿乔木,自然分布区域小且数量稀少,是我国重点保护植物[6]。金花茶喜暖热,适宜在林下种植,其花色鲜艳,树形优美,可广泛应用于城市绿化,经研究发现,金花茶具有保健和药用功效,如金花茶叶可用于治疗止痢和止血、利尿利湿、清热解毒和抗癌等[7],是一种集观赏、经济、科研、药用等多用途于一体的珍贵树种。目前有关金花茶的研究主要集中在分类[8]、栽培育种[9]、药理[10]等方面,各种胁迫方面的研究较少[11],关于金花茶在重金属胁迫下的耐性研究则未见报道。在我国城市土壤环境普遍存在铅累积的背景下[12],金花茶的实践应用面临铅污染的潜在危险,研究金花茶对铅胁迫的生长生理响应及其适应机制有利于深入了解铅的毒害机理和植物耐受机制,对金花茶的栽培管理具有重要意义。本研究以金花茶幼苗为试验材料,通过测定铅胁迫对金花茶幼苗各项生长生理指标的影响,探讨金花茶幼苗对铅的耐性,以期为金花茶在重金属污染地区的引种栽培及利用金花茶进行土壤修复提供参考依据。
1 材料与方法 1.1 试验地概况试验地位于广西大学林学院苗圃(22°51′23″ N,108°17′13″ E),属亚热带季风气候,年均温约21.7 ℃左右,年均降雨量约1 300 mm,年平均日照时间约1 827 h,光热充足,雨热同期,适合金花茶幼苗生长。
1.2 试验材料金花茶幼苗为长势一致、无病虫害的1年生实生苗(株高21.66 cm,地径3.65 mm),由广西六万林场提供。栽培基质为黏壤土与沙按3:1比例混匀而成,2017年3月将金花茶幼苗移植到有孔塑料花盆中,规格为210 mm(径)×185 mm(高),用灭菌灵进行土壤灭菌,每盆土重约2.8 kg,每盆1株,缓苗1个月后开始进行试验处理。盆栽土壤理化性质为:pH值为7.17、全氮含量0.31 g · kg-1、全磷含量0.073 g · kg-1、全钾含量0.1 g · kg-1,全铅含量52.42 mg · kg-1。药品为纯度99%的分析纯硝酸铅试剂[Pb(NO3)2],购自南宁市羽瑞生物试剂经销部。
1.3 试验方法根据周芙蓉[13]的方法,设置不同浓度铅胁迫处理,采用单因素完全随机区组设计,共设置7个铅浓度0(CK)、62.5、125、250、500、1 000和2 000 mg · kg-1,每个铅处理含苗木12株,共84株。2017年4—9月期间,以干土质量计算施铅量,称取硝酸铅试剂配制成相应浓度的母液,每次每株均匀浇灌200 mL硝酸铅溶液,为避免损耗,盆底放置红色塑料托盘,对照加不含Pb的等量去离子水,每隔15 d浇1次,共处理10次,视苗木生长情况统一进行除草及浇水等管理工作。
1.4 指标测定株高(height, H)、地径(ground diameter, GD)分别用直尺和数显游标卡尺测量,每盆苗木试验前、后各测一次。试验结束后测定苗木叶面积(leaf area, LA),每个处理组随机选取3株苗木,每株选3片成熟叶,用叶面积仪进行测定。试验结束后测量苗木生物量,各处理挖取金花茶苗木3株,分为地上和地下部分,用蒸馏水洗净后吸干水分,称其鲜重;后经105 ℃杀青30 min,70 ℃烘干至恒重,测定干重。
处理结束后,各处理选择成熟功能叶采摘,放在4 ℃冰盒中带回实验室,进行金花茶生理指标的测定。叶绿素含量采用丙酮-乙醇混合提取法[14];丙二醛(malondialdehyde,MDA)含量用硫代巴比妥酸法[15];叶片超氧化物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四唑光化还原法[15];叶片过氧化物酶(peroxidase,POD)活性采用愈创木酚法[15];叶片过氧化氢酶(catalase,CAT)活性采用紫外光吸收法[15];光合特性用LI-6400XT便捷式光合作用测定仪测定。
苗木质量指数(quality index,QI)根据公式(1)计算。用模糊隶属函数法进行综合分析,与铅浓度正相关的指标采用公式(2)计算,负相关的则用1-Ui表示。
| $ 苗木质量指数=苗木总干重/(高径比+茎根比)^{[16]} $ | (1) |
| $ {{U}_{i}}~=({{X}_{i}}-{{X}_{\text{min}}})/({{X}_{\text{max}}}-{{X}_{\text{min}}}) $ | (2) |
式中:Ui为第i个指标的隶属函数值;Xi为金花茶幼苗某个测定指标;Xmax、Xmin分别为该指标的最大值和最小值[17]。
1.5 数据分析采用Excel 2016进行实验数据的统计、制图;用SPSS 17.0进行各指标的方差分析和Pearson相关分析,用Duncan多重比法较检验差异显著性。
2 结果与分析 2.1 铅胁迫对金花茶幼苗株高地径的影响4至9月各处理组金花茶幼苗的株高地径均有所增长,但在不同处理间存在较大差异(表 1)。62.5与125 mg · kg-1铅处理时株高、地径增量均高于CK,但两者差异不显著(P>0.05),其中125 mg · kg-1处理增量最大,株高、地径总增量分别为7.68 cm、1.29 mm,较CK增加了8.63%、4.03%;当铅浓度为250~2 000 mg · kg-1时,金花茶株高、地径增量逐渐下降,极显著低于CK(P < 0.01),2 000 mg · kg-1浓度时株高、地径增量最低,分别为1.33 cm、0.12 mm,是CK的18.81%、9.68%。
| 铅浓度 Pb concentration/(mg·kg-1) |
株高Plant height/cm | 地径Ground diameter/mm | |||||
| 4月 April |
9月 September |
增量 Increment |
4月 April |
9月 September |
增量 Increment |
||
| 0 | 22.19 | 29.26±0.31Aa | 7.07±0.42Bb | 3.66 | 4.90±0.06Aa | 1.24±0.16Aa | |
| 62.5 | 21.42 | 28.88±0.28Aa | 7.46±0.94ABab | 3.61 | 4.86±0.04Aa | 1.25±0.13Aa | |
| 125 | 20.90 | 28.58±0.31Aa | 7.68±0.48Aa | 3.55 | 4.84±0.07Aa | 1.29±0.18Aa | |
| 250 | 21.93 | 26.11±0.26Bb | 4.18±0.38Cc | 3.68 | 4.30±0.06Bb | 0.62±0.25Bb | |
| 500 | 21.35 | 24.63±0.39Cc | 3.28±0.40Dd | 3.66 | 4.05±0.04BCb | 0.39±0.13Cc | |
| 1 000 | 21.89 | 23.95±0.24CDc | 2.06±0.58Ee | 3.72 | 3.93±0.05Cc | 0.21±0.03Dd | |
| 2 000 | 21.66 | 22.99±0.30Dd | 1.33±0.23Ff | 3.65 | 3.77±0.04Cc | 0.12±0.02Dd | |
| 注:大写字母表示(P < 0.01)极显著水平;小写字母表示(P < 0.05)差异显著水平。Note: upper-case letters represent extremely significant difference level(P < 0.01); lower-case letters represent significant difference level(P < 0.05). | |||||||
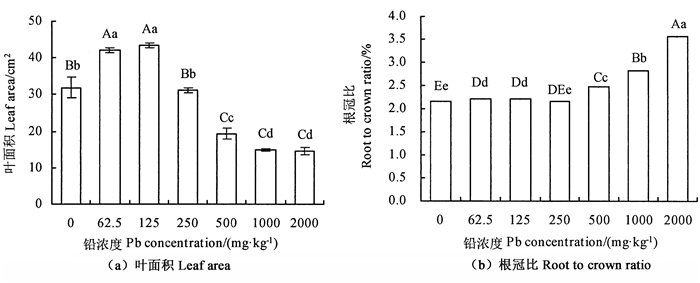
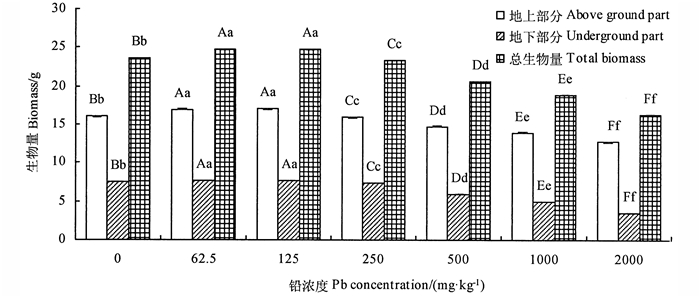
不同铅处理对金花茶幼苗叶面积、生物量的影响极显著(P < 0.01),随着铅胁迫浓度的增加,金花茶植株叶面积和各部分生物量呈先增大后降低的趋势,根冠比则表现为上升趋势(图 1, 图 2)。叶面积、各生物量及根冠比62.5与125 mg · kg-1处理均大于CK,但两者差异不显著,表明低浓度铅处理可在一定程度上促进金花茶生物量积累和叶面积生长;125 mg · kg-1铅浓度吋,叶面积和地上、地下、总生物量均最大,分别为43.4 cm2和7.71、16.99、24.71 g,较CK增加了36.00%、5.59%、3.21%、4.88%;而当铅浓度达250 mg · kg-1时,金花茶叶面积、各部分生物量开始下降,且随着浓度增大,抑制作用越强,2 000 mg · kg-1处理时各指标最小,叶面积和地上、地下、总生物量(total biomass, TB)仅为14.69 cm2和3.57、12.73、16.31 g,为CK的46.03%、79.14%、47.79%、69.21%,此时根冠比最大,是CK的165.58%。
|
注:大写字母表示差异极显著,P < 0.01;小写字母表示差异显著,P < 0.05。Note: upper-case letters represent extremely significant difference,P < 0.01; lower-case letters represent significant difference,P < 0.05. 图 1 铅胁迫对金花茶幼苗叶面积、根冠比的影响 Fig. 1 Effect of Pb stress on leaf area, root-shoot ratio of C. petelotii seedlings |
|
注:大写字母表示差异极显著,P < 0.01;小写字母表示差异显著,P < 0.05。Note: upper-case letters represent extremely significant difference,P < 0.01; lower-case letters represent significant difference,P < 0.05. 图 2 铅胁迫对金花茶幼苗生物量的影响 Fig. 2 Effect of Pb stress on total biomass of C. petelotii seedlings |
随着铅浓度增大,金花茶幼苗叶片MDA含量和抗氧化酶活性呈先降后升的趋势(表 2)。62.5 mg · kg-1铅浓度处理下MDA、抗氧化酶活性最小,分别为15.16 μmol · g-1、1 784.30 U · g-1 · h-1、1 544 U · g-1 · min-1、264 U · g-1 · min-1,低于CK,MDA含量、CAT活性与CK差异不显著(P>0.05),SOD、POD活性较CK极显著降低(P<0.01)。铅浓度高于125 mg · kg-1时,MDA含量和SOD、CAT、POD活性逐渐增大,大于CK,2 000 mg · kg-1铅浓度处理时金花茶叶片MDA含量和抗氧化酶活性最大,分别为27.76 μmol · g-1、2 832.48 U · g-1 · h-1、2 563 U · g-1 · min-1、776 U · g-1 · min-1,与其余铅浓度对比差异极显著(P<0.01)。
| 铅浓度 Pb concentration /(mg·kg-1) |
丙二醛含量 MDA content /(μmol·g-1) |
超氧化物歧化酶活性SOD activity /(U·g-1·h-1) | 过氧化氢酶活性 CAT activity /(U·g-1·min-1) |
过氧化物酶活性 POD activity /(U·g-1·min-1) |
| 0 | 15.99±0.87Dd | 2 091.71±122.38Cd | 1 728±222.56DEde | 456±32.00Cc |
| 62.5 | 15.16±1.06Dd | 1 784.30±208.42De | 1 544±114.82Ee | 264±19.59Dd |
| 125 | 16.41±0.30Dcd | 2 305.53±88.20BCcd | 1 832±191.66CDd | 472±39.19Cc |
| 250 | 18.06±0.65DcC | 2 360.49±171.71BCc | 2 064±203.00BCc | 480±50.60Cc |
| 500 | 20.63±1.05BCb | 2 442.26±53.57Bbc | 2 160±241.33Bbc | 496±59.86Cc |
| 1 000 | 21.37±1.11Bb | 2 631.55±107.34ABab | 2 280±75.89Bb | 616±19.59Bb |
| 2 000 | 27.76±0.38Aa | 2 832.48±36.64Aa | 2 563±5.31Aa | 776±32.00Aa |
| 注:大写字母表示差异极显著,P < 0.01;小写字母表示差异显著,P < 0.05。Note: upper-case letters represent extremely significant difference,P < 0.01; lower-case letters represent significant difference,P < 0.05. | ||||
由表 3可以看出:随着铅浓度增加,金花茶幼苗叶绿素a、叶绿素b和叶绿素a+b含量均呈先升后降的变化趋势。62.5 mg · kg-1处理组下叶绿素a、叶绿素b和叶绿素a+b含量最大,分别为0.29、0.18、0.48 mg · g-1,其次是125 mg · kg-1处理组,两者均大于CK,但差异不大。铅浓度大于125 mg · kg-1时叶绿素含量逐渐下降,与CK间差异增大,2 000 mg · kg-1处理时,含量最低,叶绿素a、叶绿素b和叶绿素a+b含量仅为0.17、0.07、0.24 mg · g-1,是CK的68.00%、46.67%、58.54%。
| 铅浓度 Pb concentration /(mg·kg-1) |
叶绿素a含量 Chlorophyll a content/(mg·g-1) |
叶绿素b含量 Chlorophyll b content/(mg·g-1) |
叶绿素a+b含量 Chlorophyll a+b content/(mg·g-1) |
| 0 | 0.25±0.03ABab | 0.15±0.03ABCab | 0.41±0.06ABa |
| 62.5 | 0.29±0.06Aa | 0.18±0.05Aa | 0.48±0.11Aa |
| 125 | 0.26±0.00ABa | 0.16±0.00ABab | 0.42±0.01ABa |
| 250 | 0.25±0.01ABab | 0.15±0.01ABCab | 0.40±0.02ABa |
| 500 | 0.19±0.03BCc | 0.12±0.02BCDbc | 0.31±0.05BCbc |
| 1 000 | 0.20±0.01BCbc | 0.09±0.01CDc | 0.29±0.02BCc |
| 2 000 | 0.17±0.02Cc | 0.07±0.02CDc | 0.24±0.04Cc |
| 注:大写字母表示差异极显著,P < 0.01;小写字母表示差异显著,P < 0.05。Note: upper-case letters represent extremely significant difference,P < 0.01; lower-case letters represent significant difference,P < 0.05. | |||
金花茶幼苗净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)均随铅浓度的增大呈先升后降的规律(表 4)。Pn、Tr、Gs均在62.5 mg · kg-1处理时最大,分别为3.42 μmol · m-2 · s-1、1.14 mmol · m-2 · s-1、0.06 mmol · m-2 · s-1,是CK的110.32%、108.57%、120.00%。125 mg · kg-1浓度下,Pn、Tr、Gs逐渐降低,显著低于CK(P<0.05);2 000 mg · kg-1处理时,Pn、Tr、Gs均最小,仅1.56 μmol · m-2 · s-1、0.57 mmol · m-2 · s-1、0.01 mmol · m-2 · s-1,是CK的50.32%、54.29%、20.00%,与其余铅处理差异极显著(P<0.01)。
| 铅浓度 Pb concentration/ (mg·kg-1) |
净光合速率 Pn/ (μmol ·m-2· s-1) |
蒸腾速率 Tr/ (mmol·m-2·s-1) |
气孔导度 Gs/ (mmol·m-2·s-1) |
| 0 | 3.10±0.11ABab | 1.05±0.03ABCab | 0.05±0.00Bb |
| 62.5 | 3.42±0.38Aa | 1.14±0.05Aa | 0.06±0.00Aa |
| 125 | 2.85±0.13Bb | 0.96±0.11BCbc | 0.04±0.00Cc |
| 250 | 2.32±0.15Cc | 0.96±0.03BCbc | 0.03±0.00Dd |
| 500 | 2.08±0.11Cdc | 0.91±0.01Cc | 0.03±0.00Ee |
| 1 000 | 1.91±0.12CDd | 0.73±0.00Dd | 0.02±0.00Ff |
| 2 000 | 1.56±0.12De | 0.57±0.06Ee | 0.01±0.00Fg |
| 注:大写字母表示差异极显著,P < 0.01;小写字母表示差异显著,P < 0.05。Note: upper-case letters represent extremely significant difference,P < 0.01; lower-case letters represent significant difference,P < 0.05. | |||
如表 5所示,金花茶幼苗苗木质量(QI)排序为125>62.5>CK>250>500>1 000>2 000 mg · kg-1,其中125 mg · kg-1铅处理时金花茶幼苗质量最好,苗木质量指数为3.04,其次是62.5 mg · kg-1处理,为3.02,均大于CK,2 000 mg · kg-1处理时金花茶苗木质量指数最低,生长最差。以上表明低浓度的铅能促进金花茶幼苗的生长,而中高浓度的铅胁迫不利于金花茶幼苗生长。
| 铅浓度 Pb concentration/(mg·kg-1) |
总干重 Total dry weight/g |
高径比 Height-diameter ratio |
茎根比 Root-shoot ratio |
苗木质量指数 QI |
综合排名 Comprehensive ranking |
| 0 | 23.56 | 5.98 | 2.15 | 2.89 | 3 |
| 62.5 | 24.68 | 5.95 | 2.20 | 3.02 | 2 |
| 125 | 24.71 | 5.92 | 2.20 | 3.04 | 1 |
| 250 | 23.24 | 6.07 | 2.16 | 2.82 | 4 |
| 500 | 20.66 | 6.09 | 2.47 | 2.41 | 5 |
| 1 000 | 18.89 | 6.10 | 2.82 | 2.11 | 6 |
| 2 000 | 16.30 | 6.10 | 3.56 | 1.68 | 7 |
模糊隶属函数是在多指标测定基础上,对植物特性进行综合评价的途径,是植物抗逆生理实验常用的一种方法[19]。为避免单一指标的片面性,对金花茶幼苗各生长生理指标进行隶属度分析,以综合评价其抗铅性。铅胁迫下,植物通过不同机制共同作用来减轻铅的毒害作用,以维持植株的正常生长和能量平衡。由表 6相关性分析可知,金花茶生长和生理特性之间相互影响,金花茶生长和光合指标之间均极显著相关,是直观的综合评价指标,与MDA含量、SOD、POD活性呈显著负相关,而CAT活性相关性不显著,由此分别计算各指标的隶属度,隶属度均值越大,表明抗铅性越强。
| 指标 Index |
株高 H |
地径 GD |
叶面积 LA |
总生物量 TB |
SOD活性 SOD activity |
POD活性 POD activity |
CAT活性 CAT activity |
MDA含量 MDA content |
叶绿素a+b含量 Chlorophyll a+b content |
Pn | Tr | Gs |
| 株高H | 1 | |||||||||||
| 地径GD | 0.99** | 1 | ||||||||||
| 叶面积LA | 0.94** | 0.93** | 1 | |||||||||
| 总生物量TB | 0.94** | 0.91** | 0.93** | 1 | ||||||||
| SOD | -0.87** | -0.86* | -0.81* | -0.87* | 1 | |||||||
| POD | -0.83* | -0.79* | -0.80* | -0.89** | 0.96** | 1 | ||||||
| CAT | 0.30 | 0.27 | 0.49 | 0.33 | -0.15 | -0.25 | 1 | |||||
| MDA | -0.91** | -0.88** | -0.84* | -0.96** | 0.89** | 0.91** | -0.27 | 1 | ||||
| 叶绿素a+b Chlorophyll a+b |
0.93** | 0.91** | 0.94** | 0.97** | -0.94** | -0.93** | 0.33 | -0.94** | 1 | |||
| Pn | 0.96** | 0.95** | 0.89** | 0.90** | -0.96** | -0.89** | 0.21 | -0.91** | 0.95** | 1 | ||
| Tr | 0.88** | 0.86* | 0.82* | 0.94** | -0.96** | -0.97** | 0.12 | -0.95** | 0.95** | 0.92** | 1 | |
| Gs | 0.91** | 0.90** | 0.86* | 0.88** | -0.98** | -0.91** | 0.12 | -0.87** | 0.95** | 0.97** | 0.94** | 1 |
| 注:**表示达到极显著相关水平(P < 0.01);*为显著相关水平(P < 0.05)。Note:** indicates extremely significant correlation level (P < 0.01); * indicates significant correlation level (P < 0.05). | ||||||||||||
由表 7可知,各处理平均隶属值依次为62.5>CK>125>250>500>1 000>2 000 mg · kg-1,62.5 mg · kg-1铅浓度处理时隶属度最高,2 000 mg · kg-1处理时金花茶长势最差,与苗木质量评价不完全相同是由于125 mg · kg-1铅处理下金花茶幼苗生长指标最大,而生理指标表现为62.5 mg · kg-1时最好,表明施加较低浓度的铅对金花茶幼苗有一定的促进作用,62.5 mg · kg-1下金花茶苗木整体状况最好。
| 因子 Index |
铅浓度Pb concentration/(mg·kg-1) | ||||||
| 0 | 62.5 | 125 | 250 | 500 | 1 000 | 2 000 | |
| 株高H | 0.91 | 0.96 | 1 | 0.47 | 0.34 | 0.15 | 0 |
| 地径GD | 0.95 | 0.95 | 1 | 0.43 | 0.24 | 0.08 | 0 |
| 叶面积LA | 0.59 | 0.95 | 1 | 0.57 | 0.16 | 0.01 | 0 |
| 总生物量TB | 0.86 | 0.99 | 1 | 0.82 | 0.51 | 0.31 | 0 |
| SOD | 0.71 | 1 | 0.51 | 0.46 | 0.38 | 0.19 | 0 |
| POD | 0.62 | 1 | 0.59 | 0.57 | 0.55 | 0.32 | 0 |
| MDA | 0.94 | 1 | 0.91 | 0.77 | 0.57 | 0.51 | 0 |
| 叶绿素a+b Chlorophyll a+b |
0.70 | 1 | 0.75 | 0.66 | 0.34 | 0.21 | 0 |
| Pn | 0.84 | 1 | 0.69 | 0.41 | 0.28 | 0.18 | 0 |
| Tr | 0.84 | 1 | 0.68 | 0.68 | 0.57 | 0.28 | 0 |
| Gs | 0.76 | 1 | 0.53 | 0.45 | 0.27 | 0.06 | 0 |
| 隶属度均值 Mean membership |
0.79 | 0.98 | 0.78 | 0.57 | 0.38 | 0.20 | 0 |
| 排名Ranking | 2 | 1 | 3 | 4 | 5 | 6 | 7 |
高浓度Pb不利于植物生长,而一些植物对铅胁迫的耐性较强,可以在铅含量较高的环境中生存[19]。本试验结果表明,在62.5、125 mg · kg-1铅浓度时,金花茶表现出一定耐Pb胁迫能力,金花茶幼苗的各生长指标增大,铅浓度>250 mg · kg-1时金花茶的株高、地径、叶面积、生物量下降,极显著低于CK,2 000 mg · kg-1时最小,这与前人研究结果相似[18, 20]。低浓度铅胁迫对植物生长的促进可能是一种刺激和保护效应,植物生长越快,重金属在植物体内的相对浓度就越低,而高浓度的铅在植物体内积累,保护反应消失,影响了营养物质的吸收和分配,造成植株矮小,生物量减小,生长衰退[21]。研究表明,铅主要积累和富集在植物根部,铅胁迫下,植株会优化分配各器官增长,主动地将生物量更多地分配到根系,以帮助根系从土壤中吸收营养和水分,提高植物抗性[22]。本试验中,随着Pb胁迫浓度升高,铅对根系的抑制明显大于对地上部分的影响,2 000 mg · kg-1浓度时,根冠比最大,表明高浓度的铅在根系不断积累,抑制了根系活力和根系生长,降低了金花茶对养分和水分的吸收能力,使地上部分生长受到抑制,这与李松等[23]对雷竹的研究结果一致。
本试验中,随着铅胁迫浓度的升高,金花茶幼苗MDA含量和SOD、POD、CAT活性均呈先下降后急剧上升的变化趋势,与梁泰昌研究竹柏的结果相似[24],与韩航等对类芦的研究结果相反[25]。62.5 mg · kg-1铅浓度处理时金花茶叶片内MDA含量和抗氧化酶活性降低,与通常情况下,铅胁迫会增加酶活性不同,可能是铅胁迫对金花茶抗氧化酶活性有一定的抑制作用,或是植物对低浓度铅胁迫的一种适应性反应,具有防护作用,其机理有待进一步研究[26]。而高浓度铅导致抗氧化酶活性和MDA含量上升,可能是随着铅浓度增大,金花茶幼苗叶片细胞内活性氧积累,作为本能的防御机制,SOD、POD、CAT作为保护性酶被激活,开始清除细胞内更多的活性氧自由基,以缓解其对细胞的破坏,MDA是膜脂过氧化的最终产物,金花茶和叶片MDA含量随铅浓度的增大而升高,表明铅不断进入植物体内,过多的铅与酶蛋白等大分子结合,虽然抗氧化酶活性得到了一定程度的增加,但仍无法有效调节细胞内产生的活性氧量,使金花茶幼苗的细胞膜受到伤害,导致体内代谢紊乱,膜透性增加,生长缓慢[27]。
叶绿素含量会影响植物光合作用的强弱与物质合成。本研究中,62.5 mg · kg-1铅浓度时,金花茶幼苗叶绿素含量和光合特性均增大,表明金花茶对这一浓度范围的铅浓度具有较好的抗性,低含量铅胁迫未对叶绿体结构造成损害,相反,可能会刺激合成叶绿素物质含量及关键酶活性,从而促进植物光合作用[28],高浓度(>125 mg · kg-1)铅处理时叶绿素含量下降,低于CK,Pn、Tr、Gs也显著降低(P<0.05),这与王马勃等[29]的研究结果相同。可能是由于胁迫程度加剧,植株体内活性氧自由基作用使叶绿体结构的结构和功能遭到破坏,导致金花茶幼苗光合作用受阻;也可能是高浓度的铅抑制了叶绿素酸酯还原酶的活性和氨基-卜酮戊酸的合成,阻碍叶绿素合成,影响光合作用[30]。
许多研究表明一定浓度的铅能促进植物生长,而不同的植物种类,对铅的耐受能力不同,如郑绍鑫等[31]研究发现刨花润楠的株高、地径在300 mg · L-1铅胁迫浓度时均高于CK;甘龙等[32]发现500、1 000 mg · kg-1处理浓度,苘麻的生物量、株高与CK差异不显著;夹书珊[33]认为在土壤铅浓度为600 mg · kg-1时旱柳幼苗具有最佳耐性机制。本研究中,低浓度硝酸铅(≤125 mg · kg-1)对金花茶幼苗生长有促进作用,中高浓度(>125 mg · kg-1)的铅胁迫会对金花茶幼苗生长产生明显的毒害作用。我国城市土壤铅含量均值为65 mg · kg-1,因此,金花茶在气候适生区内具有较好的推广潜力[12]。关于金花茶对土壤的修复性,以及对铅的富集,还需通过其它指标进一步研究。
| [1] |
EL-KHAWAGA H A. Influence of Pb polluted soil on growth, minerals content and yield components of flax (Linum usitatissimum L.) and canola (Brassica napus L.)[J]. Middle East Journal of Applied Sciences, 2017, 7(4): 1 052-1 065. |
| [2] |
IZBIAŃSKA K, ARASIMOWICZ-JELONEK M, DECKERT J. Phenylpropanoid pathway metabolites promote tolerance response of lupine roots to lead stress[J]. Ecotoxicology and Environmental Safety, 2014, 110: 61-67. DOI:10.1016/j.ecoenv.2014.08.014 |
| [3] |
SARWAR N, IMRAN M, SHAHEEN M R, et al. Phytoremediation strategies for soils contaminated with heavy metals:modifications and future perspectives[J]. Chemosphere, 2017(171): 710-721. |
| [4] |
刘英杰, 朱雪梅, 林立金, 等. 冬季农田杂草荠菜对铅的生理响应及积累特性研究[J]. 农业环境科学学报, 2016, 35(1): 29-36. |
| [5] |
周建, 江泽平, 魏远. 重金属铅胁迫对刺槐幼苗生长及铅离子转运特性的影响[J]. 浙江农林大学学报, 2016, 33(5): 742-748. |
| [6] |
许靖诗, 王广军, 刘娟, 等. 印度紫檀林下种植金花茶技术探索与效益评估[J]. 安徽农业科学, 2018, 46(34): 77-78, 82. |
| [7] |
段鹏飞, 何守峰, 张文, 等. 金花茶的花叶保健功效及超微粉制备技术的应用[J]. 中国野生植物资源, 2017, 36(4): 79-81, 85. |
| [8] |
李辛雷, 王洁, 殷恒福, 等. 金花茶遗传多样性和遗传结构AFLP分析[J]. 生态与农村环境学报, 2019, 35(1): 63-68. |
| [9] |
林茂, 唐庆, 李进华, 等. 不同因素对金花茶组培苗移栽成活的影响[J]. 西南农业学报, 2017, 30(9): 2119-2123. |
| [10] |
李辛雷, 王佳童, 孙振元, 等. 三种山茶属金花茶组植物花朵类黄酮成分研究[J]. 广西植物, 2019, 39(7): 917-924. |
| [11] |
张武君, 黄颖桢, 赵云青, 等. 干旱胁迫对金花茶幼树生理特性的影响[J]. 福建农业学报, 2018, 33(6): 614-620. |
| [12] |
高飞霞, 邹天森, 张金良, 等. 中国城市土壤环境铅含量分析[J]. 城市环境与城市生态, 2015, 28(2): 1-5. |
| [13] |
周芙蓉.侧柏和国槐对干旱和铅胁迫的耐性及对铅污染土壤的修复[D].杨凌: 西北农林科技大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10712-1014440381.htm
|
| [14] |
杨敏文. 快速测定植物叶片叶绿素含量方法的探讨[J]. 光谱实验室, 2002, 19(4): 478-481. |
| [15] |
陈建勋, 王晓峰. 植物生理学实验指导[M]. 2版. 广州: 华南理工大学出版社, 2006: 66-69.
|
| [16] |
付晓凤, 王莉姗, 朱原, 等. 不同施肥处理对海南风吹楠幼苗生长及生理特性影响[J]. 植物科学学报, 2018, 36(2): 273-281. |
| [17] |
谢婉, 杨喜珍, 杨利, 等. 利用隶属函数法评价马铃薯组培苗的抗旱性[J]. 中国马铃薯, 2019, 33(2): 65-76. |
| [18] |
IQBAL M M, MURTAZA G, SAQIB Z A, et al. Growth and physiological responses of two rice varieties to applied lead in normal and salt-affected soils[J]. International Journal of Agriculture & Biology, 2015, 17(5): 901-910. |
| [19] |
TOMSETT A B, THURMAN D A. Molecular biology of metal tolerances of plants[J]. Plant, Cell & Environment, 1988, 11(5): 383-394. |
| [20] |
王榆鑫, 王进鑫, 初江涛, 等. 侧柏和国槐幼苗生长对铅胁迫的阈值[J]. 江苏农业科学, 2017, 45(1): 123-127. |
| [21] |
胡仲义, 李修鹏. 铅胁迫对全缘冬青幼苗生长与生理的影响[J]. 浙江林业科技, 2008, 28(1): 19-22. |
| [22] |
杨俊兴, 胡健, 郭庆军, 等. 铅胁迫对不同湿地植物耐性和吸收的影响[J]. 生态学杂志, 2016, 35(10): 2738-2744. |
| [23] |
李松, 柳丹, 吴家森, 等. 雷竹对铅胁迫的生理响应及其修复效率研究[J]. 水土保持学报, 2014, 28(2): 175-179. |
| [24] |
梁泰昌.重金属硝酸铅对竹柏幼苗生长和生理特性的影响[D].南宁: 广西大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10593-1017041094.htm
|
| [25] |
韩航, 陈雪娇, 陈顺钰, 等. 类芦对铅胁迫的生理响应[J]. 森林与环境学报, 2017, 37(4): 398-404. |
| [26] |
杨成林, 王丽妍, 葛冬梅, 等. 铅胁迫对金盏银盘生长及生理生化的影响[J]. 灌溉排水学报, 2010, 29(1): 139-142. |
| [27] |
朱诗苗, 宋杭霖, 张丽, 等. 铅胁迫对烟草生长及生理生化指标的影响[J]. 植物生理学报, 2018, 54(3): 465-472. |
| [28] |
张宝龙, 陈美静, 辛士刚, 等. 铅胁迫对植物光合作用影响的研究进展[J]. 安徽农业科学, 2014, 42(12): 3468-3470. |
| [29] |
王马勃, 巢建国, 谷巍, 等. 铅胁迫下茅苍术生理指标、光合参数及生物量的变化[J]. 南方农业学报, 2019, 50(1): 32-39. |
| [30] |
龙栎至, 左燕平. 土壤铅污染对城市园林植物的影响[J]. 四川林业科技, 2011, 32(1): 65-68. |
| [31] |
郑绍鑫, 蒋林, 滕维超, 等. 刨花润楠对硝酸铅胁迫的生长和生理响应机制[J]. 林业科技开发, 2015, 29(3): 25-30. |
| [32] |
甘龙, 罗玉红, 王林泉, 等. 土壤铅胁迫对苘麻光合特性及生物量的影响[J]. 广西植物, 2018, 38(6): 737-745. |
| [33] |
夹书珊.旱柳生长过程对铅胁迫的响应机理研究[D].长沙: 中南林业科技大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10538-1016297783.htm
|

 2019, Vol. 39
2019, Vol. 39


