文章信息
- 夏春英, 谢小敏, 刘江枫, 郑诚乐
- XIA Chunying, XIE Xiaomin, LIU Jiangfeng, ZHENG Chengle
- 竹叶兰花粉离体萌发及其贮藏特性
- In vitro germination and storage characteristics of Arundina graminifolia pollen
- 森林与环境学报,2019, 39(5): 454-459.
- Journal of Forest and Environment,2019, 39(5): 454-459.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.05.002
-
文章历史
- 收稿日期: 2019-02-27
- 修回日期: 2019-05-16
2. 福州市于山风景区管理处, 福建 福州 350001
2. Management Office of Yushan Scenic Area, Fuzhou, Fujian 350001, China
花粉是一种具有特殊结构和功能的微小生命有机体,一般由2~5个细胞组成。作为被子植物雄配子体或者雄配子细胞的载体[1-4],花粉的质量和生活力是完成有效受精的必要条件,也是杂交育种中决定育种成功与否的重要因素[5-6]。此外,在杂交育种工作中,花粉生活力测定与贮藏性的研究是解决杂交亲本在时间与空间上的隔离进而扩大育种范围的前提,并且花粉贮藏也是保存珍稀植物种质资源一个重要途径[6-8]。因此,在人工授粉和花粉贮藏时,对花粉进行快速有效的生活力测定很有必要[5],这对了解植物有性生殖和雄配子体发育的多样性具有重要意义[9]。
竹叶兰[Arundina graminifolia (D. Don) Hochr.]隶属兰科(Orchidaceae)竹叶兰属(Arundina),多年生草本植物,又名土白芨(福建)、幽涧兰(海南)、长杆兰(四川、贵州)、野兰花、地黄草(四川)等,属地生兰,是国家Ⅱ级保护植物[10-12]。据中国植物志记载,竹叶兰在国内主要分布于华南和西南地区,国外主要分布于南亚及东南亚国家,如尼泊尔、印度、缅甸、越南等国,生于海拔400~2 800 m的草坡、溪谷旁、灌丛下或林中,花果期主要为9~11月,1~4月也有,不同海拔、不同气候的地区,竹叶兰的习性、生境不一[10, 13-14]。竹叶兰不仅具有观赏价值,还具有药用价值,经济价值颇高。目前,因自然资源的掠夺性采挖和竹叶兰自身种子繁殖的困难性,野外种质资源大大减少[15-16],引起人们广泛关注。许多学者已对竹叶兰的引种驯化、组培快繁技术和栽培技术等做了相应研究[12-19],但对其花粉离体培养和贮藏性尚未见相关报道。由于兰科植物的花粉块结构降低了花粉离体萌发的速度,使用液体培养基可以提高其萌发效率[20]。因此,本研究以福州市于山风景区兰花圃栽植的竹叶兰花粉为研究对象,采用液体培养法[21-22],分析蔗糖、H3BO3和CaCl2不同配比对竹叶兰花粉离体萌发的作用,比较不同贮藏温度和贮藏时间对竹叶兰花粉萌发的影响,测定单花花期内花粉萌发率变化,以期筛选获得竹叶兰花粉离体萌发的适宜液体培养基组分配比和贮藏方法,为竹叶兰花粉生活力的测定提供技术与方法,并为其杂交育种工作奠定理论基础,进而为竹叶兰的繁殖生物学和育种学的深入研究提供基础资料[23]。
1 材料与方法 1.1 试验材料花粉取自福州市于山风景区兰花圃内当天开放的竹叶兰新鲜花朵,上午9 : 00—11 : 00采集花粉。
1.2 试验方法 1.2.1 花粉离体萌发培养基筛选采集竹叶兰花粉在盛花期进行,于晴天的上午9 : 00~11 : 00选取竹叶兰花朵(取开花当天的新鲜花朵)于滤纸上,迅速转移至试验室条件保存备用。采用液体培养法,首先进行单因素试验设计,分别对蔗糖、H3BO3和CaCl2这3个培养基组分进行研究,设置8个浓度梯度,即蔗糖:1、10、50、100、150、200、250和300 g · L-1;H3BO3:1、5、10、20、30、40、50和60 mg · L-1;CaCl2:1、5、10、20、30、40、50和60 g · L-1。每种培养液取3 mL加入离心管,然后把适量花粉团装入离心管中并用镊子轻轻摩擦花粉团使花粉粒均匀分散于培养液中,在25 ℃恒温箱中暗培养48 h后,用滴管取适量培养液于载玻片上,在生物显微镜4倍镜下镜检。试验重复3次,每次随机选取10个视野,统计花粉萌发情况,花粉萌发以花粉管长度大于花粉粒直径为标准[23],参照余庆等[24]方法计算花粉萌发率,具体公式如下:
| $ 花粉萌发率/\%=萌发花粉数/花粉总数×100 $ | (1) |
在单因素试验的基础上,选取对竹叶兰花粉萌发影响较大的蔗糖、H3BO3和CaCl2的4个浓度水平,采用L25 (53)正交设计进行试验,每个组合重复3次,以确定培养基不同组分的最佳配比,培养与检测方法见1.2.1。
1.2.2 花粉贮藏试验采集适量竹叶兰花粉块,装入5 mL大小的离心管,并填满硅胶干燥剂;将离心管放入4、-7和-25 ℃冰箱中低温、黑暗保存,15、30、45和60 d后取出(取出时温度逐级缓冲1 h以上),用筛选出的最适液体培养基对花粉进行培养,测定花粉萌发率,培养与检测方法同1.2.1。
1.2.3 单花花期及其花粉萌发率测定盛花期内,观察竹叶兰的开花情况,记录竹叶兰单花花期,并采集不同花期的竹叶兰花粉,用筛选出的最适液体培养基对花粉进行培养,进行花粉萌发率测定,培养与检测方见同1.2.1。
1.3 数据处理对所测数据用Excel2007和SPSS19.0软件进行统计分析,采用单因素法进行方差分析,采用LSD法进行差异显著度分析,差异显著水平设置为0.05。
2 结果与分析 2.1 不同培养基组分对竹叶兰花粉离体萌发的影响由表 1可知,竹叶兰花粉离体培养的萌发率均随着3组培养基组分浓度升高,呈先升后降的趋势。当蔗糖浓度为150 g · L-1时,花粉萌发率最高,为20.93%,同时通过方差分析和多重比较进一步分析可知,当蔗糖浓度为100和150 g · L-1时,其萌发率与其他组均有显著差异,但100和150 g · L-1蔗糖浓度的萌发率之间差异不显著;当H3BO3浓度为20 mg · L-1时,花粉萌发率最高,为36.32%;CaCl2浓度为10 mg · L-1时,花粉萌发率最高,为1.91%。
| 蔗糖质量浓度 Sucrose concentration /(g·L-1) |
萌发率 Germination rate /% |
H3BO3质量浓度 H3BO3 concentration /(g·L-1) |
萌发率 Germination rate /% |
CaCl2质量浓度 CaCl2 concentration /(g·L-1) |
萌发率 Germination rate /% |
||
| 1 | 1.92±0.25e | 1 | 31.92±0.33c | 1 | 1.02±0.05c | ||
| 10 | 2.52±0.31e | 5 | 32.63±0.86bc | 5 | 1.44±0.15bc | ||
| 50 | 5.36±0.28d | 10 | 33.31±0.67b | 10 | 1.91±0.14a | ||
| 100 | 19.75±0.39a | 20 | 36.32±0.67a | 20 | 1.46±0.44b | ||
| 150 | 20.93±0.51a | 30 | 15.60±1.18d | 30 | 1.29±0.13bc | ||
| 200 | 15.67±1.21b | 40 | 6.55±0.18e | 40 | 1.28±0.35bc | ||
| 250 | 8.47±0.94c | 50 | 3.56±0.37f | 50 | 1.28±0.15bc | ||
| 300 | 5.27±1.13d | 60 | 3.22±0.21f | 60 | 1.26±0.10bc | ||
| 注:数据后不同小写字母表示差异达0.05显著水平。Note: data followed different small letters indicate significant differences at 0.05 level. | |||||||
选择在单因素试验中对竹叶兰花粉离体萌发影响较大的蔗糖、H3BO3和CaCl2的4个浓度水平,采用L25 (53)正交试验设计,寻找3因子的最佳配比。对该正交试验数据做方差分析结果表明,蔗糖和CaCl2在竹叶兰离体萌发的试验中起主导作用,H3BO3起辅助性作用(表 2)。进一步分析,花粉萌发率平方和最高值的组合为100 g · L-1蔗糖+20 mg · L-1 H3BO3+5 mg · L-1 CaCl2,此组合在正交试验中编号为10,萌发率最高,为58.71%,而编号13的组合(150 g · L-1蔗糖+5 mg · L-1 H3BO3+5 mg · L-1 CaCl2)与10号组合的花粉萌发率差异不显著。为了找出最佳培养基组合,结合单因素试验的结果,增加了150 g · L-1蔗糖+20 mg · L-1 H3BO3+10 mg · L-1 CaCl2这一组试验,编号26,此组合的花粉萌发率为45.52%,小于10号和13号组合的萌发率(58.71%和58.68%)。对10、13、26号3个组合做差异性分析,结果表明三者无显著差异(P>0.05)。综合单因素试验及正交试验结果的方差分析和比较,认为竹叶兰的最适培养基组合为100 g · L-1蔗糖+20 mg · L-1 H3BO3和5 mg · L-1 CaCl2。
| 编号 No. |
蔗糖浓度 Sucrose content /(g·L-1) |
硼酸浓度 H3BO3 content /(mg·L-1) |
氯化钙浓度 CaCl2 content /(mg·L-1) |
萌发率 Germination rate /% |
| 1 | 0 | 0 | 0 | 0.95 |
| 2 | 0 | 1 | 5 | 2.59 |
| 3 | 0 | 5 | 10 | 1.14 |
| 4 | 0 | 10 | 20 | 1.05 |
| 5 | 0 | 20 | 30 | 1.23 |
| 6 | 100 | 0 | 10 | 27.04 |
| 7 | 100 | 1 | 20 | 28.28 |
| 8 | 100 | 5 | 30 | 17.76 |
| 9 | 100 | 10 | 0 | 43.22 |
| 10 | 100 | 20 | 5 | 58.71 |
| 11 | 150 | 0 | 30 | 6.62 |
| 12 | 150 | 1 | 0 | 48.40 |
| 13 | 150 | 5 | 5 | 58.68 |
| 14 | 150 | 10 | 10 | 20.43 |
| 15 | 150 | 20 | 20 | 17.98 |
| 16 | 200 | 0 | 5 | 18.32 |
| 17 | 200 | 1 | 10 | 9.26 |
| 18 | 200 | 5 | 20 | 9.86 |
| 19 | 200 | 10 | 30 | 4.27 |
| 20 | 200 | 20 | 0 | 13.81 |
| 21 | 250 | 0 | 20 | 4.06 |
| 22 | 250 | 1 | 30 | 3.51 |
| 23 | 250 | 5 | 0 | 4.08 |
| 24 | 250 | 10 | 5 | 4.20 |
| 25 | 250 | 20 | 10 | 3.00 |
| 26 | 150 | 20 | 10 | 45.52 |
| MS | 1 194.184 | 52.824 | 385.528 | |
| F | 10.705** | 0.474 | 3.456* | |
| 注:**表示在0.01水平差异极显著,*表示在0.05水平差异显著。Note: ** means the difference is significant at the 0.01 level, * means the difference is significant at the 0.05 level. | ||||
从表 3中可以看出,贮藏条件对竹叶兰花粉萌发率的影响极大。开花当天,竹叶兰的花粉萌发率为58.71%,随着贮藏时间的推移,不同低温贮藏环境下的花粉萌发率均呈明显下降趋势,且贮藏至60 d时,竹叶兰花粉已丧失萌发力。但相对而言,-7和-25 ℃低温条件显著延缓了花粉萌发率的下降速度,在贮藏30 d后花粉萌发率仍明显比4 ℃环境下的萌发率(5.73%)高,萌发率分别为11.90%和20.61%。由此可见,当贮藏时间相同时,一定贮藏温度范围内,温度越低,花粉萌发率越高,表明花粉活力保存得越好。
| 贮藏时间Storage time/d | 花粉萌发率Pollen germination rate/% | ||
| 4 ℃ | -7 ℃ | -25 ℃ | |
| 0 | 58.71±7.16a | 58.71±7.16a | 58.71±7.16a |
| 15 | 6.91±2.21b | 20.73±4.45b | 37.87±6.51b |
| 30 | 5.73±1.06b | 11.90±2.08c | 20.61±3.14c |
| 45 | 1.78±0.44c | 3.64±1.03d | 4.75±1.44d |
| 60 | 0.00±0.00c | 0.00±0.00e | 0.00±0.00e |
根据实时观察记录可知,竹叶兰单花平均花期为(3±1) d。对不同花期的竹叶兰花粉萌发率进行测定发现,开花当天的花粉萌发率最高,为58.71%(图 1),而后呈现下降趋势,第2、3天竹叶兰花粉萌发率分别为22.47%和11.64%。结果表明,花期对竹叶兰花粉萌发率具有极显著影响(P<0.01)。
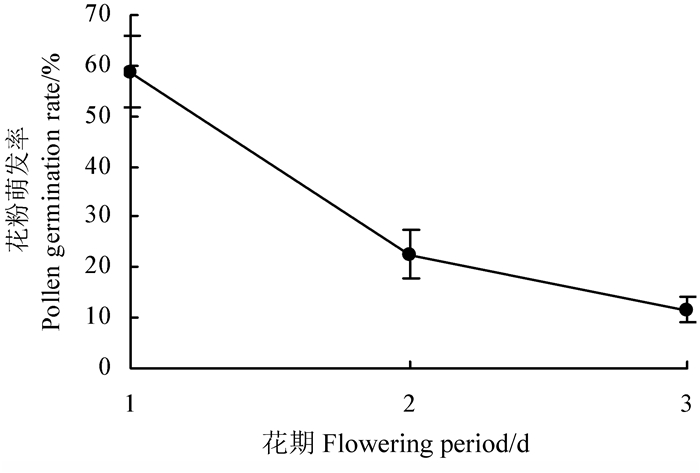
|
图 1 竹叶兰单花花期内的花粉萌发率 Fig. 1 Pollen germination rate of A. graminifolia during the flowering period |
由于兰科植物的花粉大多数是4个花粉块黏结组成的花粉团,花粉团外面包裹着类脂膜,这使得花粉萌发的速度降低,往往在研磨浸泡时也不能完全排除黏连物质对花粉萌发的影响[25]。因此本研究采用液体培养法,来提高试验效率和花粉萌发率。其次,多数研究都发现蔗糖、H3BO3和CaCl2对兰科植物花粉的萌发起关键作用,因此本试验将蔗糖、H3BO3和CaCl2作为花粉离体萌发的主要的培养基成分。
本研究综合单因素和正交试验的结果,表明蔗糖浓度以100 g · L-1为竹叶兰花粉离体萌发的最适浓度,此结果与杂种卡特兰(Cattleya Hybrida H.J.Veitch)[20]、聚石斛(Dendrobium lindleyi Miho)[26]、白芨[Bletilla striata (Thunb.) Reichb.f.][27]、原生墨兰[Cymbidium sinense (Jackson ex Andr.)Willd.][28]等的最适蔗糖浓度一致,但是低于无距虾脊兰(Calanthe tsoongiana T. Tang et F. T. Wang)[23]、大花惠兰(Cymbidium hybridium)[29]的最适蔗糖浓度。蔗糖在花粉萌发过程中,不仅作为重要的能源物质为花粉萌发提供营养,并且作为渗透物质为花粉萌发和生长起到调节渗透压的作用,恰到好处的蔗糖浓度可以维持好花粉和培养基间的渗透压,在一定程度上缓解花粉破裂,但若浓度过高或者过低,对花粉的萌发生长不仅没有促进作用,在浓度过高时还会造成原生质脱水,反而抑制了萌发[30-31]。在本试验中,蔗糖不是竹叶兰花粉离体萌发所必须的成分,这一结果与杂种卡特兰[20]、聚石斛[26]相同,用蒸馏水培养就可使其萌发,但萌发率很低,本试验结果为0.95%。其原因可能是存在一小部分花粉自身含有的营养物质能够满足花粉萌发的需求[32]。
单因素试验中,20 mg · L-1及以下的低浓度H3BO3溶液中培养的花粉萌发率比蔗糖、CaCl2中培养的都要更高,且H3BO3浓度为20 mg · L-1时花粉萌发率与其他组存在明显差异,为36.32%;但正交试验的方差分析显示H3BO3对竹叶兰花粉萌发的影响都是不显著的,究其原因,可能是在正交试验时,低浓度的H3BO3均能有效提高其花粉萌发率。综合单因素和正交试验结果,认为竹叶兰花粉萌发的H3BO3最适浓度为20 mg · L-1。虽然H3BO3在植物组织中含量很低[33],但是H3BO3能与蔗糖形成络合物,促进了糖的吸收、转运与代谢,提高花粉的萌发率。
相关研究表明,花粉的离体萌发还需要从培养基中吸收大量钙离子,降低培养基中的钙离子浓度会明显抑制花粉萌发,并且外源钙可以替代花粉萌发时的群体效应[34],因此,适宜的钙离子浓度是花粉体外萌发所必需的[35]。本研究结果表明,CaCl2单独作用不是很明显,在单因素试验中浓度10 mg · L-1时花粉萌发率最高,仅1.91%;但与蔗糖和H3BO3组合时,能起到交互作用,促进花粉萌发,正交试验分析认为在5 mg · L-1时萌发率最高。究其原因,花粉萌发时不需要外源Ca2+并不表明就不需要Ca2+的参与,很有可能是不同品种花粉自身释放的Ca2+含量不一样,花粉大多储存在花粉壁中,当在液体培养液中培养时,花粉水合释放自身Ca2+,有的品种花粉自身所含Ca2+就足以满足生长发育所需,故而对外源Ca2+表现为非必需[36]。
此外,花粉贮藏是植物种质资源保存和杂交育种工作的关键,尤其对于已经濒危的兰科植物而言,有效的花粉贮藏办法更是为其保育工作顺利开展提供了一个重要途径,因此,许多研究者针对不同兰科植物花粉的贮藏性研究作了大量工作,为兰科植物保育工作的进一步开展奠定了夯实的基础。本研究中针对竹叶兰的花粉贮藏性也进行了简单的测定,结果表明,竹叶兰花粉在4、-7和-25 ℃中贮藏相同时间,温度越低,花粉活力相对保存越好,但同时,在贮存60 d后,即使在-25 ℃条件下也已经丧失了生活力,不能进行离体萌发。因此,竹叶兰这一兰科植物在进行花粉简易贮藏时,不宜长时间保存,并且,由于单花花期内花粉活力逐渐降低,建议选取当天开放花朵的花粉进行贮藏,在最大程度上保存花粉生活力。
本研究综合单因素试验及正交试验结果的方差分析和比较,发现竹叶兰的最适培养基组合为100 g · L-1蔗糖+20 mg · L-1 H3BO3+5 mg · L-1 CaCl2;此外,在竹叶兰花粉离体萌发液体培养基筛选的基础上,对花粉贮藏性和单花花期内花粉萌发率进行了测定,发现花粉萌发率在开花当天最高,之后逐渐降低,且不耐贮藏,在-25 ℃低温下只能进行短期贮藏。影响植物花粉萌发和贮藏的因素有很多,不同的植物种类花粉萌发所需蔗糖、硼酸、氯化钙的最适浓度和进行花粉贮藏时需要采取的最佳处理方式各不相同[37],且不同的培养条件下,花粉的萌发情况也各不相同,本试验仅对同一培养条件下的不同培养液组分和低温干燥贮藏法进行了研究,关于竹叶兰的最适培养条件和长期贮藏方法还待进一步探讨,本试验结果谨为后人的深入研究作参考。
| [1] |
吕世友, 李彦舫, 陈祖铿, 等. 花粉发育的研究进展[J]. 植物学通报, 2001, 18(3): 340-346. DOI:10.3969/j.issn.1674-3466.2001.03.012 |
| [2] |
田惠桥, 朱学艺. 被子植物生殖生物学[M]. 北京: 科学出版社, 2012: 16.
|
| [3] |
苏晓梅, 刘卫东, 柳李旺. 茄子花粉形态特征及分类研究[J]. 西北植物学报, 2012, 32(2): 281-287. DOI:10.3969/j.issn.1000-4025.2012.02.011 |
| [4] |
刘武林. 花粉的采集、贮藏和生活力的测定[J]. 植物学通报, 1985, 3(3): 8-12, 45. |
| [5] |
张炎, 左丹丹, 陈宇, 等. 杉木胚珠的解剖学观察[J]. 森林与环境学报, 2017, 37(2): 142-147. |
| [6] |
王钦丽, 卢龙斗, 吴小琴, 等. 花粉的保存及其生活力测定[J]. 植物学通报, 2002, 19(3): 365-373. DOI:10.3969/j.issn.1674-3466.2002.03.017 |
| [7] |
李玉萍, 罗凤霞, 王春彦, 等. 风信子花粉萌发及贮藏性研究[J]. 西北植物学报, 2010, 30(12): 2 484-2 489. |
| [8] |
尹佳蕾, 赵惠恩. 花粉生活力影响因素及花粉贮藏概述[J]. 中国农学通报, 2005, 21(4): 110-113, 193. DOI:10.3969/j.issn.1000-6850.2005.04.032 |
| [9] |
李国平, 黄群策, 杨鹭生, 等. 黑松花粉体外萌发与花粉管生长的研究[J]. 林业科学研究, 2007, 20(2): 224-229. DOI:10.3321/j.issn:1001-1498.2007.02.014 |
| [10] |
中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1999: 333-336.
|
| [11] |
王健. 竹叶兰:珍贵的药用花卉植物[J]. 中国野生植物, 1988(3): 33-34. |
| [12] |
刘承清, 赵应红, 李晓幸. 百样解(竹叶兰)扦插育苗实验研究[J]. 中国民族民间医药, 2017, 26(16): 21-23. |
| [13] |
韦阳连, 袁志永, 余金昌. 竹叶兰最新研究进展[J]. 天津农业科学, 2016, 22(7): 147-150. DOI:10.3969/j.issn.1006-6500.2016.07.034 |
| [14] |
唐德英, 王云娇, 李荣英, 等. 野生竹叶兰引种栽培初报[J]. 中药材, 2005, 28(4): 263-264. DOI:10.3321/j.issn:1001-4454.2005.04.003 |
| [15] |
曾凌云. 海南野生竹叶兰[J]. 琼州学院学报, 2009, 16(5): 53-54. DOI:10.3969/j.issn.1008-6722.2009.05.018 |
| [16] |
黄素荣, 谌振, 杨光穗. 竹叶兰试管苗驯化栽培技术初报[J]. 热带农业科学, 2015, 35(7): 19-21. DOI:10.3969/j.issn.1009-2196.2015.07.005 |
| [17] |
张文珠, 林炳英, 林德钦. 竹叶兰的无菌播种快繁技术研究[J]. 热带农业科学, 2011, 31(12): 16-19. DOI:10.3969/j.issn.1009-2196.2011.12.005 |
| [18] |
陈之林, 曾宋君, 温铁龙, 等. 竹叶兰的无菌播种和试管成苗[J]. 植物生理学通讯, 2006, 42(1): 66. |
| [19] |
黄素荣, 谌振, 杨光穗. 竹叶兰试管苗育苗及园林种植养护技术[J]. 园艺与种苗, 2017(7): 36-38. |
| [20] |
郑宝强, 王雁, 彭镇华, 等. 杂种卡特兰花粉萌发和花粉贮藏性研究[J]. 热带亚热带植物学报, 2012, 20(1): 13-18. DOI:10.3969/j.issn.1005-3395.2012.01.003 |
| [21] |
DICKINSON D B. Rapid starch synthesis associated with increased respiration in germinating lily pollen[J]. Plant Physiology, 1968, 43(1): 1-8. |
| [22] |
DICKINSON D B. Influence of borate and pentaerythritol concentrations on germination and tube growth of Lilium longiflorum pollen[J]. American Society for Horticultural Science, 1978, 103(3): 413-416. |
| [23] |
钱鑫, 刘芬, 牛晓玲, 等. 无距虾脊兰花粉离体萌发及储藏条件的研究[J]. 西北植物学报, 2014, 34(2): 341-348. |
| [24] |
余庆, 李映志, 汪永保, 等. 菠萝蜜花粉萌发及贮藏特性研究[J]. 广东农业科学, 2014, 41(8): 60-64. DOI:10.3969/j.issn.1004-874X.2014.08.015 |
| [25] |
尚忠林.细胞外钙调素对花粉细胞内钙离子的影响及其信号传递途径的研究[D].北京: 中国农业大学, 2001. http://cdmd.cnki.com.cn/Article/CDMD-10019-2006023168.htm
|
| [26] |
邓茜玫, 郑宝强, 郭欣, 等. 聚石斛花粉生活力及贮藏的研究[J]. 林业科学研究, 2014, 27(5): 657-661. |
| [27] |
黄春球, 宋天顺, 李明静, 等. 白芨花粉活力测定与花粉保存[J]. 北方园艺, 2011(3): 182-184. |
| [28] |
郭丽霞, 莫饶. 海南原生墨兰花粉萌发试验初报[J]. 中国农学通报, 2007, 23(6): 594-597. DOI:10.3969/j.issn.1000-6850.2007.06.128 |
| [29] |
王利民, 王四清, 王彩霞, 等. 大花蕙兰花粉离体萌发试验初报[J]. 中国农学通报, 2005, 21(4): 122-124, 161. DOI:10.3969/j.issn.1000-6850.2005.04.035 |
| [30] |
马力耕, 徐小冬, 崔素娟, 等. 细胞外钙调素对花粉萌发和花粉管伸长的影响[J]. 科学通报, 1997, 42(24): 2 648-2 652. |
| [31] |
于金平, 王媛媛, 张琪, 等. 百合不同品种间花粉萌发活力检测分析[J]. 沈阳农业大学学报, 2018, 49(1): 14-19. |
| [32] |
刘自刚, 呼天明, 杨亚丽. 黄芩花粉离体萌发与花粉管生长研究[J]. 中国中药杂志, 2011, 36(19): 2 636-2 640. |
| [33] |
年玉欣, 罗凤霞, 张颖, 等. 测定百合花粉生命力的液体培养基研究[J]. 园艺学报, 2005, 32(5): 922-925. DOI:10.3321/j.issn:0513-353X.2005.05.037 |
| [34] |
胡适宜. 被子植物胚胎学[M]. 北京: 高等教育出版社, 1982: 103-136.
|
| [35] |
BREWBAKER J L, KWACK B H. The essential role of calcium ion in pollen germination and pollen tube growth[J]. American Journal of Botany, 1963, 50(9): 859-865. |
| [36] |
贾文庆, 刘宇, 陈韵, 等. Ca2+与葱兰花粉萌发和花粉管生长的关系[J]. 西北林学院学报, 2007, 22(4): 98-99, 105. DOI:10.3969/j.issn.1001-7461.2007.04.024 |
| [37] |
芦娟, 苏瑾, 姜成英, 等. 不同浓度的糖、硼、钙对油橄榄花粉萌发的影响[J]. 经济林研究, 2017, 35(1): 103-107. |

 2019, Vol. 39
2019, Vol. 39


