文章信息
- 郭霞, 李茜茜
- GUO Xia, LI Qianqian
- 黑松-美味牛肝菌菌根辅助细菌的筛选与鉴定
- Isolation and identification of a mycorrhiza helper bacteria strain from the rhizosphere soil of Boletus edulis and Pinus thunbergii
- 森林与环境学报,2019, 39(3): 315-319.
- Journal of Forest and Environment,2019, 39(3): 315-319.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.03.014
-
文章历史
- 收稿日期: 2018-09-11
- 修回日期: 2018-12-08
黑松(Pinus thunbergii Parl.)具有耐干旱、耐瘠薄、抗海风海煞、不怕盐碱沙埋及生长较迅速等特点,已成为我国东部沿海地区主要栽培树种[1]。然而,近年来因为松材线虫病、松突圆蚧(Hemiberlesia pitysophila Takagi)的不断蔓延以及土地的贫瘠化日益严重,导致黑松分布范围和数量不断减少[2]。外生菌根真菌能分泌多种激素促进植物生长,还能帮助植物抵抗在生长发育过程中遇到的干旱、洪涝、高温等非生物逆境及病原生物的迫害[3-4]。外生菌根真菌美味牛肝菌(Boletus edulis Bull.)常与黑松、冷杉属(Abies Mill.)、云杉属(Picea Dietr.)、白蜡树(Fraxinus chinensis Roxb.)等植物形成共生菌根。研究表明,黑松接种美味牛肝菌,可促进黑松对养分的吸收,提高黑松的抗病力,降低黑松幼苗的死亡率[5]。
菌根辅助细菌(mycorrhiza helper bacteria, MHB)是指能与菌根联合并对菌根的形成具有选择性促进作用的一类根际微生物。根际微生物和菌根真菌互作,在维持植物根际微环境生态系统稳定、促进植物生长和提高植物抗逆性等方面发挥了重要作用。研究表明,菌根辅助细菌能够与菌根真菌特异性结合,促进菌根真菌孢子萌发、菌丝生长,提高菌根的侵染率,促进菌根真菌在宿主植物根部定殖和生长,从而间接促进植物的生长[6-9]。野生美味牛肝菌的菌塘细菌种类多样,哪些可能是潜在的菌根促生细菌并不清楚。本研究以黑松-美味牛肝菌菌根苗为材料,对菌塘土壤中的MHB进行了筛选和鉴定,为探讨MHB与美味牛肝菌互作改善黑松根际微环境,提高黑松抗性的深入研究提供理论参考,同时还为美味牛肝菌真菌的促繁和人工菌塘构建提供科学依据。
1 材料与方法 1.1 供试材料供试土壤:采集于针阔叶混交林下,野生美味牛肝菌菌塘,详情参见文献[10]。
供试细菌:取野生牛肝菌菌塘土壤,通过稀释,在牛肉膏蛋白胨培养基上划线分离获得单菌落,取单菌落并接种于牛肉膏蛋白胨培养基上,保存、备用。
供试外生菌根真菌美味牛肝菌(Boletus edulis, Be),购买于中国微生物菌种保藏中心,采用综合马铃薯培养基培养,其配方为马铃薯提取液, 葡萄糖20.0 g,KH2PO4 3.0 g,MgSO4·7H2O 1.5 g,维生素B1微量,琼脂15.0 g,蒸馏水定容至1 000 mL,pH值6.0。
供试黑松种子购于江苏阿里种业公司。
1.2 试验方法 1.2.1 细菌代谢产物对外生菌根真菌生长的影响将分离获得的细菌菌株活化后,用接种环取少量细菌接种于50 mL牛肉膏蛋白胨液体培养基中,25 ℃、转速160 r·min-1,振荡培养72 h。取离心后的上清液,用0.22 μm的细菌过滤器过滤,获得含细菌胞外代谢产物的无菌滤液[5]。将2 mL滤液与50 mL综合马铃薯培养基混合后倒平板,用无菌打孔器取直径1 cm的美味牛肝菌菌块接种于培养皿中央,空白对照不加滤液,添加等量牛肉膏蛋白胨液体培养基,每个处理设置5个重复。平板置于25 ℃恒温培养,采用十字交叉法每24 h测1次菌落直径。
1.2.2 外生菌根真菌与细菌双接种盆栽试验外生菌根真菌菌种固体扩大培养:固体菌剂培养基质为麸皮、棉籽壳,以4:1的比例充分混合,加入综合马铃薯液体培养基拌匀后放入500 mL锥形瓶中,121 ℃灭菌60 min。冷却后,接种美味牛肝菌菌种,25 ℃下恒温培养,待菌丝长满后即可用作外生菌根真菌的固体菌剂,用于接种苗盆栽试验[5]。
接种苗:松苗培养基质采用松树林地下的砂质土,暴晒后过筛孔尺寸为0.25 mm的筛子,与蛭石1:1混合,然后高温高压灭菌2 h。将冷却的松苗培养基质平铺于72穴的育苗穴盘中,每穴种2粒种子。将育苗穴放入培养室内培养,适时喷水,待出苗后苗高0.5~1 cm时使用[9]。
盆栽试验:将灭菌的松苗培养基质和固体菌剂按照10:1的比例混均作为盆栽基质。细菌接种液浓度约为107个·mL-1,细菌接种量为5 mL·株-1。取200 g盆栽基质于育苗袋中,取苗高0.5~1 cm、未长侧根的黑松松苗直接移栽于其中。用无菌移液管吸取5 mL细菌菌液沿着松苗根附近缓慢、均匀地注入盆中,以不接种细菌菌悬液作为空白对照。每个处理包含10株苗。盆栽试验的黑松全部置于室外大棚培养,温度22~28 ℃,相对湿度70%~80%。每天用蒸馏水喷雾1~3次,3 d灌水1次。
1.2.3 菌根侵染率的测定待黑松苗生长6个月后,观察松苗的生长情况,并测量松苗的苗高、地径、茎根比等生长指标[6]。每个处理随机抽取5株松苗,将黑松苗的根系小心取出,用清水洗净、吸水纸吸干。以1 cm为标准,从根系上下及周围部分剪下根段,随机取根段100个,必要时借助解剖镜进行观察并记录形成的菌根根段数量,计算菌根侵染率[5]。
菌根侵染率/%=菌根根段数/总根段数×100。
1.2.4 MHB菌株鉴定将筛选出的菌根辅助细菌接种于牛肉膏蛋白胨平板培养基中,28 ℃培养24~36 h,挑取单菌落,对其形态和生化特性进行鉴定[11]。
16S rDNA序列测定:获得筛选出的MHB菌株单菌落,采用十二烷基硫酸钠(sodium dodecyl sulfate, SDS)法提取MHB菌株的基因组DNA。16S rDNA的通用引物27 F:5’-AGAGTTTGATCCTGGCTCAG-3’; 1 492 R:5’-TACCTTGTTACGACTT-3’。委托成都擎科梓熙生物技术有限公司进行菌株基因序列测定。
1.3 数据处理试验数据均使用SPSS 19.0软件进行分析,方差齐则进行Duncan多重比较分析差异性(P≤0.05)。方差不齐则进行t检验进行多重比较(P≤0.05)。
2 结果与分析 2.1 MHB潜力菌株对美味牛肝菌菌丝生长的影响经过首次筛选后发现,有12株细菌对美味牛肝菌菌丝生长有一定的促进作用;有3株细菌对菌丝生长没有影响;有7株细菌对菌丝生长有抑制作用。通过重复筛选,获得对美味牛肝菌菌丝生长有明显促进作用的3株MHB潜力菌株,分别是H3、H8、H12。通过MHB潜力菌株处理后的美味牛肝菌菌落直径变化见表 1,24 h内细菌对菌丝的促进作用无明显差异,24 h以后开始表现出不同程度的促进作用。取120 h菌落直径比较,这3株细菌的胞外代谢产物对菌丝生长具有显著促进作用(P<0.05)。
| 处理 Treatment |
菌落直径Colony diameter/cm | |||||
| 0 h | 24 h | 48 h | 72 h | 96 h | 120 h | |
| CK | 1.00a | 1.58±0.01a | 2.70±0.11a | 4.43±0.02a | 6.15±0.14a | 7.75±0.02a |
| H3 | 1.00a | 1.68±0.01a | 3.00±0.03a | 4.92±0.03a | 6.68±0.22b | 8.32±0.21b |
| H8 | 1.00a | 1.66±0.02a | 3.02±0.12a | 4.72±0.01a | 6.44±0.12a | 8.30±0.13b |
| H12 | 1.00a | 1.72±0.11a | 2.92±0.01a | 4.87±0.03a | 6.80±0.13b | 8.35±0.23b |
| 注:不同小写字母表示处理在P < 0.05的显著水平下差异显著; 表中直径包含菌种直径。Note: different lowercase letters within the same column indicate significant difference between treatments at P < 0.05 level.The data of diameters include the diameters of strains. | ||||||
不接种任何微生物为对照, 单接种Be菌株、双接种Be+H3、Be+H8、Be+H12于黑松幼苗根际,6个月后,观察黑松幼苗的生长情况。肉眼观察结果表明,双接种Be和潜力菌株H12的松苗长势最好,针叶为深绿色,地上部分少有发黄的针叶。MHB潜力菌株与Be互作对黑松生长的影响如表 2所示,不接种任何微生物的松苗长势最差,单接种Be对松苗的苗高、地径和侵染率均有促进作用,细菌与Be互作后对松苗的生长促进作用更明显。双接种Be+H12处理与单接种Be相比,苗高增长率为23.5%,地径增长率为50.5%,根侵染率提高了472.9%,茎根比下降了37.9%。双接种Be+H3处理的黑松幼苗与单接种Be相比,苗高、地径、茎根比、根侵染率均无显著差异。双接种Be+H8处理的黑松幼苗与单接种Be相比,虽然根侵染率较高,达到显著差异,但是苗高、地径和茎根比没有明显增加,菌株地上部分长势也不如菌株H12处理的松苗。综上所述,菌株H12为美味牛肝菌和黑松的菌根辅助细菌,促生作用较明显。
| 处理 Treatment |
生长指标Growth index | ||||
| 苗高 Seedling height/cm |
地径 Ground diameter/mm |
茎根比 Stem root rate |
根侵染率 Colonization rate of root/% |
||
| CK | 4.51±0.92a | 0.67±0.39a | 3.45±0.01a | 0 | |
| Be | 6.00±0.01b | 1.01±0.01b | 3.62±0.01a | 4.80±0.01a | |
| Be+H12 | 7.41±0.03c | 1.52±0.01c | 2.25±0.01a | 27.50±0.01c | |
| Be+H3 | 6.52±0.01b | 1.03±0.01b | 3.37±0.01a | 5.10±0.01a | |
| Be+H8 | 6.43±0.01b | 1.10±0.01b | 3.08±0.01a | 8.10±0.01b | |
| 注:不同小写字母表示处理在P < 0.05的显著水平下差异显著。Note: different lowercase letters within the same column indicate significant difference between treatments at P < 0.05 level.s | |||||
MHB菌株的形态如图 1所示。从图 1(a)中可以看出,H12菌株单菌落呈乳白色、圆形、扁平、透明、边缘规则,革兰氏染色呈阳性。菌体形状杆状,单个排列。菌体经过番红染色后,显微镜下放大1 000倍后如图 1(b)所示,菌体形状杆状,单个排列,产芽孢,芽孢中生,孢囊略微膨大,革兰氏染色呈阳性。
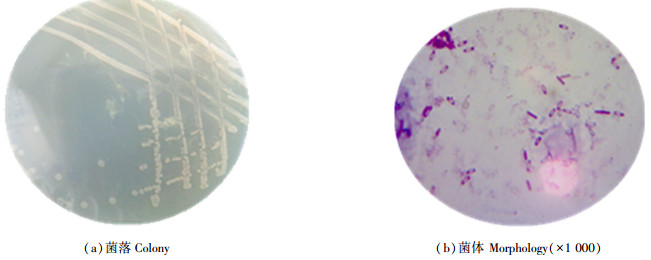
|
图 1 H12菌株的菌落及菌体形态 Fig. 1 Colony and morphology of H12 strain |
H12菌株的生化特性为需氧性阳性,淀粉水解呈阳性,硝酸盐还原呈阴性,发酵葡萄糖产酸呈阳性,发酵葡萄糖产气呈阴性,乙酰甲基甲醇试验呈阳性,甘油产二羟丙酮呈阳性。结合上述H12的形态和生化特性,推测其为蜂房类芽孢杆菌。
2.4 MHB菌株16S rDNA序列分析将测序获得H12菌株的16S rDNA1 438个碱基序列与GenBank数据库中的序列进行BLASTn比对,获得同源序列,挑选相似度99%的序列,构建系统进化树,结果见图 2。BLASTn比对结果发现,与菌株H12同源性最高的为蜂房类芽孢杆菌,同源性达99%,可以初步确定菌株H12为蜂房类芽孢杆菌(Paenibacillus alvei)。
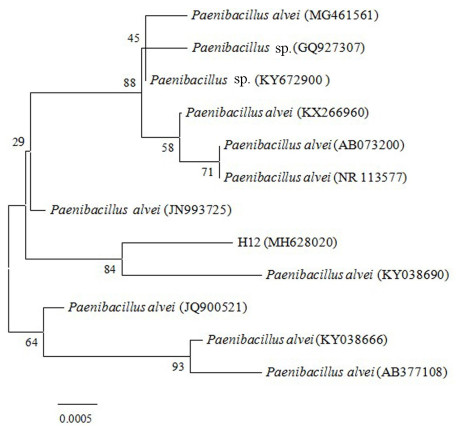
|
注:分指数值表示自展值;括号数值表示GenBank登录号;标尺为进化距离。Note: numbers at branch nodes represent bootstrap values. The GenBank accession number of aligend sequences are shown in the brackets. The bar represents nucleotide divergence. 图 2 基于16S rDNA基因序列的H12菌株的系统进化树 Fig. 2 Neighbor-joining phylogenetic tree analysis of 16S rDNA gene of isolate H12 |
微生物对某些食用和药用真菌的菌丝生长和子实体形成的促生作用已经得到证实, 例如双孢菇、鸡腿菇和猪肚菇等土生食用菌,土壤中的有益微生物对菌丝的促生和子实体形成非常关键,覆土是其子实体正常生长的必需条件[11]。RAINEY[12]也报道了从覆土层中分离的臭味假单孢杆菌对双孢蘑菇菌丝生长有促进作用。GUO et al[13]从猪苓生长穴中发现了猪苓伴生菌(Grifola sp.)是促进猪苓菌核形成的关键生物因子。本试验结果表明蜂房类芽孢杆菌对Be真菌生长、菌根合成有促进作用,推测可能的原因,一是其具有较强的几丁质酶合成能力,可以将环境中的纤维素降解为美味牛肝菌菌丝更好利用的N-乙酰葡萄糖氨[14]。阳飞等[15]在美味牛肝菌菌丝培养研究中也证明果糖、蔗糖、葡萄糖均有利于菌丝生长。二是蜂房类芽孢杆菌代谢产生的毒性蛋白质、抗菌肽具有抑菌作用[16],从而抑制土壤中其它病原微生物的生长,利于菌根合成。
目前报道筛选出的MHB种类大致有假单胞杆菌属、农杆菌、芽孢杆菌属、类芽孢杆菌属、短芽孢杆菌属、红球菌、节杆菌等细菌,未见蜂房类芽孢杆菌的促生报道。本试验结果表明,单接种Be真菌能促进黑松松苗的生长,但是蜂房类芽孢杆菌和Be互作对黑松苗的促生作用更明显。盛江梅等[5]也曾报道了Be真菌对黑松生长有促进作用,蜡状芽孢杆菌和Be互作接种黑松苗与单接Be相比,黑松的苗高增加了15.8%,地径增加了5.6%,菌根侵染率提高了7.7%。可见,菌根辅助细菌与菌根真菌的互作更有利于松苗的生长。本研究为菌塘微生物菌剂的开发,进一步研究菌根辅助细菌-外生菌根真菌-宿主植物三者互作机制提供了理论参考。
| [1] | 郑凤英, 许景伟. 威海市黑松海防林生态系统服务价值评估[J]. 科学·经济·社会, 2010, 28(2): 98–102. DOI:10.3969/j.issn.1006-2815.2010.02.021 |
| [2] | 魏初奖, 陈顺立, 张飞萍, 等. 松突圆蚧虫口数量与环境因子的关系[J]. 福建林学院学报, 2011, 31(2): 171–176. DOI:10.3969/j.issn.1001-389X.2011.02.016 |
| [3] | SCHREY S D, SCHELLHAMMER M, ECKE M, et al. Mycorrhiza helper bacterium Streptomyces AcH 505 induces differential gene expression in the ectomycorrhizal fungus Amanita muscaria[J]. New Phytologist, 2005, 168(1): 205–216. DOI:10.1111/j.1469-8137.2005.01518.x |
| [4] | 张扬, 叶建仁, 赵阳, 等. 红绒盖牛肝菌发酵条件及对杨树溃疡病的防治效果[J]. 森林与环境学报, 2016, 36(4): 397–403. |
| [5] | 盛江梅, 吴小芹, 侯亮亮, 等. 一株黑松-美味牛肝菌菌根辅助细菌的筛选及鉴定[J]. 应用与环境生物学报, 2010, 16(5): 701–704. |
| [6] | 李倩, 吴小芹, 叶建仁. 一种马尾松菌根辅助细菌:短芽孢杆菌的筛选及鉴定[J]. 林业科学, 2015, 51(5): 159–164. |
| [7] | ZHAO L, WU X Q, YE J R, et al. Isolation and characterization of cycorrhiza helper bacterium form rhizosphere soil of polar stands[J]. Biology and Fertililty of Soils, 2014, 50(4): 593–601. DOI:10.1007/s00374-013-0880-9 |
| [8] | XING R, YAN H Y, GAO Q B, et al. Microbial communities inhabiting the fairy ring of Floccularia luteovirens and isolation of potential mycorrhiza helper bacteria[J]. Journal of Basic Microbiology, 2018, 58(6): 554–563. DOI:10.1002/jobm.v58.6 |
| [9] | 付绍春.美味牛肝菌与不同宿主植物幼苗菌根合成技术研究[D].长沙: 湖南农业大学, 2008: 1-53. |
| [10] | 秦余, 李茜茜, 郑雨焕, 等. 3种野生牛肝菌的菌塘土壤细菌多样性[J]. 微生物学通报, 2016, 43(10): 2148–2153. |
| [11] | HAYES W A, RANDLE P E, LAST F T. The nature of the microbial stimulus affecting sporophore formation in Agaricus bisporus (Lange) Sing[J]. Annals of Applied Biology, 1989, 12(1): 45–51. |
| [12] | RAINEY P B. Effect of Pseudomonas putida on hyphal growth of Agaricus bisporus[J]. Mycological Research, 1991, 95(6): 699–704. DOI:10.1016/S0953-7562(09)80817-4 |
| [13] | GUO S X, WANG Q Y, ZHUANG W Y, et al. Discovery and application of the companion fungus related to sclerotial formation from hyphae of Grifola umbellata[J]. Acta Botanica Sinica, 2002, 44(10): 1151–1154. |
| [14] | 夏建辉, 龙中儿, 黄运红, 等. 蜂房芽孢杆菌利用蔗渣发酵产木聚糖酶的研究[J]. 江西师范大学学报(自然科学版), 2003, 27(1): 80–84. DOI:10.3969/j.issn.1000-5862.2003.01.022 |
| [15] | 阳飞, 张华山, 董殿波, 等. 美味牛肝菌多糖发酵工艺的研究食用菌学报[J]. 食用菌学报, 2009, 16(1): 67–72. DOI:10.3969/j.issn.1005-9873.2009.01.010 |
| [16] | BALAIAH A, VELLAICHAMY A, KACHMAN M, et al. Co-production of two new peptide antibiotics by a bacterial isolate Paenibacillus alvei NP75[J]. Biochemical and Biophysical Research Communication, 2009, 379(2): 179–185. DOI:10.1016/j.bbrc.2008.12.007 |

 2019, Vol. 39
2019, Vol. 39

