文章信息
- 蔡月琴, 刘艺敏, 凡莉莉, 杜溶讫, 荣俊冬, 郑郁善
- CAI Yueqin, LIU Yimin, FAN Lili, DU Rongqi, RONG Jundong, ZHENG Yushan
- 响应面法优化巴戟天多糖提取工艺
- Optimization of extraction of poiysaccharide from Morinda officinalis by response surface methodology
- 森林与环境学报,2019, 39(3): 303-309.
- Journal of Forest and Environment,2019, 39(3): 303-309.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.03.012
-
文章历史
- 收稿日期: 2018-09-28
- 修回日期: 2018-10-23
2. 闽南师范大学生物科学与技术学院, 福建 漳州 363000
2. College of Biological Sciences and Technology, Minnan Normal University, Zhangzhou, Fujian 363000, China
巴戟天为茜草科植物巴戟天(Morinda officinalis How)的干燥根,其味甘、辛,性微温,有祛风除湿、强筋健骨、补肾壮阳等传统功效[1],主要分布在福建、广东、广西、海南等热带和亚热带地区,是著名的“四大南药”之一[2-3]。巴戟天中含有蒽醌类、环烯醚萜类、糖类、氨基酸、甾醇类等多种化学成分,其中多糖类物质含量很高,是巴戟天重要有效成分之一[4-5]。多糖是一类具有生物活性的大分子化合物[6],现代药理研究表明,巴戟天多糖具有提高机体免疫力[7]、抗骨质疏松[8]、抗疲劳[9]、抗氧化和降血糖[10]等活性,在食品、药品、保健品等方面具有良好的开发前景。
多糖为极性强的高分子聚合物,易溶于热水,不溶于有机溶剂[11]。常用的多糖提取方法有酸碱提取法、热水提取法、超声波提取法、酶提取法、微波提取法等。酸碱提取法容易破坏一些多糖的糖苷键,影响多糖的结构性质[12];酶提取法对影响酶活性的条件要求严格,且所需酶制剂量大成本高,不适合大规模应用[13]。而超声波提取法和微波提取法需要特殊的仪器辅助设备,提取费用明显增加,且存在噪声污染和电磁波污染,物料常受热不均,长时间作用会使多糖断裂,影响其生物活性[13-14]。热水提取法操作简单,成本低,对多糖结构的破坏性小,是首选方法。而有关巴戟天多糖的提取方法主要有超声波提取[15]、酶提取[16]、溶剂提取[17]等,其中热水提取法大多采用沸水提取巴戟天多糖[18],多糖得率不高,提取时间长,能耗相对较高。本研究以漳州南靖地区巴戟天为材料,采用热水回流提取巴戟天多糖,在考察热浸提液料比、浸提温度、浸提时间等三个单因素对多糖得率影响的基础上,通过响应面法优化巴戟天多糖提取条件,旨为巴戟天多糖的生产提供技术支持,促进巴戟天多糖进一步开发和利用。
1 材料与方法 1.1 试验材料巴戟天干燥根购自漳州南靖和溪。试验试剂包括:无水乙醇、葡萄糖、苯酚、浓硫酸(均为分析纯),本实验用水均为超纯水。试验仪器包括:电热恒温鼓风干燥箱;电子天平AR124CN;UV-1750紫外分光光度计;SHB-Ⅲ型循环水真空泵;HH-6数显恒温水浴锅;植物粉碎机。
1.2 试验方法 1.2.1 样品的前处理将巴戟天的根剪碎置于60 ℃恒温干燥箱中干燥至恒重磨成粉末,过80目筛,放在干燥室中备用。
1.2.2 多糖提取工艺流程巴戟天的根→烘干粉碎→过筛→醇提→过滤→滤渣→热水浸提→过滤→滤液→测定多糖。
1.2.3 样品液的制备精确称取巴戟天粉末1 g,加80%乙醇回流提取2 h,趁热过滤,残渣用80%热乙醇洗涤3次,每次15 mL。残渣连同滤纸置烧瓶中,挥干乙醇,加蒸馏水50 mL,90 ℃浸提1 h,趁热过滤,收集滤液定容到100 mL容量瓶中,上述溶液即为样品溶液[12]。
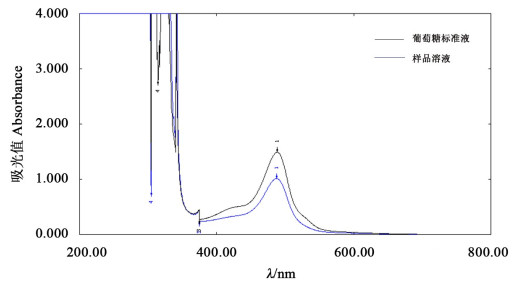
1.2.4 多糖含量的测定 1.2.4.1 波长的确定以葡萄糖为标样,采用苯酚-硫酸法进行巴戟天多糖含量测定[19]。取1 mL葡萄糖标准液(100 μg·mL-1)和样品溶液分别置25 mL具塞试管内,加入6%苯酚试剂1 mL,混匀,迅速加入浓硫酸5 mL,混匀后静置15 min,置沸水浴加热15 min,冷却至室温。以1 mL超纯水加入相同的苯酚、硫酸溶液为空白,置于紫外分光光度计从200~800 nm进行扫描,分别记录吸光值。对样品溶液和葡萄糖标准溶液进行紫外光扫描,两种溶液在488 nm均出现最大吸收值(图 1),确定多糖检测波长为488 nm。
|
图 1 样品溶液和葡萄糖标准溶液的扫描光谱 Fig. 1 Scanning spectra of sample solutions and glucose standard solutions |
称取105 ℃干燥至恒重的葡萄糖13.7 mg,配制成137 μg·mL-1的葡萄糖标准液。吸取葡萄糖标准液0、0.20、0.40、0.60、0.80、1.00 mL,加入25 mL具塞试管,加蒸馏水至1.00 mL。再加6%苯酚溶液1 mL,摇匀,迅速加浓硫酸5 mL,放置5 min后,于沸水浴中加热15 min,显色后在冷水中冷却,在波长488 nm下测定其吸光度,以1 mL超纯水按照同样显色操作为空白。得标准曲线回归方程为:Y=0.010 3X+0.098,其中:X表示葡萄糖浓度,Y为吸光度,R2=0.999 2,表明在27.5~137.5 μg·mL-1的范围内,葡萄糖浓度与吸光值呈良好的线性关系。
1.2.4.3 多糖提取率的计算吸取1.00 mL样品液按照1.2.4.1步骤操作,在波长488 nm处测得吸光度值,代入标准曲线回归方程,计算得巴戟天多糖质量浓度,按公式(1)计算巴戟天多糖得率。
| ${\rm{多糖提取率/\% = 多糖质量浓度}} \times {\rm{1}}{{\rm{0}}^{ - 6}} \times {\rm{定容体积}} \times {\rm{稀释倍数/巴戟天粉末质量}} \times {\rm{100}} $ | (1) |
吸取同一葡萄糖标准溶液1.00 mL,按照1.2.4.1方法重复操作5次,测定吸光值,得其相对标准偏差(relative standard deviation,RSD)为2.448 3%,表明仪器精密度良好。
1.2.4.5 稳定性试验吸取同一样品溶液,按照1.2.4.1方法操作,每隔2 h测定一次(n=6),测定吸光值,得其RSD为1.873 2%,表明样品溶液在12 h内,稳定性良好。
1.2.4.6 重复性试验精确称取同一批样品5份,按照1.2.3方法配置样品溶液,以1.2.4.1方法进行测定,测定吸光值,得其RSD为1.433 4%,表明该方法重现性良好。
1.2.4.7 加标回收率试验吸取已知含量样品溶液6份,每份0.50 mL。分别精确加入0.50 mL葡萄糖标准溶液。按照1.2.4.1方法测定回收率,得其平均回收率为98.319 9%,RSD为2.568 9%,表明该方法回收率高。
1.2.5 单因素试验设计称取1 g巴戟天粉末,经过醇提后,再进行热浸提,过滤,收集滤液,并且定容到100 mL容量瓶,取1 mL溶液稀释10倍,用苯酚-硫酸法测定其吸光值,并计算多糖提取率,考察热浸提液料比、浸提温度、浸提时间对多糖提取率的影响。分别选取浸提液料比为20:1、25:1、30:1、35:1、40:1(mL·g-1);浸提温度为50、60、70、80、90 ℃;浸提时间为1、2、3、4、5 h等3个因素进行单因素试验(平行试验重复3次)。
1.2.6 响应面试验设计在1.2.5单因素试验的基础上,以液料比、浸提温度、浸提时间为自变量,多糖得率为响应值,进行3因素3水平的响应面分析,采用Box-Behnken中心组合法[20-21]对巴戟天多糖的提取工艺进行响应面优化试验,各试验因素及水平见表 1。
| 水平 Level |
液料比 Liquid-soild ratio /(mL·g-1) |
浸提温度 Extraction temperature/℃ |
浸提时间 Extraction time/h |
| -1 | 20:1 | 70 | 2.5 |
| 0 | 25:1 | 80 | 3.0 |
| 1 | 30:1 | 90 | 3.5 |
运用SPSS17.0和Design Expert 8.0.6.1软件对试验数据进行统计学分析。
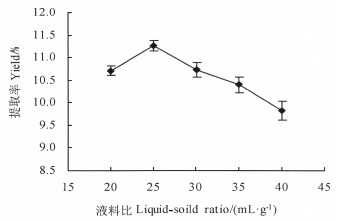
2 结果与分析 2.1 单因素试验结果 2.1.1 液料比对多糖提取率的影响称取1 g巴戟天粉末,经过醇提后,分别加入20、25、30、35、40 mL的超纯水,在80 ℃下浸提1 h,结果表明,在液料比为(20~25):1时,巴戟天多糖提取率随着溶剂量的增加而增大(图 2);在液料比为(25~40):1时,多糖提取率随着溶剂量的增加而明显降低。这可能是液料比为(20~25):1时,随着溶剂用量的增大,细胞内外的浓度差不断提高,使得多糖的传质驱动力增大,多糖提取率增加[22];当溶剂用量继续增加时,过多的溶剂导致细胞内其他物质溶出,影响多糖提取率[23]。因此,选择液料比25:1进行响应面优化试验。
|
图 2 液料比对多糖提取率的影响 Fig. 2 Effect of the ratio of liquid to solid on the yield of polysaccharide |
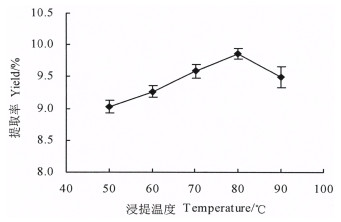
称取1 g巴戟天粉末,经过醇提后,加入25 mL超纯水,分别在50、60、70、80、90 ℃下浸提1 h,结果表明,浸提温度为50~80 ℃时,巴戟天多糖提取率随着温度的升高而增大(图 3);温度为80 ℃时多糖提取率达最大值,随后随着温度的升高,多糖提取率呈快速减小的趋势。这可能是因为温度的升高,有利于提高溶剂的渗透能力,加快多糖分子运动速率,使得多糖提取率升高;当浸提温度超过80 ℃后,多糖被氧化,分子结构受到破坏,多糖提取率降低[24]。因此,选择浸提温度80 ℃进行响应面优化试验。
|
图 3 浸提温度对多糖提取率的影响 Fig. 3 Effect of extraction temperature on the yield of polysaccharide |
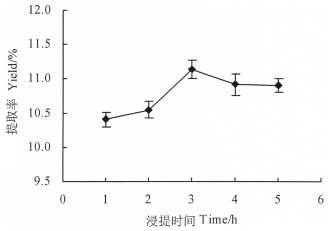
称取1 g巴戟天粉末,经过醇提后,加入25 mL的超纯水,在80 ℃下分别浸提1、2、3、4、5 h,结果表明,当浸提1~3 h时,巴戟天多糖提取率随着浸提时间的增加呈现逐渐增大的趋势;超过3 h后,多糖提取率随着浸提时间的增加而缓慢下降(图 4)。这可能是因为随着浸提时间的延长,巴戟天多糖不断被溶解出,浸提时间越长,释放出的多糖越多;当浸提时间过长,增加到3h后,长时间的高温浸泡,多糖分子结构被破坏,从而影响了多糖提取率[25-26]。因此,选择浸提时间3 h进行响应面优化试验。
|
图 4 浸提时间对多糖提取率的影响 Fig. 4 Effect of extraction time on the yield of polysaccharide |
根据单因素试验结果,选取液料比、浸提温度、浸提时间为自变量,巴戟天多糖提取率为响应值,利用Design-Expert8.0.6.1软件中Box-Behnken组合设计法进行3因素3水平的响应面优化试验,试验结果见表 2。
| 试验号 Test number |
液料比 Liquid-soild ratio/(mL·g-1) |
浸提温度 Extraction temperature/℃ |
浸提时间 Extraction time/h |
提取率 Polysaccharides yield/% |
| 1 | 0 | 0 | 0 | 11.210 1 |
| 2 | -1 | -1 | 0 | 10.709 7 |
| 3 | 0 | 0 | 0 | 11.224 8 |
| 4 | 1 | 0 | -1 | 10.936 5 |
| 5 | 0 | -1 | -1 | 10.821 4 |
| 6 | 0 | 0 | 0 | 11.251 2 |
| 7 | -1 | 0 | 1 | 10.630 8 |
| 8 | 1 | 0 | 1 | 10.723 7 |
| 9 | 0 | 0 | 0 | 11.248 7 |
| 10 | 0 | 1 | -1 | 10.861 6 |
| 11 | -1 | 0 | -1 | 10.794 3 |
| 12 | -1 | 1 | 0 | 10.743 6 |
| 13 | 0 | 1 | 1 | 10.594 3 |
| 14 | 1 | -1 | 0 | 10.806 8 |
| 15 | 1 | 1 | 0 | 10.640 2 |
| 16 | 0 | 0 | 0 | 11.208 6 |
| 17 | 0 | -1 | 1 | 10.761 2 |
对表 2试验结果进行回归分析,得出巴戟天多糖提取率(Y)对试验因素液料比(X1)、浸提温度(X2)、浸提时间(X3)的三元二次多项回归方程:Y=11.23+0.029X1-0.032X2-0.088X3-0.05X1X2-0.012X1X3-0.052X2X3-0.25X12-0.26X22-0.21X32。对该回归模型进行方差分析,并对模型系数进行显著性检验。从回归模型方差分析结果表明,方程模型的F为76.02,P < 0.000 1,表明该二次回归模型极显著(表 3);模型的一次项X2、交互项X1X2、X2X3对巴戟天多糖提取率影响显著;一次项X3、二次项X12、X22和X32对巴戟天多糖提取率的影响均达到极显著水平。模型的失拟项不显著(F=6.05,P=0.057 3>0.05),说明模型与试验值的差异较小;模型的RAdj2=0.976 9,说明97.69%的响应值变化可以用此模型来解释;相关系数R2=0.989 9>0.9,说明该模型拟合程度良好,试验误差小,此模型可以用来分析和预测巴戟天多糖的提取率。该回归模型的二次项系数均为负值,说明方程表示的抛物面开口向下有极大值点。从表中各因素的F值和P值可判断,对巴戟天多糖提取率影响最大的是浸提时间,其次是浸提温度和液料比。
| 变异来源 Source of variation |
平方总和 Sum of square |
自由度 Freedom degree |
均方 Mean square |
F值 F value |
P值 P value |
显著性 Significance |
| 模型Model | 0.90 | 9 | 0.1 | 76.02 | < 0.000 1 | ** |
| X1 | 6.54×10-3 | 1 | 6.54×10-3 | 4.95 | 0.061 5 | No |
| X2 | 8.41×10-3 | 1 | 8.41×10-3 | 6.36 | 0.039 7 | * |
| X3 | 0.062 | 1 | 0.062 | 46.82 | 0.000 2 | ** |
| X1X2 | 0.01 | 1 | 0.01 | 7.60 | 0.028 2 | * |
| X1 X3 | 6.08×10-4 | 1 | 6.08×10-4 | 0.46 | 0.519 7 | No |
| X2X3 | 0.011 | 1 | 0.011 | 8.11 | 0.024 8 | * |
| X12 | 0.25 | 1 | 0.25 | 192.59 | < 0.000 1 | ** |
| X22 | 0.28 | 1 | 0.28 | 211.35 | < 0.000 1 | ** |
| X32 | 0.19 | 1 | 0.19 | 142.28 | < 0.000 1 | ** |
| 残差Residual | 9.26×10-3 | 7 | 1.32×10-3 | |||
| 失拟项Lack of fit | 7.59×10-3 | 3 | 2.53×10-3 | 6.05 | 0.057 3 | No |
| 纯误差Pure error | 1.67×10-3 | 4 | 4.18×10-3 | |||
| 总和Sum | 0.91 | 16 | ||||
| 注:**为差异极显著(P < 0.01);*为差异显著(P < 0.05)。Note:** indicates highly significant difference(P < 0.01);* indicates significant difference(P < 0.05). | ||||||
通过分析响应曲面形状,可以确定各试验因素的水平变化对响应值的影响情况;而等高线的形状为椭圆形时,表示两因素交互作用显著,圆形则表示交互作用不显著[27-28]。从图 5可以看出,浸提时间为3 h时,浸提温度和液料比的交互作用对巴戟天多糖提取率的影响。当浸提温度在77~84 ℃、液料比在23~26.5范围时有较高的多糖提取率。在浸提温度不变时,巴戟天多糖提取率随着液料比的增大呈现先升高后降低的趋势;液料比不变时,巴戟天多糖提取率随着浸提温度的提高呈现先快速升高后缓慢下降的趋势。从图 5可知,响应曲面坡度较陡,说明浸提温度和液料比的交互作用对巴戟天多糖提取率影响较大;从等高线形状可以推断浸提温度对巴戟天多糖提取率的影响要比液料比大。
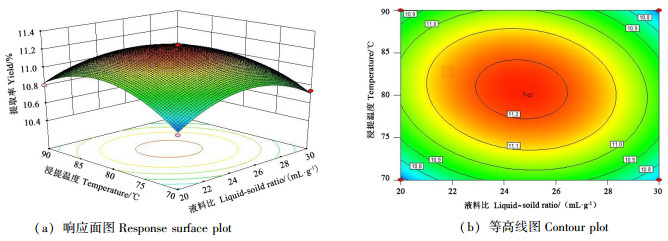
|
图 5 浸提温度和液料比交互作用对巴戟天多糖提取率的影响 Fig. 5 Interactive effects of extraction temperature and extraction time on the yield of polysaccharide |
从图 6可以看出,浸提温度为80 ℃时,浸提时间和液料比的交互作用对巴戟天多糖提取率的影响。当液料比在23~26.5、浸提时间在2.9~3.3 h范围时有较高的多糖提取率。在液料比较低时,多糖提取率随着液料比的提高而增大,当液料比超过25后,多糖提取率随着液料比的增大而降低。在液料比不变时,巴戟天多糖提取率随着浸提时间的增加呈先升后降的趋势。从图 6可知,响应曲面坡度相对较平,表明浸提时间和液料比的交互作用对多糖提取率的影响较弱;由等高线形状可以推断浸提时间对巴戟天多糖提取率的影响比液料比大。
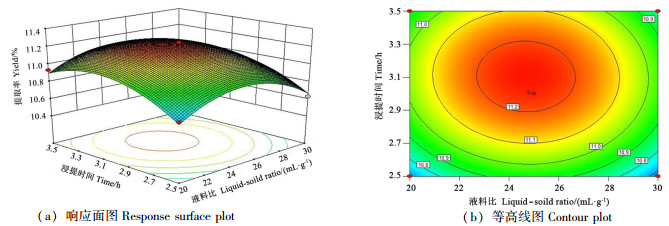
|
图 6 浸提时间和液料比交互作用对巴戟天多糖提取率的影响 Fig. 6 Interactive effects of extraction time and liquid-solid ratio on the yield of polysaccharide |
从图 7可以看出,液料比为25:1时,浸提时间和浸提温度的交互作用对巴戟天多糖提取率的影响。当浸提时间在2.9~3.3 h、浸提温度在77~84 ℃范围时有较高的多糖提取率。浸提温度不变时,巴戟天多糖提取率随着浸提时间的增加呈先升高后平缓下降的趋势。浸提温度在较低水平下,随着浸提温度的升高巴戟天多糖提取率逐渐提高,当温度超过80 ℃后,多糖提取率随着浸提温度的上升而下降。从图 7可知,响应曲面坡度较陡,表明浸提时间和浸提温度的交互作用对多糖提取率的影响较大;由等高线形状可以推断浸提时间对巴戟天多糖提取率的影响要大于浸提温度。
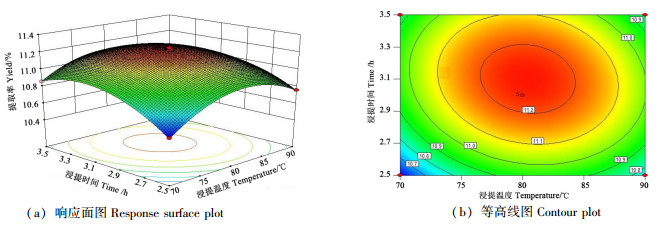
|
图 7 浸提时间和浸提温度交互作用对巴戟天多糖提取率的影响 Fig. 7 Interactive effects of extraction time and temperature on the yield of polysaccharide |
综上所述,浸提温度和液料比、浸提时间和浸提温度二者的交互作用对巴戟天多糖的提取率的影响均为显著;影响巴戟天多糖提取率因素的主次顺序为浸提时间>浸提温度>液料比,这与上述回归方差分析结果一致。
2.4 优化提取参数和验证模型Design-Expert8.0.6.1软件分析得到巴戟天多糖提取的最佳工艺条件为:液料比24.66:1 (mL·g-1)、浸提温度80.5 ℃、时间3.1 h,在该条件下预测的巴戟天多糖提取率为11.239 4%。根据实际情况调整最佳提取工艺为液料比25:1(mL·g-1),浸提温度81 ℃,时间3.1 h。为了检验响应面法的可靠性,在此条件下进行3次重复性验证试验,测得的巴戟天多糖提取率分别为11.157 9%、11.316 5%、11.372 8%,平均值为11.282 4%,相对误差为0.38%,实测值与理论预测值之间拟合度较好,说明利用响应面法对巴戟天多糖提取工艺的优化是可行的。
3 讨论与结论在巴戟天多糖提取过程中,原料先用80%乙醇回流提取2 h,以除去单糖、低聚糖、氨基酸、醇溶性蛋白质等杂质,避免对试验造成干扰。乙醇回流后的残渣继续用热水提取,水的极性强,对巴戟天组织穿透力强,作用温和,多糖提取效率高[29]。本试验巴戟天多糖的测定方法采用苯酚-硫酸法,利用多糖在强酸的环境中被水解成单糖分子,并且脱水生成糖醛衍生物,糖醛衍生物与苯酚反应生成有色化合物,用比色法在葡萄糖标准溶液与样品标准溶液的最大吸光值对应的波长下测定多糖含量,苯酚-硫酸法灵敏度高,方法简单,且不受蛋白质的影响[30-31]。
本研究采用热水浸提法提取巴戟天多糖,通过单因素试验和响应面试验设计,考察浸提温度、浸提时间和液料比3个因素及其相互作用对巴戟天多糖提取率的影响。通过单因素试验分析确定了巴戟天多糖提取工艺为液料比25:1、浸提温度80 ℃、浸提时间3 h。在单因素试验结果的基础上,经Box-Behnken中心组合设计及响应面分析,结果表明浸提时间对巴戟天多糖提取率的影响极显著,浸提温度影响显著,而液料比影响不显著,两因素间的交互作用对巴戟天多糖提取率影响较明显的是浸提温度和浸提时间、浸提温度和液料比;巴戟天多糖最佳提取工艺为:液料比25:1、浸提温度为81 ℃、浸提时间3.1 h,在该条件下,实际测得的巴戟天多糖提取率为11.282 4%,与理论预测值的误差仅为0.38%,说明本试验所建立的回归模型较为准确,优化方案合理可行。
| [1] | 国家药典委员会.中华人民共和国药典.一部: ZBBZH/ZY/1[S].北京: 中国医药科技出版社, 2010: 75. |
| [2] | 中国科学院中国植物志编辑委员会. 中国植物志:第七十一卷:第二分册:被子植物门:双子叶植物纲:茜草科:茜草亚科[M]. 北京: 科学出版社, 1999: 199. |
| [3] | 刘颖嘉, 黄宇, 荣俊冬, 等. 巴戟天遗传多样性的ISSR分析[J]. 福建林学院学报, 2011, 31(3): 203–206. DOI:10.3969/j.issn.1001-389X.2011.03.003 |
| [4] | 吴凌凤, 曾令杰. 巴戟天化学成分与质量控制研究进展[J]. 广东药学院学报, 2012, 28(1): 98–101. |
| [5] | ZHANG J H, XIN H L, XU Y M, et al. Morinda officinalis How.-a comprehensive review of traditional uses, phytochemistry and pharmacology[J]. Journal of Ethnopharmacology, 2018, 213: 230–255. DOI:10.1016/j.jep.2017.10.028 |
| [6] | 王蓉, 吴剑波. 多糖生物活性的研究进展[J]. 国外医药抗生素分册, 2001, 22(3): 97–100. DOI:10.3969/j.issn.1001-8751.2001.03.001 |
| [7] | 何传波, 李琳, 汤凤霞, 等. 不同巴戟天多糖对免疫活性的影响[J]. 中国食品学报, 2010, 10(5): 68–73. DOI:10.3969/j.issn.1009-7848.2010.05.010 |
| [8] | ZHU M Y, WANG C J, ZHANG H S, et al. Protective effect of polysaccharides from Morinda officinalis on bone loss in ovariectomized rats[J]. International Journal of Biological Macromolecules, 2008, 43(3): 276–278. DOI:10.1016/j.ijbiomac.2008.06.008 |
| [9] | ZHANG H L, LI J, LI G, et al. Structural characterization and anti-fatigue activity of polysaccharides from the roots of Morinda officinalis[J]. International Journal of Biological Macromolecules, 2009, 44(3): 257–261. DOI:10.1016/j.ijbiomac.2008.12.010 |
| [10] | 刘霄. 巴戟天多糖的降血糖和抗氧化作用研究[J]. 中药材, 2009, 32(6): 949–951. DOI:10.3321/j.issn:1001-4454.2009.06.039 |
| [11] | 陈培琳, 陈钏杰, 周雨嘉, 等. 响应面分析法优化莲子心多糖的提取工艺[J]. 福建农林大学学报(自然科学版), 2017, 46(6): 708–715. |
| [12] | 陈忠, 刘琳玲, 何猛雄. 南药巴戟天多糖提取方法的比较研究[J]. 科技通报, 2004, 20(6): 546–548. DOI:10.3969/j.issn.1001-7119.2004.06.017 |
| [13] | 薛丹, 黄豆豆, 黄光辉, 等. 植物多糖提取分离纯化的研究进展[J]. 中药材, 2014, 37(1): 157–161. |
| [14] | 刘颖, 梁盈, 林亲录, 等. 南瓜多糖的提取及其抗氧化活性研究进展[J]. 食品与机械, 2014, 30(3): 239–243. |
| [15] | 尹艳, 叶琼, 吕镇城, 等. 超声波提取巴戟天多糖工艺的研究[J]. 北方园艺, 2015(12): 124–126. |
| [16] | 李妍, 曾玩芸. 酶法辅助提取巴戟天多糖的工艺研究[J]. 食品与机械, 2010, 26(1): 95–97, 136. |
| [17] | 梁小军, 韦炳墩, 陈茜, 等. 巴戟天多糖提取工艺及抗氧化抗疲劳活性研究[J]. 食品与机械, 2018, 34(7): 158–163. |
| [18] | ZHU M Y, WANG C J, WANG X, et al. Extraction of polysaccharides from Morinda officinalis by response surface methodology and effect of the polysaccharides on bone-related genes[J]. Carbohydrate Polymers, 2011, 85(1): 23–28. DOI:10.1016/j.carbpol.2011.01.016 |
| [19] | 曾红亮, 卢旭, 卞贞玉, 等. 响应面分析法优化金柑多糖的提取工艺[J]. 福建农林大学学报(自然科学版), 2012, 41(3): 315–319. DOI:10.3969/j.issn.1671-5470.2012.03.018 |
| [20] | 李莉, 张赛, 何强, 等. 响应面法在试验设计与优化中的应用[J]. 实验室研究与探索, 2015, 34(8): 41–45. DOI:10.3969/j.issn.1006-7167.2015.08.011 |
| [21] | 王舒婷, 郭福恩, 陈婷婷, 等. 尿素-双醛淀粉树脂胶合板热压工艺优化[J]. 森林与环境学报, 2016, 36(2): 240–245. |
| [22] | 和法涛, 刘光鹏, 朱风涛, 等. 响应面法优化热水法浸提猴头菇多糖工艺提高多糖得率[J]. 食品科技, 2015, 40(1): 210–215. |
| [23] | 包华音, 刘杨, 李巧玉, 等. 丹参多糖提取影响因素研究[J]. 山东中医杂志, 2014, 33(9): 762–764. |
| [24] | 常彦莉, 魏兴芸. 影响银杏叶多糖提取因素的研究[J]. 农业科技与信息, 2018(16): 43–45, 49. |
| [25] | WANG H J, XU Z H, LI X G, et al. Extraction, preliminary characterization and antioxidant properties of polysaccharides from the testa of Salicornia herbacea[J]. Carbohydrate Polymers, 2017, 176: 99–106. DOI:10.1016/j.carbpol.2017.07.047 |
| [26] | 杨淑云. 姬松茸富硒菌丝体多糖提取条件的优化[J]. 福建农业学报, 2017, 32(5): 531–535. |
| [27] | 万阅, 齐计英, 曾红, 等. 响应面法优化香菇多糖的超声辅助提取工艺[J]. 生物技术通报, 2015, 31(1): 79–85. |
| [28] | 马趣环, 石晓峰, 沈薇, 等. 响应面分析法优化雪松松针多糖提取工艺研究[J]. 中华中医药杂志(原中国医药学报), 2018, 33(3): 1106–1110. |
| [29] | 周波, 赵臻. 中草药巴戟天有效成分提取方法的研究进展[J]. 辽宁化工, 2013, 42(2): 171–173. DOI:10.3969/j.issn.1004-0935.2013.02.022 |
| [30] | 裴莉昕, 纪宝玉, 陈随清, 等. 葛根多糖提取工艺的优化[J]. 中国现代中药, 2017, 19(4): 553–556, 567. |
| [31] | 孙晓燕, 蔡昌利, 徐丽莉, 等. 多糖含量测定方法的比较[J]. 现代中药研究与实践, 2015, 29(3): 58–62. |

 2019, Vol. 39
2019, Vol. 39


