文章信息
- 林方辉, 童应华
- LIN Fanghui, TONG Yinghua
- 椰心叶甲对植物挥发化合物的触角电位与行为反应
- Electrophysiological and behavioral responses of Brontispa longissima to plant volatile compounds
- 森林与环境学报,2019, 39(2): 214-219.
- Journal of Forest and Environment,2019, 39(2): 214-219.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.02.015
-
文章历史
- 收稿日期: 2018-06-12
- 修回日期: 2018-11-16
椰心叶甲[Brontispa longissima (Gestro)]隶属鞘翅目(Coleoptera)叶甲总科(Chrysomeloidea)铁甲科(Hispidae)潜甲亚科(Anisoderinae)平胸族(Cryptonychini) [1]。该虫原产于巴布亚新几内亚和印度尼西亚,现已扩散到中国、越南、澳大利亚、马尔代夫等26个国家和地区[2-7],是我国林业危险性有害生物之一。椰心叶甲主要寄主为棕榈科植物,喜聚集潜藏于未展开的心叶内取食危害,防治困难[8-9]。植株受害后期常表现出部分枯萎和顶冠变褐,严重时会导致植株死亡[10]。
前人研究发现,特异的植物挥发化合物可引起昆虫做出一定的趋性行为反应。ERLER et al[11]研究发现,从新鲜的薄荷叶中蒸馏提取的芳香油类,对尖音库蚊(Culex pipiens Linnaeus)雌、雄虫都具有驱避作用;LEAL et al[12]发现柠檬香草中的香橙花醛和叶醛对致倦库蚊(Culex pipiens quinquefasciatus)和白纹伊蚊(Aedes albopictus)具有趋避的作用;TEULON et al [13]研究发现,由烟碱乙酸酯和苯甲醛混合制成的引诱剂,能够有效诱杀西花蓟马[Frankliniella occidentalis (Pergande)]成虫。
潜藏于苞叶或心叶取食危害的害虫,防治时农药难于接触到虫体,已成为害虫防治的重要瓶颈问题。利用化学刺激或化学胁迫害虫逃出苞叶或心叶而暴露,促其接触化学农药致死,或携带病原微生物农药返回或逃离,从而诱发流行病,对实现害虫种群控制有重要意义。本文通过触角电位技术和行为生测,筛选对椰心叶甲成虫有强烈刺激、胁迫作用的植物挥发化合物,为该虫的防治奠定应用基础。
1 材料与方法 1.1 供试昆虫椰心叶甲成虫采自棕榈科植物老人葵(Washingtonia filifera Wendl)寄主上,将采集来的椰心叶甲放入养虫笼(20 cm×20 cm×30 cm)中,以新鲜的老人葵心叶于27 ℃条件下饲养,每3 d更换1次新鲜的心叶。
1.2 仪器昆虫触角电位仪(ZDAC-4)、Y型嗅觉仪(JCY-0001)、旋涡混合器(XH-C),移液枪、巴斯德滴管、剪刀、定性滤纸、单面刀片、解剖针、导电胶等。
1.3 供试药品根据有关植物挥发物质对鞘翅目昆虫电生理与行为影响的报道,选取了9种容易获取且具有代表性的化合物作为试验材料[14-18]。供试植物源挥发化合物溶剂、纯度和来源见表 1。
| 化合物Compound | 纯度Purity | 来源Source |
| 异丁香酚Isoeugenol | 97% | 麦克林Macklin |
| 芳樟醇Linalool | 98% | 麦克林Macklin |
| α-蒎烯α-pinene | 99% | 西亚试剂Xiya |
| 1-庚醛1-heptanal | 98% | 麦克林Macklin |
| 肉桂醛Cinnamaldehyde | 98% | 麦克林Macklin |
| 双戊烯Dipentene | 95% | 麦克林Macklin |
| 香茅醛Citronellal | 98% | 麦克林Macklin |
| 叶醇Leaf alcohol | 98% | 阿拉丁Aladdin |
| 松节油Turpentine | 分析纯Analytic purity | 麦克林Macklin |
| 薄荷脑Menthol | 分析纯Analytic purity | 艾科达Aike |
| 石蜡(溶剂)Paraffin(Solvent) | 化学纯Chemically pure | 麦克林Macklin |
触角电位(electroantennogram, EAG)反应测试采用SHEPHERD et al[19]、DELORME et al[20]、赵冬香等[15]的方法。用石蜡油作溶剂,将每种标准化合物稀释1×102倍液。测试前将椰心叶甲雌雄成虫分开并进行12 h的饥饿处理。准备测试时,用移液枪在折成“V”字形的定性滤纸条(20 mm×15 mm)上滴加10 μL稀释1×102倍液的植物挥发化合物,立即塞进巴斯德滴管中,管口两端用保鲜膜封上,备用。用单面刀片将椰心叶甲的一根触角自基部切下,再切除触角端部少许(0. 5~1. 0 mm),然后用导电胶将触角两端固定在金属电极上,插入EAG探针。调整送气管,使之与触角垂直并相距约1 cm。开始测试时,将巴斯德滴管末端与气体控制装置连接,待电脑显示窗口上的基线平稳后方可进行刺激,刺激时气流流速、持续气流均设定为400 mL · min-1。每次刺激时间0. 5 s,刺激间隔60 s,以保证触角能够完全恢复感受性能。每根触角的测定顺序按标准参照化合物-对照样品-待测化合物-标准参照化合物的顺序进行,以抵消触角反应减弱的效果。以石蜡油作为空白对照,叶醇作为标准参照化合物。每根触角按顺序测定9种化合物,每个待测化合物为1个处理,每个处理5个重复。由于该虫上午EAG反应较稳定,故此试验均在上午7: 00—11: 00进行。
1.4.2 不同浓度化合物对椰心叶甲的EAG测试选择对椰心叶甲EAG相对反应值较大的化合物,用石蜡分别稀释成1×102、1×103、1×104、5×104、1×105倍液的5个浓度梯度,进行EAG反应测试,测试顺序按低浓度到高浓度的顺序进行,测试方法同1. 4. 1。每根触角为1个处理,共5次重复。EAG相对反应值计算见公式(1)。
| $ {\rm{EAG}}\;{\rm{相对反应值}}/\% = \frac{{{\rm{待测样品反应值 - 对照样品反应值}}}}{{{\rm{标准参照反应值 - 对照样品反应值}}}} \times 100 $ | (1) |
从EAG反应测试结果中,选择对椰心叶甲成虫有较大刺激作用的挥发化合物进行行为生测。生测使用的Y型管主臂长24 cm,两侧臂长26 cm,侧臂间夹角60°,主臂和侧臂内径均为4 cm。两侧臂分别与味源瓶和对照瓶相连,在气流进入味源瓶和对照瓶之前,先经过一个活性炭过滤器和一个蒸馏水瓶,以净化空气并增加空气湿度。测定采用张振等[17]的方法,用石蜡油将化合物稀释成不同浓度(1×102、1×103、1×104、5×104、1×105倍液),用移液枪取10 μL样品滴加在滤纸条上,放入味源瓶中,以液体石蜡作为对照。试验前将椰心叶甲雌雄成虫分开置于养虫笼中饥饿12 h,并且将Y型嗅觉仪各部件连接好,放在空气洁净的生测室内。室内遮光,室温保持在25 ℃,相对湿度(80±5) %,且嗅觉仪正上方悬挂红色灯泡作为试验时的光源。测试时,Y型管两臂气流调为250 mL · min-1,将饥饿处理过且较活跃的试虫从引虫孔单头引入管内。5 min内,若椰心叶甲停留在适应臂则记为不反应,进入处理臂并停留超过60 s记为引虫数。相反,进入对照臂并超过60 s记为驱避虫数。雌、雄虫分别进行试验。各化合物的每种浓度为1个处理,每处理测试5个重复,每个重复10头成虫。更换不同气味源时,用乙醇擦洗Y型管的内外壁,自然晾干,待无气味残留后方可继续进行试验。试验时间同EAG试验,均在上午7: 00—11: 00进行。Y型嗅觉仪测试驱避率、引诱率及反应率计算见公式(2) ~ (4)。
| $ {\rm{引诱率/\% }} = {\rm{处理臂内的总虫数}}/测试的总虫数 \times 100 $ | (2) |
| $ {\rm{驱避率/\% }} = {\rm{对照臂内的总虫数}}/测试的总虫数 \times 100 $ | (3) |
| $ 反应率/\% = (对照臂内的总虫数 + 处理臂内的总虫数)/测试的总虫数 \times 100 $ | (4) |
数据采用Excel 2011进行处理,用SPSS 22. 0软件进行统计分析。椰心叶甲对各种挥发化合物的EAG反应差异比较,以及雌、雄成虫对不同浓度化合物EAG反应差异分析均采用了单因素方差分析,采用纽曼-科伊尔斯检验(Newman-Keuls,NK)进行多重比较。雌、雄虫对同一浓度化合物EAG反应的差异比较采用独立样本T检验进行分析[21]。对椰心叶甲进行Y型嗅觉行为测定时,假设挥发化合物对椰心叶甲的趋向性没有影响,则该虫对Y型管两臂(味源和对照)的趋向率均为50%,即假设测验H0为50 ︰ 50,再对Y型管两臂之间的趋向率差异做χ2检验,当P < 0. 05时,则差异达显著水平[22]。
2 结果与分析 2.1 椰心叶甲对9种植物挥发化合物的EAG反应图 1为椰心叶甲成虫对9种植物挥发化合物的EAG相对反应值。在9种化合物中,椰心叶甲雌虫触角对肉桂醛的EAG反应最强烈,相对反应值为128. 17±0. 44,极显著高于其余8种化合物(F=746. 52,df=44,P < 0. 01)。其次是双戊烯与香茅醛,两者之间无显著差异(F=746. 52,df=44,P=0. 24)。芳樟醇、α-蒎烯和薄荷脑对雌成虫触角的刺激最小,EAG相对反应值分别为33. 28±1. 18、31. 90±0. 69、32. 90±1. 60,且三者之间无显著差异(F=746. 52,df=44,P=0. 52)。各处理的EAG相对反应值大小为:肉桂醛>双戊烯>香茅醛>异丁香酚>松节油>1-庚醛>芳樟醇>薄荷脑>α-蒎烯。与雌虫相似,椰心叶甲雄虫触角对肉桂醛的电生理反应最强烈,相对反应值为103. 87±2. 54,极显著高于其余8种化合物(F=592. 46,df=44,P < 0. 01);其次是松节油、芳樟醇和薄荷脑对雄虫触角的刺激最小,EAG相对反应值分别为15. 95±0. 91和14. 55±0. 51,两者之间无显著差异(F=592. 46,df=44,P=0. 41)。各处理的EAG相对反应值大小依次为:肉桂醛>松节油>香茅醛>双戊烯>异丁香酚>1-庚醛>α-蒎烯>芳樟醇>薄荷脑。可见,肉桂醛对椰心叶甲成虫触角有较强的刺激作用。
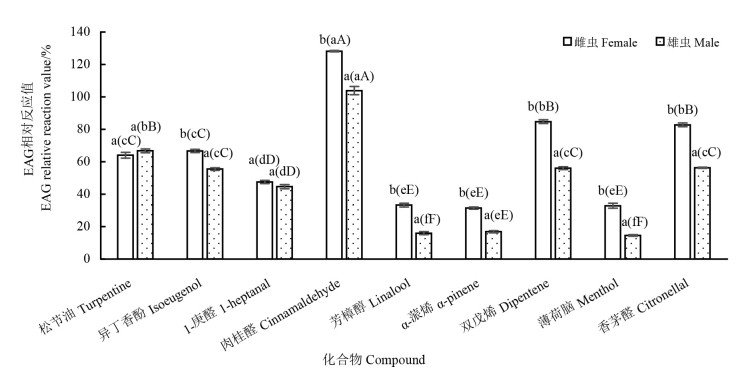
|
注:图中不同大小写字母分别表示在P < 0. 05和P < 0. 01水平下差异显著;括号外不同字母表示相同化合物雌雄虫间的反应差异显著,括号内不同字母表示雌雄虫分别对不同化合物的反应差异显著。 Note: different capital and small letters in the figure indicate significant differences at P < 0. 05 and P < 0. 01 levels, respectively; different letters outside the brackets indicate significant differences between the males and females in response to the same compound, while those in parentheses indicate significant differences between the males and females in response to the different compounds. 图 1 椰心叶甲成虫对9种植物挥发化合物的EAG相对反应值 Fig. 1 The relative values of EAG reaction of B. longissima adults in response to the 9 plant volatile compounds |
椰心叶甲雌、雄成虫对同种化合物的反应结果见图 1。在9种化合物中,除了松节油和1-庚醛,其余化合物处理雌虫触角的EAG相对反应值均显著大于雄虫。统计发现,其中,双戊烯处理的雌、雄成虫EAG相对反应值差异最大,差值达到了28. 73。说明,在这9种化合物中,椰心叶甲雌、雄成虫对大部分化合物的EAG反应均存在差异。
2.3 椰心叶甲对不同浓度肉桂醛的EAG反应椰心叶甲雌、雄虫对不同浓度肉桂醛的EAG相对反应值如表 2。由表 2可知,稀释倍数在1×102~1×105,雌、雄成虫对肉桂醛的EAG反应强度随着浓度的升高而增强。经NK多重比较发现,对于雌、雄成虫都体现出,稀释1×102倍处理的EAG相对反应值最大,分别达到了124. 60±1. 47和93. 47±1. 00,但稀释倍数为5×104和1×105处理的EAG相对反应值较小,且两浓度处理间无显著差异。说明,稀释1×104倍液的肉桂醛可能是引起雌、雄成虫敏感反应的最小浓度阈值。
| 稀释倍数 Dilution times |
雌成虫EAG相对反应值 Relative value of EAG reaction of female adults |
雄成虫EAG相对反应值 Relative value of EAG reaction of male adults |
独立样本T检验 Independent sample T test |
t值 t value |
df值 df value |
| 1×102 | 124.60±1.47aA | 93.47±1.00aA | 0.00* | 17.48 | 8 |
| 1×103 | 64.61±1.03bB | 56.48±0.89bB | 0.00* | 5.97 | 8 |
| 1×104 | 56.39±0.44cC | 41.12±0.59cC | 0.00* | 20.71 | 8 |
| 5×104 | 35.99±0.46dD | 33.71±0.50dD | 0.10 | 3.84 | 8 |
| 1×105 | 33.39±0.84dD | 31.56±0.64dD | 0.12 | 1.73 | 8 |
| 注:数据为平均值±标准误。同列数据后不同大小写字母分别表示在P < 0. 05和P < 0. 01水平差异显著,*表示独立样本T检验在P < 0. 05水平差异显著。Note:the data are x ±SE. Different capital and small letters following the data in the same column indicates significant difference at P < 0. 05 and P < 0. 01 level,respectively;* indicates that the independent sample T test is significantly different at the P < 0. 05 level. | |||||
进一步比较雌、雄成虫对同一浓度肉桂醛的EAG反应差异,结果见表 2。独立样本T检验结果显示,肉桂醛在稀释1×102、1×103、1×104倍液时,雌成虫对同一浓度肉桂醛的EAG相对反应值均显著高于雄成虫,而其余浓度处理,雌、雄成虫间的反应差异未达到显著水平。可见,浓度较高时,雌成虫对肉桂醛的EAG反应比雄虫强。
2.4 椰心叶甲对不同浓度肉桂醛的行为反应椰心叶甲对不同浓度肉桂醛的行为反应差异见表 3。稀释为1×102、1×103和1×104倍液的肉桂醛对椰心叶甲雌、雄成虫的驱避率与引诱率均呈极显著差异,其中,稀释1×102倍液的肉桂醛对雌、雄成虫的驱避率最大,分别达到了72. 41%±3. 16%和70. 22%±3. 22%;稀释5×104倍液的肉桂醛对雌、雄成虫的驱避率与引诱率呈显著差异;稀释1×105倍液的肉桂醛对雌、雄虫的驱避率最小,仅有22. 09%±1. 90%和32. 17%±1. 87%,且驱避率和引诱率均无显著差异。说明,稀释在5×104倍液以下时,肉桂醛对雌、雄成虫具有明显的胁迫驱避作用。
| 成虫Adult | 化合物稀释倍数 Compound dilution times |
驱避率 Dodge rate/% |
引诱率 Attraction rate/% |
χ2检验 χ2 test |
反应率 Response rate/% |
| 雄虫Male | 1×102 | 70.22±3.22 | 14.18±1.65 | 0.00** | 84.40±2.69 |
| 1×103 | 66.05±2.88 | 10.11±1.26 | 0.00** | 76.15±2.22 | |
| 1×104 | 56.88±2.01 | 18.97±1.34 | 0.00** | 75.85±2.20 | |
| 5×104 | 42.00±2.35 | 22.00±1.98 | 0.04* | 64.00±3.00 | |
| 1×105 | 32.17±1.87 | 26.18±2.34 | 0.21 | 58.35±2.51 | |
| 雌虫Female | 1×102 | 72.41±3.16 | 16.58±2.45 | 0.00** | 88.99±3.16 |
| 1×103 | 68.60±3.74 | 14.01±2.45 | 0.00** | 82.61±3.01 | |
| 1×104 | 54.04±3.16 | 18.00±1.89 | 0.00** | 72.04±1.03 | |
| 5×104 | 42.02±2.46 | 22.00±2.01 | 0.04* | 64.02±1.85 | |
| 1×105 | 22.09±1.90 | 26.07±2.22 | 0.38 | 48.16±1.00 | |
| 注:数据为平均值±标准误。*表示在P < 0. 05水平差异显著,* *表示在P < 0. 01水平差异极显著。Note:the data are x ±SE. * indicates significant difference at P < 0. 05 level,and * * indicates extremely significant difference at P < 0. 01 level. | |||||
通过刺激胁迫具有匿藏特性的昆虫逃离聚集场所而暴露,使其接触农药,从而增强防治效果,是一种新的防治方法。本文通过触角电位反应与行为生测,旨在筛选对椰心叶甲具较强胁迫作用的植物挥发化合物,胁迫其逃离心叶,便于化学防治时直接触杀。或利用病原微生物进行生物防治时,让其携菌返回或逃离,从而诱发流行病,这对该害虫的种群控制,有重要实际意义,同时,也为防治隐匿性食叶害虫,提供新技术与新方法。
试验结果表明,在稀释为1×102倍液条件下,选取的9种植物挥发化合物均能引起椰心叶甲触角电位反应,且引发雌、雄成虫触角产生较高EAG反应的化合物均是肉桂醛,说明肉桂醛对该虫具有较强的刺激作用。9种化合物中,除松节油外,其余化合物引发椰心叶甲生成的EAG相对反应值均是雌虫高于雄虫。马国峰[23]通过电镜扫描对椰心叶甲成虫触角感器的外部形态结构进行观察的结果表明,椰心叶甲雌雄成虫的触角均分布有5种感器,分别为毛形感器、刚毛形感器、刺形感器、芽孢形感器和锥形感器。其中,刚毛形感器只在雌虫触角中发现。这可能与其进化适应性相关,雌成虫可能由于要比雄成虫更快、更精确地找到寄主植物进行产卵繁殖,所以对气味更为敏感。
同一植物挥发物的特定浓度是影响昆虫反应的重要因子[24]。李鹏[18]认为昆虫对各挥发物的反应随浓度的变化而变化,当浓度较低时,反应并不十分强烈,而当浓度达到一定程度时,反应随之而增强。分析不同浓度肉桂醛对椰心叶甲的EAG反应差异时发现,稀释倍数低于5×104倍时,EAG反应强度随着肉桂醛浓度的升高而增大。
生测结果表明,稀释倍数低于5×104倍液的肉桂醛对椰心叶甲雌、雄成虫有明显胁迫驱避作用,且与EAG测定结果一致,肉桂醛浓度越高,EAG反应值越大,生测定向反应率越高。因此,在田间实践应用时,肉桂醛稀释倍数应在5×104倍液以下。本研究在前人研究的基础上,仅选择9种植物挥发化合物,针对椰心叶甲成虫做了胁迫驱避作用测定,因此,今后还有待进一步扩大植物化合物和其它化学物质的筛选范围,并开展椰心叶甲生产性防治试验验证。
| [1] | 肖广江.椰心叶甲种群动态及控制措施研究[D].成都: 四川农业大学, 2005: 1-53. |
| [2] | 黄法余, 梁广勤, 梁琼超, 等. 椰心叶甲的检疫及防除[J]. 植物检疫, 2000, 14(3): 158–160. DOI:10.3969/j.issn.1005-2755.2000.03.011 |
| [3] | HASSAN E. Problems of applied entomology in Papua New Guinea[J]. Anzeigefur Schadlingskunde and Pflanzenschutz, 1972, 45(9): 129–134. |
| [4] | STAPLEY J H. Insect pests of coconuts in the Pacific region[J]. Outlook on Agriculture, 1973, 5(5): 211–217. |
| [5] | 陈义群, 黎仕波, 黄宏辉, 等. 越南、瑙鲁、马尔代夫等国发生椰心叶甲[J]. 植物检疫, 2004, 18(1): 30. DOI:10.3969/j.issn.1005-2755.2004.01.013 |
| [6] | 余道坚, 陈志粦. 澳大利亚椰心叶甲的发生与检疫控制[J]. 世界农业, 2002, 276(4): 36–37. DOI:10.3969/j.issn.1002-4433.2002.04.013 |
| [7] | 陈义群, 黄宏辉, 林明光, 等. 椰心叶甲在国外的发生与防治[J]. 植物检疫, 2004, 18(4): 250–253. DOI:10.3969/j.issn.1005-2755.2004.04.030 |
| [8] | 张志祥, 程东美, 江定心, 等. 椰心叶甲的传播、危害及防治方法[J]. 昆虫知识, 2004, 41(6): 522–526. DOI:10.3969/j.issn.0452-8255.2004.06.005 |
| [9] | 周荣, 曾玲, 梁广文, 等. 椰心叶甲实验种群的生物学特性观察[J]. 昆虫知识, 2004, 41(4): 336–339. DOI:10.3969/j.issn.0452-8255.2004.04.012 |
| [10] | 吕宝乾, 金启安, 温海波, 等. 入侵害虫椰心叶甲的研究进展[J]. 应用昆虫学报, 2012, 49(6): 1708–1715. |
| [11] | ERLER F, ULUG I, YALCINKAYA B. Repellent activity of five essential oils against Culex pipiens[J]. Fitoterapi, 2006, 77(7/8): 491–494. |
| [12] | LEAL W S. Application of Gc-EAD to the determination of mosquito repellents derived from a plant, Cymbopogon citratus[J]. Journal of Asia Pacific Entomology, 1998, 1(1): 217–221. |
| [13] | TEULON D A J, PENMAN D R, RAMAKERS P M J. Volatiles chemicals for thrips (Thysanoptera:Thripidae) hostfinding and applications for thrips pest management[J]. Journal of Economic Entomology, 1993, 86(5): 1405–1415. DOI:10.1093/jee/86.5.1405 |
| [14] | 程红.青杨脊虎天牛触角感器类型及其对植物挥发物的反应[D].哈尔滨: 东北林业大学, 2006: 12-16. |
| [15] | 赵冬香, 卢芙萍, 莫圣书, 等. 几种植物挥发物对椰心叶甲成虫的触角电生理活性[J]. 热带作物学报, 2006, 27(3): 66–69. DOI:10.3969/j.issn.1000-2561.2006.03.013 |
| [16] | 邢雪.榆紫叶甲触角感器及其功能化合物的筛选研究[D].长春: 东北师范大学, 2016: 17-27. |
| [17] | 张振, 迟德富, 宇佳, 等. 青杨脊虎天牛对13种植物挥发物的电生理及行为反应[J]. 林业科学, 2010, 46(10): 69–75. DOI:10.11707/j.1001-7488.20101011 |
| [18] | 李鹏.四种害虫对14种植物挥发物的EAG和行为反应[D].哈尔滨: 东北林业大学, 2012: 8-28. |
| [19] | SHEPHERD W P, HUBER D P W, SEYBOLD S J. Antennal responses of the western pine beetle, Dendroctonus brevicomis (Coleoptera:Curculionidae), to stem volatiles of its primary host, Pinus ponderosa, and nine sympatric nonhost angiosperms and conifers[J]. Chemoecology, 2008, 17(4): 209–221. |
| [20] | DELORME J D, PAYNE T L. Antennal olfactory responses of black turpentine beetle, Dendroctonus terebrans (Olivier), to bark beetle pheromones and host terpenes[J]. Journal of Chemical Ecology, 1990, 16(4): 1321–1329. DOI:10.1007/BF01021029 |
| [21] | 张嫣, 王星霁, 张玲玲, 等. 红缘天牛成虫对葡萄挥发物的EAG和行为反应[J]. 天津师范大学学报(自然科学版), 2017, 37(2): 30–35. DOI:10.3969/j.issn.1671-1114.2017.02.007 |
| [22] | 王梦馨, 李辉仙, 武文竹, 等. 假眼小绿叶蝉对茶梢挥发物的行为反应[J]. 应用昆虫学报, 2016, 53(3): 507–515. |
| [23] | 马国峰.椰心叶甲对寄主植物嗅觉反应的研究[D].广州: 华南农业大学, 2011: 1-2. |
| [24] | 樊慧, 金幼菊, 李继泉, 等. 引诱植食性昆虫的植物挥发性信息化合物的研究进展[J]. 北京林业大学学报, 2004, 26(3): 76–81. |

 2019, Vol. 39
2019, Vol. 39


