文章信息
- 兰雁, 袁艳芳, 付学, 谢丽琼
- LAN Yan, YUANG Yanfang, FU Xue, XIE Liqiong
- 云杉木质素高降解的菌株筛选
- Screening of highly lignin-degrading fungi from Pinus schrenkiana
- 森林与环境学报,2019, 39(1): 82-87.
- Journal of Forest and Environment,2019, 39(1): 82-87.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.01.014
-
文章历史
- 收稿日期: 2018-03-26
- 修回日期: 2018-07-13
木质素是一种复杂的、非结晶形的、三维网状酚类聚合物,是地球上最丰富的生物聚合体之一。在植物体内木质素含量仅次于纤维素,约占植物干重的20%~30%[1-2]。木质素通常存在于次生加厚的植物细胞壁中,主要由对香豆醇、松柏醇和芥子醇3种单体羟基肉桂醇经过一系列羟基化、甲基化和连接与还原反应,最终生成3种甲基化程度不同的S、G、H型木质素。由芥子醇聚合而成的紫丁香基木质素为S型木质素;由松柏醇聚合而成的愈创木基木质素为G型木质素;和对一羟基苯基苯烷为H型木质素。3种单体的相对比例及化学键连接的不同类型决定了木质素的复杂性和异质性[3]。不同植物木质素类型不同,相同植物的不同发育部位木质素的沉积相同。在被子植物中,木质素主要包括S和G型;裸子植物主要是G型木质素;草本植物主要是H和G型木质素[4]。植物木质素中S与G的比值与木质素降解的难易程度密切相关,因此裸子植物木质素降解要难于被子植物[5]。木质素的难降解性已成为阻碍木质纤维素材料有效利用的最大障碍[1]。
自然界中参与降解木质素的微生物有真菌、放线菌和细菌。降解木质素的真菌主要分为3类:白腐菌(white-rot fungi)、褐腐菌(brown-rot fungi)和软腐菌(soft-rot fungi)。尽管杉木类林木的心材中含有对白腐菌、褐腐菌的生长抑制物质[6],白腐病等仍然是威胁木材生长的重要疾病[7]。白腐菌是目前发现的唯一可彻底降解木质素为CO2和水的真菌[8],主要通过分泌漆酶、锰过氧化物酶以及过氧化物酶对木质素进行降解[5]。而褐腐菌、软腐菌、放线菌、细菌等一般认为在木素降解中仅起二次性作用[1, 9]。最新研究表明,鞘脂菌(Sphingobium sp.)属细菌, 能以木质素为唯一碳源,在木质素降解过程中起重要作用[10]。
分子量大及难降解等特点使得木质素利用效率远远低于另一生物大分子纤维素,目前仅少量作为粘结剂、农药分散剂、燃料分散剂等在建筑、农业行业中使用。造纸工业上产生的大部分木质素都随废液排掉,既造成资源的极大浪费又引起严重的环境污染问题。本研究通过新疆特有种雪岭云杉(Pinus schrenkiana Fisch.et Mey)心材白腐病病株上分离木质素降解菌,筛选降解G型木质素能力高的真菌,将扩大木质素降解菌的来源,为处理工业造纸废液和生物垃圾提供候选菌株。
1 材料与方法 1.1 试验材料样品菌株从新疆伊宁库尔德宁林场、新疆南山西白杨沟和新疆南山林场采得的云杉腐木中分离。模式菌株为黄孢原毛平革菌(Phanerochaete chrysosporium),从中国普通微生物保藏管理中心购得。云杉心材组织来自于新疆维吾尔自治区乌鲁木齐市华凌木材厂。
1.2 培养基马铃薯培养基:葡萄糖、琼脂、土豆浸出液。初筛培养基:含0.04%愈创木酚的马铃薯培养基。复筛培养基:含1%的苯胺蓝的马铃薯培养基。液体培养基:200 g · L-1马铃薯、3 g · L-1KH2PO4、3 g· L-1葡萄糖、2 g · L-1 MgSO4。
1.3 菌株的分离 1.3.1 菌株的初筛将采集到的样品称重后在无菌条件下溶于无菌水中制备10-2、10-4、10-6 g · L-1浓度的菌悬液。将模式菌——黄孢原毛平革菌分为对照组与样品组分别涂布于初筛培养基上,置于30 ℃下培养7 d。产生红褐色脱色圈的菌株进行进一步的切菌纯化。
1.3.2 菌株的复筛初筛中获得的菌株用3 mm×3 mm打孔器取菌丝块,分别接种至含有1%苯胺蓝的马铃薯培养基上,置于30 ℃下避光培养10 d进行复筛。
1.4 菌株生长曲线测定用3 mm×3 mm打孔器接种目的菌株于初筛培养基上,15 d内测量菌丝直径的变化。
1.5 菌株的初步鉴定将获得的目的菌株18 S rRNA保守区进行扩增(ITS4R 5 ’TCCTCCGCTTATTGATATGC 3’, ITS1F 5’CTTGGTCATTTAGAGGAAGTAA 3’),PCR片段送至生工生物工程(上海)股份有限公司测序,将所测得的18S rRNA保守区NCBI数据库中进行比对, 寻找相似度为99%以上的菌株序列。利用Clusatlx软件进行比对,用邻接法构建系统发育树[11-12],初步确定目的菌株的分类学地位。
1.6 木质素降解能力观察与测定 1.6.1 称重法将云杉心材组织切成1.6 cm×1.6 cm×0.7 cm大小的木块,60 ℃干燥恒重后记录其质量(w1);将干燥后的小木块与目的菌株孢子液放入液体培养基中共培养,同时设置空白组,150 r· min-1, 30 ℃培养60 d,取出云杉木块,洗去表面菌丝,60 ℃干燥至恒重称质量(w2)。根据公式w /% = (w1-w2) /w1计算木质素降解率。
1.6.2 扫描电镜法干燥木块与目的菌株的孢子液共培养60 d后,取出云杉木块,洗去表面菌丝,扫描电镜观察其菌丝生长与木材表面结构的变化[13]。
2 结果与分析 2.1 目的菌株的分离从感病云杉腐朽树干或根中分离到目的菌株。一般感病云杉树干直径大于50 cm,鱼鳞状树皮表面通常长有木质化菌丝孢子体,典型的白腐病心材如图 1A所示,颜色灰白,呈绵软片状,发病木材边缘常伴生云杉褐腐病菌。

|
注:A为云杉白腐病心材,左下角可见未侵染健康黄色心材;B为马铃薯愈创木酚培养基与木质素降解菌的颜色反应。Note: A. Heartwood of Pinus schrenkiana infected with white rot, a piece of uninfected healthy yellow heartwood can be seen in the lower left corner; B is the color reaction between PDA-guaiacol medium and ligninolytic fungi. 图 1 患病云杉木材心材与愈创木酚颜色反应 Fig. 1 Color reaction between Pinus schrenkiana infected with white rot and guaiacol |
愈创木酚是木质素单体化合物之一,常作为木质素结构类似物使用。在马铃薯培养基中加入愈创木酚,木质素降解菌将与其产生颜色反应[14]。如图 1B所示,菌落外缘可见明显的红褐色脱色圈,这是菌株分泌的过氧化物酶与愈创木酚发生的特定的颜色反应,以此作为初筛的重要判断依据。
2.1.2 目的菌株的复筛采用苯胺蓝平板脱色法来检验脱色圈的产生。染料苯胺蓝Azurb B的脱色与LiP及MnP等的产生有关,主要判断依据来自于菌株在脱色培养基上的生长情况。具有木质素降解能力的菌株在加有1%苯胺蓝的马铃薯培养基上出现透明脱色圈,且随着培养时间的增长,脱色圈直径增大。结合初筛结果,复筛获得了4株可能的木质素降解菌:菌株2-A、1-G、2-B和3-E。其中菌株1-G菌落呈绒垫状,分生孢子梗多从气生菌丝长出,白色或土黄色;菌株2-A菌落呈絮状,分生孢子梗粉红白灰色。
2.2 菌株生长曲线测定菌株生长在愈创木酚马铃薯培养基上,每3 d从培养皿背面观测菌丝生长情况,测量菌丝的直径至第15天。各筛选菌株生长情况如图 2所示。
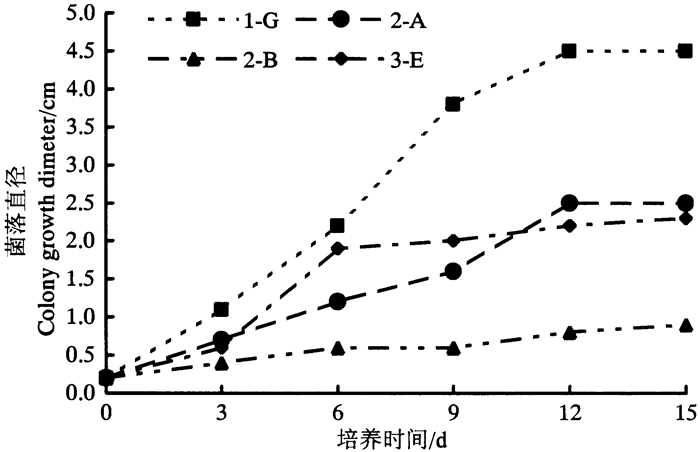
|
图 2 菌株生长曲线 Fig. 2 Strain growth curve |
图 2清楚表明了菌株在15 d之内的生长情况,可发现1-G生长速度最快,4种菌生长态势基本相同,在12 d左右基本都停止生长。
2.3 木质素降解能力的测定与观察与云杉心材共培养60 d的木质素降解试验表明,筛选菌株表现出了一定的木质素降解能力(表 1)。模式菌——黄孢原毛平革菌降解率约为5.38%,筛选菌株中,菌株2-A与1-G比黄孢原毛平革菌降解效率高,分别达到了显著和极显著的水平;菌株3-E也有一定的降解能力,菌株2-B降解能力较弱。
| 菌株 Candidate fungi |
处理前质量 Weight before treatment/g |
处理后质量 Weight after treatment/g |
平均木质素降解率 Degradation rate/% |
| CK | 0.121 | 0.120 | 0.83 |
| 2-A | 0.189 | 0.178 | 5.82 |
| 1-G | 0.385 | 0.361 | 6.23 |
| 2-B | 0.343 | 0.330 | 3.80 |
| 3-E | 0.253 | 0.240 | 5.14 |
| 黄孢原毛平革菌Phanerochaete chrysosporium | 0.613 | 0.580 | 5.38 |
扫描电镜下观察菌丝在木材上生长情况,可见筛选菌株处理后的木块表面与对照木块表面有明显差异(图 3A)。与菌株共培养后的木块表面有明显的菌丝生长情况,菌丝连成片附着在木块表面(图 3B),去除表面菌丝后,还可清晰看见生长在心材细胞里面的菌丝(图 3C)。与菌株2-A相比,菌株1-G在心材内部生长菌丝明显较多(图 3D,E)。将菌株与模式菌株进行对比,可发现菌株1-G对木质素降解能力较强,菌株2-A、3-E次之,菌株1-G在云杉心材上生长旺盛。

|
注:A.无菌培养对照木块,可见明显管胞;B.与菌株2-A共培养木块的横向切面,可见明显菌块;C.与菌株2-A共培养木块的径向切面,可见明显菌丝;D.与菌株1-G共培养木块的横向切面,可见明显菌块;E.与菌株1-G共培养木块的径向切面,内部可见致密菌丝。Note:A. Control wood block, clear tracheid were observed in the culture solution. B. Fungus plaque was clearly observed on the transverse section of wood block cocultured with 2-A. C. Hyphae were clearly observed on the radial section of wood block cocultured with 2-A. D. Fungus plaque was clearly observed on the transverse section of wood block cocultured with 1-G. E. Hyphae were clearly observed on the radial section of wood block cocultured with 1-G. 图 3 扫描电镜观察真菌生长情况 Fig. 3 Observation of fungi growth using a scanning electron microscope |
为了明确筛选菌株的分类地位,研究利用18 S rRNA保守区特性,初步鉴定了这几种木质素降解菌的种属关系。
2.4.1 18 S rRNA保守区碱基序列差异分析真菌通用引物对18 S rRNA保守区扩增,片段长度550 bp左右,用Clusatlx软件进行同源性分析。其中菌株2-A保守区全长549 bp, 保守位点171个,占全长31.1%;可变位点396个,占全长72.1%;简并位点205个,占全长37.3%;单突变位点160个,占全长29.1%;可变位点占全长72.1%。其它菌株18 S rRNA保守区的碱基变化与此大致相似。
2.4.2 降解菌系统发育树的构建及分析比对菌株2-A、1-G、2-B、3-E的18 S rRNA保守区测序结果,邻接距离矩阵法构建系统发育树(表 2)。从矩阵看出,菌株2-B、3-E碱基序列差异性较小为0.4%;菌株2-A与微壳色单隔孢属(Microdiplodia)的碱基序列差异性为0.4%;菌株1-G和三隔镰孢菌(Fusarium tricinctum)差异性为0.2%。通常碱基序列差异小于2.0%可确定为种内关系,结合菌落的生长的形态学分析和降解性能,初步确定菌株2-B、3-E可能为为同一种菌不同亚种;菌株2-A为微壳色单隔孢属;菌株1-G为三隔镰孢菌。构建的系统发育树如图 4所示。
| 真菌Fungi | 微壳色单隔孢属 Microdiplodia sp. |
赤霉菌 Gibberella avenacea |
1-G | 2-A | 2-B | 3-E | 三隔镰孢菌 Fusarium tricinctum |
| 微壳色单隔孢属 | |||||||
| Microdiplodia sp. | |||||||
| 赤霉菌 | 0.306 | ||||||
| Gibberella avenacea | |||||||
| 1-G | 0.285 | 0.024 | |||||
| 2-A | 0.004 | 0.308 | 0.287 | ||||
| 2-B | 0.613 | 0.597 | 0.595 | 0.615 | |||
| 3-E | 0.615 | 0.599 | 0.597 | 0.617 | 0.004 | ||
| 三隔镰孢菌 | 0.285 | 0.022 | 0.002 | 0.287 | 0.595 | 0.597 | |
| Fusarium tricinctum | |||||||
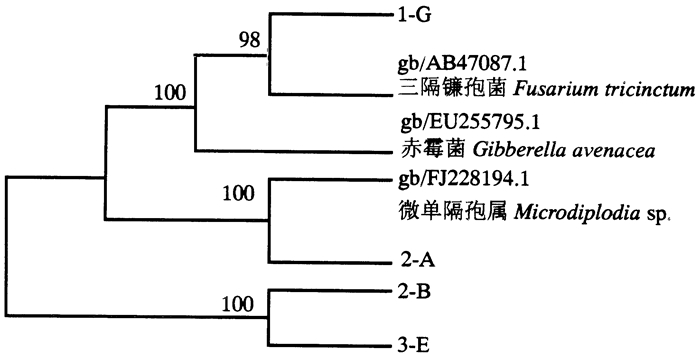
|
图 4 木质素降解菌的NJ距离矩阵 Fig. 4 NJ distance matrix of lignin-degrading fungi |
白腐菌是自然界彻底降解木质素的微生物。前人的研究表明,降解木质素的微生物主要分布在多孔菌属(Polyporus)、云芝属(Polystictus) [15]、密孔菌属(Pycnoporus) [16]、拟多孔菌属(Polyporellus) [17]、侧耳属(Pleurotus)、镰孢菌属(Fusarium) [18]等真菌和假单孢杆菌(Pseudomonas sp.) [19]等细菌中,约十几个属几百个种,降解木质素微生物的种类还在不断地扩大中。本研究在感病的雪岭云杉心材中,获得4株具有潜在木质素降解能力的真菌。称重法分析其木质素降解能力发现,菌株1-G对木质素的降解能力最强,与木质素降解模式菌——黄孢原毛平革菌相比,达到极显著水平。18 S rDNA保守区序列分析初步鉴定菌株2-A属于微壳色单隔孢属,该属微生物在川楝内生菌、水曲柳和苹果溃疡病中发现[20],可能是乔木生长常见微生物。生长动力学分析表明,菌株1-G的生长速度最快,菌株2-A次之。在第10天时,菌株1-G生长直径已达到接种时的4倍。推测其木质素降解能力较强可能与较高的生长速度有关。根据获得的几种降解菌菌株类型,推测获得的降解菌株来自森林腐殖质层。
在筛选木质素降解菌的过程中,合适的筛选和鉴定体系对降解菌的获得有关键的作用。研究多用蒽醌类染料的降解程度实验室内评估微生物对木质素降解能力,也可通过微生物在磨、水解和天然木质素等[21]中的作用推测其长期降解能力。而这类木质素材料往往由研究者自行制备,稳定性较差,结果重现性较差。不同来源木质素结构的复杂性使得直接衡量不同菌株间降解能力较为困难,限制了木质素降解菌的推广使用[13]。通过扫描电镜检测木材解剖学变化和木材称重法评价木质素降解菌活力高低,结果直观。由于木材主要组分是纤维素和木质素,进一步的工作将筛选降解纤维素菌株,探讨混合菌株在农业秸秆、纸厂废液等不同来源木质素中的降解能力,提高对木质素废弃物的综合处理能力。
| [1] | BROWN M E, CHANG M C. Exploring bacterial lignin degradation[J]. Current Opinion in Chemical Biology, 2014, 19: 1–7. DOI:10.1016/j.cbpa.2013.11.015 |
| [2] | HORN S J, VAAJE-KOLSTAD G, WESTERENG B, et al. Novel enzymes for the degradation of cellulose[J]. Biotechnology for Biofuels, 2012, 5(1): 45. |
| [3] | ARANTES V, MILAGRES A M F, FILLEY T R, et al. Lignocellulosic polysaccharides and lignin degradation by wood decay fungi:the relevance of nonenzymatic fenton-based reactions[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(4): 541–555. |
| [4] | MARTONE P T, ESTEVEZ J M, LU F C, et al. Discovery of lignin in seaweed reveals convergent evolution of cell-wall architecture[J]. Current Biology, 2009, 19(2): 169–175. DOI:10.1016/j.cub.2008.12.031 |
| [5] | HARBORNE J B. Methods in plant biochemistry.Volume 1:plant phenolics[M]. London: Academic Press, 1989. |
| [6] | 庄雪峰, 陈礼辉, 林金国, 等. 杉木心材6种溶剂提取物的抗菌活性[J]. 森林与环境学报, 2016, 36(2): 231–235. |
| [7] | 吴柳萍, 纪志荣, 连素兰, 等. 福建省森林病虫害发生风险的概率分析[J]. 森林与环境学报, 2017, 37(1): 95–101. |
| [8] | REID I D. Biodegradation of lignin[J]. Canadian Journal of Botany, 1995, 73(S1): 1011–1018. DOI:10.1139/b95-351 |
| [9] | JAFARI N, SOUDI M R, KASRA-KERMANSHAHI R. Biodegradation perspectives of azo dyes by yeasts[J]. Microbiology, 2014, 83(5): 484–497. DOI:10.1134/S0026261714050130 |
| [10] | VARMAN A M, HE L, FOLLENFANT R, et al. Decoding how a soil bacterium extracts building blocks and metabolic energy from ligninolysis provides road map for lignin valorization[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(40): E5802–E5811. DOI:10.1073/pnas.1606043113 |
| [11] | HATAKKA A. Lignin-modifying enzymes from selected white-rot fungi:production and role from in lignin degradation[J]. FEMS Microbiology Reviews, 1994, 13(2/3): 125–135. |
| [12] | TAMURA K, NEI M, KUMAR S. Prospects for inferring very large phylogenies by using the neighbor-joining method[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 11030–11035. DOI:10.1073/pnas.0404206101 |
| [13] | TAMURA K, PETERSON D, PETERSON N, et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10): 2731–2739. DOI:10.1093/molbev/msr121 |
| [14] | 张杰.白腐真菌的筛选、诱变及其对秸秆降解能力的研究[D].扬州: 扬州大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-11117-2010176328.htm |
| [15] | ROTHSCHILD N, NOVOTNÝ Č, ŠAŠEK V, et al. Ligninolytic enzymes of the fungus Irpex lacteus (Polyporus tulipiferae):isolation and characterization of lignin peroxidase[J]. Enzyme and Microbial Technology, 2002, 31(5): 627–633. DOI:10.1016/S0141-0229(02)00171-0 |
| [16] | EGGERT C, TEMP U, ERIKSSON K E L. The ligninolytic system of the white rot fungus Pycnoporus cinnabarinus:purification and characterization of the laccase[J]. Applied and Environmental Microbiology, 1996, 62(4): 1151–1158. |
| [17] | PALMIERI G, GIARDINA P, BIANCO C, et al. Copper induction of laccase isoenzymes in the ligninolytic fungus Pleurotus ostreatus[J]. Applied and Environmental Microbiology, 2000, 66(3): 920–924. DOI:10.1128/AEM.66.3.920-924.2000 |
| [18] | REGALADO V, PERESTELO F, RODRÍGUEZ A, et al. Activated oxygen species and two extracellular enzymes:laccase and aryl-alcohol oxidase, novel for the lignin-degrading fungus Fusarium proliferatum[J]. Applied Microbiology and Biotechnology, 1999, 51(3): 388–390. DOI:10.1007/s002530051407 |
| [19] | ARUN A, RAJA P P, ARTHI R, et al. Polycyclic aromatic hydrocarbons (PAHs) biodegradation by basidiomycetes fungi, Pseudomonas isolate, and their cocultures:comparative in vivo and in silico approach[J]. Applied Biochemistry and Biotechnology, 2008, 151(2/3): 132–142. |
| [20] | 任丹, 张波, 张小平, 等. 川楝内生真菌的遗传及PKS、NRPS基因的多样性[J]. 中草药, 2014, 45(10): 1461–1467. DOI:10.7501/j.issn.0253-2670.2014.10.020 |
| [21] | HIGUCHI T. Lignin biochemistry:biosynthesis and biodegradation[J]. Wood Science and Technology, 1990, 24(1): 23–63. DOI:10.1021/es00071a002 |

 2019, Vol. 39
2019, Vol. 39


