文章信息
- 曾志红, 陈玲苗, 黄秋蓉
- ZENG Zhihong, CHEN Lingmiao, HUANG Qiurong
- 丁香提取物对枝孢霉菌的抑菌效果及抑菌机理
- Study on the antibacterial effect of clove extract on Cladosporium and its mechanism
- 森林与环境学报,2019, 39(1): 77-81.
- Journal of Forest and Environment,2019, 39(1): 77-81.
- http://dx.doi.org/10.13324/j.cnki.jfcf.2019.01.013
-
文章历史
- 收稿日期: 2018-05-07
- 修回日期: 2018-07-09
2. 福建省新型污染物生态毒理效应与控制重点实验室, 福建 莆田 351100
2. Fujian Provincial Key Laboratory of Ecology-toxicological Effects & Control for Emerging Contaminants, Putian, Fujian 351100, China
水果采后真菌病害是影响水果货架期的主要因素[1-2],采用低温、气调、减压等物理方法可以降低果蔬采后病害的发生,延长保鲜时间,低温贮藏存在成本高、耗能大及冷链设施不完善等问题,而且不能彻底杜绝采前及采后水果中所含的病原真菌对水果的侵害[3],因此杀菌剂成为水果采后病害防治的主要有效手段,而使用化学药剂进行防腐抑菌会造成果蔬上的农残量增加,危害人体健康,因此安全无毒的植物源抑菌剂的开发应用成为当今研究的热点。
已有的研究表明丁香对微生物生长有一定的抑制效果[4-5], 但在水果腐烂防治中的应用研究较少。壳梭孢菌(Fusicoccum sp.)、青霉菌(Penicillium sp.)及枝孢霉菌(Cladosporium sp.)是引起果腐病及果树叶枯病的主要病原真菌,易产孢子,可随风传播,生长速率快,是导致多种水果腐烂的致腐真菌[6-8]。本课题以实验室中保存的这三株真菌为靶标菌,研究丁香提取物对常见的水果致腐真菌抑制效果,在前期研究[4]及参考相关文献[5]的基础上,进一步明确丁香提取物对病原真菌的有效抑菌浓度及其抑菌机理,为后续将丁香提取物开发应用于水果的抑菌保鲜提供依据,而且安全无毒的植物源抑菌剂的推广应用,将对绿色果蔬的可持续发展具有极其重要的现实意义。
1 材料与方法 1.1 试验材料供试菌株:壳梭孢菌(Fusicoccum sp.)、青霉菌(Penicillium sp.)、枝孢霉菌(Cladosporium sp.)从“乌龙岭”龙眼果实分离。PDA培养基(马铃薯葡萄糖琼脂培养基),PDB培养基(马铃薯葡萄糖液体培养基)。植物材料:丁香(Syzygium aromaticum) (供试部位为花蕾)。
1.2 试验方法 1.2.1 丁香提取物的制备以75%酒精为溶剂,参照文献[4],制备100 mg · mL-1丁香乙醇提取液,4 ℃下保存,备用。
1.2.2 丁香提取物抑菌效果检测用PDA培养基将丁香提取液稀释至浓度分别为6.250、3.125 mg · mL-1的含药平板,以不含药的PDA培养基为空白对照,在各平板中央放置直径为6 mm真菌菌饼,在26 ℃恒温培养箱内培养96 h,对菌落直径进行十字形测量。抑菌率[9]计算公式为:
| $ 抑菌率/\% {\rm{ }} = {\rm{ }}({d_{\rm{C}}} - {d_{\rm{T}}}) \times 100/({d_{\rm{C}}} - 6) $ | (1) |
式中:dC为对照菌落直径(mm);dT为不同处理条件下的菌落直径(mm);6是接种菌块的直径(mm)。
1.2.3 抑菌机理研究 1.2.3.1 枝孢霉菌的处理和培养分别将以1 mg · mL-1丁香提取物处理及以提取溶剂(1 mL 75%酒精)为空白对照处理的1 mL 106个· mL-1孢子悬浮液进行液态培养和平板固体培养。液态培养条件为26 ℃,转速130 r · min-1,培养132 h。
26 ℃下平板固体培养,待平板表面长满菌丝后,将菌丝刮除,用打孔器打菌块,打下来的菌块放在载玻片上,再将载玻片放入铺有湿润滤纸的培养皿中,26 ℃培养38 h后,观察孢子梗形态。
1.2.3.2 丁香提取物对枝孢霉菌细胞膜通透性的影响称取1 g菌丝体用1 mg · mL-1丁香提取液处理,以75%酒精为空白对照,分别在0、15、30、45、60、75、90、105、120 min测其电导率,最后用沸水热死处理10 min,再次测定的电导率为C′,试验重复3次。用C相对电导率表示细胞膜通透性,相对电导率的公式如下:
| $ C_{相对电导率}/\% = \left( {C - {C_0}} \right)/({C^\prime } - {C_0}) \times 100 $ | (2) |
式中:C为各时间点电导率;C0为0 min时的电导率;C′为沸水热死处理的电导率。
1.2.3.3 丁香提取物对枝孢霉菌菌丝总糖含量的影响分别称取1.2.3.1处理及对照组的菌丝各0.5 g,采用蒽酮比色法测定总糖的含量[10], 确定丁香提取物对菌丝总糖含量的影响。
1.2.3.4 丁香提取物对枝孢霉菌可溶性蛋白含量的影响分别称取1.2.3.1处理组及对照组的菌丝各0.2 g,采用考马斯亮蓝法测定可溶性蛋白的含量[10],确定丁香提取物对菌丝可溶性蛋白含量的影响。
1.2.3.5 丁香提取物对枝孢霉菌产孢情况影响将处理组及空白对照组固体平板均置于26 ℃培养12 d后,取1 cm2的菌饼放入10 mL的试管中,加入1 mL的去离子水,制成孢子悬浮液,用血球计数板计算单位面积产孢量,试验重复3次。
| $ 抑制率/\%= (处理组-空白组) / 空白组 \times 100 $ | (3) |
由表 1和表 2可知,3.125和6.250 mg · mL-1丁香提取物对3种真菌均具有较好的抑制效果,浓度为6.250 mg · mL-1的丁香提取物抑菌效果比浓度为3.125 mg · mL-1较好,说明抑菌效果与提取物浓度有关。但不同菌对丁香提取物浓度变化的敏感性不同,丁香提取物浓度的增大显著提高对壳梭孢菌的抑制效果,但对枝孢霉菌和青霉菌的抑制效果变化不明显。丁香提取物对不同菌有效的抑菌或杀菌浓度也不同,3.125 mg · mL-1丁香提取物对枝孢霉菌抑菌率达到100%,且检测菌饼直径比原来6 mm有所减小,说明具有一定的杀菌作用,而对青霉菌及壳梭孢菌具杀菌作用的丁香提取液浓度均为6.250 mg · mL-1,因此,丁香提取物对枝孢霉菌抑菌效果比较显著,后续的抑菌机理研究均以该菌为检测菌。
| 药液浓度 Concentration of solution/(mg·mL-1) |
壳梭孢菌菌丝Fusicoccum sp. | 青霉菌菌丝Penicillium sp. | 枝孢霉菌菌丝Cladosporium sp. |
| 对照组CK | 
|

|

|
| 3.125 | 
|

|

|
| 6.250 | 
|

|

|
| 药液浓度 Concentration of solution/(mg·mL-1) |
壳梭孢菌菌丝Fusicoccum sp. hypha | 青霉菌菌丝Penicillium sp. hypha | 枝孢霉菌菌丝Cladosporium sp. hypha | |||||
| 直径 Diameter/mm |
抑菌率 Antibacterial rate/% |
直径 Diameter/mm |
抑菌率 Antibacterial rate/% |
直径 Diameter/mm |
抑菌率 Antibacterial rate/% |
|||
| 对照组CK | 82.70±0.70 | 18.40±0.30 | 16.50±0.50 | |||||
| 3.125 | 34.00±1.00 | 63.50±1.30 | 6.10±0.10 | 99.20±1.10 | 5.95±0.25 | 100 | ||
| 6.250 | 6.00±0.60 | 100.00±0.78 | 4.85±0.35 | 100 | 4.75±0.05 | 100 | ||
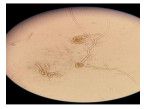
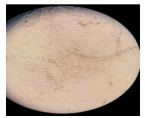
液体培养结果:经过1 mg · mL-1的丁香提取液处理的枝孢霉菌生长缓慢,培养132 h后才可见枝孢霉菌菌丝长出,光学显微镜下可见菌丝形态呈现畸形,菌丝分枝变多,节间被拉长、变细, 甚至有出现菌丝断裂、皱缩、凹陷、部分区域膨大等现象;而对照组菌丝细长、粗细均匀且无膨大和分枝增多等情况(表 3)。
| 组别 Group |
菌丝形态 Mycelial morphology |
菌落生长情况 Colony growth |
孢子梗形态 Morphology of spore stem |
| 处理组 Treatment group |
|

|
|
| 空白组 Blank group |
|

|

|
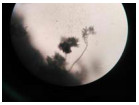
固体培养结果:26 ℃培养72 h后,处理组没长出菌丝,空白对照组则长了绿色的菌丝;处理组培养了288 h才长满整个平板,空白对照组只需132 h就长满了菌丝。在显微镜下可以看到处理组孢子梗瘦弱纤细,容易倒伏,孢子数减少,而对照组孢子梗形态健康,孢子数多,孢子梗丛密集(表 3)。可见丁香提取物能明显抑制菌丝的生长和繁殖。
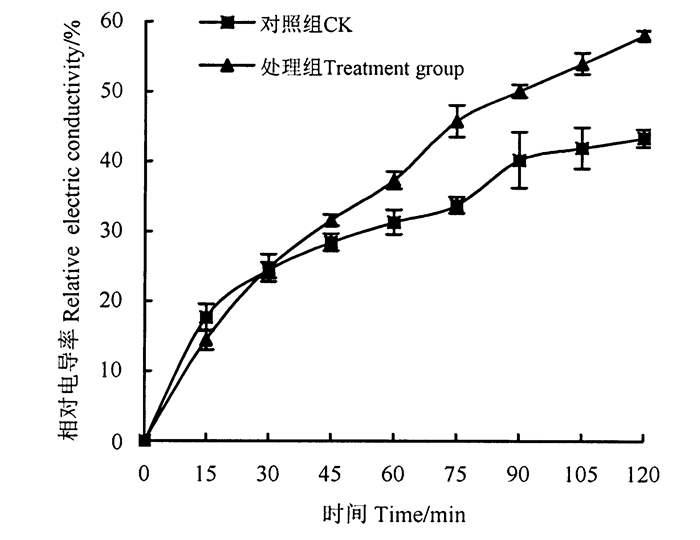
2.2.2 丁香提取液对枝孢霉菌细胞膜通透性的影响由图 1可知,处理组和对照组的枝孢霉菌电导率具有相似的变化趋势,在0~120 min内电导率呈上升趋势,上升幅度明显,但处理组的枝孢霉菌电导率上升的幅度比对照组高。真菌的细胞膜是一个重要结构,细胞膜受到了损伤将表现为膜透性增加和电解质外渗速率加快,通过测定电导率可以了解真菌细胞膜通透性的变化,反映细胞受伤害的程度[11],由此推测丁香提取液破坏了枝孢霉菌的细胞膜结构,使得电解质外渗速率加快,膜透性增加。
|
图 1 丁香提取液对枝孢霉菌细胞膜通透性的影响 Fig. 1 Clove extract on the membrane permeability of Cladosporium sp. |
以葡萄糖含量为横坐标、以吸光度为纵坐标绘制标准曲线,得线性回归方程为y=0.002 5x-0.004 5,相关系数为0.997 2。根据标准曲线可算出:1 mg · mL-1的丁香提取液处理的枝孢霉菌菌丝总糖含量为1.35%,空白组菌丝总糖含量为10.41%,处理组总糖含量比空白组下降了87.18%,两组差异达到极显著水平(P < 0.01)。从以上丁香提取液对枝孢霉菌细胞膜通透性的影响推断丁香提取液破坏了细胞膜结构,导致细胞内糖的流失或因相关离子的流失阻碍了糖的合成。
2.2.4 丁香提取液对枝孢霉菌可溶性蛋白含量的影响以蛋白质含量为横坐标、以吸光度为纵坐标绘制的标准曲线,拟合的线性回归方程为y=0.005x+0.018 8,相关系数为0.996 9。由此可算出经1 mg · mL-1的丁香提取液处理的枝孢霉菌菌丝可溶性蛋白含量为15.85 mg · g-1,而空白组为5.29 mg · g-1,经分析差异达到极显著水平(P < 0.01)。处理组可溶性蛋白质含量约为对照组的3倍。
可溶性蛋白是重要的渗透调节物质和营养物质,他们的增加和积累能提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用,是筛选生物抗性的重要指标。结果显示,枝孢霉菌经丁香提取物处理后,其可溶性蛋白质含量显著增加这一现象可能是因为丁香提取物抑制了其可溶性蛋白质的分解代谢[12],同时也是其对化学胁迫的自我适应和调节,当这种胁迫超过一定极限时将导致其病变或死亡。
2.2.5 丁香提取液对枝孢霉菌产孢量的影响以1 mg · mL-1丁香提取液处理枝孢霉菌,12 d后处理组产孢量为(4.48±0.28) ×106个· cm-2,空白组产孢量为(1.46±0.11) ×107个· cm-2,经分析差异达到极显著水平(P < 0.01),产孢抑制率高达69.31% (表 4),可见丁香提取液对枝孢霉菌产孢有较强的抑制作用。
| 组别Group | 产孢量Sporulation quantity/cm-2 | 产孢抑制率Spore inhibition rate/% |
| 处理组Treatment group | (4.48±0.28)×106** | 69.31 |
| 对照组CK | (1.46±0.11)×107** | 0 |
| 注:* *表示差异极显著(P < 0.01)。Note:* *Indicate the extremely significant difference (P < 0.01)。 | ||
丁香提取物对壳梭孢菌、青霉菌及枝孢霉菌均具有抑菌效果。丁香提取物对枝孢霉菌处理组电导率上升幅度比空白组大,推断丁香提取物破坏细胞膜结构的完整性,使得膜通透性加大,细胞膜结构的完整性被破坏后导致内部一些重要的离子流出,这些离子的流失可能导致一些重要的酶失去作用,从而影响到菌体的物质代谢[12],抑制了菌体的生长。由此推断,丁香提取物对真菌菌丝抑制作用的系列反应可能是从破坏菌丝体的细胞膜开始,真菌细胞膜是丁香提取物的重要作用靶位,这与前人研究的植物抑菌活性物质杀菌或抑菌作用机理相同[13-15];从繁殖方面看,病原真菌能以抗逆性极强的孢子进行传播和繁殖,可在果树残体、地表及土壤内越冬, 成为第二年初的侵染源[16],病叶上的真菌是采后水果果实贮藏期真菌性病害的主要初侵染来源[17],而丁香提取物既可以杀菌又能抑制枝孢霉菌孢子的产生,降低或阻断病菌后代继续危害的可能[18],可从侵染源头抑制真菌病害的发生,这是一般化学杀菌剂难以达到的成效。丁香是可食用的香料,因其低毒、无残留,而且低浓度下就有明显的杀菌和抑菌作用的特性,既可将其直接用于水果的采后保鲜又可用于果树的田间杀菌。丁香提取物应用于水果保鲜的使用浓度应高于离体抑菌试验中的杀菌浓度,具体的喷施浓度有待于进一步研究。
| [1] | LIN H T, CHEN S J, CHEN J Q, et al. Current situation and advances in post-harvest storage and transportation technologies of longan fruit[J]. Acta Horticulturae, 2001, 558(558): 343–351. |
| [2] | JIANG Y, ZHANG Z, JOYCE D C, et al. Postharvest biology and handling of longan fruit (Dimocarpus longan, Lour.)[J]. Postharvest Biology & Technology, 2002, 26(3): 241–252. |
| [3] | 刘程惠, 马涛, 胡文忠, 等. 鲜切苹果腐败霉菌的分离鉴定及致腐力的研究[J]. 食品工业科技, 2016, 37(7): 131–136. |
| [4] | 曾志红, 朱新辉, 宋洪波. 植物提取物对龙眼主要致腐真菌的抑制作用[J]. 森林与环境学报, 2016, 36(2): 227. |
| [5] | 郭松年.丁香提取液对水果防腐保鲜效果研究[D].杨凌: 西北农林科技大学, 2006: 22-42. http://cdmd.cnki.com.cn/Article/CDMD-10712-2006179737.htm |
| [6] | 江峰.猕猴桃腐败菌的分离鉴定及壳聚糖席夫碱对其抑菌作用研究[D].贵州: 贵州医科大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10660-1016242415.htm |
| [7] | 石立岩, 赵桂华, 孟庆兰, 等. 不同温度、pH值和培养基对杨树梭形溃疡病病原菌生长的影响[J]. 西部林业科学, 2009, 38(1): 55–59. DOI:10.3969/j.issn.1672-8246.2009.01.009 |
| [8] | 魏超, 代晓航, 郭灵安, 等. 草莓致腐霉菌的鉴定及其产毒能力研究[J]. 食品安全质量检测学报, 2017, 8(5): 1721–1726. |
| [9] | 张丽, 李霆格, 杨文汉, 等. 茶树油对2种农业致病菌的抑菌效果[J]. 热带农业科学, 2016, 36(3): 49–52. |
| [10] | 钱丽红, 陶妍, 谢晶. 茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理[J]. 微生物学通报, 2010, 37(11): 1628–1633. |
| [11] | 曾荣.凤仙透骨草抑菌活性成分、抑菌机理及对柑橘防腐保鲜效果的研究[D].南昌: 南昌大学, 2012: 1-172. http://cdmd.cnki.com.cn/Article/CDMD-10403-1015506010.htm |
| [12] | 吴方丽.丙烷脒对番茄灰霉病菌的抑菌机理初探[D].咸阳: 西北农林科技大学, 2008: 1-117. http://cdmd.cnki.com.cn/Article/CDMD-10712-2008102375.htm |
| [13] | CHINN S. Is methicillin-resistant staphylococcus aureus more virulent than methicillin-susceptible S. aureus? A comparative cohort study of british patients with nosocomial infection and bacteremia[J]. Clinical Infectious Diseases, 2003, 37(11): 1453–1460. DOI:10.1086/379321 |
| [14] | KNIGHT G C, NICOL R S, MCMEEKIN T A. Temperature step changes:a novel approach to control biofilms of Streptococcus thermophilus in a pilot plant-scale cheese-milk pasteurisation plant[J]. International Journal of Food Microbiology, 2004, 93(3): 305–318. DOI:10.1016/j.ijfoodmicro.2003.11.013 |
| [15] | GUNDUZ G T, TUNCEL G. Biofilm formation in an ice cream plant[J]. Antonie Van Leeuwenhoek, 2006, 89(3/4): 329–336. |
| [16] | 周德庆. 微生物学教程[M]. 北京: 高等教育出版社, 1993. |
| [17] | 王琪, 赖传雅. 广西龙眼真菌性病害种类调查初报[J]. 广西农业生物科学, 2002, 21(4): 229–234. |
| [18] | YENJIT P, ISSARAKRAISILA M, INTANA W, et al. Fungicidal activity of compounds extracted from the pericarp of Areca catechu, against Colletotrichum gloeosporioides in vitro, and in mango fruit[J]. Postharvest Biology & Technology, 2010, 55(2): 129–132. |

 2019, Vol. 39
2019, Vol. 39

